דלקת כבד נגיפית - Hepatitis Infection - B
| דלקת כבד נגיפית מסוג בי | ||
|---|---|---|
| Hepatitis B Infection | ||
| 250px | ||
Electron micrograph of Hepatitis B virus
| ||
| ICD-10 | Chapter B 16. Chapter B 18.0 Chapter B 18.1 | |
| ICD-9 | 070.2 | |
| MeSH | D006509 | |
| יוצר הערך | ד"ר ריפעת ספדי פרק הטיפול נכתב ע"י ד"ר אמיר שלומאי  
|
|
דלקת כבד נגיפית B (דלקת הנגרמת על ידי הנגיף HBV- Hepatitis B Virus) נחשבת לאחד הזיהומים השכיחים והקשים ביותר בעולם, וגורמת מדי שנה למותם של כמיליון חולים. במאמר זה סוקר ד"ר ספדי את המחלה החל מצורות ההדבקה, דרך בדיקות המעבדה ועד לדרכי מניעתה והטיפול בה.
מבוא
דלקת כבד נגיפית B (דלקת הנגרמת על ידי הנגיף HBV- Hepatitis B Virus) נחשבת לאחד הזיהומים השכיחים והקשים ביותר בעולם וגורמת מדי שנה למותם של כמיליון חולים.[1] כשליש מאוכלוסיית העולם נחשפה לנגיף ומתוכם 5% נשארו נשאים כרונים.[2] כרבע מהנשאים מפתחים מחלת כבד כמו שחמת וגידולים.[2] בשנת 1992 המליץ ארגון הבריאות העולמי לחסן נגד דלקת כבד נגיפית B. נכון להיום, 16 שנים לאחר תוכנית החיסונים הבינלאומית שיעור ההמצאות של נשאי הנגיף בעולם המערבי עומד על פחות מ 2%. בישראל שיעור הנשאות נע בין פחות מ 1% ל 8% לפי אזורי מגורים.[3] העברת הנגיף בצורה אנכית מהאם לתינוק גורמת להדבקתם של 40 אחוז מכלל הילדים שנולדים לאמהות עם HBsAg חיובי בדרום מזרח אסיה.[4] מסקירת הספרות לאחר שנת 1992 עולה, כי שיעור הדבקה כרונית בצורה אנכית בישראל הוא אפס.[5] מחקר אחד דווח על הדבקה ורטיקאלית בשיעור של 1.7% לפי הסמן antiHBc,[6] אך הממצאים במגזר ערבים יותר חמורים.[7]
דלקת כבד נגיפית ויראלית Viral hepatitis
אחת הפעילויות החשובות ביותר של הכבד היא טיהור הגוף מחומרים רעילים: מתכות כבדות, מיקרואורגניזמים פתוגניים והתרכובות הרעילות שהם מייצרים, תרכובות מסרטנות ועוד. הכבד ממלא תפקיד מרכזי בשמירה על בריאות הגוף, מאחר ופעילותו משפיעה על כל מערכות הגוף (מטבוליזם, ויסות הורמונאלי, ייצור פקטורי קרישה, עיכול ועוד). פגיעה בכבד ובדרכי הניקוז שלו, קרי דרכי המרה, עלולה לגרום למחלות וסיבוכים רבים, גם ברמת איברים אחרים. דלקות של הכבד נגרמות על ידי חשיפה לזיהומים, תרופות, אלכוהול, כימיקאלים ועוד. אחת הדלקות השכיחות היא דלקת הכבד (הפטיטיס, hepatitis), נקראת לעיתים "צהבת" על שם התסמין הקליני הנפוץ שלה - גוון צהבהב של העור ושל רירית העין. דלקת כבד נגיפית היא זו הנגרמת על ידי נגיפים, התוקפים באופן ייחודי את תאי הכבד. היום ידועים מספר נגיפים (A ,B ,C ,D ,E ,EBV ,CMV ועוד). כל אחד מהנגיפים יכול לגרום לדלקת כבד חריפה הנמשכת כמה שבועות, ומאופיינת בצהבת בעור ורירית העין, שתן כהה, עייפות קיצונית, בחילות, הקאות וכאבי בטן. הדלקת יכולה להתבטא במגוון תסמונות קליניות הנעות ממחלה קלה יחסית החולפת ללא כל שיירים ועד למחלה חמורה ביותר. לאחר ההדבקה יש לעיתים התפתחות של נשאות כרונית של הנגיף, מצב שעלול להביא לפגיעה מתמשכת בכבד עד למצב של שחמת הכבד (cirrhosis) והופעת גידולי כבד.[1]
דלקת כבד נגיפית HBV) B)
דלקת כבד נגיפית B נחשבת כאחת מהמחלות המדבקות שמחייבות דווח למשרד הבריאות. לפי נתוני המרכז הלאומי לבקרת מחלות בשנים 2000-2004 שנבנה על סמך הודעות רופאים ללשכת הבריאות. דווח על 498 מקרי דלקת כבד נגיפית מסוג B ושיעור ההיארעות של המחלה הוא 1.519 ל 100000 נפשות.[8]
אפידמיולוגיה
יותר משני בליון בני אדם, כמעט שליש מתושבי העולם נדבקו בדלקת כבד נגיפית מסוג B (דלקת הנגרמת על ידי הנגיף HBV-Virus Hepatitis B, מהם כ-350 מליון בני אדם נשאים כרוניים (2,3). רוב החולים במחלת הכבד הנגיפית מסוג B הם חסרי תסמינים, ולמרות כך המחלה גורמת לאחוזי תמותה גבוהים מהסיבוכים של המחלה כמו אי ספיקת כבד, שחמת (Cirrhosis) וגידול בכבד (מסוג Hepatocellular Carcinoma) (10-11). יותר משליש הנפגעים בעולם הם באסיה, המזרח התיכון ואפריקה.[2]
דרום מזרח אסיה נמנה בעבר כאזור בעל המצאות גבוהה של נשאים, אבל סין היום היא המדינה היחידה באסיה שנשארה בקטגוריה הזאת עם שיעורי המצאות של HBs-Ag חיובי בטווח של 7-20%.[1] התמונה האפידמיולוגית הזו משתנה עם הזמן ככל שתוכניות החיסון למחלה הזאת הופכות להיות יעילות יותר. טייוון לדוגמא נחשבה עד לא מכבר למדינה בעלת שכיחות בינונית, אבל תוכנית החיסון היעילה הורידה את השכיחות של הנגיף והפכה להיות בעלת שכיחות דומה לאזורים הנמוכים. קוריאה, תאילנד והפיליפינים נחשבות למדינות בעלות המצאות בינונית. מדינות בהן ההמצאות נמוכה כוללת בין היתר את יוון, פקיסטאן, בנגלדש ו סרי-לאנקה. שיעור הנשאות במדינות אלו הינו 0.2-1.9% עבור HBsAg חיובי ו 4-10% עבור נוגדני HBV מסוג anti-HBc. במזרח התיכון, בחריין, אירן, ישראל וכווית, 80% מהאוכלוסייה כבר חוסנה נגד HBV במסגרת תוכנית של מערכת חיסון רחבה (Expanded Programme on Immunization (EPI, וכולן נחשבות היום למדינות בעלות שכיחות נמוכה של הנגיף, בשיעור של פחות מ- 2% נשאות ל- HBsAg חיובי.[1]
שיעורי הנשאות לנגיף זה נעים בין 0.63% (באוכלוסייה היהודית-האשכנזים) ל- 8.2% (בקרב חלקים מאוכלוסייה הערבית),[3] אפילו עד 18% בקרב האוכלוסייה האתיופית.[6] במחקר שבוצע בירושלים בשנת 1976,[3] נכללו 1033 אנשים בגילאים שונים שאותרו בבנק הדם ובחדר מיון. שיעור ההמצאות הכללי של HBsAg חיובי היה 1.8%, בקרב האוכלוסייה הערבית היה 3% לעומת 2.2% בקרב התושבים היהודיים ילדי הארץ ו 1.2% בקרב היהודים העולים. בקרב הילודים עד גיל 3 חודשים (שכולם היו ילודים יהודים) השיעור היה אפס. בנוסף הדבקה בנגיף לפי הסמן anti-HBs (בדיקה שבוצעה אז, מעידה על חשיפה לנגיף ומקבילה היום לסמן anti-HBc) הייתה 20.8% בקרב האוכלוסייה הערבית לעומת 4.8% בקרב היהודים ומגיעה עד 9% בילודים מאותו מוצא.
מאוחר יותר, בשנת 1991, שנה לפני תחילת תוכנית החיסון הלאומית, פורסמה בדיקת סקר שבוצעה בבית החולים וכללה 11123 נשים בהיריון בגילאים 24-34. ניתוח הנתונים הראה ששיעור הנשאות לנגיף בקרב הנשים המוסלמיות 4.3% לעומת 0.67% בקרב הנשים היהודיות בעיר.[9]
לאחרונה בוצע מחקר חתכי תיאורי (עבודת סטודנט מאסטר מיח'איל ראני, מרכז רפואי הדסה) בשיתוף והנחיית ביה"ס לבריאות הציבור (ד"ר רונית קלדרון מרגלית) ויחידת הכבד (ד"ר ריפעת ספדי) המרכז הרפואי הדסה ושל שירותי בריאות כללית במחוז ירושלים (ד"ר יפה אשור). איתור אוכלוסיית המחקר התבצע לפי רישומי המעבדה הווירולוגית מתחילת שנת 2005 ולתקופה של 13 חודשים. לפי רשימת השמות, זוהו 164 נשים ערביות בגיל הפוריות (18-44 שנים) עם בדיקת HBsAg חיובית. לאחר מכן אותרו דרך המחשב המרכזי 409 ילדים שענו על קריטריון המחקר (נולדו משנת 1992 וגילם שנה ומעלה). לאחר קבלת אישור ועדת הלסינקי, התבקשו 45 רופאי המשפחה לבצע בדיקות סקר לנשאות HBV לאותם ילדים. התקבלו נתונים עבור 188 ילדים שנולדו ל- 70 אמהות. בשלב האחרון אותר מקום לידתם של 48 ילדים שנולדו ל 24 אמהות ב 4 בתי חולים אשר הסכימו להשתתף במחקר. זיהוי הילדים וסוג החיסון אותו קיבלו בעת לידתם התבצע דרך הרשומות הרפואיות של אותם בתי חולים. ראינו שיעור הנשאות ל-HBV לפי הסמן HBsAg חיובי בקרב אוכלוסיית המבוטחים (2.64%). שיעור הנשאות בקרב המבוטחים הערבים (3.9%) לעומת (1.59%) בקרב היהודים. שיעור הנשאות ל HBsAg חיובי בקרב הנשים הערביות בגיל 18-44 (2.84%) לעומת (0.66%) בקרב היהודיות. שיעור ההדבקה האנכית בקרב הילדים בגיל מעל שנה (8.4%) לפי הסמן anti-HBc חיובי ו (4.4%) שיעור נשאות כרוני לפי הסמן HBsAg חיובי. (37.1%) מהילדים היו עם כייל נוגדנים שלילי לפי הסמן (anti-HBs, (41.4% עם כייל נוגדנים mlU/ml 100- 11 anti-HBs ו (21.5%) עם כייל נוגדנים anti-HBs >100 mlU/ml. הדבקת הילדים ורטיקאלית זוהתה בקרב אלה שקיבלו את החיסון האקטיבי בלבד סמוך ללידתם. אף לא אחד מהילדים שקיבלו את שני החיסונים האקטיבי והפסיבי נדבק מאמו הנשאית. יחד עם שיעורי נשאות ל HBV גבוהים בקרב האוכלוסייה הערבית, המודעות לצורת העברה ורטיקאלית בקרב רופאי הקהילה נמוכה. כלומר, העברה אנכית עדיין קיימת בארץ למרות תוכנית החיסון הלאומית המופעלת היום והמודעות לצורת העברה זו נמוכה. כידוע דרך העברה זו מסתיימת ב- 90% נשאות כרונית עם כל הסיבוכים המאוחרים של המחלה. לכן יש צורך בנקיטת צעדים למניעת ההתפשטות הנגיף וטיפול במקרים הידועים על מנת לחסוך בתחלואה, תמותה ובעלות ההוצאות הכספיות.
אטיולוגיה
צורות הדבקה
כאמור, דלקת כבד נגיפית B היא מחלה מדבקת. הנגיף עלול לעבור בצורה רוחבית מאדם לאדם למשל באמצעות דם מזוהם החודר לגוף דרך מחט מזוהמת. אך הדם אינו האמצעי היחיד העלול לגרום להידבקות במחלה. ידוע שהנגיף עלול להימצא בכל נוזלי הגוף כגון זרע והפרשות מהנרתיק, לכן אפשר להידבק במחלה גם תוך קיום יחסי מין. כך נדבקים לעתים קרובות אנשים החיים עם אדם הנושא את הנגיף, אנשים המקיימים יחסי מין עם יותר מבן זוג אחד, הומוסקסואלים, וצרכני סמים. אך קיים גם כן מעבר אנכי מאמהות נשאיות לילדיהן, השכיחות הגבוהה לצורת העברה זו תוארה בארצות אנדמיות, לדוגמה בדרום מזרח אסיה.[4] העברת הנגיף מאמהות בעלות HBsAg חיובי לתינוקות התבצעה בכ-40 אחוז מהמקרים.[4] העברת הנגיף מהאם הנשאית לתינוק מתרחשת בתעלת הלידה. ההעברה מתבצעת ע"י MICROTRANSFUSIONS בזמן הלידה או ע"י מגע עם נוזלי גוף מזוהמים. דרך העברה זו מסתיימת ב- 90% נשאות כרונית עם כל הסיבוכים המאוחרים האפשריים של שחמת וגידולים עד לכדי מוות.[10] העברת הנגיף בבית החולים יכולה להתרחש אף בין הילדים (הדבקה רוחבית), ותוארה באפריקה ובמזרח התיכון, ובמדינות מסוימות כמו בירדן. שיטת העברה זו גם גורמת לנשאות כרונית אבל בסיכויים יותר קלושים עם פחות סיבוכים כרוניים מאוחרים.[10] כאשר ההדבקות קורת בגילאים יותר מאוחרים למשל בפעילות מינית, רק 5% מהמקרים הופכים להיות נשאים כרונים.[10] העברת הנגיף מהאם לעובר דרך השליה מתבצע בדרך כלל בזמן הופעת דלקת חריפה אצל האם ושכיחה יותר בשליש האחרון להריון. צורת העברה זו מתבצעת בשתי צורת: המטוגנת עם זיהום של תאי אנדותל בקפילרות של השליה או העברה תאית מתא אחד לשני אחוז הזיהום ב HBV יורד בהדרגה לאורך שכבות התאים בשליה מהצד האימהי לעוברי, עם קשר בין זיהום HBV ב-VILLOUS CAPILLARY ENDOTHELIAL CELLS להעברת הזיהום תוך רחמית.[10]} עד היום אין עדות שניתוח קיסרי מונע העברת הנגיף מהאם לתינוק וחלב אם לא מופיע כמגדיל סיכון להעברת הנגיף.[10] שיעור ההדבקה קשור באופן ישיר לעומס הנגיפי אצל האם, שיעור ההדבקה בקרב ילודים שנולדים לאמהות עם HBeAg חיובי (המעיד על מחלה פעילה) הינו סביב ה-90 אחוז.[10]
קליניקה
דלקת כבד נגיפית B בצורתה החריפה עלולה לגרום לסימפטומים קשים ורבים כגון חולשה, עייפות, חום, הקאה וכן להופעת צבע צהוב בעור ובלובן העיניים (צהבת). למרות שהיא גורמת מוות לעתים רחוקות, אלה שחלו בה בצורה חריפה מאושפזים לעתים קרובות, ונזקקים לזמן רב, שבועות ואף חודשים של מנוחה והחלמה לפני שהם יכולים לשוב לחיים תקינים. תקופת הדגירה עלולה להימשך מ 45 ועד 180 ימים והחולה עלול, במשך תקופה זו להיות גורם מדבק ולהוות סכנה לכל מי שבא אתו במגע. המחלה החריפה עלולה להפוך לכרונית ב- 10% - 5% מהנדבקים המבוגרים. בילדים, הסיכון להפוך לחולה כרוני עוד יותר גבוה.[11] הצורה הכרונית של המחלה שונה ומסוכנת הרבה יותר. בדלקת כבד נגיפית B כרונית הסימפטומים עלולים להיות חבויים במשך שנים, בלי שניתן יהיה להבחין בהם. נשא הנגיף איננו מרגיש דבר ואיננו יודע שהוא חולה ואף עלול להדביק אחרים במחלה. במצב זה נגיף המחלה נמצא בגופו, והוא עלול להרוס את הכבד שלו לאט. המחלה הכרונית מאובחנת בשיטות מעבדתיות ויכולה להופיע בשתי צורות, שקטה ופעילה, אשר השנייה מסוכנת יותר ומתאפיינת במספר עותקי נגיף הגבוהים מ 100,000 עותקי DNA במ"ל של דם ובהפרעה באנזימי הכבד. היום דלקת כבד נגיפית B בצורתה הכרונית מטופלת באמצעות תכשירים אנטי ויראליים המאפשרים שליטה בפעילות הנגיף. יחד עם זאת עלולה המחלה לגרום למוות עקב התפתחות שחמת או סרטן הכבד.[11]
אבחנה
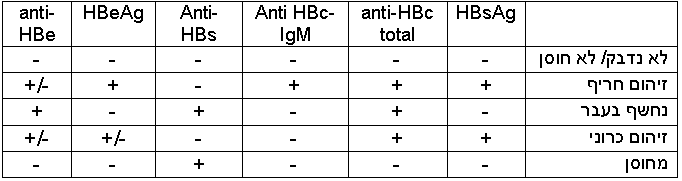
ההדבקה בדלקת כבד נגיפית מסוג B כרוכה בשינויים אופייניים בסרום של החולים, רמות אנטיגנים ונוגדנים מיוחדים. הסמנים הללו בסרום משמשים ככלי לאבחנה בין שלבים קליניים שונים. זיהוי החולים וקביעת שלבי המחלה ניתן לאבחון ע"י שימוש בכלים מעבדתיים.[11] חלבון המעטפת (HBsAg, נקרא אוסטרליאן אנטיגן בעבר), חלבון הליבה (core אנטיגן HBc ) הנמצא בתוך הנגיף ולא משתחרר בקלות למחזור הדם, חלק מה core שכן משוחרר הוא ה- HBeAg, הנגיף עצמו (HBV DNA) בשיטות PCR כמותי ואיכותי. מערכת החיסון מייצרת נוגדנים נגד הסמנים שהוזכרו כולל החלבון הקטן e שהוא חלק מחלבון הליבה וניתן לזהותם בדם. ל- Anti core יש שני סוגים האחד IgM שמרמז על זיהום אקוטי בששה חודשים האחרונים ו- IgG שמרמז על זיהום בעבר.[11]
בדיקות המעבדה[12]
- HBsAg - בדיקת אנטיגן השטח של נגיף הפטיטיס B מעידה על מצב נישאות
- anti-HBs - בדיקת נוגדנים נגד אנטיגן השטח מעידה על חיסון
- anti-HBc - בדיקת נוגדני IgG כנגד נגיף אנטיגן הליבה מעידה על חשיפה בעבר
- Anti HBc-IgM - בדיקת נוגדני IgM כנגד אנטיגן הליבה מעידה על הדבקה חריפה
- HbeAg - אנטיגן הליבה חיובי בזן הבר ובד"כ יותר פעיל בהשואה להעדרו במוטנט
- anti-HBe - בדיקת הנוגדן ל- HBeAg שלילית בזן בר וחיובית במוטנט
- HBV DNA ב-PCR מדד לפעילות נגיפית איכותי/כמותי בנסיוב
משמעותן הקלינית של הסרולוגיות[13]
מניעה
הדרך הטובה ביותר למניעת הדבקה רוחבית היא קבלת חיסון פעיל. החיסון המסורתי בארץ היה ENGERIX-B אך לאחרונה אושר בסל הבריאות חיסון חדש בשם Sci B Vac הכולל לא רק HBsAg אלא גם חלבוני Pre-S1 & Pre-S2 בעלי השפעת יותר אימוגנית (תוצרי הנדסה גנטית. החיסון חדש מביא לתגובה מהירה יותר, רמות נוגדנים יותר גבוהות ואחוזי מגיבים גבוה מתכשירים על בסיס HBsAg בלבד. החיסון להפטיטיס B כולל שלוש זריקות, שניתנות במהלך חצי שנה, ומעניקות חיסוניות למשך שנים רבות. היום מחסנים בארץ את כל התינוקות כחלק משגרת החיסונים בטיפת חלב (זריקה ראשונה מיד אחרי הלידה). כמו כן מחסנים בחיסון הפעיל עובדי מערכת הבריאות, מטיילים למדינות המזרח וקרובי משפחה של חולה או נשא HBV תוך מעקב אחרי רמת הנוגדנים בדמם. בנוסף לחיסונים יש צורך במניעה מכאנית הכוללת, זהירות ממגע ישיר עם הפרשות נשא HBV החולה, דקירות ממחטים או ציוד חד כל שהוא הנמצא בשימוש החולה או הנשא ושימוש בקונדום בעת קיום יחסי מין.[10]
החיסון הסביל HBIG- מושג על ידי מתן אימונוגלובולין ספציפי כנגד הווירוס. החיסון ניתן זמן קצר לפני או מיד לאחר חשיפה ל HBV. ההגנה מיידית, אך יעילה לתקופה של 3 עד 6 חודשים בלבד. החיסון הסביל אינו מומלץ כטיפול מונע לפני החשיפה מכיוון שהוא יקר, יעיל לזמן קצר וגורם לעיתים נדירות לתופעות לוואי לא רצויות כגון שוק אנאפילקטי. HBIG ניתן למבוגר תוך שעות מזמן החשיפה.[1]
טיפול
תרופות אנטי-ויראליות לטיפול בזיהום כרוני בהפטיטיס B
שתי הקבוצות העיקריות של תרופות לטיפול בזיהום כרוני ב-HBV כוללות מעכבים ספציפיים של הנגיף שמנגנון פעולתם הוא עיכוב הפולימרז הנגיפי, ותרופות ממשפחת האינטרפרון שמנגנון פעולתן מורכב וכולל עירור תגובה תאית אנטי-ויראלית, שפעול מערכת החיסון ואף עיכוב ישיר של הנגיף. יתרונן הגדול של התרופות מהקבוצה הראשונה הוא יעילות גבוהה בדיכוי הנגיף בד-בבד עם מיעוט תופעות לוואי. כל זאת במחיר סיכון להתפתחות תנגודת נגיפית בטיפול ארוך טווח (הפירוט להלן).
מעכבי הפולימרז הנגיפי:
הפולימרז הייחודי של נגיף ה-HBV, שהוא בעל פעילות של רוורס טרנסקריפאז (Reverse transcriptase), הכרחי לשכפול הנגיף, ומטבע הדברים הוא מטרה מצוינת לטיפול אנטי-ויראלי. ואכן, בתחילת שנות ה- 2000 אושרה לשימוש התרופה הראשונה ממשפחת מעכבי הפולימרז, Lamivudine.
Lamivudine: אנלוג נוקלאוזידי העובר הכלה (Incorporation) לשרשרת ה- DNA הנוצרת על ידי הפולימרז הנגיפי, ומעכב את פעולתו של זה האחרון. תרופה זו הראתה יעילות רבה בדיכוי נגיף ה- HBV, אולם חסרונותיה העיקריים הם חוסר יכולת להעלים את ה- DNA הנגיפי מגרעין תא הכבד, עובדה המסבירה את הצורך בטיפול ארוך טווח שמשכו רוב חיי החולה, ואחוז גבוה של עמידויות לתרופה המתפתח בקרב המטופלים. עמידות זו, שמקורה העיקרי הוא מוטציה במקטע ה- YMDD של הפולימרז, מתפתחת בכ- 70% מהנוטלים את התרופה לאחר חמש שנים, ומחייבת הוספה של תרופה נוספת לLamivudine (בד"כ Hepsera (Adefovir)) או החלפתה בתרופה מדור מתקדם יותר. לכן, Lamivudine איננה משמשת כיום כקו הראשון בטיפול בחולי HBV, ועיקר שימושה הוא במקרים שבהם דרוש דיכוי קצר טווח של הנגיף, כגון: במחלה חריפה דוהרת (Fulminant) או כטיפול מונע בחולים מדוכאי חיסון [14].
בשנים האחרונות הוכנסו לשימוש תרופות מתקדמות יותר ממשפחת מעכבי הפולימרז. גם לתרופות אלה אין היכולת להכחיד את ה- DNA הנגיפי מגרעין התא המודבק, עובדה המצריכה טיפול ארוך טווח בתכשירים אלה. אולם, יתרונן העיקרי של התרופות מהדור החדש הוא שנוסף על יעילותן הגבוהה בדיכוי שכפול הנגיף, הסיכון להיווצרות תנגודת נגיפית לתרופה הוא נמוך באופן משמעותי מהסיכון שכרוך בטיפול בLamivudine.
Sebivo (Telbivudine): תרופה ממשפחת האנאלוגים הנוקלאוזידיים שהוכיחה יעילות גבוהה יותר ביחס לLamivudine בדיכוי הנגיף (GLOBE study) [15] הן בחולים החיוביים והן בשליליים ל-HBeAg. אף שהסיכון לעמידות נגיפית קטן יותר במטופלים בSebivo ביחס למטופלים בLamivudine, עדיין קיים שיעור עמידות משמעותי בקרב המטופלים בSebivo (10.8% ו- 25% עמידות בשנתיים טיפול בשליליים ובחיוביים ל- HBeAg, בהתאמה). יתרון בולט של Sebivo הוא בטיחות רבה יותר, ביחס למעכבי פולימרז נגיפי אחרים בטיפול בנשים בהיריון (Category B).
Baraclude (Entecavir): תרופה מהדור החדש שהוכנסה לאחרונה לשימוש בישראל, הראתה שיעור עמידות נמוך בחולים נאיביים (כ- 1% עמידות בטיפול ל- 5 שנים). אולם, בחולים שלהם כבר עמידות לLamivudine, שיעור העמידות המתפתחת לBaraclude גבוה בהרבה (כ- 50% עמידות ב- 5 שנים). תרופה זו הראתה יעילות מוגברת בדיכוי הנגיף בחולים חיוביים או שליליים ל- HbeAg בטיפול לשנה, הן ביחס לLamivudine והן ביחס לHepsera ויעילות דומה לזו שנצפתה בטיפול בViread (Tenofovir) או בSebivo. Baraclude נחשבת כיום כתרופה קו ראשון בטיפול בחולי HBV נאיביים [16].
Viread (Tenofovir): תרופה מעכבת פולימרז מסוג אנלוג נוקלאוטידי. היא הראתה עמידות אפסית במעקב של שנתיים בטיפול בחולים נאיביים ויעילות טובה יותר בהשוואה לHepsera לאחר שנת טיפול [17]. זאת ועוד, בעבודה רטרוספקטיבית שפורסמה לאחרונה, נמצא כי בחולים שפיתחו עמידות לLamivudine ו\או לHepsera, מתן Viread היה יעיל מאוד בדיכוי הנגיף [18]. לתרופה זו, שעדיין לא נכנסה לשימוש בישראל, יהיה מקום רב בעתיד בטיפול הן בחולים נאיביים והן בחולים שכבר פיתחו עמידות לטיפול בLamivudine ו\או בHepsera.
המעקב אחר החולים המטופלים במעכבי פולימרז נעשה על ידי בדיקת העומס הנגיפי בדמם אחת ל- 3 חודשים בשנה הראשונה ואחת לחצי שנה לאחר מכן. היעדר ירידה של 2 לוג בעומס הנגיפי לאחר חצי שנה של טיפול לפחות, מעיד על כישלון טיפולי המצריך החלפת התרופה או הוספה של תרופה נוספת. חולה שהגיב היטב לטיפול ובהמשך מפתח עלייה באנזימי הכבד ו\או עלייה בעומס הנגיפי, חשוד להתפתחות של עמידות נגיפית. בחולה זה יש לשלול עמידות על ידי בדיקה מולקולרית מתאימה, ובמקרה שעמידות כזו אכן אומתה יש להחליף את הטיפול.
אינטרפרון: אף שרובם המכריע של החולים הסובלים מזיהום בנגיף ה- HBV מטופלים עדיין בתרופות מקבוצת מעכבי הפולימרז, בעת האחרונה יש מגמה של "חזרה" לטיפול המסורתי של אינטרפרון בחולי HBV כרוניים [19]. היתרונות של טיפול באינטרפרון הוא משך זמן טיפול מוגבל, היעדר עמידות נגיפית ואפשרות ריאלית להיעלמות ה- HbsAg מהדם ולמעשה לריפוי. התכשיר המאושר לשימוש הוא Pegasys (Peginterferon alpha 2a), ומשך הטיפול המקובל הוא 48 שבועות. המועמד האידאלי לטיפול באינטרפרון הוא חולה צעיר עם מחלה פעילה ועומס נגיפי משמעותי, אך לא גבוה מדי, רמות טרנסאמינזות מוגברות (>-3X2 מהנורמה), וגנוטיפ A. יעילות הטיפול בחולים שאינם בקטגוריה זו, כמו גם משך הטיפול ואפשרות להוספת מעכבי פולימרז נגיפי הם נושאים הנמצאים במחקר עכשווי.
מספר עבודות הראו שמעקב כמותי אחר רמת ה- HbsAg בדם הוא כלי יעיל למעקב תוך כדי טיפול, ומעניק חיזוי טוב לגבי סיכויי הצלחת הטיפול, כולל תגובה וירולוגית לטווח הארוך ואפשרות לסילוק ה- HbsAg בעתיד [20]. אולם, ספק אם מעקב אחר רמות HbsAg בדם יחליף לגמרי את המעקב ה"מסורתי" אחר רמת ה- DNA הנגיפי, שכן עבודות אחרונות מצביעות על כך שדווקא המעקב המשולב אחר רמות ה- DNA הנגיפי ורמת ה- HbsAg בדם הוא כלי יעיל יותר למעקב אחר התגובה לטיפול בקרב מטופלי האינטרפרון מאשר מעקב אחר כל אחד מהם בנפרד. לנוכח זאת, ייתכן כי בדיקה כמותית של ה- HBsAg תצורף בעתיד למעקב "המסורתי" אחר רמת העומס הנגיפי ואנזימי הכבד במטופלי אינטרפרון.
הטיפול בהפטיטיס B בקבוצות מיוחדות
לרוב, אין צורך בטיפול אנטי-ויראלי במחלה חדה. הטיפול במחלה חדה יינתן אך ורק לחולים שלהם מהלך דוהר (Fulminant) או לאלה שלהם דלקת כבד המוגדרת כקשה, ואשר מלווה בהארכה ניכרת של ה- INR ו\או בעלייה משמעותית בבילירובין. הטיפול המקובל הוא בLamivudine לנוכח הצורך בטיפול קצר לרוב במתאר זה.
חולים המקבלים טיפול כימותרפי המשולב בסטרואידים, בעיקר זה הניתן לממאירויות המטולוגיות, נמצאים בסיכון ממשי להתלקחות קטלנית של דלקת כבד מסוג B. לכן, יש לבדוק את סטטוס ה- HBsAg בכל חולה המועמד לטיפול כימותרפי או טיפול המדכא את מערכת החיסון.
לאלה הנמצאים חיוביים ל- HBsAg, יש לבדוק אנזימי כבד ועומס נגיפי, ואם הם עומדים בקריטריונים לטיפול כרוני, יש לטפל. באלה שלא מועמדים לטיפול כרוני, יש להתחיל טיפול אנטי-ויראלי מונע שבעה ימים לפחות לפני התחלת הכימותרפיה ועד 6 חודשים לאחר סיומה. טיפול בLamivudine בהחלט סביר במתאר זה.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 WHO 2000. Epidemic and Pandemic alert and response. Electronic version Hepatitis fact sheet 204 from: http://www.who.int/mediacentre/factsheets/fs204/en.
- ↑ 2.0 2.1 2.2 Lee W. Hepatitis B virus infection. N Engl J Med 1997; 337:1733-1745.
- ↑ 3.0 3.1 3.2 Sandler SG, Nath N, Biger Y. Seroepidemiology of hepatitis B virus in Israel. Results of a pilot study in Jerusalem. Am J Epidemiology 1977; 106: 76-82.
- ↑ 4.0 4.1 4.2 Teo EK, Lok A. transmission and prevention of hepatitis B virus infection. Uptodate on epidemiology 2006.
- ↑ Zamir D, Zamir C, Rishpon S. Epidemiology of hepatitis B virus infection among family members of chronic carriers in Israel. Isr Med Assoc J. 2001;3(5):338-40.
- ↑ 6.0 6.1 Zamir C, Dagan R, Zamir D, Rishpon S, Fraser D, Rimon N, Ben Porath Edna. Evaluation of screening for hepatitis B surface antigen during pregnancy in a population with a high prevalence of hepatitis B surface antigen-positive/hepatitis B e antigen-negative carriers. Pediatric infectious disease Volume 1999; 18, 262-266.
- ↑ ספדי ושות', טרם פורסם, הוצג בכנסים של החברה ישראלית לחקר כבד.
- ↑ [1].
- ↑ Bogomolski-Yahalom V, Granot E, Linder N, Adler R, Korman S, Manny N, Tur-Kaspa R, Shouval D. Prevalence of HBsAg carriers in native and immigrant pregnant female populations in Israel and passive/active vaccination against HBV of newborns at risk. J Med Virol 1991.;34:217-22.
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 Broderick A, Jonas M. Overview of hepatitis B virus infection in children. Uptodate June 2006.
- ↑ 11.0 11.1 11.2 11.3 Yeo W, Johnson PJ. Diagnosis, prevention and management of hepatitis B virus reactivation during anticancer therapy. Hepatology 2006; 43:209-20.
- ↑ Lok A. Serologic diagnosis of hepatitis B virus infection. Uptodate June 2006
- ↑ Weinbaum C, Lyerla R, Margolis H. Preventation and control of infections with hepatitis virus in correctional settings. Morbidity and mortality weekly report. Centers for disease control and prevention 2003; 53:1- 34.
- ↑ Shibolet O, Ilan Y, Gillis S, et al. Lamivudine therapy for prevention of immunosuppressive-induced hepatitis B virus reactivation in hepatitis B surface antigen carriers. Blood 2002;100:391-396
- ↑ Lai CL, Gane E, Liaw YF, et al. Telbivudine versus lamivudine in patients with chronic hepatitis B. NEJM 2007;357:2576-2588
- ↑ Woo G, Tomlinson G, Nishikawa Y, et al. Tenofovir and Entecavir are the most effective antiviral agents for chronic hepatitis B:a systemic review and Bayesian meta-analyses. Gastroenterology 2010;139(4):1218-1229
- ↑ Marcellin P, Heathcote EJ, Buti M, et al. Tenofovir disoproxil fumarate versus adefovir dipivoxil for chronic hepatitis B. NEJM 2008;359:2442-2455
- ↑ van Bommel F, de Man RA, Wedemeyer H, et al. Long-term efficacy of tenofovir monotherapy for hepatitis B virus-monoinfected patients after failure of nucleoside/nucleotide analogues. Hepatology 2010; 51:73-80
- ↑ Perrillo R. Benefits and risks of interferon therapy for hepatitis B. Hepatology 2009;49:103-111
- ↑ Moucari R, Mackiewicz V, Lada O, et al. Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients. Hepatology 2009;49:1151-1157
קישורים חיצוניים
- דלקת כבד נגיפית מסוג B, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר ריפעת ספדי, רופא בכיר, יחידת הכבד, מרכז רפואי הדסה ע"כ, ירושלים; ד"ר אמיר שלומאי יחידת הכבד, המכון לגסטרואנטרולוגיה ולמחלות כבד, מרכז רפואי ת"א ע"ש סוראסקי


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק