כאב נוירופתי מרכזי - קליניקה, פתופיזיולוגיה ואבחון - Central neuropathic pain - presentation, pathophysiology and diagnosis
| כאב נוירופתי מרכזי - קליניקה, פתופיזיולוגיה ואבחון | ||
|---|---|---|
| Central neuropathic pain - presentation, pathophysiology and diagnosis | ||
| ICD-10 | M79.2 | |
| ICD-9 | 729.2 | |
| יוצר הערך | פרופ' רות דפרין | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – כאב נוירופתי , כאב מרכזי
כאב מרכזי (Central pain) מוגדר ככאב המתפתח ישירות בעקבות נזק או מחלה במערכת העצבים המרכזית (Central Nervous System, CNS) ולפיכך הוא שייך לקטגוריה של כאב נוירופתי (Neuropathic pain)[1]. מאחר והכאב המרכזי קשור ישירות לנזק מרכזי, כאב משני לתהליכים מרכזיים כמו כאב עוויתי (Spastic pain) בטרשת נפוצה (Multiple sclerosis), אינו נכלל בהגדרה זו. כמו כן, שינויים ב-CNS בעקבות נזקים פריפריים, כמו שינויים בקרן האחורית (Dorsal horn) בעקבות נוירופתיה פריפרית (Peripheral neuropathy) אינם נכללים בהגדרה. חשוב לזכור כי אנשים עם נזקים או מחלות ב-CNS עלולים לסבול מכאבים נוספים, שאינם כאב מרכזי.
פתולוגיות הגורמות לכאב מרכזי יכולות להתקיים בכל מקום ב-CNS, כולל חוט השדרה (Spinal cord), גזע המוח (Brainstem) והמוח. הכאב מרכזי הוא כאב כרוני חזק, המורגש באזורי הגוף שבהם חלה פגיעה תחושתית (שלמה עד כדי שיתוק מלא, או חלקית) עקב הנזק ל-CNS, והוא משפיע על איכות החיים ועל התפקוד של האדם ומקשה על שיקומו. הפתופיזיולוגיה של הכאב איננה ברורה דיה, אולם ידוע כי תנאי הכרחי לכאב מרכזי הוא פגיעה במערכת הספינותלמית (The Spinothalamic system), לפיכך סימן זיהוי חשוב הוא ירידה או אבדן בתחושות כאב וטמפרטורה באזורי הכאב. התפתחות רגישות ותגובתיות יתר עצבית באזור הכאב אופייניות אף הן. כאב מרכזי נחשב לעמיד יחסית בפני טיפולים אולם אבחנה מדויקת, המתבצעת סמוך ככל האפשר למועד התפרצותו, עשויה לשפר את יעילות הטיפול.
היסטוריה
האזכור הראשון לכאב מרכזי נעשה על ידי Greiff (1883), שתיאר מטופל שפיתח כאב כרוני לאחר נזק איסכמי למוח שכלל את הרמה (Thalamus). בעקבות זאת, טען Edinger (1891) לקיומו של כאב מרכזי, שכן כבר אז היה ידוע שהרמה נחשבת גורם עיקרי לכאב מרכזי משום שמגיעים אליה מסלולים סנסורים. טענה זו חוזקה על ידי הנוירולוגים הצרפתים Dejerine and Roussy (1906), אשר ביצעו ניתוחים לאחר המוות בשישה אנשים שסבלו מכאב כרוני בעקבות אירוע מוח ומצאו מתאם בין המאפיינים הקליניים שלהם לבין הנזקים ברמה. הם כינו את הכאב הזה בשם התסמונת הרמתית (The thalamic syndrome). Edinger הוסיף וטען כי גם נזקים בקליפת המוח (Brain cortex) יכולים לגרום לכאב מרכזי, לאור מקרים של כאב בזמן התקפים אפילפטיים. מאוחר יותר תוארו מקרים של כאב מרכזי לאחר נזקים בגזע המוח, במיוחד באזור המוח המוארך (Medulla oblongata), על ידי Ridoch (1938) ואחרים. מלחמת העולם הראשונה הביאה לתיאורים נוספים של כאב מרכזי לאחר חבלות בחוט השדרה. הנוירולוג Holmes תיאר פצועי מלחמה שנפגעו בחוט השדרה וסבלו, לדבריו, מכאב ומרגישות יתר בדומה לאלה שתוארו בתסמונת הרמתית.
שמות נרדפים לכאב מרכזי הם: Deafferentation pain, Disaesthetic pain, Central disaesthesia syndrome, Thalamic pain, Pseudothalamic pain, Central post stroke pain, Central deafferentation.
הגורמים לכאב מרכזי
היום ידוע כי הנזקים ב-CNS אשר עלולים לגרום לכאב מרכזי כוללים[2]:
- חבלה
- נזקים וסקולריים (אוטם, דימום, פגם וסקולרי)
- טרשת נפוצה
- סירינגומייליה (Syringomyelia) וסירינגובולביה (Syringobulbia)
- גידולים
- מורסה (Abscess)
- מחלות דלקתיות ו/או נגיפיות
- כיפיון (אפילפסיה, Epilepsy)
- מחלת פרקינסון (Parkinson's disease)
על פי מספר מקורות, המצבים בהם כאב מרכזי הוא הנפוץ ביותר הם חבלות בחוט השדרה (40-90% מהמקרים), טרשת נפוצה (23-30%) ושבץ מוחי (50-67%). קיימים קווי דמיון בכאב המרכזי בנפגעי חוט שדרה ובאנשים שחוו שבץ. הדמיון בין שתי אוכלוסיות אלו אינו מקרי.
נפגעי חוט שדרה
תמונה קלינית
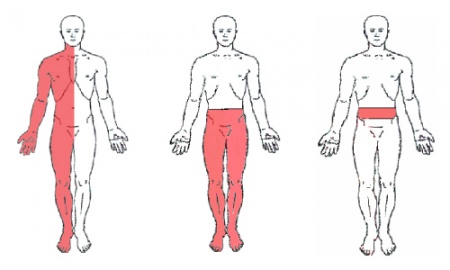
נפגעי חוט שדרה עלולים לסבול מכאבים כרוניים מסוגים שונים כגון נוירופתיה פריפרית, כאב שמקורו בשריר שלד (Musculoskeletal pain), כאב שמקורו באיברים פנימיים (Visceral pain) ועוד. יחד עם זאת, הכאב הבעייתי ביותר להתמודדות הוא כאב מרכזי. כאב מרכזי בנפגעי חוט שדרה עשוי להיות ממוקם בגובה הפלס התחושתי (At level central pain) או מתחת לגובה הפלס התחושתי (Below level central pain) והוא יורגש באזורים המשותקים באופן חלקי או מלא (תמונה מספר 1). כלומר, כאב מרכזי נפוץ באנשים עם פגיעה שלמה או חלקית בחוט השדרה, ללא הבדל בשכיחות ביניהם. לכאב מספר איכויות אופייניות: לרוב הוא מתואר כבוער או שורף, אך גם כדוקר או לוחץ, חותך, מועך, חודר או דמוי זרם חשמלי. לרוב, נפגעי חוט שדרה מדווחים על יותר מאיכות אחת של כאב, אך אופייני שהכאב יתואר כעמוק[3],[4],[5],[6].
באזורי הגוף המשותקים באופן חלקי או מלא, הכאב מפושט ללא כל חוקיות דרמטומלית. לדוגמה, הכאב יכול להיות ממוקם ברגל אחת או שתיים, בברך של רגל אחת ובירך וכף הרגל של הרגל השנייה וכדומה. הכאב יכול לכלול את כל אזורי הגוף מתחת לפלס הפגיעה או "איים" המפוזרים על פני הגוף. מה גם, שללא קשר לגובה הסגמנט הפגוע (צווארי, חזי או מותני), בהרבה מהמקרים הכאב כולל בעיקר את החלקים הדיסטליים של הרגליים (שוקיים וכפות רגליים)[3],[4],[5],[6].
כאשר מבצעים בדיקה תחושתית של אזורי הגוף הכואבים מתחת לגובה הפלס התחושתי, מתגלה פרופיל תחושתי אופייני הכולל פגיעה חלקית או שלמה של תחושות טמפרטורה (חום, קור וכאב תרמי) והישרדות יחסית של תחושות מגע קל ווויברציה. יש לציין כי באנשים עם פגיעה שלמה בחוט השדרה לא ניתן לעורר תחושות מתחת לפלס, אולם מדידות באזור הפלס ידגימו פרופיל תחושתי דומה. ממצא זה מצביע על פגיעה במערכת המסילות הספינותלמיות (Spinothalamic tracts) והישרדות יחסית של המסילות הדורסליות (Dorsal columns).
כאב המתפתח עקב פגיעות ספינליות מתחת לגובה חוליה L1 עלול להיות כאב נוירופתי ממקור פריפרי משום שהפגיעה העצבית בגובה זה תהיה בשורשי זנב הסוס (Cauda equina), דיסטלית לקצה התחתון של חוט השדרה. מעורבות פריפרית תיתכן גם במצבים של כאב בגובה הפלס התחושתי עקב פגיעה בשורשים במהלך החבלה בחוט השדרה[2].
מהלך הופעת הכאב המרכזי ותחושות נלוות
כאב מרכזי בנפגעי חוט השדרה יכול להתפתח בין ימים לשנים לאחר החבלה, אולם ברוב המקרים הוא מתפתח תוך כשלושה עד חמישה חודשים אחרי. ידועים גם מקרים של כאב מרכזי שהתעורר גם שנים לאחר החבלה. לאחר התפתחותו, הכאב נותר שנים, בדרך כלל לכל החיים. עוצמת הכאב בדרך כלל חזקה, מתוארת תכופות כבלתי נסבלת והיא קבועה או משתנה. רוב נפגעי חוט השדרה מדווחים כי הכאב מחריף עם השנים.
בנוסף לאובדן התחושתי הנובע מעצם הפגיעה בחוט השדרה, הכאב המרכזי מלווה גם הוא בתופעות תחושתיות פתולוגיות אשר תורמות לעתים להחרפתו:
- אלודיניה (Allodynia) - אחת התחושות הנפוצות. מדובר במצב בו גירוי קל ולא מכאיב גורם לכאב חזק. כך, נפגעי חוט שדרה מדווחים על כאב בעקבות מגע קל, כמו מגע הבגד או הסדין, מים קרים או חמימים ועוד
- דיסאסטזיות (Dysesthesia) - תחושות אבנורמליות לא נעימות או מכאיבות, ספונטניות או מעוררות על ידי גירוי סומטי, וכמו כן גם תחושות תרמיות אבנורמליות של קור וחום לסירוגין
תחושות אלו קיימות באזורי הכאב מתחת לפלס התחושתי רק באנשים עם פגיעה חלקית בחוט השדרה. לעומת זאת, באנשים עם פגיעה שלמה, התחושות יכולות להופיע באזור הפלס עצמו. כאב מרכזי יכול להיות מוחמר על ידי גורמים חיצוניים כגון שינויי מזג אוויר ומגע בגדים וכן על ידי גורמים פנימיים כגון מלאות של שלפוחית השתן או הקיבה, תנועה, מחלות חום, מתח ועצבנות[3],[4],[5],[6].
המנגנון המשוער
המנגנון האחראי להתפתחות כאב מרכזי בנפגעי חוט שדרה אינו ברור עדיין. יחד עם זאת, עדויות המבוססות על רישומים מתאי עצב בחוט השדרה בבעלי חיים ובבני אדם, על מחקרים פרמקולוגיים ועל מדידות פסיכו-פיזיות, מאפשרות להעלות השערה אשר מקובלת על רוב החוקרים. הטענה היא כי לקבוצות תאי עצב (Neuronal pools) בחוט השדרה ובכל מקום אחר לאורך העץ העצבי, קיים פוטנציאל להפוך למוקדים של פעילות חשמלית עצמונית (כלומר לפעול כמעין קוצבים)[7],[8]. במצב תקין, המוקדים הללו נמצאים תחת בקרה של קלטים תחושתיים הנכנסים לחוט השדרה (עיכוב סגמנטלי) ושל מסילות מעכבות היורדות מגזע המח, שהטריגר להפעלתן הוא קלט מכאיב העולה למרכזים אלה דרך המסילות הספינותלמיות. אולם, כאשר חלה דה-אפרנטציה (Deafferentation) של המסילות הספינותלמיות ונתק בהולכה של סיבים תחושתיים, שבעקבותיו חלה הפחתה במנגנונים המעכבים מגזע המוח, מופחתת או מופסקת הבקרה הקיימת על אותן קבוצות תאי עצב ספינליים ששרדו את החבלה. או אז, תאי העצב הללו עלולים לפתח ירי פתולוגי ספונטני שמהווה הבסיס לכאב הספונטני[9],[10].
עדויות אכן מראות כי תאי עצב ספינליים ששרדו את הנזק יורים בהתפרצויות חשמליות אבנורמאליות במקביל להתפרצויות הכאב. תכונות תאי העצב הללו, יחד עם הסרת הבקרה המעכבת עליהם, גורמות להם להיות רגישים מהרגיל לעירור, מצב אשר יכול להסביר אלודיניה ודיסאסטזיה באנשים עם כאב מרכזי. רגישות יתר חשמלית זו נובעת מהיעדר עצבוב ומכונה Denervation supersensitivity. עדויות מבעלי חיים מראות התבטאות יתר של תעלות נתרן מסוג NAV1.3 ושל קולטנים לגלוטמט (Glutamate) באותם תאי עצב ששרדו את הנזק. חסימתם של התעלות והקולטנים הללו מפחיתה את רגישות היתר לגירויים השונים[9],[10]. מאחר והתאים הללו שולחים קלט של כאב נוציספטיבי לרמה ולקליפת המוח, מבנים המעורבים בעיבוד המרכיבים הסנסורים של הכאב, הרי שהכאב יכול להיות מורגש גם באזורים אשר מהם לא מגיע הקלט ישירות. זאת ועוד, עם הזמן, תאי עצב ברמה ובקליפת המוח הסומטו-סנסורית מפתחים גם הם פעילות חשמלית פתולוגית שעשויה להיות קשורה לכאב הספונטני המתפרץ, לרגישות היתר ולהגברת הכאב בעקבות גירויים לא מכאיבים או בעקבות מצבי מחלה ודחק נפשי. ואכן, גירוי הרמה בנפגעי חוט שדרה הסובלים מכאב מרכזי מעורר את תבניות הכאב שלהם.
בנוסף, מחקרי דימות תפקודיים הראו פעילות מוגברת ברמה בעקבות גירוי אזורים אלודיניים בנפגעי חוט שדרה עם כאב מרכזי[11],[12],[13]. הפוגה חלקית של כאב מרכזי בנפגעי חוט שדרה ושל התנהגות כאב במודל חיה של כאב מרכזי, באמצעות אופיאטים (Opiates) ואגוניסטים לקולטני GABA, מחזקת את ההשערה כי הפחתה במנגנונים המעכבים, במקביל להתפתחות רגישות ותגובתיות יתר, הן הבסיס למנגנון הכאב המרכזי באוכלוסייה זו.
שבץ מוחי
תמונה קלינית
כאב מרכזי יכול להתפתח לאחר נזקים באזורים שונים במוח והיארעותו תלויה באזור שנפגע. לדוגמה, נמצא כי 25-67% מהאנשים עם אוטם במוח המוארך מפתחים כאב מרכזי. לעומת זאת, רק 18-20% מבין האנשים עם אוטם ברמה מפתחים כאב מרכזי[14],[15]. בדומה לנפגעי חוט שדרה, גם אנשים שעברו שבץ מוחי יכולים לסבול מכאב כרוני מסוגים שונים, בעיקר על רקע כאב שמקורו בשריר שלד או כאב נוירופתי פריפרי. אחד הכאבים הנפוצים ביותר באוכלוסיה זו הוא כאב כתף (Hemiplegic shoulder pain). אולם, על אף שפע גורמים אפשריים שמקורם בשרירי שלד או ממקורות נוירופתים פריפריים לכאב כתף באוכלוסייה זו, ייתכן שבחלק מהמקרים כאב הכתף הוא ממקור מרכזי[16].
כאב מרכזי לאחר שבץ ממוקם תמיד במחצית הגוף המנוגדת לצד שבו התרחש השבץ. באזורים שבהם קיימת פגיעה תחושתית שלמה או חלקית (תמונה מספר 1), הכאב עלול להיות מורגש בכל מחצית הגוף, או בחלקים ממנה, ללא חוקיות דרמטומלית אולם כתלות במיקום האוטם. לדוגמה, כאב פנים חד צדדי במיוחד באזור ארובת העין (Periorbital area) נפוץ יחסית (31-56% מהמקרים) באנשים שעברו אוטם במוח המוארך (Lateral medullary syndrome ,Wallenberg's syndrome), בעוד שכאב במחצית הגוף נפוץ במיוחד לאחר אוטם ברמה (80% מהמקרים).
כמו בנפגעי חוט שדרה, בדיקה תחושתית באזורי הגוף הכואבים מראה פרופיל תחושתי אופייני הכולל פגיעה משמעותית עד אובדן מוחלט של תחושות טמפרטורה (חום, קור וכאב תרמי) ופגיעה חלקית של תחושות מגע קל ווויברציה (במצבים שבהם קיים שיתוק מלא, לא ניתן לעורר בצד הפלגי תחושות כלל). ממצא זה מצביע על פגיעה קשה יותר במערכת המוליכה כאב וטמפרטורה (המערכת הספינותלמית-תלמוקורטיקולרית), בהשוואה לזו של המערכת המוליכה תחושות מגע (המערכת הדורסלית).
מהלך הופעת הכאב המרכזי ותחושות נלוות
הכאב המרכזי מתפתח בתוך שלושה עד שישה חודשים מאירוע השבץ, אולם ברוב המקרים הוא יופיע כבר במהלך החודש הראשון. קיימים מקרים נדירים שבהם הכאב הופיע מספר שנים לאחר השבץ[14],[15],[17]. כאב מרכזי לאחר שבץ מוחי הוא בדרך כלל בינוני עד חזק בעוצמתו. עוצמת הכאב עלולה להיות קבועה או משתנה וייתכן אף מצב של כאב קבוע עם התפרצויות של כאב חזק יותר. הכאב מתואר כבוער או שורף בעיקר, אך קיימים גם תיאורים של כאב דוקר, יורה, לוחץ ומועך.
לירידה התחושתית מתלוות תחושות פתולוגיות בדומה לקורה בנפגעי חוט השדרה:
- אלודיניה - הנפוצה ביותר. אנשים אחרי שבץ מוחי הסובלים מכאב מרכזי מדווחים על אלודיניה לקור ואלודיניה מכאנית בעקבות תנועה או פעילות גופנית[14],[15],[18]
- דיסאסטזיה - אופיינית גם היא באזורים אלה
הכאב המרכזי באנשים לאחר שבץ מוחי יכול להיות מוחמר על ידי גורמים שונים כאשר הנפוצים ביותר הם מזג אוויר קר וסטרס[14],[15].
המנגנון המשוער
בדומה לכאב מרכזי ממקור חוט שדרה, כאב מרכזי ממקור מוחי אינו מובן דיו. המחקר בתחום אינו מפותח כמו בנפגעי חוט שדרה אולם גם כאן הועלו מספר השערות אשר לחלקן ביסוס מחקרי. מוסכם כי הגורם ההכרחי להתפתחות כאב מרכזי לאחר שבץ מוחי הוא דה-אפרנטציה ספינותלמית (Spinothalamic deafferentation). ההשערה היא שתאי עצב דה אפרטנים בחלק הפוסטרו-מדיאלי של הרמה, אשר שרדו את הנזק, מפתחים התפרצויות ירי פתולוגיות, מצב המבטא רגישות מוגברת של אזור זה[19],[20]. התפרצויות אלו מתאפשרות עקב הסרת העיכוב המופעל בדרך כלל על תאי עצב אלה מצד גרעין בחלק הפוסטרו-לטראלי של הרמה אשר ניזוק או עקב הסרת העיכוב המופעל על האזור המדיאלי של הרמה מצד קליפת המוח. בהמשך להשערה זו אף נטען כי ארגון מחדש של שדות הקלט (Receptive fields) של תאי העצב בחלק הלטראלי של הרמה אחראי גם הוא להתפתחות תבניות כאב אבנורמליות[19],[21]. רגישות מוגברת של תאי העצב ברמה ו/או בקליפת המוח הסומטוסנסורית, ששרדו את הנזק המוחי, יכולה להיות הבסיס לכאב הספונטני ולהפרעות התחושתיות המלוות את אזורי הכאב.
אבחון כאב מרכזי[2],[15]
- תנאים הכרחיים
- הימצאות ברורה של פגיעה מרכזית (בחוט השדרה או במוח, בהתאמה)
- שלילת גורמים אחרים לכאב כגון כאב נוציספטיבי ונוירופתיה פריפרית
- התפתחות הכאב לאחר הפגיעה המרכזית
- חסרים תחושתיים באזורים שקשורים לפגיעה המרכזית, בעיקר אינדיקציה לפגיעה ספינותלמית (בפלס או מתחת לפלס בנפגעי חוט שדרה, או בצד הגוף המנוגד למיקום האוטם, בהתאמה)
- כאב הממוקם בטריטוריה של החסר התחושתי
- סימנים וסימפטומים התומכים באבחנה
- הימצאות רגישות יתר באזור הכאב, במיוחד אלודיניה
- התפרצות הכאב תוך שנה, בדרך כלל תוך שישה חודשים מהפגיעה המרכזית
- ירידה או אבדן תחושת קור ו/או חום
- כאב בוער או שורף וכאב שטחי
ביבליוגרפיה
- ↑ Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW, Hansson P, Hughes R, Nurmikko T, Serra J. Redefinition of neuropathic pain and a grading system for clinical use: consensus statement on clinical and research diagnosis criteria. Neorology 2008;70;1360-5.
- ↑ 2.0 2.1 2.2 Boivie J. Central pain. McMahon SB, Koltzenburg M. (eds) in: Wall and Melzack's textbook of pain. Churchill Livingstone, London. Fifth Edition. 2006. pp 1057-1074.
- ↑ 3.0 3.1 3.2 Finnerup NB, Johannesen IL, Fuglsang-Frederiksen A, Bach FW, Jensen TS. Sensory function in spinal cord injury patients with and without central pain. Brain 2003;126:57-70.
- ↑ 4.0 4.1 4.2 Defrin R, Ohry A, Blumen N, Urca G. Characterization of chronic pain and somatosensory function in spinal cord injury subjects. Pain 2001;89:253-63.
- ↑ 5.0 5.1 5.2 Siddall PJ, McClelland JM, Rutkowski SB, et al. A longitudinal study of the prevalence and characteristics of pain in the first 5 years following spinal cord injury. Pain 2003;103:249-57.
- ↑ 6.0 6.1 6.2 Zeilig G, Enosh S, Rubin-Asher D, Lehr B, Defrin R. The nature and course of sensory changes following spinal cord injury: predictive properties and implications on the mechanism of central pain. Brain 2012; 135(2):418-430.
- ↑ Edgar RE, Best LG, Quail PA, Obert AD. Computerassisted DREZ microcoagulation: Posttraumatic spinal deafferentation pain. J Spinal Disord 1993;6(1):48-56.
- ↑ Wasner G, Lee BB, Engel S, McLachlan E. Residual spinothalamic tract pathways predict development of central pain after spinal cord injury. Brain 2008;131(Pt 9):2387-400.
- ↑ 9.0 9.1 Boroujerdi A, Zeng J, Sharp K, Kim D, Steward O, Luo ZD. Calcium channel alpha-2-delta-1 protein upregulation in dorsal spinal cord mediates spinal cord injury-induced neuropathic pain states. Pain 2011;152(3):649-55.
- ↑ 10.0 10.1 Hains BC, Waxman SG. Sodium channel expression and the molecular pathophysiology of pain after SCI. Prog Brain Res 2007;161:195-203.
- ↑ Murray PD, Masri R, Keller A. Abnormal anterior pretectal nucleus activity contributes to central pain syndrome. J Neurophysiol 2010;103(6):3044-53.
- ↑ Lenz F, Martin R, Tasker R, et al. Characterization of somatotopic organization and spontaneous neuronal activity in the region of the thalamic principle sensory nucleus in patients with spinal cord transection. J Neurophysiol. 1994;72:1570-1587.
- ↑ Wrigley PJ, Press SR, Gustin SM, Macefield VG, Gandevia SC, Cousins MJ, et al. Neuropathic pain and primary somatosensory cortex reorganization following spinal cord injury. Pain 2009; 141(1-2): 52-9.
- ↑ 14.0 14.1 14.2 14.3 Andersen G, Vestergaard K, Ingeman-Nielsen M, Jensen TS. Incidence of central post stroke pain. Pain 1995;61;187-193.
- ↑ 15.0 15.1 15.2 15.3 15.4 Klit H, Finnerup NB, Jensen TS. Central post-stroke pain: clinical characteristics, pathophysiology, and management. Lancet Neurol 2009;8(9):857-68.
- ↑ ZeiligG, RivelM, Weingarden H, Gaidoukov E, Defrin R. Hemiplegic shoulder pain: Evidence of a neuropathic origin. Pain 2013;154:263-271.
- ↑ Misra UK, Kalita J, Kumar B. A study of clinical, magnetic resonance imaging, and somatosensory evoked potential in central post stroke pain. J Pain 2008;9(12);1116-1122.
- ↑ Greenspan JD, Ohara S, Sarlani E, Lenz FA. Allodynia in patients with post-stroke central pain (CPSP) studied by statistical quantitative sensory testing within individuals. Pain 2004;109(3):357-66.
- ↑ 19.0 19.1 Casey LK. Pathophysiology of central poststroke pain: the contribution of functional imaging and a hypothesis. Henry JL (ed) in: central neuropathic pain: focus on poststroke pain. IASP press, Seatle. 2007 pp 115-131.
- ↑ Kim JH, Greenspan JD, Coghill RC, Ohara S, Lenz FA. Lesions limited to the human thalamic principal somatosensory nucleus (ventral caudal) are associated with loss of cold sensations and central pain. J Neurosci 2007;27(18);4995-5005.
- ↑ Kalita J, Kumar B, Misra UK, Pradhan PK. Central post stroke pain: clinical, MRI, and SPECT correlation. Pain Med 2011;12:282-8.
קישורים חיצוניים
- כאב נוירופתי מרכזי – פתופיזיולוגיה ואבחון, Medic Digital אוקטובר 2013, מגזין רפואי בתחום הכאב
המידע שבדף זה נכתב על ידי פרופ' רות דפרין - בית הספר למקצועות הבריאות, בית הספר לרפואה ע"ש סאקלר, אוניברסיטת תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק