סרטן הערמונית - טיפול בהקפאה - Prostate cancer - cryotherapy
| סרטן הערמונית - טיפול בהקפאה | ||
|---|---|---|
| Prostate cancer – cryotherapy | ||
| 250px | ||
| יוצר הערך | ד"ר שמואל ציטרון 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן הערמונית
קריותרפיה מוגדרת כהקפאה במקום (In situ) של רקמת מטרה כדי להרסה בשוליים מוגדרים ללא פגיעה משמעותית בסביבה.
הקריותרפיה נחשבת לטיפול זעיר פולשני (Minimally invasive procedure) והיא יעילה מאוד. גבולות שדה הטיפול מודגמות היטב ונשלטות בקלות, ואחוז הסיבוכים נמוך ומהותם קלה בעיקר. הפרוצדורה היא זעיר פולשנית אמיתית. הפעולה נשלטת על ידי המנתח ואינה סכמטית וכמובן, תוצאות הפעולה תלויות ביכולתו של המבצע.
מטרות הקריותרפיה של הערמונית בטיפול זעיר פולשני הן לחסל את הגידול המקומי, להפחית את תופעות הלוואי, לקצר את תקופת האשפוז, להביא לחזרה מהירה לתפקוד היומיומי ולעבודה ולצמצם את עלויות הטיפול בסרטן הערמונית.
התפתחות הטיפול בקריותרפיה בסרטן הערמונית
שנות השישים
מתמרי הקריו היו גדולים בממדיהם, ובעיקרון ההקפאה נעשתה באמצעות חנקן נוזלי בדחיסה. ניתן היה אך ורק להקפיא, ללא אפשרויות לחמם. למעשה מתמר בודד היה זה שייצר את כדור הקרח. השימוש במתמרים גדולים אלו נעשה בגישה טרנסאורטרלית או בגישה ניתוחית פרינאלית פתוחה. הם מוגדרים דור ראשון.
הטיפולים הוגדרו כיעילים, אך תופעות הלוואי היו משמעותיות, הן בעצמתן והן בשכיחותן, ולכן שיטה זו לא זכתה לפופולריות, ואף ננטשה לדורות.
שנות התשעים
בשנות התשעים הופיע הדור השני, של מכשיר הקריו: המתמרים היו דקים יותר משמעותית, אך עדיין גדולים מספיק, וניתן היה להשתמש בשניים עד חמישה מתמרים בו-זמנית (תלוי בגודל הערמונית ובצורתה).
החידוש בדור השני בא לידי ביטוי בנקודות הבאות:
- הנחיית US במיקום המתמר
- שימוש בכמה מתמרים בו-זמנית
- שימוש במחממים שופכתיים שהפחיתו בהרבה את תופעות הלוואי
המצויין לעיל שיפר משמעותית את הפרופיל הבטיחותי של שיטת הטיפול בהקפאה.
שנות האלפיים
בשנות האלפיים פותח הדור השלישי של מכשירי הקריו. בדור זה השתמשו בגזים אצילים: ארגון לקירור, והליום לחימום.
המעבר לגזים אלו בלחצים גבוהים מאוד איפשר להוריד את ממדי המתמרים לממדי מחטים 17G, דהיינו מחטים המכונים Cryo needles. את המחטים האלה ניתן לפזר בצורה הומוגנית ברקמת הערמונית (לפי שיקול דעתו של המנתח ולפי ניסיונו), כך שניתן להגיע לפיזור הקרח בצורה הומוגנית, ולהימנע מ"אזורים חמים" - אזורים שבהם ההקפאה היא תת-אופטימלית.
השימוש בגז מחמם מאפשר שליטה טובה בכל שלבי ההקפאה ואף לעצור בזמן, בטרם יתפשט כדור הקרח לרקמות סמוכות שמעוניינים לשמרן, כמו דופן הרקטום למשל.
נוסף על כך, קוטר מחטי הקפאה אלו מאפשר לנעוץ אותן בדופן הרקטום כדי לחממו וכדי למנוע את קפיאתו, בזמן שכדור הקרח בעצמת טמפרטורה של C°40 - ואף פחות מזה מקפיא את הדופן האחורית של הערמונית, הסמוכה מאוד.
בהתאם לכך מכשירי הקריו של הדור השלישי מציעים אפשרויות הקפאה יעילות מאוד, פרופיל בטיחות גבוה מאוד, אפשרות להקפיא בלוטות ערמונית גדולות עד 120-140 סמ"ק, וכל זאת בהנחיית אולטרה-סאונד טרנס רקטלי (TRUS).
עקרונות הקריו-ביולוגיה
הקפאה אטית (Low cooling rate) משמעה ירידת הטמפרטורה עד C°1-5 בדקה.
ההקפאה האטית יוצרת מצב של היפותרמיה שבו מתרחשים התהליכים האלה:
- הנוזל החוץ תאי מתקרר ומתגבש
- הסביבה הופכת להיפראוסמוטית - ריכוז האלקטרוליטים מאמיר
- התאים חווים התייבשות (דהידרציה) ומתכווצים
- הממברנות ומרכיבי התא ניזוקים בצורה רצינית
המסקנה מכך היא שהקפאה אטית אינה גורמת תמיד לתאים למות.
הקפאה מהירה (High cooling rate), דהיינו ירידת הטמפרטורה עד C°20-25 בדקה, גורמת להיפותרמיה משמעותית יותר במקרים האלה:
- תמס (Lysis) של התאים
- נמק קרישתי (Coagulative necrosis)
- הממברנות התאיות ומרכיבי התא נפגעים פיזית בתהליך התגבשות הקרח
מסקנה: הקפאה מהירה מאיימת בצורה משמעותית על חיות התאים, וגורמת כמעט תמיד למותם.
ניתן לסכם ולומר כי:
- הקפאה מהירה עדיפה ויש להשתמש בה (מכשירי קריו מהדור השלישי)
- הפשרה נחוצה
- שני מחזורי הקפאה-הפשרה מניבים תוצאות טובות יותר בהרג התאים ברקמה מאשר מחזור בודד אחד
מנגנון הפגיעה ויצירת הנזק לתאים:
- פגיעה ישירה בתאים:
- ההקפאה החוץ תאית (אקסטרה-צלולרית)
- ההקפאה התוך תאית (אינטרה-צלולרית)
- אפקט ההפשרה
- פגיעה וסקולרית ואיסכמיה
- מסלול נוסף להרג התאים בעקבות הקפאה:
- מזרז את מסלול האפופטוזיס
- מאיץ תהליכים אימונולוגיים בגוף
בעשור האחרון חל שיפור ניכר ומשמעותי בטכנולוגית הקריו: פותחו מחטים דקות בגדלים שונים ובעצמת פעולה גבוהה, דבר המביא לשיפור בהולכת הקרח באופן הומוגני יותר ברקמה. היווצרות הקרח מהירה יותר, עובדה המקצרת את זמן הפעולה, ולרוב אין צורך ב"משיכה אחורה" (Pullback). כל זאת בזמן שהחדירה לגוף מינימלית: נראים סימני דקירה בלבד.
השימוש ב- TRUS הוא בעל חשיבות ראשונה במעלה. מכשור ה- TRUS שופר מאוד טכנולוגית, וכיום רוב האורולוגים מאומנים בשימוש בו.
התוצאות המושגות הן מצוינות מחד גיסא, ותופעות הלוואי המשמעותיות נדירות יותר מאידך גיסא. כמו כן הפעולה קלה יחסית ללמידה.
נוכח המצוין לעיל משתמע שיתרונות הטיפול בהקפאה (Cryotherapy) הן אלה:
- פעולה זעיר פולשנית
- אשפוז קצר וחזרה מהירה לפעילות שגרה
- מתאים ביותר לכישלון של טיפול קרינתי (Radiation failure)
- תחליף מצויין לטיפול קרינתי, הן חיצוני והן ברכיתרפיה
- תחליף טוב לטיפול הורמונלי ראשוני
- מתאים מאוד לחולים המצויים בסיכון ניתוחי גבוה (High-risk patients)
- שליטת האורולוג ומעקבו
התוויות לטיפול בקריותרפיה בחולי סרטן הערמונית
טיפול הצלה בקריותרפיה כהצלה לאחר כישלון טיפול קרינתי
- בחירת החולים
- הישנות סרטן הערמונית המוכחת בביופסיה טרם ההקפאה
- שלילת עדות למחלה מחוץ לקופסית (Extra capsular), אם כי מעורבות הקפסולה עצמה נחשבת עדיין בהוראות הטיפול ההקפאתי
- שלילת עדות לפגיעה בדופן החלחולת (Rectal injuries), כמו: דימומים אקטיביים, כיבים, נזק ידוע אחר
- אין מגבלת גיל, אלא אם כן קיימת התוויות נגד להרדמה
- אין מגבלת גודל הערמונית, למעט ממדים חריגים מאוד (יותר מ- 150 סמ"ק)
ההתוויה הראשית לשימוש בקריותרפיה (Prostate cryosurgery) היא כישלון של טיפול קרינתי, שלרוב בוצע כמה שנים קודם לכן, ונוכח עליית ערכי האנטיגן הסגולי של הערמונית (Prostate specific antigen - PSA) בתקופת המעקב.
ביופסיה עדכנית בוצעה, והמחישה הישנות מקומית של סרטן הערמונית.
בשלב זה יש לבצע קביעת שלב (Staging) כדי לאמת מחלה ממוקמת: ביצוע MRI/CT אגן קטן, מיפוי עצמות ובדיקת TRUS לרוב מספיקים כדי להגיע למסקנה קלינית זו. לעתים נזקקים לדיסקציה של בלוטות הלימפה (Lymph node dissection). הטיפול בקריותרפיה מתאים ביותר להישנות שלאחר טיפול קרינתי, בעיקר משום שהוא מונחה ישירות לבלוטת הערמונית על גבולותיה ובחריגה של 3-5 מ"מ מחוץ לגבולות הערמונית. משום כך הוא אינו מערב רקמות סמוכות ועדינות יותר כמו דופן הרקטום, דופן כיס השתן, כלי דם ולימפה באגן הקטן, שנחשפו לטיפול הקרינתי וחוו נזק בדרגות שונות, ורצוי מאוד שלא לחשפן לנזק נוסף. לדוגמה, לא ניתן להקרין שוב איזור שהוקרן בעבר בכמות קרינה מקסימלית, משום שהנזק שייווצר על רקמה שכבר הוקרנה גדול מאוד וכמעט ודאי. מעבר לכך, כדי לשמור על תפקוד ההשתנה נהוג להגן על השופכה באמצעות צנתר מחמם שבו מוזרם נוזל בטמפרטורה של C°42-43 לכל משך פעולת ההקפאה ואף מעט לאחריה.
קריותרפיה כטיפול ראשוני לסרטן הערמונית
התוויות:
- מחלה ממוקמת - קרצינומה של הערמונית בדרגה T1-T3 עם דירוג גליסון גבוה (Ca of prostate T1-T3 and high gleason grade)
- חולים הסובלים ממחלה ממוקמת שאינם מתאימים לניתוח כריתה נרחבת (רדיקלית) של בלוטת הערמונית, כמו חולים הסובלים ממחלות רקע קשות ומקשיים אנטומיים, וכן חולים מבוגרים מידי לניתוח
- חולים המסרבים לקבל טיפול ניתוחי, קרינתי או הורמונלי
קריותרפיה כטיפול משני לסרטן הערמונית
התוויות:
- כישלון טיפולי בקרינה חיצונית (EBRT)
- כישלון טיפולי בברכיתרפיה
- הפסקת טיפול הורמונלי בשל תופעות לוואי
- כישלון טיפול הורמונלי (Hormonal treatment escape)
- הישנות מקומית מוכחת ב- TRUS וביופסיה לאחר כריתה נרחבת של הערמונית (מקרים שנבחרו היטב)
ממצאים המנבאים תוצאות תת-אופטימליות בטיפול קריותרפיה
- PSA גבוה בטרם הטיפול
- גליסון גבוה בטרם הטיפול
- Staging lymph node dissection
- זמן הכפלה מהיר (Rapid doubling time) של PSA לאחר הטיפול
- רמת PSA המושגת לאחר הפעולה (3/12, Cryo nadir)
- שינויים אנטומיים בצורת הערמונית
תיאור הפעולה
הפעולה מתבצעת בהרדמה (כללית או אזורית) בתנוחת ליטוטומיה (Lithotomy position). תחילה מתבצעת ציסטוסקופיה, שבמהלכה סוקרים את השופכה, את כיס השתן לפתולוגיות כמו היצרויות או גידולים בכיס השתן, וכן מעריכים את מרחק הפיות מהצוואר. מחדירים חוט מוליך (Guidewire) שישמש מנחה להחדרת הצנתר המחמם (Urethral warmer).
בהנחיית TRUS מדמים את הערמונית ונועצים בגישה פרינאלית, באמצעות כוונת מיוחדת (Perineal template), את מחטי הקריו במרווחים של כ- 1-1.5 ס"מ זה מזה בצורה הומוגנית, שורות שורות. לאחר החדרת המחטים מתבצעת ציסטוסקופיה חוזרת שתפקידה לוודא שהמחטים לא נעוצות בשופכה או בדופן כיס השתן ובעיקר בסמוך לפיות. מחט שתימצא באזורים אלו תוצא ותוחדר שוב למיקום הרצוי. בשלב זה מוחדרות גם מחטי טרמוסנסור המודדות את הטמפרטורה במקומות שונים בערמונית (המטפלים הם המחליטים באילו חלקים). כמו כן מוחדרות מחטים בדופן הרקטום כדי למנוע את קפיאתו וכתוצאה מכך נזק בלתי הפיך (נצור - Fistula). זה השלב שבו גם מוחדרות מחטי החימום בחיץ שבין הערמונית לדופן הרקטום - שיטה המכונה Rectal wall protection, המאפשרת להקפיא בבטחה את הקופסית האחורית של הערמונית ולשלוט בכדור הקרח שלא יתפשט לכיוון דופן הרקטום ויקפיאה בשוגג. כל שיטות ההגנה הללו מבטיחות פעולת הקפאה עמוקה ויעילה מחד גיסא, ושמירה על דופן הרקטום שלא יוקפא וייפגע מאידך גיסא.
לאחר בקרת מיקום המחטים מוחדר הצנתר המחמם לשופכה על גבי המוליך המוביל, ולאחר מכן מתחילה פעולת חימום השופכה. בשלב זה מתחילה פעולת ההקפאה - תחילה השורה הקדמית, בהמשך השורה שאחריה וכן הלאה, וזאת כדי לוודא שכל מחט פועלת ויוצרת את כדור השלג שלה.
מתבצעים שני מחזורי הקפאה-הפשרה. מחזור ההקפאה נמשך 8-12 דקות מקבוצת המחטים האחרונה שהופעלה.
מחזור ההפשרה מורכב משני תהליכים:
- הפשרה אקטיבית: הפשרה על ידי הפעלת מערכת החימום במחטים (הפשרה מהירה) ובהמשך -
- הפשרה פסיבית: היינו עליית הטמפרטורה באטיות משנית לחימום המחמם השופכתי ולחימום האיבר שזרימת הדם חוזרת ומתרחשת בו.
זמן ההפשרה הכללי הוא 5-10 דקות, ובסוף פעולת ההפשרה הטמפרטורה בערמונית הופכת חיובית. בתום שני מחזורי ההקפאה-הפשרה ותוך כדי הפשרה מוציאים את המחטים אחת אחת, ואילו המחמם בשופכה עדיין מופעל ומחמם לעוד כ- 20 דקות. נוסף על כך מבוצעות שטיפות באמצעות סליין חם C°40 לחלל הרקטום המבטיחות שמירה נוספת על שלמות דופן הרקטום.
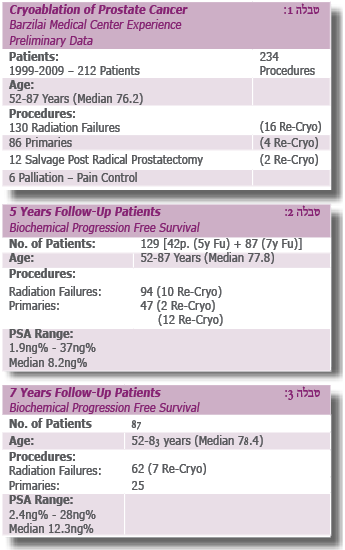
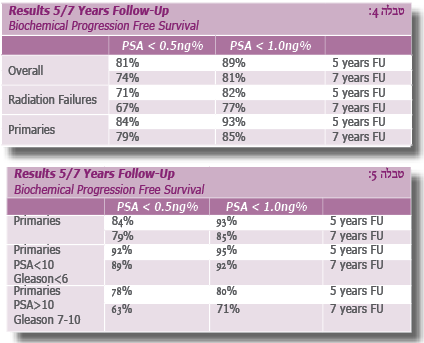
בטבלאות 1-5 נראות תוצאות ראשוניות וכלליות של טיפולי קריו, הן כטיפול ראשוני והן כטיפול משני, לאחר כישלון טיפול קרינתי והורמונלי (ללא פילוח הקבוצות השונות ועיבוד סטטיסטי).
סיבוכים
הסיבוכים מתחלקים לשני סוגים: סיבוכים רציניים וסיבוכים מתונים.
דוגמאות לסיבוכים רציניים הן אלה: נצור (Fistula), אי-נקיטת שתן, דמם המצריך עירויי דם, זיהום-ספסיס, לבביים-ריאתיים (Cardiopulmonar) וכן כלי דם. אלו באים לידי ביטוי בסדרה המוצגת בחלקי אחוזים זניחים.
דוגמאות לסיבוכים מתונים הן אלה: דימומים שאינם משפיעים על רמת ההמוגלובין ובאים לידי ביטוי בעיקר בהמטומות פרינאליות ובשק האשכים, באי-נקיטת שתן במאמץ, בזיהום במערכת השתן, בעצירת שתן עד כי יש צורך לבצע כריתת ערמונית דרך השופכה (TURP). הכאבים הם לרוב מתונים ונשלטים באמצעות משככי כאבים רגילים (לא אופיאטים). היפוסטזיה - נימול מדווח אך לא מפריע ממש, גם אלו שהם ברמת היארעות נמוכה, והטיפול בהם הוא קל לרוב.
פגיעה בתפקוד הזקפתי
מקובל היה לחשוב שהטיפול בקריותרפיה לפרוסטטה מקפיא את עצבי הזקפה ומסתיים באין אונות בכל החולים, אך למעשה אין הדבר כך. רוב מטופלי הקריו (לאחר טיפול קרינתי) מגיעים ולהם כבר פגיעה בתפקוד הזקפתי. למעשה בחולים אלו הטיפול בקריותרפיה אינו משפיע על התפקוד שממילא לא היה מלכתחילה.
בסדרה המוצגת מתוך חולי הטיפול הראשוני שלא קיבלו כל טיפול קודם לסרטן הערמונית, 15 חולים שהם 18% מכלל החולים, היו פוטנטים לפני הטיפול בקריו. שמונה חולים בגיל פחות מ-60 היו פוטנטים באופן מלא.
לשבעה מהם שבה האונות 18-24 חודשים לאחר הטיפול בקריותרפיה (רובם משתמשים במעכבי PDE5). חמישה מקבוצת חולים זו (62%) הם מתחת לגיל 60! ארבעה משתמשים במכשיר ואקום וארבעה אחרים משתמשים בזריקות תוך מחילתיות (Intracavernous injection).
מעקב לאחר הטיפול
המעקב מתבצע בעיקר אחר רמות PSA:
פעמיים ראשונות פעם בשלושה חודשים; בהמשך פעם בשישה חודשים; לאר מכן פעם בשנה בדיקות TRUS+FLOW ולאחר שלוש שנים PSA אחת לשנה.
PSA בפרוצדורה שבה הערמונית מושארת במקומה ולא נכרתת כפי שמבוצע בניתוח נרחב רמת PSA נורמלית מקובלת היא מ- %gn0.5 ל- ng%1> ויציבה. חימום השופכה משאיר כנראה עדיין שרידי רקמה מפרישים, ואלו יכולים להגיע עד 1ng%.
אם ערכי PSA מטפסים יותר מ- %2-3ng יש לבצע ביופסיה מהערמונית, ואם אכן מתקבלת תשובה חיובית לסרטן הערמונית, ניתן לשקול בחיוב רב לבצע פרוצדורת קריותרפיה חוזרת (Re-Cryotherapy).
כאן המקום להזכיר שיטת טיפול חדישה התופסת יותר ויותר את מקומה במרכזים רבים בעולם, והיא שיטת ההקפאה המוקדית (Focal cryotherapy). לאור התוצאות הטובות של הדברת הרקמה הנגועה בסרטן הערמונית באמצעות שיטת ההקפאה העמוקה, מתגבשת בשנתיים-שלוש שנים האחרונות שיטה טיפולית והיא הקפאה מוקדית של גידול קטן ומתוחם בערמונית.
נוכח התקדמות החקר באבחון סרטן הערמונית, וכמובן בעקבות עליית מודעות הקהל לאיתור מוקדם של סרטן הערמונית - PSA , TRUS, ביופסיות, MRI רקטלי ועוד, פוגשים האורולוגים גברים שלהם גידולים מזעריים בערמונית, הממוקמים רק באזור מסוים כששאר הבלוטה אינה נגועה בשאת, נחשפים בביופסיות ברוויה (Saturation biopsies or maping biopsies). יותר ויותר אורולוגים עוברים לטיפול מוקדי באמצעות קריותרפיה (Focal cryoablation) ובהמשך למעקב אקטיבי. הטיפול המוקדי יעיל מאוד, קל וקצר ביותר, נטול תופעות לוואי כמעט, לרוב אינו דורש אשפוז ואינו כרוך בפגיעה בתפקוד המיני. יש לציין שצורת טיפול זו של קריותרפיה מוקדית היא אטרקטיבית מאוד הן לחולים והן לרופאים, אך הניסיון בה הוא קצר מועד.
ביבליוגרפיה
- Aus G, Abbou CC, Bolla M, et al. EAU guidelines on prostate cancer.Eur Urol 2005;48:546
- American Urological Association. Best policy statement on the treatment of cryosurgery for the treatment of localized prostate cancer. AUA Annual Meeting, Maryland, 17–22 May 2008
- National Institute of Clinical Excellence. Cryotherapy as a primary treatment for prostate cancer. 2005
- National Institute of Clinical Excellence. Cryotherapy for recurrent prostate cancer. 2005. www.nice.org.uk
- Baust JG, Gage AA. The molecular basis of cryosurgery. BJU Int 2005;95:1187
- Clarke DM, Baust JM, Van Buskirk RG, et al. Addition of anticancer agents enhances freezing-induced prostate cancer cell death: implications of mitochondrial involvement. Cryobiology 2004;49:45
- Tatsutani K, Rubinsky B, Onik G, et al. Effect of thermal variables on frozen human primary prostatic adenocarcinoma cells. Urology 1996;48:441
- Soanes WA, Gonder MJ. Use of cryosurgery in prostatic cancer. J Urol 1968;99:793
- EAU guidelines on prostate cancer. http://www.uroweb.org/files/uploaded_files/guidelines/07%20Prostate%20Cancer.pdf
- Lane BR, Stein DE, Remzi FH, et al. Management of radiotherapy induced rectourethral fistula. J Urol 2006;175:1382
- Moreira Jr SG, Seigne JD, Ordorica RC, et al. Devastating complications after brachytherapy in the treatment of prostate adenocarcinoma. BJU Int 2004;93:31
- Cytron S, Paz A, Kravchick S, et al. Active rectal wall protection using direct transperineal cryo-needles for histologically proven prostate adenocarcinomas. Eur Urol 2003;44:315
- Izawa JI, Perrotte P, Greene GF, et al. Local tumor control with salvage cryotherapy for locally recurrent prostate cancer after external beam radiotherapy. J Urol 2001;165:86
- Chin JL, Touma N, Pautler SE, et al. Serial histopathology results of salvage cryoablation for prostate cancer after radiation failure. J Urol 2003; 170(4 Pt 1):1199
- Touma NJ, Izawa JI, Chin JL. Current status of local salvage therapies following radiation failure for prostate cancer. J Urol 2005;173:373
- ןRogers E, Ohori M, Kassabian VS, et al. Salvage radical prostatectomy: outcome measured by serum prostate specific antigen levels. J Urol 1995;153:104
- Amling CL, Lerner SE, Martin SK, et al. Deoxyribonucleic acid ploidy and serum prostate specific antigen predict outcome following salvage prostatectomy for radiation refractory prostate cancer. J Urol 1999;161:857
- Ahlering TE, Lieskovsky G, Skinner DG. Salvage surgery plus androgen deprivation for radioresistant prostatic adenocarcinoma. J Urol 1992;147(3 Pt 2):900
- Garzotto M, Wajsman Z. Androgen deprivation with salvage surgery for radiorecurrent prostate cancer: results at 5-year followup. J Urol 1998;159:950
- Izawa JI, Madsen LT, Scott SM, et al. Salvage cryotherapy for recurrent prostate cancer after radiotherapy: variables affecting patient outcome. J Clin Oncol 2002;20:2664
- Katz AE, Ghafar MA. Selection of salvage cryotherapy patients. Rev Urol 2002;4(2):S18
- De La Taille A, Benson MC, Bagiella E, et al. Cryoablation for clinically localized prostate cancer using an argon-based system: complication rates and biochemical recurrence. BJU Int 2000;85:281
- Bahn DK, Lee F, Badalament R, et al. Targeted cryoablation of the prostate: 7-year outcomes in the primary treatment of prostate cancer. Urology 2002;60(2 Suppl 1):3
- Consensus statement. Guidelines for PSA following radiation therapy. Int J Radiat Oncol Biol Phys 1997;37:1035
- Shelley M, Wilt TJ, Coles B, et al. Cryotherpay for localised prostate cancer. Cochrane database Syst Rev 2007;18(3):CD005010
- Jones JS, Rewcastle JC, Donnelly BJ, et al. Whole gland primary prostate cryoablation: initial results from the cryo on-line data registry. J Urol 2008;180:554
- Cytron S, Greene D, Witzsch U, et al. Cryoablation of the prostate: technical recommendations. J Prostate Cancer and Prostatic Diseases 2009;1-8
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר שמואל ציטרון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק