סרטן השד - הקשר ההורמונלי - Breast cancer and hormones
| סרטן השד - הקשר ההורמונלי | ||
|---|---|---|
| Breast cancer and hormones | ||
| 250px | ||
| יוצר הערך | ד"ר איתן פאר, האגודה למלחמה בסרטן - Israel cancer association | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – טיפול הורמונאלי חליפי, סרטן השד
כשני שלישים מהתאים הסרטניים בשד מכילים קולטנים להורמוני המין אסטרוגן ופרוגסטרון.
בתרביות בתנאי מעבדה נמצא שתוספת של פרוגסטרון בלבד מאיצה את קצב חלוקת תאים אלו. בהתאם לממצאים אלה, הטיפול ההורמונלי הניתן כיום לנשים בגיל המעבר (Menopause) מותאם למצבן באופן ספציפי. למסקנות אלה הגיעו החוקרים אחרי שורה ארוכה של מחקרים ועבודות שונות.
הקשר שקיים בין הורמונים וסרטן שד הוא קשר מורכב מאוד ולא ברור לחלוטין עדיין.
לטיפול באמצעות אסטרוגן בלבד אפקט מגן המפחית את הסיכון לפתח סרטן שד. מנגד, הורמון הפרוגסטרון מגביר הן את קצב החלוקה של תאי סרטן השד והן את יכולת ההתפשטות הגרורתית שלהם. לסוגי פרוגסטינים שונים יש אפקט שונה, התלוי הן באופן בו הם ניתנים לאישה והן במינון שנקבע לה. מסיבה זו לא ניתן לייחס כיום "Class effect" לטיפול הורמונלי בהקשר של סרטן השד.
קרוב לוודאי שהמילה האחרונה בסוגיה טעונה זו, טרם נאמרה. עם זאת, מניעה גורפת של מתן טיפול הורמונלי לנשים, על כל התועלת הטמונה בו, היא בגדר טעות רפואית. יש לשקול כל מקרה לגופו ולהתאים את הטיפול באופן ספציפי לתלונות המטופלות.
טיפול הורמונלי חלופי
הטיפול ההורמונלי בנשים בתקופת גיל המעבר צבר תאוצה עצומה בשנות השמונים והתשעים של המאה הקודמת, זאת מאחר שיעילותו הוכחה בתחומים רבים בהם מניעה או הקלה על תופעות הלוואי המתרחשות בגיל המעבר כגון גלי חום, הפרעות שינה, ומצבים דיכאוניים, כתוצאה ממחסור בהורמונים.
הטיפול ההורמונלי מסייע בעיכוב תהליכי הזדקנות של העור, מניעת השמנה אנדרוגנית (בטנית), הקלה על כאבים בפרקים ובגב התחתון, מניעת ניוון רקמות אלסטיות בכלי דם (ועלייה בלחץ דם עקב כך) בנרתיק, ובשלפוחית השתן (יובש בנרתיק), דלקות שתן חוזרות ונשנות, בעיות בשליטה על שלפוחית השתן (הטלת שתן לילית - Nocturia), מניעת אוסטיאופורוזיס, האטה ניכרת במחלת אלצהיימר ואפילו הפחתה בהתקפי לב ותעוקה קרדיאלית.
יעילות הטיפול ההורמונלי ויתרונותיו התערערו בצורה משמעותית בעקבות מחקר רחב היקף שתוצאותיו פורסמו ביולי 2002. המחקר המכונה "מחקר בריאות הנשים" (Women's health initiative), עורר הדים רבים בכלי התקשורת בעולם, ואף הופסק מוקדם מהמתוכנן - אחרי כ-5 שנים (המחקר היה אמור להימשך 8 שנים), בעקבות טענת החוקרים כי ממצאיו הראו על עלייה בשכיחות מקרי סרטן השד בקבוצת הנשים שנטלו טיפול הורמונלי חלופי, לעומת קבוצת הביקורת שכללה נשים שלא קיבלו טיפול הורמונלי.
הממצאים עליהם דווח במחקר הצביעו על 8 מקרים נוספים של סרטן שד לכל 1,000 נשים (8/1000) או כפי שתואר במחקר: עלייה של 24% (32 מקרים במקום 24 לכל 1,000 נשים - נתון שנראה מרשים ומגמתי יותר מאשר נתונים במספרים אבסולוטיים)[1]. הפרסומים האלה גרמו נזק בריאותי אדיר לנשים שנטלו טיפול הורמונלי חלופי, וכתוצאה מהפרסום השלילי, הפסיקו את השימוש בו באופן מיידי.
הנזק שנגרם לנשים לאחר ההפסקה המיידית של הטיפול ההורמונלי, תואר בעבודה שפורסמה בשנת 2013, לפיה מעל 90,000 נשים בארצות הברית נפטרו - מוות מיותר שניתן היה למנוע אותו אילו נטלו טיפול הורמונלי חלופי בעשור שחלף מאז הפרסום. נוסף על כך, נשים רבות נשארו אמנם בחיים, אך נגרם להן נזק בריאותי רב ופגיעה קשה באיכות חייהן בשל הימנעות מנטילת הורמונים חלופיים בגיל המעבר במטרה להקל על תופעות הלוואי[2].
בעקבות פרסום המחקר מיולי 2002, התחדד הצורך לבסס את הטיפול הרפואי בגיל המעבר על עובדות מדעיות, ולא על סקרים אפידמיולוגים בלבד. בנוסף, התעוררו שאלות רבות כמו למשל מדוע שכיחות סרטן השד עולה דווקא אחרי גיל חמישים (בגיל 50 = 1/52, בגיל 60 = 1/24, בגיל 70 = 1/14, בגיל 80 = 1/10, בגיל 85 = 1/9) וממשיכה לעלות ככל שהאישה מתרחקת מהגיל בו עדיין קיימת פעילות הורמונלית שחלתית. שאלה נוספת שעלתה בעקבות מסקנה זו, היא האם להורמונים המיוצרים בשחלה יש אפקט מגן - שאלה מורכבת למדי, שכן כריתת שחלות לפני גיל 40 בקרב נשאיות של מוטציות בגנים 1BRCA ו-BRCA2, מפחיתה את הסיכון לפתח סרטן שד.
עובדה זו מעוררת שאלה נוספת - האם ייתכן שאצל נשאיות BRCA ההורמונים מעלים את הסיכון לפתח סרטן שד, ואילו בקרב נשים שאינן נשאיות הם מפחיתים סיכון זה?
מבחינה היסטורית, בשנות השישים, הטיפול האונקולוגי בקרב נשים עם גרורות מסרטן שד כלל מתן אסטרוגן בעירוי - דבר ששיפר את מצבן של המטופלות באופן משמעותי. לאור זאת נשאלת השאלה כיצד הפך האסטרוגן ל"אויב העם".
בנוסף, הביולוגיה של סרטן השד מעידה שתאי החלוקה של סרטן השד מוכפלים מידי 90 יום ויש צורך בכ-40 חלוקות בכדי שהגידול יגיע לשלב בו הוא ניתן לזיהוי, כלומר נדרשים לכך 3,600 ימים, שהם כ-10 שנים[3]. הפסקת המחקר שבדק טיפול הורמונלי תחליפי אחרי 5 שנים עקב גילוי יתר של מקרי סרטן שד כאמור, עומדת בסתירה לעובדה ביולוגית זו. מסיבה זו, החלו חוקרים רבים בעולם לבדוק (בכל רמה אפשרית) את הקשר בין הורמוני המין לסרטן השד ובאיזה אופן נרקם קשר זה.
המקור האסטרוגני של תאי סרטן השד
מספר מחקרים, בהם קיבלו הנשים עירוי של אסטרוגן מסומן 24 שעות לפני כריתת גוש בשד (Lumpectomy), הראו שהאססרוגן המסומן (בנוזל הפלזמה) לא זוהה בתאי הסרטן. בנוסף, רמות האסטרוגן התוך תאי בקרב נשים בגיל המעבר היו גבוהות באופן משמעותי מרמות האסטרוגן בפלזמה של אותן נשים. כמו כן, נמצא כי גם בתאים הסרטניים, רמות האסטרוגן היו גבוהות יותר מאשר בתאים הלא ממאירים הסמוכים לגידול[4].
ניתן להבין תופעה זו באמצעות התחקות אחר מקורות האסטרוגן בתאי סרטן השד הנובעים מייצור עצמי של אותם תאים.
אצל אישה לאחר גיל המעבר (Postmenopausal) ישנם שני מקורות המייצרים אנדרוגנים: טסטוסטרון, המיוצר בשחלות המנופאוזליות מתאי הטקה (Theca) תחת גירוי LH (Luteinizing Hormone), והאדרנל המייצר דהידרו-אפיאנדרוסטרון אצטט (DHEA, Dehydroepiandrosterone). אנדרוגנים אלו נקלטים באופן אקטיבי על ידי תאי השד, ודרך מנגנון אנזימטי של ארומטאז (Aromatase) בתחילה, וסולפטאז (Sulfatase) לאחר מכן, הופכים האנדרוגנים לאסטרון סולפאט (E15, Estrone sulfate), הפועל על קולטני האסטרוגן בתאי השד הסרטניים ומאיץ את תהליך השגשוג (Proliferation) ואת קצב חלוקתם[5].
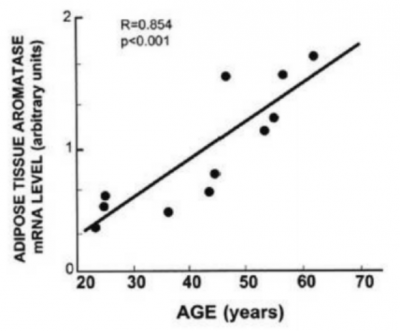
גילוי זה הוביל לתפנית חשובה בטיפול בסרטן השד באמצעות תרופות המעכבות את פעילות הארומטאז. כמו כן תולים החוקרים תקוות גדולות בתרופות נוספות המעכבות את הסולפאט ונמצאות בבדיקות קליניות.
רמת הארומטאז מושפעת מרמת האסטרוגן בדם. כל עוד מתקיימת פעילות שחלתית היוצרת אסטרוגנים, ישנו דיכוי יחסי של הארומטאז. בתקופת גיל המעבר רמת האסטרוגן יורדת ורמת הארומטאז עולה לינארית וכך גם יצירת האסטרון סולפאט בשד.
תופעה זו מסבירה מדוע ישנה עלייה בשכיחות סרטן השד עם הגיל, וכן מדוע מתן אסטרוגן באמצעות עירוי לנשים עם סרטן שד גרורתי, עזר במידה מסוימת.
עובדה זו תואמת את הממצא של מחקר בריאות הנשים: בקרב נשים ללא רחם, שטופלו באסטרוגן בלבד כטיפול הורמונלי תחליפי, ללא פרוגסטרון, נמצאה ירידה של 34% בהיארעות סרטן השד. תופעה זו אומתה במחקר רחב היקף בקליפורניה, המכונה מחקר המורות, שם נעשה מעקב במשך 11 שנים אחרי נשים המקבלות טיפול באסטרוגן בלבד, ונמצאה ירידה משמעותית במקרי סרטן השד (והמעי הגס), לעומת קבוצת הביקורת[7].
מכאן ניתן להסיק כי לאסטרוגן אפקט הגנתי מפני סרטן שד (וסרטן המעי).
תפקיד הפרוגסטרון בסרטן השד
כאמור, למרבית סרטני השד ישנם גם קולטנים לפרוגסטרון, מכאן שגם להורמון זה תפקיד בהתפתחות סרטן השד. מחקרים רבים ניסו לבדוק את השפעת הפרוגסטרון על הסיכון להיווצרות סרטן שד, אולם מסתבר שקיימת בעיה אמיתית לחקור את השפעת הפרוגסטרון, היות שיש כיום למעלה מעשרים סוגים שונים של תכשירים פרוגסטטיביים הנמצאים בשימוש, וככל הנראה אין להם אפקט אחיד, ואילו במחקר בריאות הנשים נעשה שימוש אך ורק בתכשיר Medroxyprogesterone acetate (MPA), שהשימוש בו אינו נפוץ באירופה.
במחקר רחב היקף שנערך בצרפת (E3N) במשך עשור, התברר כי מרבית הנשים משתמשות בסוגים אחרים של פרוגסטינים, ולא נמצאו אותם הממצאים שתוארו במחקר בריאות הנשים. מחקר זה הראה שפרוגסטינים ממקור צמחי לא העלו את השכיחות של סרטן השד. עוד התברר שכאשר הפרוגסטינים ניתנים לאישה באמצעות ספיגה עורית, השפעתם על התפתחות סרטן השד הייתה קטנה יותר ממתן הטיפול דרך הפה[8].
בתהליך ההתפתחות הפיזיולוגית של השד, האסטרוגן אחראי על התפתחות מערכות צינורות השד (Ducts) ואילו הפרוגסטרון אחראי על ההסתעפויות של אותן צינוריות וכן על המערכת הלובולרית של השד. לכן, במרבית גידולי השד בהן מעורבות צינוריות השד, יהיו קולטנים לאסטרוגן, ובחלקם יהיו גם קולטנים לפרוגסטרון. בגידולים לובולריים ישנם בעיקר קולטנים לפרוגסטרון.
נמצא שתאי שד המבטאים קולטני פרוגסטרון מפרישים חומר פאראקריני (Paracrine) הגורם לשגשוג גם של תאים סמוכים בשד שאין להם קולטני פרוגסטרון. חומר פאראקריני זה שבודד לפני כשלוש שנים - מכונה RANKL (Receptor Activator of NF-Kβ Ligand) ושייך לקבוצת TGF-β (Transforming Growth Factor). לחומר זה המצוי בבלוטות הלימפה, בתימוס, בעצם, בשד ועוד, ביטוי נרחב מאוד בתאי סרטן שד[9].
נוסף על כך, ה-RANKL מפעיל את הקולטן RANK וגורם להתמיינות (Differentiation) של מאקרופאגים בפלזמה לאוסטאוקלאסטים פעילים ה"מעכלים" את העצם ומפנים מקום לתאי גידול, הן מהשד והן מהערמונית (Prostate), להתפשטות וחדירה לתוך העצם[10].
הפרוגסטרון, ובמיוחד ה-MPA מפעילים מערכת זו, בעיקר כאשר תאי סרטן השד חיוביים לקולטני פרוגסטרון. מערכת זו נתפסת כיום כמקשרת ברמה המולקולרית, בין פרוגסטינים ובין תהליכים סרטניים אפיתליאליים בשד. עיכוב של מערכת זו על ידי תרופה המכונה Denosumab הוכח כטיפול יעיל מאוד בסרטן השד, סרטן הערמונית וכן בסרטן גרורתי לעצמות[11].
מבחינה ביולוגית, כדי שתא סרטני יתנתק מהגידול המרכזי, עליו לעבור טרנספורמציה: התא עוקף את הממברנה הבסיסית של כלי הדם ודרכי הלימפה מבלי לפגוע בשלמותם, יוצא מהם ו"נשתל" במקום מרוחק יותר, וכך נוצרות גרורות. בתהליך זה הציטופלזמה משתנה, נוצרים סיבים של מיוזין ואקטין היוצרים Filopedia ו-Lamellipodia ואז (בתנועות המזכירות תנועות אמבה) הסיבים הללו מתארכים, מוצאים את החללים בין תאי הממברנה הבסיסית, ועוברים דרכם. הליך זה משנה את מבנה התא כולו.
אחד המחקרים בהקשר של פרוגסטטיבים ותאי סרטן השד, ממנו ניתן ללמוד רבות, היה מחקר בו הוסיפו סוגים שונים של פרוגסטטיבים במינונים שונים, עם או בלי אסטרוגן, לתרביות של תאי סרטן שד[12]. בניסוי זה, שנעשה בתנאי מעבדה, נמצא שכל הטרנספורמציה המתוארת לעיל נתמכת ומואצת בהשפעת פרוגסטרון. כמו כן נמצא שלפרוגסטינים שונים יכולות שונות להגביר או למזער טרנספורמציה זו. בנוסף, נמצא שתוספת אסטרוגן מאיצה את האפקט האמור של הפרוגסטרון. מכאן נוצר מושג חדש בתחום - Invasion index of progestatives.
בנוסף ובמקביל, הפרוגסטינים מפעילים את הקולטנים המינרלוקורטיקואידים (Mineralocorticoid Receptors). קולטנים אלו מהווים קו-פקטור משמעותי בהתפתחות סרטן השד. הפעלה של קולטנים אלו מאיצה את תהליך השגשוג של תאי הסרטן - זהו הבדל משמעותי בין הסוגים השונים של הפרוגסטינים. ישנם כאלו המפעילים בעוצמה רבה יותר את הקולטנים הללו, עקב אפיניות (Affinity) גבוהה אליהם, ובראשם ה-MPA המפעיל במידה רבה יותר (למעלה מפי 2,000) את הקולטנים הללו, בהשוואה ליתר הפרוגסטינים. לעומת זאת ישנם פרגוסטינים אחרים שאף מדכאים קולטנים אלו[13]
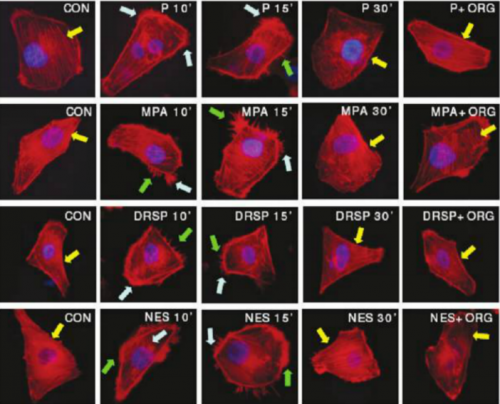
Fu XD, Giretti MS, Goglia L, et al. Comparative actions of progesterone, medroxyprogesterone acetate, drospirenone and nestorone on breast cancer cell migration and invasion. BMC Cancer. 2008 Jun 9;8:166[12]
ביבליוגרפיה
- ↑ Chlebowski RT: Hendrix SL, Larger RD, et al. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the women's Health Initiative Randomized Trial. JAMA. 2003 )un 25;289(24):3243-53.
- ↑ Sarrell PM, Njike VY, Vinante V, Katz DL. The mortality toll of estrogen avoidance: an analysis of excess deaths among hysterectomized women aged 50 tc 59 years. Am J Public Health. 2013 Sep;103(9):1 5838. Epub 2013 Jul 1S.
- ↑ Harris JR, Lipprnan ME, Morrow M, Osborne K. 2nd ed. Breast Diseases. Philadelphia: JB Lippincott; 1991:165-189.
- ↑ Pasqualini JR, et al. Concentrations of estrone, estradiol, and estrone sulfate and evaluation of sulfatase and aromatase activities in pre- and postmenopausal breast cancer patients. J Clin EndocrinolMetab. 1996 Apr;81(4): 1460-4.
- ↑ Sasano H, Harada N. Intratumoral aromatase in human breast, endometrial, and ovarian malignancies. Endocr Rev. 1998 Oct;19(5):593-607
- ↑ Bulun SE, et al. Aromatase in aging women. Semin Reprod Endocrinol. 1999;17(4):349-58.
- ↑ Saxena T, Lee E, Henderson KD, et al. Menopausal hormone therapy and subsequent risk of specific invasive breast cancer subtypes in the California Teachers Study. Cancer Epidemiol Biomarkers Prev. 2010 Sep; 19(9):2366-78. Epub 2010 Aug 10.
- ↑ Fournier A.Berrino F, Clavel-Chapelon F Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat. 2008 Jan; 107{1 ):103-11. Epub 2007 Feb 27.
- ↑ Gonzales-Suarez E, Jacob AP: Jones J, et al. RANK ligand mediates progestin-induced mammary epithelial proliferation and carcinogenesis. Nature. 2010 Nov 4;468(7320):103-7. Epub 2010 Sep 29.
- ↑ Schramek D, Leibbrandt A, Sigl V, et al. Osteoclast differentiation factor RANKL controls development of progestin-driven mammary cancer. Nature. 2010 Nov 4;468{7320):98-102. Epub 2010 Sep 29.
- ↑ McClung MR, Lewiecki M, Cohen SB, et al. Denosumab in postmenopausal women with low hr׳nr irinrral density. N Ergl I Mod. 2006 Feb;354:821-831.
- ↑ 12.0 12.1 Fu XD, Giretti MS, Goglia L, et al. Comparative actions of progesterone, medroxyprogesterone acetate, drospirenone and nestorone on breast cancer cell migration and invasion. BMC Cancer. 2008 Jun 9:8:166.
- ↑ Reichardt HM, Horsch K, Grone HJ, et al. Mammary aland development and lactation are controlled by different glucocorticoid receptor activities. Eur J Endocrinol 2001; 145:519-527.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר איתן פאר מנהל מרפאת גיל המעבר, הקריה הרפואית לבריאות האדם רמב"ם, חיפה, מכבי שירותי בריאות חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק