פרוסטגלנדין - Prostaglandin - D2
| מדריך בדיקות מעבדה | |
| פרוסטגלנדין D2 | |
|---|---|
| Prostaglandin D2 | |
| שמות אחרים | PGD2 |
| |
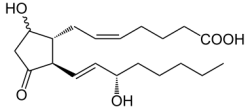
נוסחה כימית: C20H32O5
משקל מולקולארי: 352.465 g/mol | |
| מעבדה | כימיה בדם או אנדוקרינולוגיה בדם |
| תחום | מחלות אלרגיות |
| טווח ערכים תקין | למבוגרים מעל גיל 18 שנה-35-115 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אלרגיה
פרוסטגלנדינים הם קבוצה של חומצות שומניות עם שרשרת של 20 פחמנים וקשרים בלתי רוויים המכילים מבנה ייחודי של טבעת 5-פחמנית. PGD2 נחשב זמן רב כפרוסטגנדין מינורי שאינו פעיל ביולוגית. רק בשנות ה-80 נמצא ש-PGD2 הוא ה-PG השכיח ביותר במוח של חולדות (Narumiya וחב' ב-Life Sci משנת 198, וכן שכיח ביותר במוח של יונקים אחרים כולל באדם (Ogorochi וחב' ב-J Neurochem משנת 1984), מה שרמז על תפקידו המשמעותי במערכת העצבים המרכזית. התפקיד הפיזיולוגי של PGD2 מוגדר ומובן כעת באופן בולט הרבה יותר.
פרוסטגלנדינים (להלן PG) הם משפחת של eicoanoids בעלי מבנה דומה, שהם בעלי תפקידים רגולטוריים במצבים פיזיולוגיים תקינים אך גם בהקשרים פתולוגיים (Simmons וחב' ב-Pharmacol Rev משנת 2004). אנזימים ממשפחת ה-cyclooxigenase מקטלזים את ההתמרה של חומצה אראכידונית שהיא חומצת שומן בעלת הרכב של C20:4, ל-PGH2, והאחרון מותמר לפרוסטנואידים אחרים הכוללים את PGD2, PGF2α, פרוסטציקלין או PGI2, ו-thromboxane A2 על ידי פעולת אנזימי synthase ספציפיים (McAdam וחב' ב-J Clin Invest משנת 2000, ו-Gilroy וחב' ב-Nature Med משנת 1999).
פרוסטגלנדין D2
פרוסטגלנדין D2 (להלן PGD2) נקשר לקולטן PTGDR1 וכן לקולטן CRTH2 (על פי Saito וחב' ב-Am J Reprod Immunol משנת 1989, ו-Pettipher ו-Hansel ב-Drug News משנת 2008).
פרוסטגלנדין D2 הוא הפרוסטגלנדין העיקרי הנוצר על ידי תאי פיטום (mast cells), והוא מגייס תאי Th2, אאוזינופילים ובזופילים. לכן ביונקים מעבר לרמות משמעותיות שלו במוח, ניתן למצוא אותו בתאי פיטום. פרוסטגלנדין D2 קריטי להתפתחות מחלות אלרגיות כגון אסתמה. רמת PGD2 בחולי אסתמה גדולה פי-10 מזו שבנבדקים בריאים, בפרט לאחר שחולה האסתמה בא במגע עם אלרגנים. במוח יצירת פרוסטגלנדין D2 מתבצעת במסלול חלופי דרך הפרשה של ה-enzyme β-trace המסיס הידוע כיום כ- prostaglandin D synthase על פי Bachmann וחב' ב-Neurosurgery משנת 2002.
PGD2 synthase
אנזים זה, או בשמו האחר prostaglandin-H2 D-isomerase, מקודד באדם על ידי הגן PTGSD (על פי Nagata וחב' ב-Proc Natl Acad Sci USA משנת 1991(. החלבון המקודד על ידי גן זה הוא glutathione-independent prostaglandin D synthase המקטלז את ההמרה של prostaglandin- H2 (הידוע גם כ-(PGH2 ל-prostaglandin D2 (PGD2). האנזים PGD2 synthase משמש קלינית כסמן אבחוני לתרחיש של liquorrhea, דהיינו לבדוק האם נוזל הדולף מהאף או מהאוזן מכיל נוזל צרברו-ספינאלי. בדיקה זו חיונית בהערכה של חומרת טראומה לראש.
הסינתזה של PGD2 מהקודמן שלו PGH2 מתבצעת על ידי 2 אנזימי PGD synthase הידועים כ-H-PGD synthase ו-L-PGD synthase (על פי Urade וחב' ב-Sleep Med Rev משנת 2011). אכן, PGD2 נוטל חלק בפונקציות נוירו-פיזיולוגיות מגוונות, כמו הרגולציה של טמפרטורת הגוף, הפרשת הורמונים, מודולציה של תגובות לריח ולכאב (noniception) ב-CNS, והרגולציה של שינה-יקיצה ביונקים, כמו גם התפקוד האולפקטורי. בעוד ש-PGD2 פועל דרך 2 קולטנים הקשורים לחלבוני G, הידועים כ-PGD2R1 ו-PGD2R2 הידוע גם כ-CRTH2, הרי ש-15d-PGJ2 מסוגל לשפעל את PPAR או peroxisome proliferator-activated receptors-gamma, ולעכב על ידי כך מספר מסלולים המאותתים למצבי דלקת כולל NF-κB (על פי Ricote וחב' ב-Nature משנת 1998).
פעילויות פיזיולוגיות של PGD2
פרוסטגלנדינים הן חומצות שומניות שמקורן במטבוליזם של חומצה אראכידונית. פרוסטגלנדינים קשורים באופן קרוב ל-thromboxanes ו-leukotrienes. פרוסטגלנדין D2 מקורו בעיקר מפרוסטגנדין H2, על ידי פעולת האנזים PGD2 synthase והוא עובר מטבוליזם לקבלת Dihydroketo Prostaglandin D2. פרוסטגנדין D2 מופרש ישירות לשתן. אזורי הגוף בהם פעילות פרוסטגלנדין D2 הם המוח, עמוד השדרה, המעי והקיבה. פרוסטגלנדין D2 הוא הפרוסטגלנדין העיקרי הנוצר ברקמת הרחם. פרוסטגלנדין D2 הוא מכווץ פוטנטי של סמפונות הריאה, הוא נוירו-מודולטור אך גם גורם טרופי במערכת העצבים המרכזית, וכן פועל כנגד החלבון אנטי-תרומבין. פעילויות נוספות של פרוסטגלנדין D2 הן בעידוד של ההורמון הפנקראטי גלוקאגון, וכן פעילות נוגדת גרורתיות בסוגים רבים של תאי סרטן ממאיר. יצירת פרוסטגלנדין D2 ורמתו בצירקולציה מדוכאים באופן ניכר על ידי אספירין ו-indomethacin.
PGD2 כרוך בוויסות של הורדת טמפרטורת הגוף בשינה, ופועל באופן מנוגד ל-PGE2. פרוסטגנדין זה אחראי להרחבת כלי-דם, וכן הוא משחק תפקיד בהתפתחות המינית של הגבר. הוא עושה זאת על ידי יצירת לולאה עם Sox9, המשופעל על ידי ה-SRY של כרומוזום Y. לעומת זאת, PGD2 בלולאה אחרת עם FGF9, מסייע לשמור על רמה גבוהה דיה של SOX9 כדי לשפעל גנים אחרים, כגון Fgf9 ו-Sf1, הנחוצים להתפתחות מערכת הרבייה הזכרית (Moniot וחב' ב-Development משנת 2009). ממצא אחר הוא שרמות מוגברות של PGD2 ושל PGD2 synthase בזקיקי השיער בגולגולת אחראיות באופן חלקי למתווה ההתקרחות הזכרית הידועה כ-androgenetic alopecia (על פי Garza וחב' ב-Sci Translational Med משנת 2012). כאשר PGD2 נמרח באופן מקומי על פרוות עכברים, נמנעה צמיחת שיער מקומית, בה במידה שעכברים טרנסגניים בהם הושרתה גנטית סינתזה מוגברת של PGD2 נמצא עיכוב צמיחה כללי של שיער. בנוסף, נמצא שרמת פרוסטגלנדין זה באזורי גולגולת קרחים הייתה גבוהה בהרבה מזו שבאזורי גולגולת שעירים. החוקרים הציעו שעיכוב צמיחת שיער היה כרוך בקישור של PGD2 לקולטן הקרוי GPR44, וייתכן שקולטן זה צריך לשמש כיעד תרפויטי למניעת התקרחות אנדרוגנית בגברים ובנשים.
מחקר של Morrow וחב' שהופיע בשנת 1989 ב-Prostaglandins, הראה ש-PGD2 הוא המתווך העיקרי הרחבת כלי-דם לאחר צריכת ניאצין (nicotinic acid), ותופעת הסומק הידועה כ- "The "niacin flush. נמצא ש-PGD2 משתתף גם בכיווץ והרפיה של שריר חלק, והוא מעכב יעיל של צימות טסיות. מחקרים עם עכברים טרנסגניים המבטאים ביתר את הגן ל-PGD2 מרמזים לכך שגן זה עשוי להיות קשור לוויסות לשינה של non-rapid eye movement. במאמרם של Onoe וחב' ב-Proc Natl Acad Sci USA משנת 2012, הם מתייחסים לPGD2- כאל חומר המשרה שינה בעכברים.
PGD2 גם כן מונע צימות של טסיות ומשרה הרחבת כלי-דם וכיווץ דרכי אוויר בריאות. הוא מופרש מתאי-פיטום כמתווך של אלרגיה ומצבי דלקת (Lewis ב-J Immunol משנת 1982), והוא אחראי לתסמינים המוכרים במטופלים עם mastocytosis, כמו סומק, שלשולים, tachycardia, קוצר נשימה ושינה עמוקה (Roberts וחב' ב-New Eng J Med משנת 1980). במסגרת המטבוליזם של PGD2 מותמר פרוסטגלנדין זה ל-9α,11β-PGF2, שהוא סטראו-איזומר של PGF2α. כמו כן, PGD2 עובר במהירות דהידרציה in vitro ו-in vivo (על פי Hirata וחב' ב-J Biol Chem משנת 1988) ליצירת פרוסטגנדינים מסְדרת J, כגון PGJ2, 12-PGJ2Δ ו-15-deoxy-Δ12,14-PGJ2, כאשר התוצר האחרון זוהה כליגנד אקסוגני הנקשר לקולטן הגרעיני peroxisome proliferator-activated receptor γ, והוא מעודד התמיינות (דיפרנציאציה) של אדיפוציטים.
PGD2 יכול להפגין השפעה פרו-דלקתית או גם נוגדת-דלקת במערכות ביולוגיות שונות. במודל אסתמה ומחלה אלרגית בעכברים נמצא ש- PGD2הוא בעל השפעה פרו-דלקתית משמעותית, על ידי וויסות של פעילות אאוזינופילים, היפר-אקטיביות של דרכי-אוויר, יצירת ריר (mucus), וכן השפעה על רמת ציטוקינים שלTh2 (על פי Fujitani וחב' ב-FASEB J משנת 2010, ו-Matsuoka וחב' ב-Science משנת 2000). יתרה מכך, עיכוב של סינתזת PGD2 וחסימת איתות של PGD2, הם בעלי השפעה מדכאה של תרחיש נוירו-דלקתי במודל עכברים של מחלת Krabbe (על פי Mohri וחב' ב-J Neurosci משנת 2006). הזרקה של PGD2 לתוך העור נמצא גורם לבצקת, erythema, קשיוּת והסננה של לויקוציטים (Pettipher וחב' ב-Nature Rev Drugs Discovery משנת 2007).
בניגוד להשפעות פרו-דלקתיות אלו, PGD2 ונגזרי cyclopentenone של פרוסטגלנדינים, מפגינים דווקא השפעות נוגדות דלקת. יש עניין רב בחשיבות של PGD2 ותוצריו על התפוגגות מצבי דלקת (Gilroy וחב' ב-FASEB J משנת 2003). חוקרים אלה הראו שבמודל ניסויי של pleuritis, הייתה ל-PGD2 השפעה מפחיתת דלקת. בדומה, במודל ניסויי של colitis, PGD2 שנוצר על ידי פעילות COX-2, מחליש את ההסננה של נויטרופילים לרירית המעי הגס (Ajuebor וחב' ב-Am J Physiol משנת 2000). במודל באדם בו הושרתה תגובה דלקתית חריפה על ידי הזרקת ליפופוליסכריד (LPS) להופעת תסמינים דמויי-שפעת עם חום גבוה ותגובה הומודינמית, הראו Song וחב' ב-J Biol Chem משנת 2008, שרמת אחד המטבוליטים של PGD2 הידוע כ-tetranor-PGDM, גדלה משמעותית בעת התגובה הדלקתית האחרונה, וש-PGJ2 הוא בעל השפעה המפחיתה את חום הגוף. נתונים אלה תומכים בחוזקה בהשפעות נוגדות הדלקת של PGD2.
למרות שמספר מחקרים בחנו את תפקידו של PGD2 במצבי דלקת, תפקידו של פרוסטגלנדין זה בתגובה החיסונית של הגוף נחקר פחות. מחקר מוקדם יותר הראה שרמת PGD2, אך לא זו של PGE2, מוגברת בנוזל צרברו-ספינאלי במטופלים עם מחלת שינה אפריקאית הנגרמת על ידי Trypanosoma crucei (על פי Pentreath וחב' ב-Trans Royal Soc Trop Med Hygene משנת 1990). חוקרים אלה הראו שאסטרוציטים ופיברובלסטים של עכברים בתרבית תאים המטופלים על ידי T. crucei מייצרים PGD2 (על פי Alafiatayo וחב' ב-Parasitol Res משנת 1994), אך למרות שיצירת PGD2 מוגברת in vitro ההשפעות הפיזיולוגיות שלו במערכת זו אינה ברורה.
במחקר עדכני של Zhao וחב' ב-J Clin Invest משנת 2011, הם הראו שעליה ברמת PGD2 בעכברים התלויה בגיל, גרמה להפחתה ביכולת הנדידה של תאים דנדריטים במערכת הנשימה, ולכן הפחתה בתגובת תאי-T במצבים של תגובה חיסונית לנגיפים. חוקרים אלה מצאו שהזרקת אנטגוניסט של PGD2 גרמה להיפוך של הפגמים האמורים בנדידת דנדריטים, ולחיזוק התגובה האנטי-נגיפית של תאי T. נתונים אלה מרמזים שבמחלה אלרגית של דרכי האוויר, נראה שיש ל-PGD2 הוא בעל השפעה המדכאת את מערכת החיסון בהדבקות נגיפיות. במודל של עכברים של הדבקת ריאות עם Pseudomonas aeruginosa, נמצא שעיכוב של פעילות COX-2 משפרת הישרדות במודל לתאלי של הדבקה עם חיידק זה (Sadikot וחב' ב-Europ J Immunol משנת 2007(. הפינוי של חיידק פסאודומונאס תוגבר על ידי בעכברי knockout משוללי COX-2, בעוד שעכברים טרנסגניים המבטאים ביתר את COX-2, פגומים ביכולתם לנקות את הריאות מחיידק זה (Park וחב' ב-Clin Exp Immunol משנת 2007).
Joo וחב' במאמרם משנת 2007 ב-J Immunol בחנו את השפעות ההזרקה של PGD2 במודל של הדבקת ריאות עכברים בחיידק פסאודומונאס. עכברים להם הוחדרPGD2 לקנה הנשימה הראו פינוי מוגבר של החיידק מריאותיהם. תוצאות אלה היו בהסכמה עם התוצאות של מחקרים בעכברי knockout החסרים L-PGD synthase או בעכברים טרנסגנים המבטאים ביתר את האנזים הזה. Syed וחב' ב-Exp Cell Res משנת 2010, חקרו in vitro את המנגנון דרכו PGD2 מדגים את יכולתו האימונו-מודולטורית. נמצא ש-PGD2 מעכב את הקולטן TREM-1על פני מקרופאגים, שמשמש נוגדנים פרו-דלקתיים.
החשיבות של PGD2 בפתוגניות והפתרון של דלקת הולכת ומתבררת (Gilroy וחב' ב-Nature Rev Drugs Discovery משנת 2004, ו-Serhan וחב' ב-FASEB J משנת 2007). עם זאת, ההשפעה של PGD2 על מצבי דלקת מאוד מורכבת כיוון ש-PGD2 יכולה לעודד אך גם לדכא דלקת בתלות בסביבה הדלקתית. דואליזם זה מסתבך עוד יותר בשל העובדה ש-PGD2 עובר תהליכים לא אנזימטיים ליצירת 15d-PGJ2, שהוא ליפיד נוגד דלקת. לכן ההשפעה נטו של פרוסטגלנדין זה עשויה להיות מושפעת מקצב היצירה של תוצרים של PGD2 בתלות בשלב המחלה.
מעכבי פעילות PGD2
Fevipiprant (שם קוד פיתוח QAW039) הוא תכשיר פומי שפותח על ידי חברת Novartis הפועל כאנטגוניסט בררני של הקולטןPGD2R2 הידוע גם כ-DP2 או CRTh2 (על פי Vets וחב' ב-Clin Pharmacol Drugs משנת 2016, וכן Sykes וחב' ב-Mol Pharmacol משנת 2016 ו-Erpenbeck וחב' ב-Pulm Pharmacol Ther משנת 2016). בשנת 2016 הוחל בניסויים קליניים phase III לבחון יעילות מעכב זה בטיפול בחולי אסתמה (Gonem וחב' ב-Lancet Respir Med משנת 2016). Setipiprant (שמות קוד פיתוח ACT-129,968 ו-KYTH-105), הוא תכשיר שפותח במקור על ידי חברת Actelion, המשמש בנטילה פומית בררנית כאנטגוניסט של PGD2R2 המבוטא על תאיTh2 (על פי Fretz וחב' ב-J Med Chem משנת 2013). במקור נוסה תכשיר זה כטיפול באלרגיות ומפגעים דלקתיים, בעיקר באסתמה. אך למרות שהתכשיר היה נסבל היטב בניסויים קדם-קליניים ולמרות שהוא הראה יעילות כנגד תגובות המושרות על ידי אלרגנים בדרכי האוויר של חולי אסתמה (Diamant וחב' ב-Clin Exp Allergy משנת 2014), הוא נכשל להראות מספיק יתרונות בהשוואה לתרופות קיימות ולכן הופסק פיתוחו בתחום זה.
עם זאת, לאחר הממצא משנת 2012 שהקולטן שלPGD2 מבוטא ברמות גבוהות באזורים מקריחים במתווה זכרי, נרכשו הזכויות של setipirant על ידי חברת Kythera בניסיון לפתחו כטיפול חדשני להתקרחות. בשנת 2016 הוחל בניסוי phase IIA להערכה של הבטיחות, הנסבלות והיעילות של setipirant פומי, בהשוואה לפלצבו ולתכשיר בר-ההשוואה הפעיל finasteride בגברים בגיל שבין 18-41 שנה הסובלים מהתקרחות אנדרוגנית.
Ramatroban ) שם קוד u3405 BAY) הוא אנטגוניסט של הקולטן ל-thromboxane אך גם אנטגוניסט של הקולטן ל-PGD2 (על פי Sogimoto וחב' ב-J Pharmacol Exp Ther משנת 2003). אנטגוניסט זה חוסם את התנועה של איאוזינופלים ושל בזופילים (Royer וחב' ב-Eur.J Clin Invest משנת 2008). ניסויים קדם-קליניים בחנו את יעילותו בטיפול במחלת עורקים כליליים (Fiedler וחב' ב-Stroke משנת 1990),וכן על יעילותו בטיפול בחולי אסתמה (Endo ו-Akiyama ב-Nippon Rinsho משנת 1996). תכשיר אחרון זה מיוצר על ידי חברת Bayer AG בשיתוף עם החברה היפאנית Nippon Shinyaku Co תחת שם המותג Baynas.
הוראות לביצוע הבדיקה
ניתן לבצע את הבדיקה בנסיוב (לקיחת דם במבחנה כימית, פקק אדום או צהוב) או בפלזמה (לקיחת דם במבחנת ספירת-דם עם EDTA, פקק בצבע סגלגל), ולאחר סרכוז יש להעביר את הנוזל העליון למבחנת פלסטיק ולהעביר במהירות למעבדה בקירור או בהקפאה. גם דגימות נסיוב או פלזמה שהן המוליטיות, איקטריות או ליפמיות מתקבלות לבדיקה. מבחנות המגיעות בטמפרטורת החדר פסולות לבדיקה. הדגימה יציבה משך 180 יום בהקפאה. מטופלים עם אספירין, עם תכשירים נוגדי-דלקת לא-סטרואידיים (NSAIDs) או עם indomethacin אמורים להימנע מצריכת תרופות אלו לפחות 48 שעות לפני לקיחת הדם. הבדיקה מתבצעת בשיטת Radioimmunoassay (RIA).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 