קומה נמוכה - Short stature
| קומה נמוכה | ||
|---|---|---|
| Short stature | ||
| 250px | ||
| ICD-10 | Chapter E 34.3 | |
| ICD-9 | 783.43 | |
| יוצר הערך | ד"ר מרינה רחמיאל | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפרעות גדילה
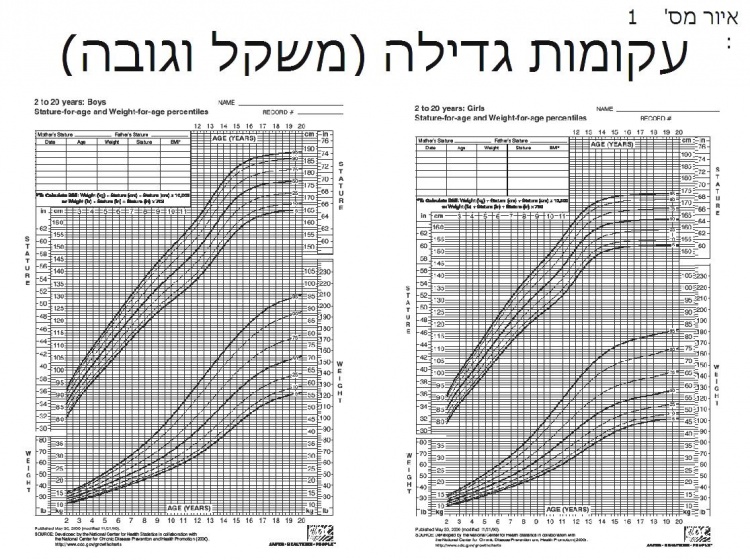
טווח הגובה התקין רחב מאוד, ומבוסס על פיזור הגובה של ילדים בריאים באוכלוסיית העולם. מדידות גובה שבוצעו בארצות הברית לאורך שנים הובילו ליצירת עקומות הגדילה של ה-CDC (Centers for Disease Control and Prevention), המכילות את פיזור הגובה התקין על פי גיל ומין. קומה נמוכה המצריכה בירור רפואי מוגדרת כגובה מתחת לאחוזון 3 באוכלוסייה בהתאם לגיל ולמין, קומה נמוכה משמעותית ביחס לממוצע הגובה המשפחתי, וקצב גדילה שנתי הנמוך מ-5 סנטימטר בשנה. ישנם גורמים רבים לקומה נמוכה, הכוללים בעיקר גנטיקה והשפעות סביבתיות שונות. יש לכוון את הבירור הרפואי בהתאם לאטיולוגיה. אבחנה מוקדמת היא חשובה ביותר על מנת שניתן יהיה לטפל בקומה הנמוכה בהקדם האפשרי ובהתאם לגורם.
אטיולוגיה
טווח הגובה התקין רחב מאוד, ומבוסס על פיזור הגובה של ילדים בריאים באוכלוסיית העולם. בארצות הברית בוצעו מדידות גובה לאורך שנים, בקרב אוכלוסייה גדולה של ילדים בגילאי 0–18 שנים שרובם אינם ניזונים מהנקה. אותן מדידות הניבו את פיזור הגבהים באוכלוסייה. על סמך מדידות אלו, יצר ה-CDC עקומות גדילה סטטיסטיות המכילות את פיזור הגובה התקין בכל גיל ולכל מין. העקומות פורסמו בשנת 2000[1].
פיזור הגובה התקין הוא בין אחוזון 3 לאחוזון 97 – קרי, תשעים וחמישה אחוזים מהילדים בכל הגילאים והמינים נמצאים בתוך הטווח התקין, כאשר ממוצע הגובה לכל גיל הוא בעצם אחוזון 50, ואחוזון 3 ו-97 הם בטווח של 2 סטיות תקן מערך ממוצע זה.
העקומות מאפשרות להעריך האם גובהו של ילד מתאים, נמוך או גבוה לגילו, ובאיזו מידה ביחס לממוצע. בשנת 2007 פורסמו עקומות גדילה נוספות על ידי ארגון ה-WHO (World Health Organization)[2][3]. העקומות החדשות מבוססות על אוכלוסיות מ-5 מדינות בעולם, כולל ארצות הברית, ובעיקר על ילדים שינקו עד גיל 4 חודשים לפחות. עקומת הגדילה המקובלת על ידי האנדוקרינולוגים בישראל להערכת גובה בילדים בישראל היא עקומת ה-CDC משנת 2000[1]. מעקב אחר תינוקות ופעוטות בגילאים 0–2 שנים בטיפת חלב היא על סמך עקומות ה-WHO.
מדד נוסף להערכת גובהו של ילד הוא פוטנציאל הגובה הגנטי. גובה הילד נקבע ב-70 אחוזים על פי גובה ההורים, וב-30 אחוזים על פי גורמים סביבתיים, המצב הבריאותי, המצב התזונתי ועוד. ניתן להעריך את גובהו הגנטי של כל ילד על פי חישוב גס של ממוצע גובה ההורים, עם הפחתה של 6.5 ס"מ בבנות או הוספה של 6.5 ס"מ בבנים. מהתוצאה יש לקחת כ-8 ס"מ עבור 2 סטיות תקן – היות שהגובה הגנטי מהווה טווח של גבהים ולא מספר בודד.
המדד השלישי החשוב לצורך הגדרת גדילה תקינה הוא קצב הצמיחה. קצב הצמיחה מוערך כמספר הס"מ שהילד גבה במהלך שנה של מעקב. קצב הצמיחה גבוה במיוחד במהלך 2 תקופות בחיים: השנתיים הראשונות לחיים, וההתבגרות המינית. פרט לשנים אלו, קצב הצמיחה הוא קבוע. קצב צמיחה תקין מעל גיל 3 שנים ולפני תחילת גיל ההתבגרות הוא כ־5 ס"מ בשנה.
הגדרה
ההגדרה של קומה נמוכה המצריכה בירור רפואי כוללת כל אחד מהמצבים הבאים[4][5]:
- גובה מתחת לאחוזון 3 ביחס לגיל ולמין למשך שנה, על פי עקומות ה-CDC 2000
- גובה מתחת ל-1.5 סטיות תקן ביחס לגובה הגנטי, במשך שנה
- ירידה בקצב הגדילה ביחס לנורמה במשך כשנה, בילד מעל גיל שנתיים. כלומר, צמיחה של פחות מ-5 ס"מ בשנה
פתוגנזה
תהליך הגדילה התקין תלוי במספר גורמים:
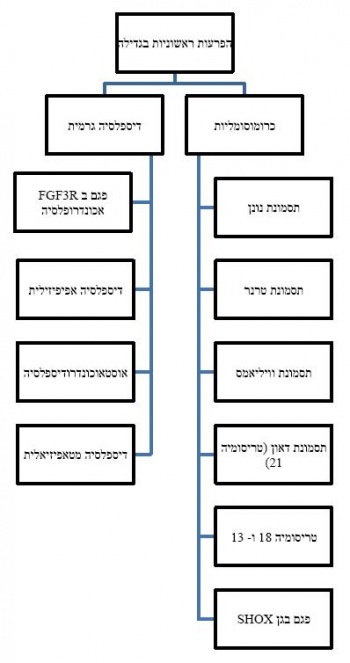
- גנטיקה - ישנם כרומוזומים רבים הנושאים מידע גנטי הקשור לגדילה, כגון כרומוזום X הנושא עליו את הגן SHOX. גדילה תקינה תלויה באינטראקציה בין מספר גנים וביטויים. אם כן, קומה נמוכה מהווה ביטוי קליני של הפרעות כרומוזומליות רבות – כגון תסמונת Turner. לעומת זאת, לא כל הגנים הנוטלים חלק בקביעת הגובה הסופי ידועים, ולא כל התפקידים התבררו. מה שידוע הוא כי גובהו הסופי של הילד ותבנית הגדילה שלו נקבעים בעיקר על ידי הגנטיקה המשפחתית המורכבת
- גדילה בתקופה העוברית - ישנם גורמים רבים המשפיעים על הגדילה התוך רחמית - כגון חשיפה לתרופות, תזונה, עישון, זיהומים, יתר לחץ דם, הפרעות כרומוזומליות בעובר ואי ספיקה שלייתית. כל אחד מהגורמים עשוי להביא למצב של עובר קטן לגיל ההיריון (SGA (Small for Gestational Age)). נמצא קשר בין SGA לקומה נמוכה יחסית לטווח ארוך. מנגנון ההשפעה אינו ידוע, אך קיימות מספר השערות, כגון תבנית שונה של הפרשת הורמון גדילה [GH (Growth hormone)] בילדים שהם SGA, והפרעה בהשלמת הגדילה בגיל ההתבגרות[6][7]
- תזונה - גדילה וצמיחה לגובה אינן מהוות צורך קיומי בסיסי. לכן, במצבים של תת-תזונה ישנו ניתוב של הקלוריות והאנרגיה לצרכים הבסיסיים של תפקוד האיברים החיוניים - כולל הלב, המוח והשרירים, והגדילה וההתבגרות המינית עשויים להיות מעוכבים. בכדי לאפשר צמיחה תקינה לגובה, בעיקר בשנים הראשונות לחיים ובגיל ההתבגרות, יש צורך בכמות מספקת של אבני בניין, קרי תזונה בריאה ומגוונת ואורח חיים בריא. ידוע כי גם חסרים של מינרלים מסוימים המצויים במזון - כגון ברזל, אבץ, סידן וזרחן - עשויים להפריע למימוש פוטנציאל הצמיחה
- דלקת כרונית - כל מחלה כרונית שאינה מאוזנת, בין אם מטבולית (כגון הפרעות במאזן הסידן או החלבון) או דלקתית (כגון סוכרת (Diabetes Mellitus), כרסת (Celiac disease), דלקת פרקים (Arthritis) או זאבת (Lupus)) עשויה לפגוע בתהליך הצמיחה לגובה. אם מחלות אלו פעילות ולא מאוזנות, בעיקר בגיל ההתבגרות, עשוי להיווצר קיפוח בגובה הסופי
- העצם ולוחית הגדילה - הצמיחה לגובה תלויה בצמיחה של הגפיים (עצמות ארוכות) והחוליות. צמיחת החוליות והגו משמעותית יותר בגיל ההתבגרות, ותלויה במיוחד בהורמוני המין. צמיחת העצמות הארוכות, לעומת זאת, מושפעת יותר מהורמון הגדילה. המבנה התקין של העצם, חלבון הקולגן ולוחיות הגדילה חיוני על מנת להשלים את פוטנציאל הגובה. כל פגיעה במבנה העצם - בין אם ראשונית ומולדת, או משנית (כגון דלקת פרקים), תפגע בצמיחה לגובה
- המערכת ההורמונלית פרט לציר הורמון הגדילה - פרט לציר הגדילה, ישנם הורמונים רבים המשפיעים על הגדילה באופן בלתי ישיר - כגון הורמון בלוטת התריס (Thyroid hormone), קורטיזון, והורמון בלוטת יותרת התריס (Parathyroid hormone). חסר של אחד ההורמונים הללו, או עודף קורטיזון [מסיבה אינטרינזית (Intrinsic) או בשל מתן חיצוני ממושך בשאיפה או בצורה פומית], עשויים להתבטא בתסמינים ספציפיים לכל אחד מההורמונים, ובנוסף לכך בפגיעה בקצב הגדילה
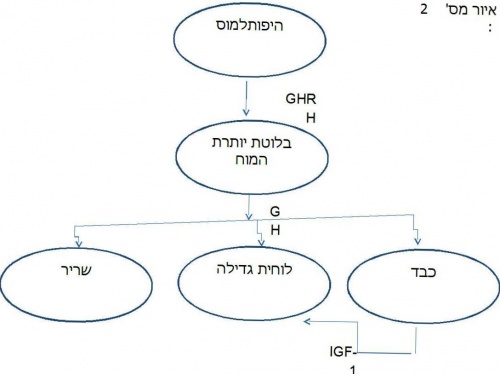
- ציר הורמון הגדילה - ציר הורמון הגדילה הוא הציר ההורמונלי העיקרי האמון על הצמיחה לגובה. תפקודו של ציר זה מושפע מיתר הגורמים שתוארו לעיל. ציר זה קרוי גם GH-IGF1 ומתואר באיור מספר 2
הורמון הגדילה מופרש מבלוטת יותרת המוח (Pituitary gland), לאחר קבלת גירוי מההיפותלמוס להפרשתו, על ידי הורמון משחרר הורמון גדילה (GHRH). פפטידים (שרשראות קצרות של חומצות אמינו) שמקורם ברקמת המוח הם האחראיים לשפעול ההפרשה הראשונית של GHRH. הורמון הגדילה מופרש בצורה פולסטילית (גלית), ועיקר ההפרשה מתרחשת בשעות הלילה. ההפרשה אינה זהה במשך כל שעות היום, ומשתנה גם כתלות במצבי לחץ, רעב, תרופות ועוד. הורמון הגדילה משפיע באופן ישיר על לוחית הגדילה, אך עיקר השפעתו היא על הכבד – שם הוא יוצר גירוי להפרשת הורמון אחר המכונה IGF-1 (Insulin Growth Factor 1). הורמון ה-IGF-1 פועל בעצמו באופן ישיר על לוחית הגדילה, על מנת לאפשר גדילה תקינה.
הפרשתו של IGF-1 תלויה בהורמון הגדילה, אך גם בתזונה בריאה, וערכו בדם נמוך במצבים של תת-תזונה. במצבים של חסר תגובה להורמון הגדילה על רקע חוסר תפקוד הקולטן (Receptor), כגון תסמונת Laron - רמות הורמון הגדילה יהיו תקינות או מוגברות, ורמות ה-IGF-1 יהיו נמוכות מאוד.
הסיבה השכיחה ביותר לחסר הורמון גדילה אינה ידועה (Idiopathic growth hormone deficiency). על כן, חשוב לבצע אבחנה זו על דרך השלילה, ולשלול קודם את הגורמים הנוספים לחסר הורמון גדילה – הכוללים תהליך תופס מקום [SOL (Space Occupying Lesion)], חסר התפתחות או Hypoplasia של בלוטת יותרת המוח, או גורמים משניים כגון קרינה לאזור הגולגולת.
הגורמים לקומה נמוכה
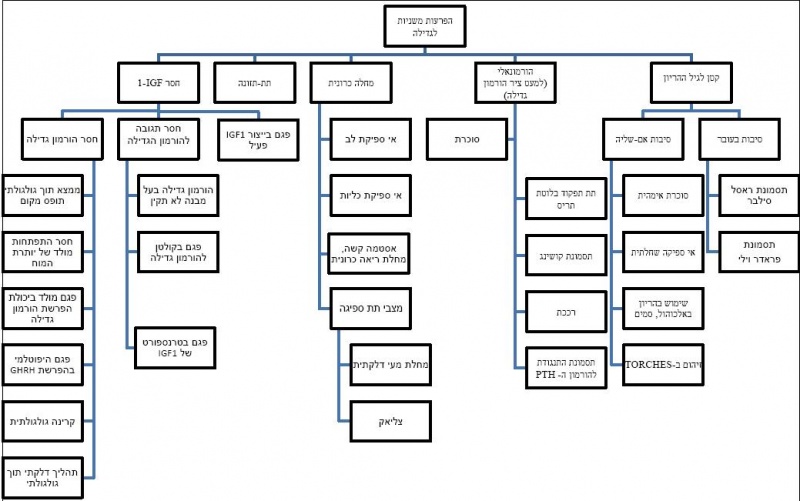
ישנם גורמים רבים לקומה נמוכה. ניתן לחלקם ל-5 קבוצות עיקריות:
- קומה נמוכה על רקע הפרעות ראשוניות בגדילה - כגון הפרעות כרומוזומליות, הפרעות גרמיות ו-SGA
- קומה נמוכה על רקע הפרעות משניות בגדילה - כגון תת-תזונה, מחלה דלקתית, חסר תפקוד של בלוטת התריס, או חסר כלשהו בציר הורמון הגדילה
- קומה נמוכה על רקע גנטי – לדוגמה, גובה אם ואב באחוזון 3, וגובה גנטי מחושב באחוזון 3
- קומה נמוכה על רקע איחור התפתחותי כוללני (Constitutional delay of growth and puberty) - עיכוב גם בגדילה וגם בהתבגרות המינית. זוהי למעשה הסיבה השכיחה ביותר לקומה נמוכה בילדים ומתבגרים שאינה מצריכה התערבות. מצב זה כולל איחור גם בגדילה לגובה וגם בהופעת סימני התבגרות מינית. קיים סיפור משפחתי, והבירור האנדוקריני תקין. גיל העצמות בדרך כלל מאחר, בטווח של שתי סטיות תקן. ברוב המקרים קיימת השגת גובה סופי כל עוד הגובה הגנטי תקין. אולם, אבחנה זו מבוצעת רק על דרך השלילה, שכן הגורמים הנוספים לקומה נמוכה עשויים להצריך התערבות
- גם לאחר בירור מלא ומקיף, ישנם ילדים שהם נמוכים מסיבה לא ברורה. ילדים אלו סובלים ככל הנראה מעמידות מסוימת להורמון הגדילה, מפגם במבנה הורמון הגדילה, או שקומתם נמוכה מסיבה שעדיין לא נמצאה. מצבים אלו מכונים ISS – Idiopathic Short Stature[4]
לעיתים קרובות, קיימת חפיפה קלינית ואבחנתית בין מצבים של קומה נמוכה על רקע משפחתי, למצבים הנוצרים על רקע איחור בהתבגרות המינית או מסיבה לא ידועה. יש הכוללים את שלושת האבחנות הללו תחת הכותרת של ISS.
קליניקה[4][8]
הביטוי הקליני עשוי להתחיל בכל גיל, בהתאם לגורם. ייתכן מצב של צמיחה איטית קבועה, או ירידה בקצב הצמיחה של ילד שגדל באופן תקין עד לנקודת זמן מסוימת. הגיל בו נוצר השינוי בקצב הגדילה מכוון לאטיולוגיה המתאימה. לדוגמה, ירידה משמעותית בקצב הצמיחה סביב גיל 9–10 חודשים לאחר צמיחה תקינה מתאימה לחסר מולד של הורמון גדילה. הקליניקה עשויה לכלול קומה נמוכה בלבד, או שילוב של קומה ומשקל נמוכים.
אבחנה
אנמנזה
חשוב לברר לגבי גיל ההיריון, משקל וגובה הלידה, היסטוריה של היפוגליקמיה בילוד, לידת עכוז, לידה טראומטית או Micropenis. כמו כן, יש לברר נתונים לגבי הגדילה בשנים הראשונות לחיים וגדילה בשנים הסמוכות למועד הבירור, ולאסוף כמה שיותר מדידות של גובה ומשקל. תלונות נוספות העשויות לכוון לאטיולוגיה ולהצריך בירור נוסף כוללות שלשול כרוני, עצירות כרונית משמעותית, פזילה ועיוורון מוקדמים.
בנוסף, חשוב למדוד את גובה ההורים ולברר לגבי נישואי קרובים ולגבי הגובה של קרובי המשפחה. אם גובהו של אחד ההורים מתחת לאחוזון 3, חישוב הגובה הגנטי אינו מהווה מדד היות שייתכן חסר משפחתי של הורמון גדילה.
בדיקה גופנית
יש להקפיד על הערכת קצב הגדילה, בדיקת הפרופורציות של הילד, חיפוש סימנים וכתמים עוריים כגון היפרפיגמנטציה (Hyperpigmentation), בירור שלב ההתפתחות המינית, מבנה הגולגולת המצח והפנים, סימני רככת (Rickets), מספר השיניים וקצב הופעתן. כמו כן, יש לחפש סימנים של Dysmorphism, בעיקר בבנות בחשד לתסמונת Turner, ובבנים בחשד לתסמונת Nonnan (Noonan syndrome).
בירור ראשוני
- צילום כף יד להערכת גיל העצמות
- בדיקות דם כלליות - הכוללות ספירת דם, מדדי דלקת, תפקודי כבד ותפקודי כליה, רמת IGF-1, סרולוגיה ל-Celiac disease, ובדיקת Karyotype אם מדובר בבת נמוכה משמעותית
- בדיקת שתן
רמות IGF-1 פחות אמינות בשנתיים הראשונות לחיים, כך שייתכן מצב של ערך נמוך במצבים של תת-משקל ותת-ספיגה.
בירור שניוני
הבירור השניוני מבוצע בדרך כלל רק בהמלצת אנדוקרינולוג ילדים. בירור זה מבוצע בהתאם לתוצאות הבירור הראשוני וקצב הגדילה, וכולל הערכה פעילה של מאגר הורמון הגדילה. הערכה זו אינה יכולה להתבצע על ידי בדיקת דם רגילה, היות שהורמון הגדילה מופרש באופן פולסטילי – ועל כן מדידת הורמון הגדילה בדם באופן שגרתי היא חסרת משמעות, והסבירות למצוא ערך גבוה מוקדם בבוקר בבדיקה אקראית נמוכה.
לאור זאת, הערכת מאגר הורמון הגדילה דורשת עירור של בלוטת יותרת המוח למצב של גירוי יתר, שיעורר הפרשת יתר זמנית של הורמון גדילה. ישנו טווח תקין של רמות הורמון הגדילה בהתאם לגירויים שונים - כגון פעילות גופנית, מתן תרופות פומיות (תבחין Clonidine) או תוך-שריריות (תבחין Glucagon), או מתן אבני בניין תוך-ורידי (תבחין Arginine)[9][10].
התבחינים אינם אמינים במאה אחוז, ושיעור התגובה השלילית השקרית (False negative) הוא כ־10 אחוזים. לכן, בכדי לאבחן חסר הורמון גדילה יש להדגים חסר בשני תבחינים שונים. בתבחינים המבוצעים בישראל, חסר מוגדר כערך נמוך מ-7.5 ננוגרם למ"ל (מיליליטר) לאחר גירוי. ב-18–60 אחוזים מהמקרים יודגם חסר בתבחין המבוצע בילדות, אך תבחין חוזר זהה שיבוצע בגיל מבוגר יותר ידגים רמות תקינות. כמו כן, לתבחינים ישנן תופעות לוואי שונות – הכוללות תגובה אלרגית, היפוגליקמיה, ישנוניות וירידת לחץ דם. יש לבצע אותם במסגרת אשפוז יום ובנוכחות רופא ילדים בלבד.
אם נתגלה חסר הורמון גדילה, יש מקום לבצע הדמיה מוחית על ידי MRI (Magnetic Resonance Imaging) בכדי למצוא את הגורם לחסר. במרבית המקרים לא תודגם פתולוגיה אנטומית במבנה בלוטת יותרת המוח, אך ישנם מקרים מעטים בהם יודגם חסר התפתחות של הבלוטה או היפופלסיה שלה. לעומת זאת, על פי המחקרים, ב-80 אחוזים מהמקרים של חסר הורמון גדילה מבודד וב-93 אחוזים מהמקרים של חסר במספר הורמונים מודגמות אנומליות מולדות במבנה הבלוטה[11][12].
טיפול
הטיפול בקומה נמוכה תלוי באטיולוגיה. ככל שהגורם מאובחן מוקדם יותר וההתערבות מוקדמת יותר, הגובה הסופי יהיה תואם יותר לגובה הגנטי[13].
לרוב ההפרעות הכרומוזומליות והגרמיות לא נמצא טיפול יעיל המביא לרווח גובה משמעותי. לעומת זאת, במצב של תסמונת Turner, טיפול מוקדם בהורמון גדילה עשוי להביא לרווח גובה של כ-10 ס"מ. גם במצב של תסמונת נונן הוכח כי הטיפול עשוי להביא לרווח גובה סופי של כ-6 ס"מ, ועל כן הטיפול בהורמון גדילה מאושר גם בהתוויה זו.
במצבים של קומה נמוכה על רקע הפרעות משניות, אבחון וטיפול מוקדם במצבים של תת-תזונה, הפרעת אכילה, ומחלות דלקתיות או כרוניות ימנעו פגיעה בצמיחה לגובה. טיפול בהורמון גדילה נמצא יעיל גם במצבים של קומה נמוכה על רקע אי ספיקה כלייתית. לעומת זאת, במצבים של קומה נמוכה על רקע מצבי תת-ספיגה דלקתיים (כגון מחלת מעי דלקתית) ובמצבים דלקתיים שגרונתיים, נמצא כי הטיפול בהורמון גדילה אינו יעיל יותר משיפור תזונתי או הזנת לילה. במקרים אלו, שליטה על התהליך הדלקתי מאפשרת השגת גובה, כל עוד היא מבוצעת בשלב מוקדם מבחינת הגדילה.
טיפול בחסרים הורמונליים משניים, כגון חסר הורמון בלוטת התריס, יאפשר השגת גובה סופי תקין, כל עוד יאובחן בשלב מוקדם.
במצבים בהם הפגיעה נובעת מחסר הורמון גדילה, יש לאבחן את הסיבה לחסר. חשוב לוודא שאין פגיעה בהפרשת הורמונים אחרים מבלוטת יותרת המוח (TSH (Thyroid Stimulating Hormone), ACTH (Adreno-Cortico-Tropic Hormone), FSH (Follicle-Stimulating Hormone), LH (Luteinizing Hormone)). רק לאחר השלמת תהליכים אלו ניתן להתחיל טיפול בהורמון גדילה. במקרים של חסר של הורמון גדילה, נמצא כי טיפול יומי קבוע בהורמון במינון קבוע של כ-0.3 מ"ג (מיליגרם) לק"ג (קילוגרם) מאפשר להגיע לגובה סופי בטווח התקין - כתלות בגיל תחילת הטיפול, במינון ובהיענות לטיפול[5][14][15][16][17][18].
במצבים של SGA שלא הצליח להשלים את גדילת הפיצוי (Catch up growth) ולהגיע לגובה מעל אחוזון 3 עד גיל 3–4 שנים, הסבירות להשלמת הגובה ירודה. במצבים אלו, נמצא כי טיפול בהורמון גדילה למשך שנים יעיל ועשוי להוביל לתוספת של כ-5 ס"מ לגובה הסופי. הטיפול מאפשר התמודדות טובה יותר עם גיל ההתבגרות. חשוב לוודא שאין ציפיות יתר מהטיפול, היות שרווח הגובה מטיפול ארוך זה הוא מוגבל[6].
פורסם נייר עמדה על ידי Cohen וחבריו[4] העוסק באבחון מצבים של קומה נמוכה מסיבה לא ידועה, לאחר השלמת הברור. לפי ההמלצות בנייר העמדה, ניתן לטפל בקבוצת הילדים עם ISS בהורמון גדילה, ללא תופעות לוואי שונות מאלו שתוארו בשימוש בהורמון גדילה במצבי חסר, אולם במינון יותר גבוה. ניתן לשקול את הטיפול במצבים בהם לא נמצאה כל הפרעה בבירור, והגובה הסופי המוערך נמוך מ-150 ס"מ בבנות או 160 ס"מ בבנים. גובה סופי משוער ניתן לחישוב על סמך הגובה בבדיקה הגופנית, הערכת גיל העצמות ושימוש בטבלאות של Bayley ו-Pinneau[19]. הערכות אלו אינן מדויקות, ולא מומלץ לנבא את הגובה הסופי על פיהן. הטיפול בהורמון גדילה במצבים אלו מצריך מינון גבוה פי שניים מהמינון המקובל בילדים עם חסר בהורמון גדילה, ורווח הגובה הסופי שתואר הוא כ-7.5-0 ס"מ (3.9 ס"מ בממוצע) לאחר כ־6 שנות טיפול.
טיפול בהורמון גדילה רקומביננטי
הטיפול בהורמון גדילה מאושר על ידי ה-FDA (Food and Drug Administration) בטווח מינונים של 0.05-0.03 מ"ג לק"ג ליממה (מקסימום 0.07 מ"ג לק"ג ליממה). הטיפול מאושר להתוויות הבאות:
- חסר הורמון גדילה
- תסמונת Turner
- תסמונת Noonan
- תסמונת Prader-Willie
- אי-ספיקת כליות
- תינוקות שנולדו SGA ולא ביצעו פיצוי של הגובה עד גיל 4 שנים
- ISS
טיפול בהורמון גדילה ניתן באמצעות זריקות עצמיות במתן תת-עורי מדי ערב. התכשיר מיוצר בהנדסה גנטית. תופעות הלוואי שתוארו, כוללות החמרה של עקמת (Scoliosis), החמרה של SCFE (Slipped Capital Femoral Epiphysis), עלייה ברמות הסוכר עד כדי סיכון לסוכרת מסוג 2, עלייה בערכי IGF-1 בדם, Gynecomastia בזכרים, דלקת לבלב (Pancreatitis), עלייה בלחץ התוך-גולגולתי, כאבי ראש, בחילה ותגובות מקומיות.
לא נמצאה עדות לעלייה בשכיחות גידולים ממאירים, למעט במצבים בהם הגורם הראשוני לחסר בהורמון גדילה הוא מחלה שגורמת בפני עצמה לעלייה בשכיחות גידולים ממאירים. במקרים אלו, השילוב של הורמון גדילה עשוי להגביר את הסיכון עוד יותר[20][21].
בישראל קיימות 3 חברות תרופות המשווקות את הורמון הגדילה - Pfizer, Novo Nordisk ו-Ferring. לא נמצא הבדל ביעילות התכשירים השונים מבחינת השגת הגובה הסופי וקצב הגדילה.
טיפול ב-IGF-1 רקומביננטי
במצבים של חסר IGF-1 על רקע חוסר תפקוד הקולטן להורמון גדילה, הטיפול בהורמון גדילה אינו מועיל. על כן, הטיפול המומלץ הוא מתן IGF-1 רקומביננטי. הטיפול ניתן מדי יום באמצעות הזרקה עצמית תת-עורית. התגובה לטיפול טובה. תופעות הלוואי של הטיפול כוללות בחילה, כאבי ראש, מצב דמוי שפעת, היפוגליקמיה וכאבי פרקים.
ביבליוגרפיה
- ↑ 1.0 1.1 www.cdc.gov/growthcharts/
- ↑ de Onis M, Garza C, Onyango AW, Borghi E. Comparison of the WHO child growth standards and the CDC 2000 growth charts. J Nutr. 2007; 137:144-8.
- ↑ de Onis M, Onyango AW, Borghi E, Siyam A, Nishida C, Siekmann J. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ. 2007; 85:660-7.
- ↑ 4.0 4.1 4.2 4.3 Cohen P, Rogol AD, Deal CL, Saenger P, Reiter EO, Ross JL, et al. Consensus statement on the diagnosis and treatment of children with idiopathic short stature: a summary of the Growth Hormone Research Society, the Lawson Wilkins Pediatric Endocrine Society, and the European Society for Paediatric Endocrinology Workshop. J Clin Endocrinol Metab. 2008; 93:4210-7.
- ↑ 5.0 5.1 Consensus guidelines for the diagnosis and treatment of growth hormone (GH) deficiency in childhood and adolescence: summary statement of the GH Research Society. GH Research Society. J Clin Endocrinol Metab. 2000; 85:3990-3.
- ↑ 6.0 6.1 Jung H, Rosilio M, Blum WF, Drop SL. Growth hormone treatment for short stature in children born small for gestational age. Adv Ther. 2008; 25:951-78.
- ↑ Rosenfeld RG CP. Disorders of growth hormone/insulin growth factor secretion and action. In: Sperling M, (ed). Pediatric Endocrinology. Third Ed. Elsevier, Pittsburgh, Pennsylvania, 2008, pp. 254-316.
- ↑ Oostdijk W, Grote FK, de Muinck Keizer-Schrama SM, Wit JM. Diagnostic approach in children with short stature. Horm Res. 2009; 72:206-17.
- ↑ Carel JC, Tresca JP, Letrait M, Chaussain JL, Lebouc Y, Job JC, et al. Growth hormone testing for the diagnosis of growth hormone deficiency in childhood: a population register-based study. J Clin Endocrinol Metab. 1997; 82:2117-21.
- ↑ Ranke MB. Diagnosis of growth hormone deficiency and growth hormone stimulation tests. Karger, Tubingen, 2003.
- ↑ Abrahams JJ, Trefelner E, Boulware SD. Idiopathic growth hormone deficiency: MR findings in 35 patients. AJNR Am J Neuroradiol. 1991; 12:155-60.
- ↑ Hamilton J, Blaser S, Daneman D. MR imaging in idiopathic growth hormone deficiency. AJNR Am J Neuroradiol. 1998; 19:1609-15.
- ↑ August GP, Julius JR, Blethen SL. Adult height in children with growth hormone deficiency who are treated with biosynthetic growth hormone: the National Cooperative Growth Study experience. Pediatrics. 1998; 102:512-6.
- ↑ Blethen SL, Baptista J, Kuntze J, Foley T, LaFranchi S, Johanson A. Adult height in growth hormone (GH)-deficient children treated with biosynthetic GH. The Genentech Growth Study Group. J Clin Endocrinol Metab. 1997; 82:418-20.
- ↑ Cutfield W, Lindberg A, Albertsson Wikland K, Chatelain P, Ranke MB, Wilton P. Final height in idiopathic growth hormone deficiency: the KIGS experience. KIGS International Board. Acta Paediatr Suppl. 1999; 88:72-5.
- ↑ Rabasa-Lhoret R, Bourque J, Ducros F, Chiasson JL. Guidelines for premeal insulin dose reduction for postprandial exercise of different intensities and durations in type 1 diabetic subjects treated intensively with a basal-bolus insulin regimen (ultralente-lispro). Diabetes Care. 2001; 24:625-30.
- ↑ Rachmiel M, Rota V, Atenafu E, Daneman D, Hamilton J. Final height in children with idiopathic growth hormone deficiency treated with a fixed dose of recombinant growth hormone. Horm Res. 2007; 68:236-43.
- ↑ Bramswig JH, Schlosser H, Kiese K. Final height in children with growth hormone deficiency. Horm Res. 1995; 43:126-8.
- ↑ Bayley N, Pinneau SR. Tables for predicting adult height from skeletal age: revised for use with the Greulich-Pyle hand standards. J Pediatr. 1952; 40:423-41.
- ↑ Bell J, Parker KL, Swinford RD, Hoffman AR, Maneatis T, Lippe B. Long-term safety of recombinant human growth hormone in children. J Clin Endocrinol Metab. 2010; 95:167-77.
- ↑ Carel JC, Butler G. Safety of recombinant human growth hormone. Endocr Dev. 2010; 18:40-54.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר מרינה רחמיאל, מומחית באנדוקרינולוגיה-ילדים, מנהלת השרות לסוכרת ילדים ונוער, מרכז רפואי אסף הרופא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק