קלצינורין - Calcineurin
| מדריך בדיקות מעבדה | |
| קלצינורין | |
|---|---|
| Calcineurin | |
| שמות אחרים | protein phoaphatase 3, או calcium-depenent serine-threonine phosphatase |
| מעבדה | כימיה בדם |
| תחום | הביולוגיה של calcineurin, בעיקר במערכת החיסון. |
| יוצר הערך | פרופ' בן-עמי סלע |
האנזים calcineurin (להלן CaN) הוא פוספטאז חלבון סרין/תריאונין התלוי לפעילותו בסידן וב-calmodulin (על פי Yamashita וחב' ב-J Exp Med משנת 2000, Stewart וחב' ב-Eur J Biochem משנת 1983). קלצינורין משפעל את תאי T של מערכת החיסון, על ידי שפעול גורם השעתוק הציטופלזמי של תאי T, הידוע כ-NFATC1, על ידי דה-פוספורילציה שלו, וגורם ל-NFATC1 המשופעל לנוע אל תוך גרעין התא, וגורם לביטוי מוגבר של הציטוקין IL-2, כאשר האחרון מחיש את השגשוג וההתמיינות של תאי T, שחשיבותם מרכזית בתהליך החסינות התאית. CaN מהווה יעד לקבוצה של תכשירים המעכבים אותו, הכוללים ציקלוספורין, voclosporin וכן pimecrolimus ו-tacrolimus.
המבנה של calcineurin
קלצינורין הוא למעשה חלבון-מטאלי המכיל בליבה שלו אטום ברזל תלת ערכי (3+Fe) ואטום אבץ דו-ערכי (3+Zn) (על פי Yu וחב' ב-J Am Chem Soc משנת 1995). החלבון הוא הטרומר המורכב מ-2 תת-יחידות: תת-יחידה קטליטית α (המכונה CanA), שגודלה 60 אלף דלטון ויכולה להיקשר ל-calmodulin, ותת-יחידה רגולטורית (המכונה CanB) בגודל של 19 אלף דלטון (Hurwitz וחב' ב-FEBS lett משנת 1988, ו-Shenolikar ב-Ann Rev Cell Biol משנת 1988). קלצינורין מורכב ממקטע קטליטי בקצה ה-N טרמינלי של CaN, מסגמנט סלילי הנקשר ל-CanB, מסגמנט הנקשר ל-calmodulin וכן מפפטיד הפועל כמעכב עצמי של של CaN. שלושת הסגמנטים האחרונים משמשים לרגולציה של תת-היחידה α. בפעילות של CaN משתתפים גם 2 הגורמים CanB ו-calmodulin, המאפשרת ל-CanB לקשור 4 אטומי סידן. תת-היחידות CanA ו-CanB קשורות ביניהן באופן הדוק, גם בנוכחות חומרים סופחי סידן, ואילו הקישור של CanA ל-calmodulin תלוי בסידן.
חלבונים עם הומולוגיה ניכרת ל-CaN מוצאים באורגניזמים רבים כגון טפילים, פטריות, צמחים ובעלי חוליות. ביונקים מוצאים 3 גנים המקודדים לתת היחידה הקטליטית אלפא (והם ידועים כ-PPP3CB, PPP3CA ו-PPP3CC), ו-2 גנים המקודדים לתת היחידה הרגולטורית (והם ידועים כ-PPP3R1 ו-PPP3R2). שני איזופורמים של תת-היחידה הקטליטית, CnAalfa ו-CnAbeta, מופיעים במגוון גדול של רקמות כגון שריר השלד, ואילו האיזופורם CnAγ נמצא בעיקר באשכים, ובמוח.
מנגנון הפעולה של CaN
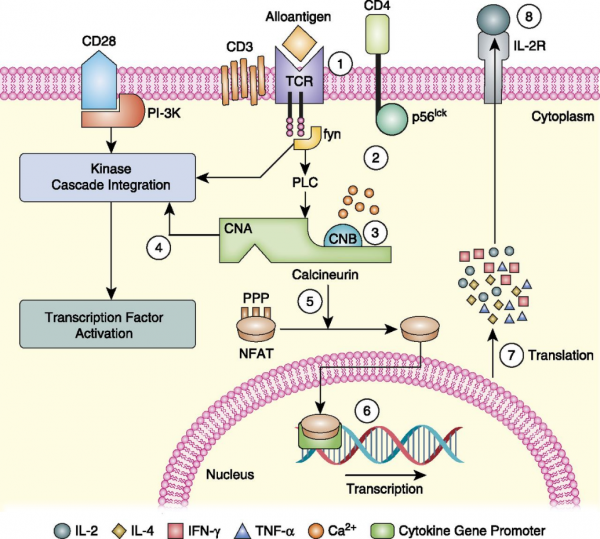
כאשר דנדריט (תא מציג אנטיגן) מתקשר עם הקולטן על תאי T, עולה הריכוז של יוני סידן בציטופלזמה של תאים אלה, התורם לשפעול של CaN. סידן עושה זאת על ידי התקשותו לתת היחידה הרגולטורית, והשפעול של קישור calmodulin לתת היחידה הקטליטית. לאחר שפעולו, CaN משפיע על גורמי שעתוק אחדים (ממשפחת NFAT) המסייעים לשעתוק של הגנים המקודדים ל-IL-2. בהמשך, IL-2 משפעל תאי T סייענים (helper T cells) ומסייע ליצירה של ציטוקינים נוספים ולהפעלת הפעילות של תאי T ציטוטוקסיים. ככל שיותר IL-2 נוצר על ידי תאי T, כך גם גדלה התגובה החיסונית.
המשמעות הקלינית
במרוצת השנים דווח על פעילויות פיזיולוגיות רבות בהן מעורב CaN, ולהלן אחדות מהן: בקרה על האנזים adenylate cyclase (על פי Antoni וחב' ב-Phosphoprot Res משנת 1999, ו-Sharma ו-Kalra ב-Clin Invest Med משנת 1999), תפקיד באי-ספיקה ופגיעה מוחית (Morioka וחב' ב-Prog Neurobiol משנת 1999), המעורבות של CaN בפעילות של משפחת גורמי השעתוק NFAT (על פי Jain וחב' ב-Curr Opin Immunol משנת 1995, Rao ב-Immunol Today משנת 1994 ו-Rao וחב' ב- Ann Rev Immunol משנת 1997), מעורבות CaN באיתות על ידי יוני סידן ומחזור חיי התא (Takuwa וחב' ב-Cell Signal משנת 1995, Santella ו-Carafoli ב-FASEB J משנת 1997, Means ב-FEBS Lett משנת 1994 ו-Nikoshiba ב-Curr Opin Neurobiol משנת 1997), המעורבות של CaN בשפעול של תאי T, ומנגנוני הפעולה של תכשירים מדכאי התגובה החיסונית (Bierer וחב' ב- Curr Opin Immunol משנת 1993, Clipstone ו-Crabtree ב-Ann NY Acad Sci משנת 1993, Halloran ב-Clin Transplant משנת 1996, Ho וחב' ב-lJ Immunol Immunopathol משנת 1996, Thomsen וחב' ב-Ther Drug Monit משנת 1995 ו- O'Kefee ו-O'neill ב-Perspect Drug Disc Design משנת 1994), פעילות CaN בנפרון של יונקים (Tumlin ב-Am J Kidney Dis משנת 1997), CaN והרגולציה של תעלות יונים (Yakel ב-Trends Pharmacol Scu משנת 1997), CaN ואפופטוזיס (Iwata וחב' ב-Stem Cells משנת 1996), CaN והרגולציה של dystrophin (על פי Michalak וחב' ב-Biochem Cell Biol משנת 1996), תפקיד CaN ביתר לחץ-דם (Sander וחב' ב-Am J Hypertens משנת 1996), והתפקיד של CaN ברגולציה של microtubules משנת 1996 (על פי Mandelkow וחב' ב-Neurobiol Aging משנת 1995).
קלצינורין קשור גם לפעילות של מספר קולטנים במוח, כגון גלוטמאט ושחרורו (Nichols ו-וחב' ב-J Biol Chem משנת 1994, ו-Victor וחב' ב-Proc Natl Acad Sci USA משנת 1995), דופאמין ו-GABA (על פי Miyakawa וחב' ב-Proc Natl Acad Sci USA משנת 2003, ו-Huang ו-Dillon ב-J Pharmacol Exp Ther משנת 1998). ניסויים בעכברי knockout טרנסגניים עם מוטציות המונעות פעילות CaN איתרו אצלם תסמינים דומים לסכיזופרניה באדם, פגם בזיכרון ובכושר ריכוז, והתנהגות חברתית חריגה (Heit וחב' ב-Nature משנת 2006). ל-CaN בשילוב עם גורמי השעתוק NFAT יש פעילות מסייעת המשפרת את תפקודן של תאי β יצרני אינסולין בבלוטת הלבלב (Heit ב-BioAssays משנת 2007, ו-Crutchlow ו-Bloom ב-Clin J Am Soc Nephrol משנת 2007). ל- CaN יש השפעה על הפרשת amylase מתאים אצינריים של הלבלב (Groblewski וחב' ב-J Biol Chem משנת 1994). לכן התכשיר tacrolimus המדכא תגובה חיסונית לדחיית השתלת כליות (Fuentes וחב' ב-Hum Mol Genet משנת 2000), עלול לתרום במספר מקרים להתפתחות מחודשת של סוכרת לאחר ההשתלה (Dave וחב' ב-J Clin Invest משנת 2006).
ל-CaN יש השפעה על ספיגת עצם על ידי תאים אוסטאוקלסטים (Awumey וחב' ב-Biochem Biophys Res Commun משנת 1999), והשפעתו על תאי Chief בקיבה בהקשר של אקסוציטוזה והפרשת פפסינוגן (Raufman וחב' ב-Biochim Biophys Acta משנת 1997).
מעכבי CaN
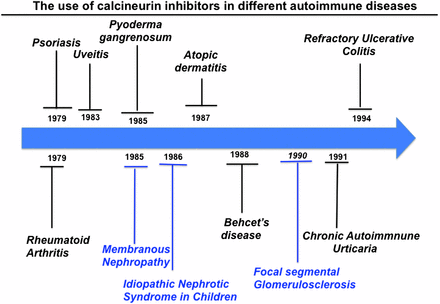
בתחילת שנות ה-80 הפכו מעכבי CaN לתכשירים תרופתיים לטיפול בחולי דלקת מפרקים שגרונית (RA), דלקת מפרקים פסוריאטית, פסוריאזיס, מחלת Behçet, דלקת מפרקים כרונית אידיופטית של ילדים, דרמטו- ופולימיוזיטיס, לופוס, סקלרוזיס רב-מערכתית, קוליטיס כיבית חריפה, גלומרולו-נפריטיס ממברנלית, אנמיה אפלסטית, תסמונת נפרוטית שאינה מגיבה לסטרואידים, atopic dermatitis, מיאסטיניה גרביס, אסתמה חריפה התלויה בקורטיקו-סטרואידים, pemphigus vulgaris, ותסמונת העין היבשה כגון תסמונת Sjögren (על פי Bannai וחב' ב-Neuron משנת 1999).
הכניסה של ציקלוספורין לשגרה הטיפולית בשנת 1983, היוותה נקודת מפנה ברפואה המודרנית, והסתייעה במחקרים של אנשי חברת Sandoz, הידועה כ-Novartis (על פי Kapturczak וחב' ב-Transplant Proc משנת 2004). ציקלוספורין שיפר רבות את קליטת איברים מושתלים בהשוואה לתכשירים קודמים וממשך להוות התכשיר המועדף בטיפול למניעת דחיית שתלים (Kolata ב-Science משנת 1983, ו-Zand ב-Semin Dial משנת 2005). Lazary ו-Borel ב-Sandoz היו החלוצים בחיפוש את מדכא מערכת החיסון ללא תופעות לוואי משמעותיות. למטרה זו ובשיתוף פעולה עם Hartmann Stahelin, הם פיתחו מודל בעכבר בו מבחן המאגלוטינין שימש למדידת דיכוי התגובה החיסונית של התכשיר החדש, ואילו שגשוג תאי סרטן היה קנה מידה לפעילות הציטוטוקסית שלו (Heusler ו-Pletscher ב-Swiss Med Wkly משנת 2001). אף על פי שציקלוספורין בודד מהפטרייה הפילמטית Tolypocladium inflatum, בחיפוש אחר תכשיר אנטיביוטי, מצא Stahelin תוצאות מצוינות של תכשיר זה כמדכא מערכת חיסון המשפיע על לימפוציטים T, וכבעל פעילות ציטוסטטית (borel ב-Wien Klin Wochenschr משנת 2002). חוקרים אלה הראו שבניגוד לתכשירים מדכאי-חיסון וציטוסטטיים אחרים מאותה תקופה, לציקלוספורין הייתה פעילות מיאלו-טוקסית חלשה, מה שמנע את תופעת הלוואי העיקרית של תכשירים אחרים. באמצע שנות ה-80 חוקרים ב-Fujisawa Pharmaceuticals ביפן, בודדו מולקולה אחרת מפטריית הקרקע Stretomyces tsukubaensis, שכונתה בתחילה FK506 ולאחר מכן הוסב השם ל-tacrolimus. גם תכשיר זה בדומה לציקלוספורין מדכא פעילות של תאי T משופעלים, על ידי שהם מעכבים את CaN.
מבנה ומנגנון הפעולה של מעכבי קלצינורין
ציקלוספורין הוא פפטיד ציקלי המכיל 11 חומצות אמינו בעל משקל מולקולרי של 1,203 דלטון. הוא מכיל חומצות אמינו שעברו מתילציה מה שמגן עליו מפני אינאקטיבציה במערכת העיכול, ולכן ניתן לשימוש כתכשיר הנלקח פומית. לעומתו, tacrolimus הוא אנטיביוט מאקרולידי, עם משקל מולקולרי של 804 דלטון. Tacrolimus מסיס במים טוב יותר מאשר ציקלוספורין, אך שני התכשירים הם בעלי מסיסות דומה בליפידים ובממסים אורגניים אחרים. המעכבים של CaN נקשרים בציטופלזמה לחלבונים הקרויים immunophilins: ציקלוספורין נקשר ל-cyclophilin, ו-tacrolimus נקשר ל-FK-binding proteins. הקומפלקס הזה נקשר אז בתוך התא ל-CaN, מה שמעכב את פעילות האחרון, ולפיכך מעכב את פעילות תאי T (על פי Bram וחב' ב-Mol Cell Biol משנת 1993). השפעול של תאי T דרך גירוי הקולטן TCR, מעלה את רמות סידן בתא ומשפעל את CaNB, מה שמשחרר את פעילות הפוספטאזה של CaNA. מולקולת CaNA גורמת לדה-פוספורילציה של NFATc הציטופלזמי שהוא גורם שעתוק המביא לטרנסלוקציה של גורם שעתוק זה שנודד יחד עם CaN אל תוך הגרעין, מה שמגביר בגרעין ביטוי של ציטוקינים אחדים שגורמים לשפעול תאי T. בין החברים במשפחת NFAT, שלוש מולקולות NFAT2, NFAT1 ו-NFAT4, קשורים לשפעול של גנים המקודדים ל-IL-4, IL-2 ול-CD40 (על פי Rao וחב' ב-Ann Rev Immunol משנת 1997). יצירת IL-2 במיוחד, מעודדת את הגדילה וההתמיינות של תאי T (על פי Shibasaki וחב' ב-Nature משנת 1996). הקומפלקסים cyclophilin/ciclosporin ו-FK-binding protein/FK נקשרים ישירות ל-CnA ומעכבים את פעילות הפוספטאז. אף על פי שעיכוב CaN בתאי T מדכא את שפעול תאים אלה, נתונים מעודכנים יותר מצביעים על השפעה שלילית של מעכבי CaN על שגשוג ותפקוד של תאי T רגולטורים (Miroux וחב' ב-Transplant Proc משנת 2009).
ניסויים קדם-קליניים וקליניים עם מעכבי CaN
בניסויים המוקדמים של Borel וחב' השתמשו במודלים בחיות שעברו השתלת עור או מח עצם. חוקרים אחרים בחנו את ההשפעה של ציקלוספורין במודלים של חולדות וחזירים שעברו השתלת לב, או בארנבות וכלבים שעברו השתלת כליות, ובכולם התקבלו תוצאות מצוינות (Calne וחב' ב-Lancet משנת 1978, ו-Green ו-Allison באותו כתב עת מאותה שנה). תוצאות מעודדות אלו בניסויי חיות תורגמו עד מהרה לניסויי באדם, כאשר 7 מושתלי כליה מתורמים מתים שאינם קרובי משפחה טופלו בציקלוספורין כטיפול מדכא חיסון יחידני. בניסוי זה אחד משבעת המטופלים איבד את הכליה המושתלת כתוצאה מ-pielonephritis, ומושתל נוסף נפטר באופן שניוני כתוצאה מ-aspergillosis מפושטת. חמשת המושתלים האחרים שוחררו לביתם עם שתלים מתפקדים (Calne וחב' ב-Lancet משנת 1978). בניסוי אחר, 5 מטופלים עם לויקמיה חריפה שפיתחו מחלת שתל-נגד-הפונדקאי (GVHD) לאחר השתלת מח עצם, טופלו עם ציקלוספורין ובכולם נעלמה תוך יומיים תגובת העור האריתמטוזית שמקורה ב-GVHD, אם כי ארבעה מתוכם נפטרו מכשל כבד רב-גורמי (Powles וחב' ב-Lancet משנת 1978). חלוץ השתלות הכבד בעולם, Thomas Starzl מפיטסבורג הראה במאמר ב-N Eng J Med משנת 1981, שעשרה מתוך 12 מושתלי כבד שטופלו עם ציקלוספורין ופרדניזון, שרדו עד 14.5 חודשים לאחר ניתוח ההשתלה. עם זאת נצפה תופעת לוואי של נפרוטוקסיות בה נדון בהמשך.
ממצאים מעודדים אלה הביאו למספר ניסויים רב-מוסדיים באירופה, בהם נכללו 232 מושתלי כליה ממתים, שטופלו עם ציקלוספורין כטיפול יחידני לעומת מושתלים שטופלו בטיפול השגרתי עם azathioprine ו-prednizolone. ממצאי ניסויים אלה הצביעו על הישרדות למשך שנה שהייתה גבוהה יותר בקרב מטופלי ציקלוספורין (72% לעומת 52%, עם p=0.001). עם זאת, תפקוד הכליות במטופלי ציקלוספורין לעומת המטופלים בטיפול השגרתי, בגין נפרוטוקסיות של תכשיר זה (סיכום הניסויים ב-Lancet משנת 1983). באופן סימולטני, נערך בקנדה ניסוי רב-מוסדי, בו נכללו 285 מושתלים שטופלו עם ציקלוספורין ופרדניזון, לעומת אלה שטופלו את המתכון הסטנדרטי של azathioprine וקורטיזון. ממצאי ניסוי זה הראו הישרדות למשך שנה של 84% בקרב מטופלי ציקלוספורין, לעומת הישרדות של 67% בקבוצת המטופלים עם azathioprine (סיכום הניסוי בקנדה הופיע ב-N Eng J Med בשנת 1983). תוצאות 2 ניסויים רב-מוסדיים אלה, הביאו את ה-FDA לאשר שימוש בציקלוספורין בנובמבר 1983, כ-13 שנה לאחר גילוי התרופה ויתרונותיה. מיד לאחר מכן נערכו ב-200 מרכזי השתלות באירופה ניסויים שהוכיחו את היתרון של ציקלוספורין במושתלי כליה (Opelz ב-Prog Allergy משנת 1986). ניסויים מוקדמים אלה הפכו את ציקלוספורין לטיפול הסטנדרטי בשנים שלאחר מכן, לא רק בהשתלות כליה אלא אף בהשתלות של איברים סולידיים. הכנסת ציקלוספורין שיפרה את ההישרדות לשנה אחת ל-74% בקרב מושתלי לב (Reece וחב' ב-Thorax משנת 1984), וכן דווח על הישרדות של למעלה משנה במושתלי ריאה בקנדה המטופלים בציקלוספורין (Schafers וחב' ב-Pneomologie משנת 1990).
השימוש בציקלוספורין שלא במקרי השתלות איברים
ציקלוספורין משמש לטיפול במגוון של מחלות אוטו-אימוניות. Herrmann ו-Mueller היו הראשונים שטיפלו בציקלוספורין במטופלים מקבוצה הטרוגנית של פולי-ארטרופתיות, כולל פסוריאזיס ודלקת מפרקים שגרונתית (RA) עם תוצאות מעודדות (Mueller ו-Herrmann ב-N Eng J Med משנת 1979, ו-Forre וחב' ב-Immunopathol משנת 1988). הטיפול בחולי פסוריאזיס עם ציקלוספורין, העלים כמעט את הרבדים הפסוריאטיים תוך 5 ימים מתחילת הטיפול. בניסוי אחר 85 מטופלים עם פסוריאזיס חמורה, טופלו בריכוזים עולים של ציקלוספורין למשך 16 שבועות. תסמיני הפסוריאזיס השתפרו במתאם עם ריכוזים עולים של ציקלוספורין, כאשר התפוגגות הפסוריאזיס הופיעה ב-36%, 65% ו-80% של המטופלים עם ציקלוספורין בריכוזים של 3, 5 או 7.5 מיליגרם/ק"ג משקל גוף, בהתאמה. כל שלושת ריכוזי התכשיר נתנו תוצאות עדיפות על אלה שהתקבלו בטיפול עם פלצבו (Ellis וחב' ב-N Eng J Med משנת 1991).
אף על פי שמעכבי קלצינורין כרוכים בנזק כלייתי חריף או כרוני, בוצעו ניסויים רבים בהם ניסו להפחית או אפילו להימנע ממעכבי קלצינורין, ובעיקר ציקלוספורין (Nankivell וחב' ב-N Eng J Med משנת 2003, Sharif וחב' ב-J Am Soc Nephrol משנת 2011, ו-Vincenti וחב' ב-Am J Transplant משנת 2010). מטה-אנליזה עדכנית של Sharif וחב' השוותה טיפול עם מעכבי rapamycin לטיפול עם מעכבי קלצינורין, עם תוצאות דומות של דחיית השתל. ניסוי CONVERT כלל 830 מושתלי כליה שטופלו עם מעכבי קלצינורין לעומת אלה שטופלו ב-rapamycin (Schena וחב' ב-Transplantation משנת 2009). מושתלי כליה עם GFR הנמוך מ-40 בשעה שהחלו טיפול עם sirolimus חוו אחוז גבוה יותר של דלקת ריאות ומוות. לעומתם, אלה עם GFR הגבוה מ-40 בעת המעבר לטיפול ב-sirolimus, היו בעלי GFR גבוה יותר לאחר 12 ו-24 חודשים, אך עם נתוני פרוטאינוריה גרועים יותר.
המאמצים להמיר מעכבי קלצינורין, המשיכו בהכנסה של התכשיר belatacept, שאושר בשנת 2011 על ידי ה-FDA לטיפול במושתלי כליה (El-Charabaty וחב' ב-Expert Rev Clin Immunol משנת 2012). מספר מחקרים בחנו את היעילות של belatacept לטיפול מתחזק במושתלי כליה בהשוואה לציקלוספורין (Durrbach וחב' ב-Am J Transplant משנת 2010, ו-Vincenti וחב' ב-J Am Soc Nephrol משנת 2010). ניסוי BENEFIT כלל 666 מטופלים שחולקו באקראי ל-3 קבוצות: טיפול אינטנסיבי עם belatacept, טיפול פחות אינטנסיבי עם belatacept או טיפול בציקלוספורין. לאחר 12 חודשים אלה שטופלו עם belatacept הראו תוצאות טובות במידה שווה לאלה שטופלו עם ציקלוספורין, בהקשר לאי דחיית השתל. עם זאת, דחייה חריפה של השתל הייתה מובהקת יותר במטופלי belatacept . בהקשר של תפקוד כלייתי הטיפול ב-belatacept היה אפילו עדיף על הטיפול בציקלוספורין. גם הפרופילים הקרדיו-וסקולריים ומטבוליים היו טובים יותר במטופלי belatacept.
שיטות למדידת פעילות CaN
Carr וחב' פרסמו ב-Clin Chem משנת 2014 שיטה למדידת פעילות קלצינורין על ידי Liquid Chromatography-Tandem Mass Spectrometry או LC-MRM-MS. בשיטה זו נקבעה פעילות קלצינורין על ידי מדידת הדה-פוספורילציה של מצע פוספו-פפטידי סינתטי. אנלוג של איזוטופ יציב של התוצר הפפטידי שימש כ-internal standard, וקוקטייל של מעכב חדש גרם למינימיליזציה של ראקציית הדה-פוספורירלציה על ידי פוספטאזות סרין/תריאונין אחרות. שיטה זו שמשה לקביעה של פעילות קלצינורין בתאי דם מונו-נוקלאריים היקפיים. גם Fontova וחב' השתמשו במודיפיקציה של אותה שיטה, Ultra-High Performance Liquid Chromatography-Tandem Mass Spectrometry, למדידה של פעילות קלצינורין בתאים חד-גרעיניים היקפיים של מושתלי כליה מטופלים במעכב קלצינורין, tacrolimus (Clin Chim Acta משנת 2019). שיטה זו מבוססת על ניטור של דה-פוספורילציה תלויית-Ca+2 של מצע פוספו-פפטידי.
גישה אחרת היא מדידה ספקטרופוטומטרית למדידת פעילות קלצינורין בלויקוציטים שבודדו מדם אדם, פותחה על ידי Seller וחב' (Anal Biochem משנת 2006). בבדיקה נכללו מושתלי כליה מטופלים עם קלצינורין או עם tacrolimus. השיטה מבוססת על מדידה ספקטרופוטומטרית של רמת פוספאט בליזאט של לויקוציטים. רמת הדה-פוספורילציה של מצע פוספו-פפטידי המכיל 19 חומצות אמינו, נקבעה על ידי שימוש ב-Malachite green המגיב עם פוספאט בנוכחות okadaic acid עם או בלי EGTA, הקושר סידן. כדי להימנע מאובדן פעילות של קלצינורין כתוצאה מאחסון או שיהוי ממושך של הדגימה לפני המדידה, הוספה חומצה אסקורבית לתוך ה-lysis buffer. סף הרגישות לזיהוי תוצר הדה-פוספורילציה בשיטה זו הוא leukocytes pmol/min/10615.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק