שחמת הכבד - מעקב וטיפול - Liver cirrhosis - management
| שחמת הכבד - מעקב וטיפול | ||
|---|---|---|
| Liver cirrhosis - management | ||
| יוצר הערך | ד"ר מיכל כרמיאל-חגי 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – שחמת הכבד
שחמת כבד (Liver cirrhosis) מהווה את סיבת המוות העשירית בשכיחותה בישראל בקרב אנשים בני 45-64 והתמותה השנתית המחושבת עומדת על 5 מתוך 100,000 תושבים[1]. שחמת כבד מהווה את הגורם העיקרי להתפתחות של סרטן ראשוני של הכבד (HCC, Hepatocellular Carcinoma)[2]. סימני השחמת מוכרים עוד מהעת העתיקה ותוארו בכתבי הפרעונים (הפפירוס של Ebers) כמצב של נוקשות הכבד וסימנים של שחמת התחלתית התגלו בנתיחה של מומיה בת 3,200 שנים[3].
הטיפול בחולה השחמת דורש שימת לב מיוחדת לכל שינוי. לרוב המחלה מתקדמת לאט אולם החמרה חדה פירושה לרוב זיהום, התייבשות, תגובה לתרופות, שינוי חד באורח חיים (תזונה, מחזור שינה ועוד) ולעתים נדירות דימום או גידול. שינוי עלול להופיע בבדיקות מעבדה (עליית קריאטינין או המוגלובין), שינוי בהתנהגות או צבירת נוזלים. איחור בזיהוי סימני ההחמרה עלול לגרור הידרדרות מהירה ובלתי ניתנת לעצירה, לפיכך נדרשת חשדנות גבוהה עם סף נמוך להתחלת בירור וטיפול. קיום קשר ישיר, רצוי כערוץ פתוח ומיידי (טלפון או מייל), עם צוות מרפאת הכבד ישפר את איכות הטיפול המשותף בחולה המורכב. חולים יציבים יש לשמור במעקב מסודר תוך הימנעות מתרופות או פעולות מיותרות. השתלת כבד היא ברירת מחדל רק עבור חולים לא יציבים או חולים עם סרטן כבד המתאימים לכך.
אבחנה וקליניקה
שחמת היא מושג היסטולוגי המתאר החלפה של לפחות 75% מרקמת הכבד על ידי צלקת תוך אובדן מבנה ותפקוד אונית הכבד. אבחנה קלינית של שחמת כבד אפשרית על סמך שילוב מדדים קליניים, בדיקות מעבדה והדמיה וכיום גם בשיטות לא חודרניות.
הסימנים הקליניים בשחמת מתקדמת ברורים. בעוד שחמת התחלתית היא מושג מעבדתי בעיקר ללא קליניקה מיוחדת. ירידה בתפקוד הכבד תתבטא בסימנים ותסמינים הקשורים ליתר לחץ דם פורטלי ותפקוד ירוד של הכבד וברוב המקרים סימנים אלו יתקיימו בו זמנית:
- מיימת על חשבון דלדול שרירי שלד
- תשישות ואנצפלופתיה (Encephalopathy)
- דימום ממערכת העיכול
- נטייה לזיהומים
- ממצאים עוריים אופייניים כמו Palmar erythema, Spider angiomata, Caput meduza
מעבדה
ממצאים אופייניים עלולים להופיע בכל טווח בדיקות המעבדה. האופייניים שבהם:
- ספירת הדם: ספירת טסיות נמוכה <150,000 היא סמן אופייני ליתר לחץ דם פורטלי ומיוחסת לתסמונת הגדלת הטחול (Hypersplenism), אולם לא מפתיע לגלות במקביל גם פאנציטופניה (Pancytopenia) משנית ליתר לחץ דם פורטלי. אנמיה בהקשר של מחלת כבד כרונית אינה נדירה ולרוב אינה נובעת מחוסר ברזל. לרוב תופיע מאקרוציטוזיס (Macrocytosis) כחלק ממחלת הכבד הכרונית (גם ללא קשר לשתיית אלכוהול). פער ברמת ההמוגלובין הגבוה באופן יחסי לעומת יתר המדדים צריך להדאיג בשאלה של תגובה פרא-נאופלסטית והפרשת יתר של אריתרופויאטין בעקבות HCC[4]
- תפקודי כבד: התפקוד הכבדי בבדיקות המעבדה יבוא לביטוי ב:
- תפקודי קרישה: כפי שמבוטאים ב-INR (יחס בינלאומי מתוקנן - International Normalized Ratio) או ב-PT (זמן פרותרומבין - Prothrombin time) כחלק ממדד לייצור פקטורי קרישה
- פיברינוגן: רמת פיברינוגן נמוכה מופיעה באי ספיקה כבדית מתקדמת
- אלבומין: 25% מכלל החלבון המיוצר בכבד הוא אלבומין. עם זאת רמת אלבומין אינה סמן רגיש מספיק
- בילירובין: פינוי בילירובין על ידי תאי הכבד משמש כלי להגדרת ירידה בתפקוד הכבד. ערכי בילירובין יעלו במצבים של פגיעה משמעותית בתפקוד הכבד
- בדיקות מעבדה נוספות משמעותיות בחולה שחמת:
- תפקודי כליה המתבטאים בערכי קריאטינין: בהיעדר מחלת כליה ראשונית, ערכי הקריאטינין בחולה שחמת אמורים להיות תקינים ואפילו נמוכים בהתאם למסת השריר הנמוכה. קריאטינין מוגבר >1.5, עשוי להופיע במצבי מחלה ראשונית של הכליה, משנית לטיפול תרופתי (Spironolactone, Neomycin או חומר ניגוד) או ירידה בזרימה כלייתית כתוצאה מלחץ מילוי נמוך (Intravascular depletion). שעלול להתקדם לתסמונת כבדית-כלייתית (HRS, Hepatorenal Syndrome) במקרים של מיימת, בהקשר לזיהום או ניקור. עלייה חדה או מגמת עלייה מתמדת בערכי קריאטינין תדרוש התייחסות. אי ספיקת כליות בחולה שחמת קשורה ישירות לתמותה[5],[6]
- רמת נתרן: רמת נתרן נמוכה בחולה שחמת דורשת בירור סיבתי הכולל בדיקת אוסמולריות בשתן. ברוב המקרים תימצא רמה אוסמולריות תקינה אשר תשלול חסר אמיתי של נתרן ותכוון למרכיב של דילול (Dilutional hyponatremia), בעיקר כאשר החולה צבר נוזלים
- אנזימי הכבד: ALT (אלנין טרנסאמינאזה - Alanine transaminase) ,AST (אספרטאט טרנסאמינאזה - Aspartate transaminase),ALK-P (פוספטאזה בסיסית - Alkaline phosphatase) ,GGT (גמא-גלוטאמיל טרנספראזה - Gamma glutamyl transferase) עשויים להיות תקינים או מעט מוגברים בנוכחות שחמת. אנזימי הכבד אינם סמן לתפקוד הכבד אלא לפעילות דלקתית. עלייה חדה של אנזימי הכבד דורשת בירור וטיפול בהקדם על מנת למנוע קיפוח נוסף במספר התאים הפעילים וכפועל יוצא ירידה נוספת בתפקוד הכבד
הדמיה
השימוש באולטרסאונד (US, Ultrasound), טומוגרפיה ממוחשבת (CT, Computed Tomography) או דימות תהודה מגנטית (MRI, Magnetic Resonance Imaging) מאפשר אבחנה של שחמת ויתר לחץ דם פורטלי. נוכחות של כבד גבשושי בעל קווי מתאר לא סדירים, עם הגדלה של האונה השמאלית ובעיקר הזנבית, על חשבון האונה הימנית, מרמזת על נוכחות צלקת מרובה בכבד ויתר לחץ דם פורטלי. וריד פורטלי מורחב, טחול מוגדל, מיימת ומעקפים ורידיים בחלל הבטן מחזקים אבחנה של יתר לחץ דם פורטלי.
הערכת הצלקת
ביופסיית כבד עדיין נחשבת בדיקת הבחירה להערכה של מידת הצלקת בכבד, אולם כיום יש בדיקות לא חודרניות המבוססות על מידת נוקשות הכבד או נוכחות של סימני צלקת המאפשרות הערכה טובה של מידת הצלקת ונמצאות כיום בשימוש ואף הוכנסו לסל הבריאות לצורך הערכה של צלקת בהתוויות מסוימות (ה-FibroScan וה-FibroTest, בהתאמה)[7].
ניהול חולה עם שחמת כבד
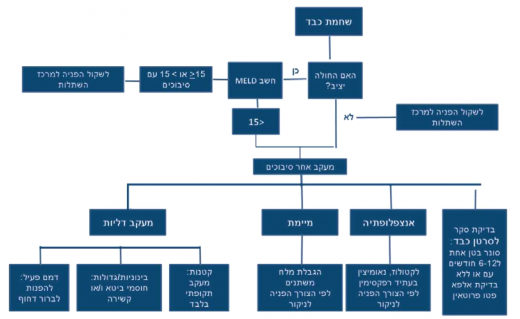
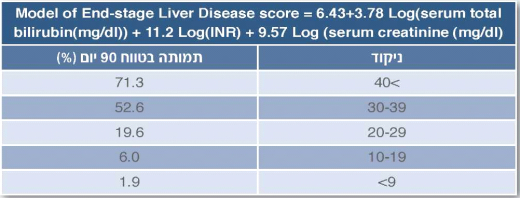
ברגע שנעשתה אבחנה של שחמת כבד חובה להתייחס לחומרת המחלה והופעה של סיבוכים, בהם סיבוכים מסכני חיים. על חולה להיות במעקב משותף עם מרפאת כבד וניהול המקרה ייעשה במקביל לרופא המשפחה גם על ידי רופא כבד בתדירות שתיקבע בהתאם למצב המטופל. הערכת חומרת המחלה תיעשה בין היתר על ידי חישוב ה-MELD (Model for End-stage Liver Disease) של החולה כבר בביקור הראשון ותשמש כלי למעקב: נוסחת ה-MELD מבוססת על חישוב לוגריתמי של תפקודי קרישה, כליה ובילירובין והיא נמצאה בעלת יכולת ניבוי גבוהה מאוד לתמותה של חולי שחמת (טבלה 1), וכיום נמצאת בשימוש לצורך הגדרת חומרת מחלת הכבד: לקביעת דחיפות השתלה, סיכון ניתוחי ועוד[5]. החישוב ייעשה על ידי מרפאת הכבד אולם אפשר להשתמש בנוסחה הנמצאת לשימוש חופשי באינטרנט[8]. שחמת מפוצה פירושה ניקוד MELD מתחת ל-15 בהיעדר כל סיבוך אחר (כגון: אנצפלופתיה, מיימת או דימום מדליות), ויידרש מעקב שמרני בלבד בקהילה ותקופתי אצל רופא כבד. במעקב יושם דגש על סימנים להופעה של אחד הסיבוכים. אם ניקוד ה-MELD שווה ל-15 או גבוה ממנו ו/או למטופל סיבוך אחד או יותר, יש להפנותו למעקב מומחה כבד בהקדם ולדון בצורך בהשתלת כבד במקביל לטיפול מתקדם (ציור 1).
נוסף להערכת חומרת המחלה יש לבצע בכל חולה שחמת:
- בדיקת סטטוס ויראלי: לבדוק חשיפה וחיסון לווירוסים הפטיטיס A (HAV, Hepatitis A Virus) והפטיטיס B (HBV, Hepatitis B Virus). אם אין עדות לחיסון יש לחסן את המטופל. אם בעבר קיבל המטופל חיסון להפטיטיס B אולם כמות הנוגדנים בדמו אינה עולה על 10 mIU/ml (יחידות מידה בינלאומיות/מיליליטר) מומלץ לחזור על החיסון או לפחות לתת מנת דחף אחת ובהתאם לתגובת טיטר הנוגדנים להחליט על המשך הטיפול. בכל מקרה של חיסון חוזר מומלץ להשתמש בתכשיר המכיל 3 אפיטופים כנגד חלבון ה-S. התכשיר קיים בארץ ונמצא בשימוש (Sci-B-Vac)[9]
- מעקב תקופתי אחר סרטן כבד: יש לערוך סקר יזום לכל חולה שחמת על ידי בדיקת הדמיה (סונר בטן, CT בפרוטוקול כבד או MRI) לשלילת סרטן כבד אחת ל-6-12 חודשים. אולטרסאונד היא בדיקה לא מספקת בחולה עם כבד מצומק מאוד או בלתי חדיר (אקוגני). אף שעדיין מומלץ לעקוב אחר רמת חלבון עוברי (AFP, Alpha Fetoprotein), הדעות חלוקות לגבי רגישותו וסגוליותו[10],[11]
סיבוכים מיוחדים בחולי שחמת
מיימת וזיהום עצמוני של חלל הצפק (SBP, Spontanious Bacterial Peritonitis)
מיימת:
הצטברות נוזל מיימת בחולה השחמת נובעת מכמה גורמים כגון הלחץ הפורטלי הגבוה עם זרימת דם גבוהה במערכת הספלנכנית (Splanchnic circulation) ללא יכולת ניקוז נאותה והחזר לבבי הולם מחד גיסא, וירידה משמעותית בלחץ האונקוטי בעקבות ירידה סינטטית בייצור החלבון על ידי הכבד מאידך גיסא. גם פינוי כלייתי נמוך בשל הפרשת יתר של רנין-אנגיוטנסין יתבטא באגירת מלח וצבירת נוזלים. מיימת חדשה או החמרה של הקיימת פירושה יציאה מאיזון והיא דורשת בירור אצל מומחה כבד. כל שינוי במצב המיימת יכול להיגרם כתוצאה ממהלך טבעי של המחלה, שינוי בתזונה או בתרופות. עם זאת יש לשלול גורם נוסף כמו חסימת הווריד הפורטלי על ידי קריש, גידול הגורם לקיפוח בתפקוד הכבד ולעלייה בלחץ הפורטלי, זיהום כולל SBP או בעיה כלייתית. הבירור יכלול בדיקות דם, ניקור מיימת והדמיה מתאימה. הופעת נוזל פלאורלי (בעיקר מימין) עשויה להיות ביטוי של מיימת והגישה האבחנתית והטיפולית תהיה דומה.
במיימת תמיד יועדף טיפול שמרני על פני כל טיפול חודרני והוא יכלול:
- דיאטה דלת מלח (הגבלה ל-2 גרם נתרן ליום)
- משתנים: המלצה לשילוב Spironolactone וFurosemide ביחסים של 100 מ"ג (מיליגרם): 40 מ"ג בהתאמה, במינון עולה לפי צורך ומעקב תפקודי כליה ואלקטרוליטים. דרך טובה לבדוק בחולה שחמת, אשר אינו מוריד משקל רטוב, אם הוא שומר בקפדנות אחר דיאטה דלת מלח היא איסוף שתן 24 שעות לנתרן וקריאטינין:
- נתרן בשתן (UNa) > 78 מילימול/24 שעות (mmol/24h) מרמזת על אי הקפדה על תזונה דלת מלח
- קריאטינין בשתן (UCr)< 15 מ"ג/קילוגרם (גבר)/10 מ"ג/קילוגרם (אישה) - איסוף חסר
- הגבלת נוזלים אינה דרושה אלא במצבי היפונתרמיה קיצונית (נתרן בדם <125 מילימול/ליטר)
- יש להפסיק משתנים בכל מקרה של דימום פעיל, החמרה משמעותית באנצפלופתיה, חשד לזיהום, עלייה בקריאטינין מעל ל-2 מ"ג/ד"ל (דציליטר), נתרן הדם מתחת ל-125 מילימול/ד"ל[6]
זיהום עצמוני של חלל הצפק:
נוזל המיימת הוא מקום נוח להתרבות חיידקים. זליגת חיידקים מהמעי נעצרת לרוב בזכות כמה מחסומים יעילים מבחינה חיסונית ברמת רירית המעי, דופן המעי, מערכת הלימפה, הדם ובכבד עצמו בזכות תאי הקופפר (Kupffer cells) ותאי מערכת החיסון הנמצאים בתוך רשת קפילרות סינוסואידליות מפושטת. גם נוזל הצפק העשיר בחלבוני צימות (Opsonin) מונע התרבות מחוללים. לחולה השחמתי דופן מעי בצקתית, זרימה פורטלית אטית, אובדן ארכיטקטורה כבדית הפוגעת ביעילות המערכת החיסונית, וכן מיעוט חלבוני משלים בנוזל המיימת, המגדילים את הסיכון לזיהום נוזל מיימת. לכן יש להיות חשדנים במיוחד לקיום SBP בחולה השחמת. לרוב קיימת הסתמנות כלשהי, אולם זו אינה שגרתית ולא תתבטא בסימני דלקת צפק אופייניים אלא בהופעת אי נוחות בטנית, חולשה, בחילה, חום נמוך, שלשול, ירידת לחץ דם או דופק מהיר, צבירת מיימת או אנצפלופתיה. עליית בילירובין, קריאטינין ו-INR כמדד לקיפוח הכבד עשויה להיות רגישה יותר מספירת דם. אבחנה של SBP תיעשה על ידי ניקור והוכחה של ריבוי לויקוציטים (>mm3/500) או נויטרופילים (>mm3/250) בנוזל. צמיחת חיידק תופיע תוך 48 שעות ב-40% מהמקרים, אולם היעדר צמיחה אינה שוללת זיהום. לרוב תופיע צמיחה של חיידקי מעי כמו E.Coli או Klebsiella, אולם במטופלים הנוטלים טיפול מונע קבוע בקווינולונים (Quinolones) עלול להופיע זיהום בחיידקי גרם חיובי. הטיפול ב-SBP דורש אשפוז שכן הסיכוי לסיבוכים גבוה. לאחר אירוע ראשון של SBP מומלץ טיפול ארוך טווח מניעתי של Ciprofloxacin 750 מ"ג אחת לשבוע[6].
תסמונת כבדית-כלייתית (HRS)
חולים עם שחמת נמצאים בסיכון מוגבר לירידה בתפקוד הכלייתי, משנית לירידה בזרימת הדם לכליה והופעה של תסמונת כבדית-כלייתית. גורמי הסיכון העיקריים להופעת HRS בקרב חולי שחמת הם נוכחות מיימת, היפונתרמיה ותפקוד לבבי ירוד. התסמונת יכולה להופיע בשני אופנים: Type I אז תופיע עלייה חדה בערכי קריאטינין עם הכפלה מהערך הבסיסי או >1.5 בטווח של ימים. לרוב קשורה לקיפוח חריף בעקבות התייבשות, דימום או זיהום. תסמונת HRS Type I היא מצב קטלני שיש לאבחן ולטפל בו באגרסיביות. לעומת זאת HRS Type II תתבטא בעלייה מתונה של ערכי קריאטינין על פני שבועות ולרוב קשורה לניקור חוזר של מיימת וטיפול במשתנים. אמנם המהלך שפיר יותר אולם יש צורך בהערכה ושינוי תרופתי וטיפולי בהתאם. עבודות חוזרות מראות את הקשר הברור בין אי ספיקה כלייתית בחולה השחמת לבין תמותה, ואכן בניקוד MELD ניתן משקל משמעותי לערכי הקריאטינין. אי לכך יש חשיבות במעקב תפקודי הכליה והאלקטרוליטים במסגרת הקהילה. כמו כן יש להיות ערים לגורמים אחרים העלולים להחמיר את התפקוד הכלייתי בחולה השחמת ולהימנע מפגיעתם ככל האפשר:
- תרופות בעלות פוטנציאל נפרוטוקסי (Nephrotoxicity), כולל Spironolactone, גליקוזידים (Glycosides) (כולל Neomycin), מעכבי אנזים מהפך אנגיוטנסין [inhibitors (Angiotensin Converting Enzyme) ACE]
- שימוש בחומר ניגוד תוך-ורידי המכיל יוד
- התייבשות כתוצאה מהגבלת נוזלים, משתנים או שלשול[6]
אנצפלופתיה
בהגדרתה, מצב נוירו-פסיכיאטרי המתאפיין בירידה מנטלית והפרעה בתפקוד הפסיכו-מוטורי, תוך ירידה הדרגתית ביכולת הריכוז, ההתמצאות, פגיעה בזיכרון לטווח קצר, הארכה של זמן תגובה, הפרעה במחזור השינה עם היפוך יום ולילה, ובהמשך ירידה במצב העירות עד לאובדן הכרה. האנצפלופתיה קשורה ככל הנראה להצטברות חומרים נוירו-טוקסיים הנוצרים על ידי חיידקי מעי ונספגים בדם: אמוניה, מרקפטן (Mercaptan), פנול (Phenol) וחומצות שומן קצרות, אשר באופן תקין מועברות באמצעות הווריד הפורטלי לכבד ועוברות שינויים מטבולים המאפשרים פינוי מהיר על ידי הכליה. בשחמת, תפקוד הכבד ירוד ונוכחות מערכת כלי דם עוקפים (דליות) מאפשר רמת רעלנים גבוהה יותר המגיעה למערכת העצבים המרכזית. מטופלים לרוב יאשימו פקטורים כמו גיל, תרופות או נסיבות אחרות. תופעות נוירולוגיות כמו Flapping tremor יופיעו בשלב מתקדם יותר. תרגילי זיכרון קצר טווח של כמה פרטים (לזכור שם וכתובת לא מוכרים שניתנו בתחילת הראיון הרפואי) או מבחן ציור עשויים להפתיע (טבלה 2). לאחרונה עלתה החשיבות באבחון אנצפלופתיה לגבי נהיגה אם כי עדיין אין חובת דיווח מיוחדת על חולים עם אנצפלופתיה. אנצפלופתיה היא תהליך מתמשך ואף שאינה גורמת לנזק כרוני היא פוגעת באיכות החיים של המטופל, לכן יש לזהותו ולמזער אותו ככל האפשר.
החמרה חדה באנצפלופתיה דורשת בירור לשלילת התייבשות, חוסר איזון אלקטרוליטי, שימוש בתרופות (בנזודיאזפינים), דימום ממערכת העיכול או זיהום כולל SBP. בכל מקרה של מיימת יש צורך בניקור במסגרת אשפוז. מכיוון שאמוניה נוצרת מפירוק חלבון מהחי בחלל המעי, גם עצירות ועיכוב בזמן המעבר במעי עלולים להיות גורם להחמרה באנצפלופתיה.
הגישה לחולה עם אנצפלופתיה כרונית:
- תזונה - מומלץ להימנע מארוחות כבדות המכילות כמות בשר גדולה (בעיקר אדום) וחלקים פנימיים, אך אין למנוע צריכת חלבונים מהחי בשל המצב הקטבולי שבו נמצאים החולים. מומלץ לאכול כמה ארוחות קטנות לאורך היום ולהימנע מצום ממושך. במחקר ישראלי הוכחה חשיבותה של ארוחת הבוקר בשיפור התפקוד בחולים עם אנצפלופתיה מינימלית[12]
- תרופות - יש להימנע מתרופות בעלות מרכיב מרדים, בעיקר בנזודיאזפינים, ומובן שיש לאסור על שתיית אלכוהול. הופעת דיכאון עלולה להחמיר את הסתמנות האנצפלופתיה ויש לזהות דיכאון ולטפל כמקובל
- מחזור השינה - יהיה לרוב מופרע ולכן יש להדריך את המטופל ובני משפחתו להימנע מתנומות במשך היום. אם אינו נרדם יש לשקול בזהירות רבה מתן תרופות לשינה, עדיף כאלה עם פינוי כלייתי כמו Vaben (Oxazepam) במינון נמוך מאוד ולא יאוחר מחצות
- טיפול תרופתי - הטיפול המקובל כיום הוא עדיין Lactulose אם כי יש חילוקי דעות לגבי יעילותו. עקרון הפעילות מעבר לקיצור זמן השהות של תוכן המעי במעי הוא שינוי החומציות בחלל המעי באופן המשנה את פלורת המעי ומונע ספיגת האמוניה. נטילת ה-Lactulose גורמת לתופעות לוואי של ריבוי גזים, כאב בטן ושלשול ויש להדריך את המטופל לגבי מציאת המינון האופטימלי באופן עצמוני כדי להימנע משלשול והתייבשות אך לקבל אפקט של 3-4 יציאות רכות ליום. יש להדריך לגבי תוספת Lactulose בימים של ישנוניות, עצירות ולאחר ארוחה גדולה. לחולים שנכשלו או שאינם סובלים Lactulose אפשר להציע טיפול אנטיביוטי. כיום רק שתי תרופות הוכחו כיעילות: Neomycin - אמינוגליקוזיד, שאינו אמור להיספג במעי וגורם לשינוי פלורת המעי. יש להיזהר מאוד במתן התרופה, שכן היא נפרוטוקסית ואוטוטוקסית (Ototoxic). הטיפול ב-Neomycin דורש מעקב תפקוד לכליות ובדיקות שמיעה. בשנים האחרונות הוכנס לשימוש הטיפול ב-Lormyx (Rifaximine) - אנטיביוטיקה שאינה נספגת במעי ומיועדת לשלשול מטיילים. תרופה זו נמצאה יעילה מאוד במצבי אנצפלופתיה והיא נכנסה לסל התרופות בשנת 2013[13]
- דימום ממערכת העיכול - דימום משמעותי עם קיפוח המודינמי, לרוב בעקבות דמם מדליות, דורש הערכה וטיפול מיידי באשפוז. דימום אטי יותר בעקבות גסטרופטיה היפרטנסיבית (Hypertensive gastropathy), אנגיודיספלזיות (Angiodysplasia) וכדומה, יכול להתבטא בירידה בהמוגלובין. ירידת המוגלובין בחולה שחמת אינה בהכרח ביטוי של חוסר ברזל אך דורשת בירור. מתן ברזל באופן בלתי מבוקר בחולה שחמת אינו רצוי, שכן מדובר במתכת אוקסידנטית השוקעת בכבד. כל חולה שחמת נדרש לבצע גסטרוסקופיה אבחנתית לזיהוי והערכה של דליות. החלטה על טיפול מונע (תרופתי או קשירה) תיעשה על ידי רופא הכבד לפי ממצאי האנדוסקופיה. נוכחות דליות קטנות אינה דורשת טיפול אלא מעקב בלבד (< דרגה 2). חשוב שפענוח הממצאים האנדוסקופיים ייעשה על ידי גסטרואנטרולוג העוסק בטיפול בחולים עם יתר לחץ דם פורטלי. הטיפול התרופתי המומלץ הוא חוסמי קולטני בטא לא סלקטיביים (Propranolol או Carvedilol) ויש לעלות בהדרגה את המינון תוך מעקב דופק ולחץ דם. אפשר ומומלץ לטפל בתכשירים המשתחררים לאט (SR, Slow Release) בשל היענות טובה יותר. הטיפול בניטרטים אפשרי אולם לא כקו ראשון. קשירת דליות כטיפול מונע ראשוני נחשבת אף היא ליעילה ומקובלת. הטיפול נטול תופעות לוואי (למעט סביב הפעולה) ואינו דורש היענות המטופל על בסיס יומי. חולה שדימם בעבר מדליות יידרש לטיפול משולב אנדוסקופי ותרופתי. מטופלים רבים יתארו הפרשה דמית מהפה והאף בעיקר לאחר לילה. יובש בריריות במקביל לשבירות קפילרית ונטייה לדמם הם לרוב הסיבה לדימום זה ואפשר להרגיע את המטופל עם המלצה להגדיל את לחות חדר השינה על ידי מכשיר אדים, להימנע ממזגן וכדומה
ביבליוגרפיה
- ↑ N. Goldberger, M Aburaba and Z Haklai Leading death cause in Israel 1999-2008 Ministry of Helth, State of Israel http://www.old.health.gov.il/ Download/pages/Death_210711.pdf
- ↑ Bosch FX. Ribes J. Diaz M. Clerie R. Primary liver cencer: worldwide incidence and trends. Gastroenterology 2004;127:S5-S16.
- ↑ A. Cockburn, E. Cockburn and T.A Reyman Mummie: disease and ancient cultures, Cambridgre University Publication 2nd eddition;1998: Chapter I: p101-102.
- ↑ Matsuyama M, Yamazaki O, Horii K, Higaki I, Kawai S, Mikami S, Higashino M, Oka H, Nakai T, Inoue T: Erythrocytosis caused by an erythropoietin-producing hepatocellular carcinoma. J Surg Oncol 2000;75:197-202.
- ↑ 5.0 5.1 5.2 Kamath PS, Wiesner RH, Malinchoc M, Kremers W, Therneau TM, Kosberg CL, D'Amico G, Dickson ER, Kim WR. A model to predict survival in patients with end-stage liver disease. Hepatology. 2001 Feb;33(2):464-70.
- ↑ 6.0 6.1 6.2 6.3 European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010 Sep;53(3):397-417.
- ↑ Shaheen AA, Wan AF, Myers RP FibroTest and FibroScan for the prediction of hepatitis C-related fibrosis: a systematic review of diagnostic test accuracy. Am J Gastroenterol. 2007 Nov;102(11):2589-600.
- ↑ http://www.mayoclinic.org/meld/mayomodel6.html
- ↑ 2011 ,משרד הבריאות, המחלקה לאפידמיולוגיה. 1999, עדכון מרץ ,B תדריך חיסון כנגד דלקת כבד
- ↑ AASLD Practice Guidelines: Management of Hepatocellular Carcinoma HEPATOLOGY 2010; July; 1-34.
- ↑ AASLD Practice Guidelines: Management of Hepatocellular Carcinoma: An Update HEPATOLOGY 2011; 53(3); 2010-2011.
- ↑ Vaisman N, Katzman H, Carmiel-Haggai M, Lusthaus M, Niv E. Breakfast improves cognitive function in cirrhotic patients with cognitive impairment. Am J Clin Nutr. 2010 Jul;92(1):137-4
- ↑ Nathan M. Bass, Kevin D. MullenD., Arun Sanyal, Fred Poordad, et al. Pharm.D.Rifaximin Treatment in Hepatic Encephalopathy. The NEJM; 2010 March 25, vol. 362 no. 12: 1071-1081.
המידע שבדף זה נכתב על ידי ד"ר מיכל כרמיאל-חגי - מנהלת יחידת הכבד, המרכז הרפואי לגליל המערבי, נהריה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק