7-Dehydrocholesterol-delta 7-reductase
הופניתם מהדף Dehydrocholesterol reductase-7 לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| 7-dehydrocholesterol-delta 7-reductase | |
|---|---|
| שמות אחרים | DHCR7 |
| מעבדה | כימיה בדם |
| תחום | אבחון תסמונת Smith-Lemli-Opitz |
| טווח ערכים תקין | רמה אפסית של 7Dehydrocholesterol |
| יוצר הערך | פרופ' בן-עמי סלע |
האנזים reductase-7 7-dehydrocholesterol-delta
אנזים זה מקודד באדם על ידי הגן DHCR7 הממוקם על הזרוע הארוכה של כרומוזום 11 באתר 11q13.4 (Moebius וחב' ב-Proc Natl Acad Sci USA משנת 1998, ו-Wassif וחב' ב-Am J Hum Genet משנת 1998). אנזים זה מקטלז את השלב האחרון ברצף הריאקציות המובילות ליצירת כולסטרול מתוצר הביניים dehydrocholesterol-7 (להלן DHC-7) תוך שימוש ב-NADPH. אנזים זה הוא למעשה delta-7-sterol reductase המסיר את הקשר הכפול בין פחמנים 7 ו-8 במולקולה של DHC-7, קשר שנוצר על ידי האנזים sterol delta8-delta7 isomerase. חוסר האנזים DHC reductase-7 הוא הגורם הישיר לתסמונת Smith-Lemli-Opitz (על פי Waterham וחב' ב-Biochem Biophys Acta משנת 2000, ו-Fitzky וחב' ב-Proc Natl Acad Sci USA משנת 1998, וכן Wassif וחב' ב-Am J Hum Genet משנת 1998). יצוין שתסמונת Smith- Lemli- Opitz תוארה לראשונה על ידי שלושת חוקרים אלה במאמר משנת 1964 ב-J Pediatr.
האנזים DHCR7 מאוד יעיל בחיזור של DHC7, אך הוא מסוגל לחזר גם את הקשר הכפול בין פחמנים 7-8 של סטרולים נוספים. רצף חומצות האמינו המקודד על ידי הגן DHCR7 אמור להכיל 475 חומצות אמינו כמו גם מספר motifs של חלבונים, ביניהם מספר motifs של sterol reductase. הוא מכיל מה שקרוי SSD או sterol sensing domain שנחוץ כנראה להתקשרות למצעים סטרוליים. האנזים מכיל גם מספר אתרי זרחון, כולל אתרים ספציפיים לאנזימים הרגולטוריים protein kinase C ו-tyrosine kinase.
מוטציות בגן DHCR7
המשקל המולקולארי של האנזים DHCR7 באדם הוא 54,489 דלטון, עם 475 חומצות אמינו והוא בעל נקודה איזואלקטרית של 9.05. הגן המקודד לאנזים זה הוא באורך של 14,100bp ומכיל 9 אֶקסונים ו-8 introns (Porter ב-Eur J Hum Genet משנת 2008), כאשר ה-mRNA התואם הוא באורך של bp2,786 (כאשר שאר הרצף של DNA הוא אינטרוני). על פי Witsch-Baumgartner וחב' ב-Hum Mutation משנת 2001, אֶקסונים 3-9 מקודדים לאנזים. בגן זה ישנן קומבינציות של אינטרונים ואקסונים, ואזור של opening reading frame המכיל 1,425 נוקלאוטידים ונמצא אחרי ה-promoter.
מעניין שהמבנה של הגן DHCR7 בחולדה דומה מאוד לזה שבאדם. הרמות הגבוהות ביותר של ביטוי הגן DHCR7 התגלו בבלוטת האדרנל, באשכים, בכבד ובמוח. ביטוי הגן מושרה על ידי רמות נמוכות של sterol דרך SREBP או sterol regulatory binding proteins. כפי שצוין, האנזים DHCR7 מקטלז את החיזור של DHC7 לכולסטרול, כמו גם את החיזור של dehydrodesmosterol-7 ל-desmosterol. לשם כך זקוק האנזים ל-NADPH כקופקטור, והוא גם כורך פעילות של cytochrome-450 oxidoreductase. ההשערה היא שהאנזים DHCR7 מכיל גם ברזל, והוא מהווה חלבון אינטגראלי בממברנה של הרטיקולום האנדופלזמי, ומכיל 9 מקטעים (domains) טרנס-ממברנאליים.
בהינתן ש-SLOs הוא מפגע אוטוזומאלי-רצסיבי, נדרשות מוטציות בשני העותקים של כרומוזום 11 כדי לגרום למפגע (Yu ו-Patel ב-Clin Genet משנת 2005). עד כה זוהו למעלה מ-150 מוטציות בגן זה, בהן 130 מוטציות missense (עם פגיעה בנוקלאוטיד בודד) שהן השכיחות ביותר ומהוות 87.6% מכלל המוטציות ב-SLOs, כאשר פגיעתן בפעילות האנזים חלקית בלבד, ולעומתן 25 מוטציות Null שהן שכיחות פחות, אך פגיעתן בפעילות האנזים קשה בהרבה (Correa-Cerro ו-Porter ב-Mol Genet Metab משנת 2005). בין מוטציות Null אלו נמנות 8 מוטציות nonsense, חמש מוטציות המוגדרות כ-splice site, שמונה מוטציות שֶמֶט או deletion, שתי מוטציות insertion, ומוטציית indel אחת (שהיא מוטציית "תערובת" בה יכולים להופיע insertions או deletions של נוקלאוטידים). יש הכורכים מוטציות missense אלו בהתרחשות הפלות ספונטניות.
המוטציה השכיחה ביותר ב-DHCR7 היא מוטציית IVS8-1G>C או c.832-1G>C, המהווה 28.2% מכלל מקרי SLOs. מוטציה זו פוגעת בחיבור בין exon8 ו-exon9, מה שגורם ל-insertion של 134bp של רצף אינטרוני של נוקלאוטידים לתוך ה-mRNA של DHCR7. תרחיש זה מביא ל-frameshift ולהופעה מוקדמת של stop codon (נחשבת למוטציית nonsense או Null mutation). חולים עם מוטציה זו התגלו לראשונה באיים הבריטיים, עם שכיחות נשאים (carriers) של 1.09% באוכלוסייה לבנה ממוצא אירופי. בהמשך נמצא שהנשאוּת של מוטציה זו בקרב אוכלוסיות Caucasian בעולם כולו עומדת על כ-3%, והיא נמוכה יותר בקרב אסייאנים ואפריקאים.
המוטציה השנייה בשכיחותה (10.4%) היא 278C>T בה מתיונין בעמדה 93 משוחלף על ידי תראונין. זו מוטציית missense עם תסמינים מתונים, וזו המוטציה השכיחה ביתר באוכלוסיות של איטלקים, קובּאנים, ואלה ממוצא ים תיכוני. המוטציה השלישית בשכיחותה )6.0%) היא 452G>A, שהיא מוטציית nonsense עם טריפטופן קצה בעמדה 151, המונעת את יצירת האנזים. משערים שהיא החלה בדרום פולין וכיום היא שכיחה בעיקר במדינות צפון אירופה. מוטציות נוספות בסדר שכיחות יורד הן: מוטציית missense הידועה כ- 1210C>T עם ארגינין במקום ציסטאין בעמדה 404 עם שכיחות של 5.2% (על פי Witsch-Baumgartner וחב' ב-Am J Hum Genet משנת 2000); מוטציה 976G>T עם ואלין במקום לאוצין בעמדה 1326 ושכיחות של 5.0%; מוטציה C<T1054 עם ארגינין במקום טריפטופאן בעמדה 352 ושכיחות של 3.2%; מוטציה 1342G>A עם חומצה גלוטמית במקום ליזין בעמדה 448 ושכיחות של 3.2%; מוטציה 1228G>A עם גליצין במקום סרין בעמדה 410 ושכיחות של 2.2%; מוטציה 725G>A עם ארגינין במקום ציסטאין בעמדה 242 ושכיחות של 1.8%; מוטציה 506C>T עם סרין במקום לאוצין בעמדה 169 ושכיחות של 1.7%; מוטציה 906C>G עם פניל-אלנין במקום לאוצין בעמדה 302 ושכיחות של 1.3%; מוטציה 725G>A עם ארגינין במקום היסטידין בעמדה 242 ושכיחות של 1.0%. שתיים עשרה מוטציות אלו מהוות ביחד 69.2% מכלל המוטציות ב-SLOs. ברוב החולים עם SLOs נתגלו 2 מוטציות Null בגן, או עם שתי מוטציות בלולאה 8-9, ואילו במקרים של 1-2 מוטציות בלולאה 1-2, או עם מוטציה אחת בקצה ה- N טרמינאלי, הפנוטיפ היה קל בהרבה ורק במקרים נדירים התגלתה רק מוטציה אחת (Waterham ו-Hennekam ב-Am J Hum Genet משנת 2012).
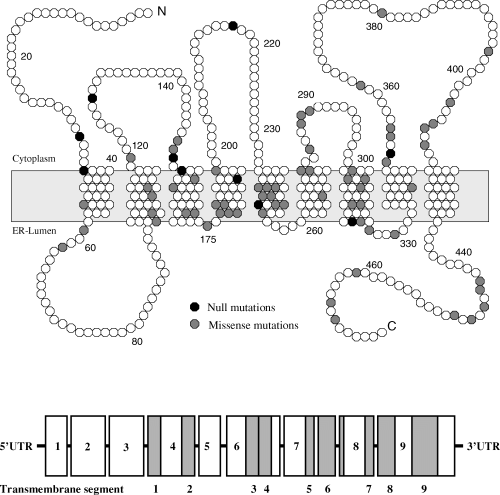
הדגמה של מיקומו של האנזים dehydrocholesterol reductase-7 בממברנת התא (בחלק העליון של התרשים) כאשר הסגמנטים הטרנס-ממברנאליים 4 עד 8 מייצגים את המקטע (domain) המשומר ביותר ובעל הזיקה הגבוהה למצעים סטרוליים (Fitzky וחב' ב-Proc Natl Acad Sci USA משנת 1998). מקומן של מוטציות Null (בשחור) ומוטציות missense (באפור) מודגש. בחלק התחתון של התרשים מתואר ארגון ה-intron-exon כאשר הרצפים המקודדים מסומנים באפור.
תסמונת Smith-Lemli-Opitz
תסמונת Smith-Lemli-Opitz (להלן SLOs) היא מפגע אוטוזומאלי-רצסיבי הנוצר על ידי מוטציה בגן DHCR7 מה שגורם לחסר באנזים reductase 7 dehydrocholesterol-delta-7, וכתוצאה מכך להצטברות בפלזמה של שני הקודמנים של כולסטרול, (DHC-7) dehydrocholesterol-7 ו-(DHC-8) dehydrocholesterol-8. קלינית התסמינים יכולים לכלול מיקרוצפאלי, פיגור בגדילה, פיגור התפתחותי, תווי פנים דיסמורפיים , חך שסוע (cleft palate), פגמים בגפיים ובעיקר 2-3 syndatyly באצבעות הרגליים וכן פולידקטיליה פוסטאקסיאלית (הופעת אצבע נוספת או חלקה ליד אצבעות כף היד), וכן עיוותים במבנה הלב והכליות וחסכים קוגניטיביים.
השכיחות של SLOs
שכיחות מפגע זה מוערכת בין 1:20,000 ל-1:40,000 לידות-חי (Tint וחב' ב-N Eng J Med משנת 1994, ו- Nowaczyk וחב' ב-J Pediatr משנת 2004), אם כי באלה ממוצא צפון או מרכז אירופי השכיחות מוערכת בין 1:10,000 ל-1:60,000 (על פי Porter ב-Mol Genet Metab משנת 2000 ו-Yu ו-Patel ב-Clin Genet משנת 2005). בקרב אלה ממוצא אסיאתי או אפריקני SLOs פחות שכיחה (Wright וחב' ב-Am J Med Genet משנת 2003). ייתכן מאוד שהשכיחות גבוהה יותר שכן האבחון של SLOs בקרב נשים מוחמץ לעתים יותר מאשר בקרב גברים, בגלל חסר של אנומליות באברי המין הבולטים באופן מובהק יותר בגברים הלוקים במחלה.
מחקר של Battaile וחב' ב-Mol Genet Metab משנת 2001 כלל בדיקה של 1,503 טיפות דם מיובשות שנלקחו מסקר יילודים, כאשר ב-16 מתוכן נמצאה המוטציה IVS8-1G>C. נתון זה שימש לחישוב השכיחות של 1:30 של נשאים, המנבאת שכיחות של SLOs בין 1:1,590 ל-1:13,500. חישוב זה של שכיחות צפויה של SLOs הגבוהה משמעותית מזו הנצפית קלינית באופן מעשי, יכול להיות מוסבר או על ידי תמותה מוגברת של עוברים הפגועים עם SLOs ברחם, או מלידה של יילודים מתים עם פגיעת SLOs, או מדיווח-חסר של פרטים פגועים באופן מתון, בהם לא מופיעים התסמינים החיצוניים האופייניים למחלה.
מודלים גנטיים של SLOs בחיות
עכברים וחולדות משמשים הרבה לבחינת פרמטרים שונים של SLOs שכן מבנה האנזים DHCR7 של מכרסמים אלה דומה לזה של אדם. שתי דרכים מקובלות לקבלת תסמיני SLOs הן או על ידי שימוש בחומרים טרטוגנים או על ידי מניפולציות גנטיות ליצירת מוטציות בגן האמור בחיות אלו.
מודלים גנטיים מיוצרים על ידי פגיעה ישירה (knocking out) בגן DHCR7. מחקר של Wassif וחב' ב-Hum Mol Genet משנת 2001, תאר פגיעה בגן זה בתאי גזע עובריים של עכברים. בדומה למקובל באדם, עכברים הטרוזיגוטיים (בהם רק באלל חד נוצרה מוטציה) הם נורמאליים פנוטיפית, והם זווגו עם עכברים בהם המוטציה מופיעה באלל הנגדי. העכברים ההומוזיגוטים לפגם זה שנולדו, מתו כבר ביום הראשון לחייהם, בגלל הכשל שלהם לינוק, והראו בפרק חייהם הקצר מאפיינים דומים לאלה המופיעים בבני אדם עם SLOs. היו להם רמות נמוכות של כולסטרול, רמות מוגברות של 7DHC ו-8DHC, היו במשקל נמוך יותר בלידתם מזה של עכברים בריאים מאותו זן, תנועתם הייתה מוגבלת יותר, ואף ניכרו בהם עיוותים cranio-facial. ממצאים אלה מוסברים בכך שכולסטרול במכרסמים יכול לעבור את השליה, והוא חיוני להתפתחות העובר. באדם, מעט מאוד מהכולסטרול של האם מועבר לעובר.
יחד עם זאת, המגוון המשמעותי בחומרת התסמינים, אפילו בקרב אנשים עם מוטציות דומות בגן DHCR7, מרמז לכך שקיימות השפעות משמעותיות על הפנוטיפ מעבר למוטציות האמורות (Porter ב- Mol Genet Metab משנת 2000). גורם חשוב אחד עשוי לכלול את הטרנספורט של כולסטרול מהאם לעובר בשלב מוקדם של ההיריון. פנוטיפ חמור יותר של המחלה נמצא בתינוקות שנולדו לאימהות בעלות האלל APOE E2 שעלול להפריע לקישור של ליפופרוטאינים ממקור האם המכילים apo E בשליה (Witsch-Baumgartner וחב' ב-J Med Genet משנת 2004, ו-Woollett ב-Am J Clin Nutr משנת 2005).
מודלים טרטוגניים מושרים על ידי האכלת חולדות או עכברים בהיריון עם מעכבים של DCHR7. שני מעכבים שכיחים הם BM15766 או chlorocinnamyl) piperazin-4-yl]ethyl)-benzoic acid-4)-1]-2)-4 ו- AY9944 או trans-l,4-bis(2-chlorobenzylaminomethy1)cyclohexane dihydrochloride. המעכב AY9944 משרה holoprosencephaly ועיוותים מיניים כפי שמוצאים באנשים עם SLOs (על פי Wolf וחב' ב-J Lipid Res משנת 1996), וכן לפגוע בקולטן לסרוטונין שהוא פגם אחר שמוצאים בחולים עם SLOs (על פי Xu וחב' ב-Bichem Biophys Acta משנת 1996). המעכב השני-BM15766 גורם לחuסר כולסטרול וחומצות מרה כפי שמוצאים במחלה זו באדם. מגבלה אחת של מעכבים אלה בחיות היא שרמות DHC-7 ו-DHC-8 נמוכות יותר ממה שמקובל בחולי SLOs. הנתון האחרון יכול להיות מוסבר על ידי העובדה שבני-אדם חולים חווים חסם קבוע של פעילות DHCR7, בעוד שעכברים וחולדות המטופלים במעכבים אלה חווים רק חסמים חולפים. יתרה מכך, זנים שונים של עכברים וחולדות עמידים יותר לפעולת המעכבים הטרטוגנים ולכן עלולים להיות פחות יעילים במודלים בחיות ל-SLOs.
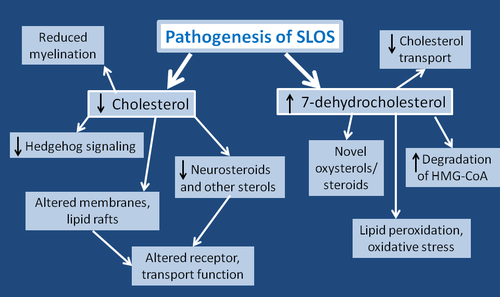
חסר כולסטרול, הגורם העיקרי ל-SLOs
לכולסטרול יש תפקיד חיוני בתהליכים תאיים והתפתחותיים רבים. בנוסף להיותו מרכיב בממברנת התא, הוא משמש קודמן (precursor) של מספר מולקולות חיוניות בשגשוג תאים ובהתמיינות (differentiation) שלהם, בגליקוזילציה של חלבונים, ובמסלול איתות תאיים. הביוסינתזה של כולסטרול והמרתו לתרכובות חשובות אחרות כמו הורמונים אחדים מורכבת ביותר, וכורכת מספר גדול של תוצרי ביניים ותהליכים אנזימטיים. מפגעים הנובעים מחסר של אנזימים אלה, מביאים להצטברות תוצרי הביניים ומניעה של יצירת כולסטרול כמו גם תוצרי ביניים הנמצאים במסלול הביוסינתזה של כולסטרול. ממצאים קליניים המשותפים למפגעים בביוסינתזה של כולסטרול, כוללים עיוותי שלד מוּלדים, תווי פנים דיסמורפיים, פיגור התפתחותי פסיכו-מוטורי וכשל שגשוגי (FTT).
המטבוליזם והתפקוד של כולסטרול
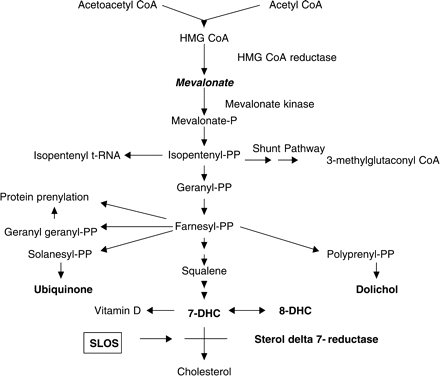
כולסטרול יכול להתקבל מהמזון אך הוא יכול להיווצר גם על מסלולי מטבוליזם בגוף עצמו, שמתרחשים בעיקר בכבד, אך גם במעיים. ראוי לציין שכולסטרול אינו יכול לעבור דרך מחסום דם-מוח (BBB), כך שבתוך המוח הביוסינתזה שלו היא המקור היחיד של מולקולה זו (Patti וחב' ב-Neuroscience משנת 2010). באדם, הסינתזה של כולסטרול מתחילה במסלול ה-mevalonate המוביל לסינתזה של FPP או farnesyl pyrophosphate. מסלול זה משתמש ב-2 מולקולות של acetyl-CoA וב-2 מולקולות של NADPH ליצור mevalonate, העובר מטבוליזם ליצירת IPP או isopentenyl pyrophosphate תוך שימוש ב-3 מולקולות ATP. משלב זה 3 מולקולות IPP נחוצות ליצור מולקולה אחת של FPP. השילוב של 2 מולקולות FPP מביא ליצירת squalene מה שמייצג את הצעד המחויב הראשון ליצירת כולסטרול, שכן squalene מביא ליצירת lanosterol ממנו יש מספר מסלולים המוליכים לביוסינתזה של כולסטרול. הצעד הנחשב ל-rate limiting הוא ההפיכה של hydroxy-3-methylglutaryl-CoA-3 (או HMG-CoA) ל-mevalonate, צעד המקוטלז על ידי האנזים HMG-CoA reductase.
מספר ריאקציות מורכבות מביאות את lanosterol ליצירת zymosterol. בנקודה זו חל פיצול במסלול יצירת כולסטרול. באדם, המסלול העיקרי ידוע כמסלול Kandutsch-Russel (על פי Nowaczyk ו-Waye ב-Clin Genet משנת 2001), בו zymosterol עובר מטבוליזם ליצירת α-cholesta-7,24-dien-3β-ol-5, ממנו ל-lathosterol, וממנו ל-dehydrocholesterol-7, או DHC7. המטבוליט האחרון הוא הקודמן המידי של כולסטרול, והאנזים DHCR7 הוא האחראי להפיכתו לכולסטרול. אנזים זה מחזר את הקשר הכפול על פחמן 7 של DHC7 ליצירת תוצר לא אסטרי, ומוטציות באנזים זה אחראיות לפגמים המופיעים ב-SLOs. במסלול אחר המביא לסינתזה של כולסטרול, DHCR7 דרוש לחיזור של dehydrodesmosterol-7 ליצירת desmosterol.
הרגולציה של סינתזת כולסטרול
מסלול הסינתזה של כולסטרול מורכב ונמצא תחת בקרה העוברת בעיקר דרך האנזים HMG-CoA reductase, ומתבצעת על ידי לולאת משוב הרגישה לרמות כולסטרול בתאים. ארבעת השלבים העיקריים של בקרה זו הם כדלקמן:
הסינתזה של האנזים HMG-CoA reductase מבוקרת על ידי SREBP או sterol regulatory element binding protein, שהוא גורם שעתוק שאינו פעיל כאשר רמות כולסטרול גבוהות, ונכנס לפעולה כאשר רמות אלו נמוכות. כאשר רמות כולסטרול נופלות, משתחרר SREBP מממברנת גרעין התא או מהרטיקולום האנדופלזמי ונודד לגרעין וגורם לשעתוק של הגן ל-HMG-CoA reductase. התרגום על פני mRNA של HMG-CoA reductase מעוכב על ידי נגזרות של mevalonate וכן על ידי כולסטרול המגיע מהמזון. הפירוק וההפחתה של HMG-CoA reductase מבוקרים באופן הדוק: כאשר החלק של אנזים זה הקשור לרטיקולום האנדופלזמי קולט איתותים, כגון עליה ברמת כולסטרול, הוא עובר פירוק פרוטואליטי. כאשר HMG-CoA reductase עובר זרחון, פעילותו פוחתת. משמעות הדבר שכאשר רמת האנרגיה (ATP) בתא נמוכה, סינתזת כולסטרול פוחתת.
תפקידו של כולסטרול
כולסטרול הוא אחד הליפידים המרכזיים הכרוכים בתהליכים מטבוליים, בתפקוד התאי, ובמבנה התא. בעיקר חשיבותו בבקרה על הנוזליות (fluidity) של השכבה הכפולה (bilayer) של פוספוליפידים בממברנת התא. יתרה מכך, כולסטרול מהווה מרכיב ב-lipid rafts, שהם צברים של חלבונים וליפידים (כולל כולסטרול וספינגוליפידים) ה"שטים" בתוך ממברנת התא, ומהווים חלק חשוב בתפקוד הממברנה. חלקיקי ה-lipid rafts מאורגנים או קשוחים יותר מאשר ה-bilayer העוטף אותם, ותפקידם חשוב בעיקר בכך שחלבונים שונים הם בעלי זיקה גבוהה אליהם. קישור זה חיוני בהעברת איתותים (signals) בינתאיים. כולסטרול פועל ספציפית כ"דבק" ב-lipid rafts אלה, ובהעדרו מתרחש תהליך הפרדה בין חלבונים למרכיבי ממברנה אחרים (Simons וחב' ב-J Clin Invest משנת 2002).
בהינתן ששכיחותו הניכרת בממברנות תאים, כולסטרול כרוך במידה רבה בתהליכי טרנספורט מסוימים. הוא עשוי להשפיע על תפקודן של תעלות יונים וטרנספורטרים ממברנאלים אחרים. לדוגמה, כולסטרול נחוץ לפעילות קישור ליגנדים של הקולטן לסרוטונין (Singh וחב' ב-Biochem Biophys Res Commun משנת 2007). בנוסף, כולסטרול מאוד חיוני בתהליכי exocytosis. כמו כן, כולסטרול קשור למודולציה של תכונות ממברנאליות, ועשוי לווסת את האיחוי של vesicles בתוך הממברנה. בהינתן שתאי עצב תלויים מאוד בתהליכי exocytosis להעברת איתותים (impulses) יש לכולסטרול תפקיד מאוד חיוני במערכת העצבים (Linetti וחב' ב-J Cell Science משנת 2010).
מסלול רלוונטי במיוחד בו נוטל כולסטרול חלק, הוא מסלול ה-hedgehog signaling המעביר מידע חיוני לתאים עובריים הנחוץ להתפתחותם. מסלול זה חיוני כאמור בשלב התפתחות העובר, ונוטל חלק בקביעת הרקמה אליה אמורים התאים העובריים לנדוד באמבריוגנזה. חלבוני hedgehog כרוכים גם בשעתוק של גנים המווסתים את ההתמיינות והשגשוג של תאים. כולסטרול חשוב למסלול זה כיון שהוא נקשר קו-וולנטית לחלבוני hedgehog ומשפעל אותם (Herz וחב' ב-Nat Genet משנת 1997). בריכוזי כולסטרול נמוכים, פעילות איתות זו נפגעת כמו גם התמיינות התאים (Ingham ב-Current Biol משנת 2008). מצב זה עלול לתרום לריבוי המומים המולדים אותם מזהים בלית תינוקות פגועים עם SLOs. חלבון איתות ייחודי המשתייך למשפחת חלבוני hedgehog הואSHH או sonic hedgehog החשוב להתפתחות מערכת העצבים המרכזית. חלבוני Hedgehog אחרים כרוכים כנראה בהתפתחות אברי הרבייה והשלד.
כולסטרול הוא קודמן של מולקולות חשובות רבות, כולל חומצות מרה, אוקסיסטרולים, נוירו-סטרואידים גלוקו-קורטיקואידים, מינראלו-קורטיקואידים (החיוניים למאזן האוסמוטי), וסטרואידי-המין (כגון אסטרוגן וטסטוסטרון, כמו גם בהתפתחות העוברות של אברי הרבייה). לבסוף, כולסטרול הוא מרכיב עיקרי במיאלין העוטף את האקסונים של תאי עצב לצורך הבידוד החשמלי שלהם. תהליך המיאלינציה מתרחש באופן אינטנסיבי בשלבי התפתחות העובר, מה שמדגיש את החיוניות בביו-סינתזה של כולסטרול בשלבים אמבריונאליים.
זיהוי נשאים
כיוון שקיימת חפיפה ניכרת בין תחומי הריכוזים של כולסטרול ו-DHC-7 בנסיוב של נשאי המחלה ושל אנשים בריאים, לא ניתן לקבוע את הסטאטוס של נשאים על ידי מדידה של רמת כולסטרול ו-DHC-7. לעומת זאת, ניתן לקבוע בוודאות באופן ביוכימי את נשאוּת המחלה על ידי שימוש בפיברובלסטים (Shefer וחב' ב-Metabolism משנת 1997). ניתן כמו כן לקבוע נשאוּת על ידי אנליזה מולקולארית-גנטית אם ידועות המוטציה או המוטציות שגרמו ל-SLOs בבני משפחה אחרים.
הריונות בסיכון גבוה ל-SLOs ובחינה prenatal של SLOs בהיריון
בהריונות שיש בהם סיכון של 25% ל-SLOs על פי סיפור משפחתי, תוצאה של רמות לא תקינות של DHC-7 בנוזל מי-שפיר בשבועות 15-18 (על פי Abuelo וחב' וכן Rossiter וחב' ב-Am J Med Genet משנת 1995, וכן Dallaire וחב' ב-Prenat Diagn משנת 1995, כמו גם Griffiths וחב' ב-Clin Chem משנת 2008), או ברקמה המופקת מדגימות של סיסי שליה (CVS) בשבועות 10-12 להיריון (Mills וחב' ב-Pediatr Res משנת 1996, ו-Sharp וחב' ב-Prenat Diagn משנת 1997), נחשבות אבחוניות. יש לנקוט בזהירות באבחון פרטים עם סיפור משפחתי של צורה מתונה של SLOs, ובמקרים אלה יש להדגים את חסר האנזים בתאים ממקור השלייה (amniocytes) שמגדלים בתרבית.
אם שתי מוטציות ב-DHCR7 זוהו בעובר הנבדק, ראוי לבצע בחינה גנטית מולקולארית במקום בדיקה ביוכימית, כדי לחזור ולהבהיר תוצאות בלתי-פסקניות (Loeffler וחב' ב-Prenat Diagn משנת 2002, ו-Waye וחב' באותו כתב עת משנת 2007). בעוּבּרים עם אנומליות מולדות מרובות, ניתן לאבחן SLOs בבדיקה סונוגראפית. פיגור בשגשוג של העובר (IUGR) אופייני אף הוא במקרים של SLOs. מאפיינים של תווי-פנים לא תקינים ניתן לאבחן בדיקת על-שמע כבר בשבוע ה-18 להיריון (Nowaczyk ו-Irons ב-Am J Med Genet משנת 2012, ו-Quelin וחב' ב-Eur J Med Genet מאותה שנה). יחד עם זאת, יצוין שממצאי בדיקת על-שמע יכולים להתקבל תקינים בעיקר במקרים מתונים של SLOs (על פי Goldenberg וחב' ב-Am J Med Genet משנת 2004).
כאשר לאישה בהיריון מוצאים בנסיוב רמות נמוכות של estriol חופשי, או ממצאי בדיקה "משולשת" או בדיקה מורחבת של 4 פרמטרים המתאימים לתסמונת trisomy אלא שתוצאות האנליזה הקריוטיפּית תקינות, זה יכול לשמש מדד של SLOs או של חסר באנזים steroid sulfatase. מחקר של Shackleton וחב' שפורסם ב-1999 ב-J Clin Endocrinol Metab, הראו נוכחות יוצאת דופן של estriols האופייניים לסוס שהיוו למעלה ממחצית האסטרוגנים שהופרשו על ידי אישה שברחמה עובר פגוע עם SLOs. כך זוהו estratetraene-3,16α,17β-triol-7,(10)3,5 וכן estrapentaene-3,16α,17β-triol-6,8(10)1,3,5.
תסמינים פיזיים של SLOs
התסמינים השכיחים ביותר הם מיקרוצפאלי, היצרוּת המרחק בין הרקות, ptosis, אף קצר, המאנגיומה קפילארית של האף, לסת קטנה מאוד (מיקרוגנטיה) וקפלים אפיקנטליים בזוויות העין. מאפיינים פיזיים אחרים שיכולים להופיע כוללים: אוזניים במנח נמוך ונטייה לקיפול לאחור, חך נוקשה צר ומוגבה, חך או שפה שסועים, ניוון של הקורפוס קלוסום, היפופלזיה צרבראלית, אונה מצחית קטנה בממדיה, פולידקטיליה של אצבעות הרגליים או הידיים, סידקטיליה של אצבעות 2 ו-3 בכף הרגל, בוהן קצרה, עיוותים באצבעות אחרות, איבר מין זכרי דמויי אבר מין נקבי, פגמים מולדים לבביים, אי-סדירות של הכליות, הריאות, הכבד והעיניים.
כיוון שכולסטרול הוא קודמן של הורמונים סטרואידים, כולל קורטיזול, אלדוסטרון וטסטוסטרון, ניתן להבין את היקפן של הבעיות האנדוקריניות המופיעות כולל היפוגליקמיה, יתר לחץ-דם ואי-סדירות אלקטרוליטית. אי-ספיקה של האדרנל עלולה לגרום לאי-סדירות אלקטרוליטית חמורה (Chemaitikky וחב' ב-Horm Res משנת 2003). גברים עם SLOs חמור, סובלים מרמות נמוכות מאוד של טסטוסטרון (Chasalow וחב' ב-Steroids משנת 1985).
Park וחב' ב-J Pediatr משנת 1968 וכן Lin וחב' ב-Am J Med Genet משנת 1997,דווחו על עד 50% מאלה עם SLOs הסובלים מפגמים לבביים הקשורים לבעיות קרדיו-רספירטוריות. בחולים אלה אובחנו גם בעיות מורפולוגיות של אונות הריאה שמעורבותם ניכרת בבעיות נשימתיות בחולים אלה (Donnai וחב' ב-J Med Genet משנת 1986, ו- Quélin וחב' ב-Eur J Med Genet משנת 2011). בערך רבע מהלוקים ב-SLOs ובלים מפגמים ואי-סדירות בפעולת הכליות כגון היפופלזיה כלייתית, ציסטות קורטיקליות בכליות, הידרונפרוזיס, אי-סדיקות מבנית של המערכת המאספת (Nowaczyk וחב' ב-Am J Med Genet משנת 2001, ו-Ryan וחב' באותו כתב עת משנת 1998).
ממצאים קליניים
חוסר כולסטרול המאפיין SLOs היא תופעה הנוגעת במגוון גדול של מפגעים צפויים במערכות גוף שונות (Ryan וחב' ב-J Med Genet משנת 1998). לידת עכוז טרם-עת שכיחה. היילודים והתינוקות בהמשך מפגינים כוח יניקה דל, רגזנות, ו-FTT (על פי Pinsky ו-DiGeorge ב-J Pediatr משנת 1965). בעיות ההזנה נובעות מהיפוטוניה, חוסר קואורדינציה מוטורית פומית, ובעיות גסטרואנטרליות הקשורות לחוסר תנועתיות או תנועתיות דלה במערכת העיכול, עצירות ורפלוקס גסטרו-אזופגאלי. בעיות ההזנה עלולות לנבוע גם מהיצרות שוער הקיבה (pyloric stenosis) ומחלת הירשפרונג הכרוכה בחלק ממקרי SLOs (על פי Dallaire ו-Fraser ב-J Pediatr משנת 1966, וכן Patterson וחב' באותו כתב עת משנת 1983 ו-Lipson ו-Hayes באותו כתב עת משנת 1984). מחלת כבד יכולה להופיע במגוון רחב של תסמינים מכולסטאזיס חמור עד עליה מתונה באנזימי כבד.
תסמינים מולדים של ירוד (cataract) מופיעים ב-20% ממקרי SLOs (על פי Finley וחב' ב-J Pediatr משנת 2012, ו-Goodwin וחב' ב-Am J Med Genet משנת 2008). ממצאים אופתלמולוגיים אחרים כוללים ptosis, אטרופיה או היפופלזיה של עצב הראייה, ניסטגמוס ופזילה (Atchaneeyasakul וחב' ב-Am J Med Genet משנת 1998). שינויים בתגובה הפוטו-רצפטורית של הקנים (rods) בילדים עם SLOs דווחה על ידי Elias וחב' ב-Arch Ophthalmol בשנת 2003, וכן דווח על שינויים דומים במבוגרים עם SLOs (על פי Garry וחב' ב-Doc Opthalmol משנת 2010).
מאפיינים התנהגותיים בחולי SLOs
במקרים של רמת משכל נמוכה שמוצאים לעתים בחולי SLOs, הם יכולים להגיב באופן שלילי או על ידי יתר-אקטיביות לגירויים תחושתיים שונים. ברבים מהחולים מוצאים התנהגות אגרסיבית הכוללת נטייה לפגיעה עצמית (כגון הכאה עצמית בידיים או חבטת הראש בקיר או ברהיטים או להפרעות שינה (Tiemey וחב' ב-Am J Med Genet משנת 2001). ניתן למצוא בהם נטייה בולטת לרגזנות.
התנהגות אוטיסטית והיפר-אקטיביות מזוהים לעתים קרובות בילדים עם SLOs (על פי Bukelis וחב' ב-Am J Psychiatry משנת 2007). ההתנהגות האוטיסטית האופיינית ביותר באלה עם SLOs היא תנועה נמרצת וממושכת של פלג הגוף העליון (opisthokinesis), מתיחת פלג הגוף העליון ומחיאות כפיים מדי פעם. יש המעריכים שב-46-53% מהמאובחנים עם SLOs ניתן להבחין בתסמינים המופיעים בקשת האוטיסטית (Sikora וחב' ב-Am J Med Genet משנת 2006). בחלקם ניכרת אי-שליטה עצמית וחסכי תקשורת וקשרים חברתיים (התנהגויות נוספות הכרוכות עם SLOs יכולות להיכרך עם אי-סדירויות פיסיקאליות. כמו בעיות ההזנה (Diaz-Stransky ו-Tiemey ב-Am J Med Genet משנת 2012).
הפגיעה הקוגניטיבית בחולי SLOs יכולה כאמור להיות גבולית אך להגיע גם לרמת משל נמוכה משמעותית (Mueller וחב' ב-Am J Med Genet משנת 2003, וכן Lowry ו-Yong באותו כתב עת משנת 1980).
אבחון מבדיל
למרות שבתסמינים רבים ניתן למצוא עיוותי-גוף המופיעים ב-SLOs כגון פולידקטיליה, חך שסוע או היפּוֹספּדיאס (כאשר פתח השופכה ממוקם בחלק התחתון של הפין), רק לעתים נדירות תסמינים אלה יכילו יותר מ-2 עיוותים משותפים ל-SLOs. במקרים אלה הממצאים הביוכימיים הנלווים עשויים לסייע בהבדלה בין SLOs לבין תסמינים אחרים. מבחינה ביוכימית, רק ב-SLOs ניתן למצוא רמות מוגברות של 7-DHC במקביל לרמות נמוכות של כולסטרול בפלזמה. בין התסמינים האחרים עם אי-סדירות בביו-סינתזה של סטרולים ניתן לציין את desmosterolosis (בה ניתן למצוא macrocephaly או microcephaly, גשר-אף היפופלסטי, רכסים מכתשיים (alveolar ridges) מעובים, קשרירים (nodules) בחניכיים, חך שסוע, פגיעה במערכת הוורידית של הריאות, עיוותים באברי מין, גפיים קצרות ואוסטאו-סקלרוזיס), ו-lathosterolosis (בה ניתן למצוא microcephaly, מצח צר, גשר-אף משוקע, חך שסוע, כבד שומני ואי-סדירויות המטולוגיות), או תרחיש בגברים של X-linked chondrodysplasia punctata, קשים להבדלה קלינית מ-SLOs,אך המדדים הביוכימיים שונים בתכלית.
הספקטרום הקליני של המחלה רחב, כאשר באלה עם תסמינים מתונים ניתן למצוא רק סינדקטיליה של אצבעות 2-3 בכפות הרגליים וחסר קוגניטיבי קל. מפגעים אחרים של ביוסינתזה של כולסטרול, הכוללים חסר באנזים desmosterol reductase וכן sitosterolemia, יכולים להראות תסמינים דומים לאלה של SLOs, וניתן לאבחן מפגעים אלה באופן ביוכימי על ידי בדיקה כמותית של סטרולים בפלזמה.
רמות כולסטרול בנסיוב
למרות שמׅתאם מדויק בין רמות כולסטרול בנסיוב לבין הממצאים הקליניים אינו מעשי, רוב המחקרים זיהו מתאם הפוך בין רמות כולסטרול בנסיוב לבין החומרה של תסמיני SLOs (Tint וחב' ב-J Pediatr משנת 1995, ו-Waterham ו-Hennekam ב-Am J Med Genet משנת 2012). התמותה בקרב אלה עם SLOs גבוהה במיוחד כאשר רמות כולסטרול אצלם נמוכות במיוחד (כ-10 מיליגרם/ד"ל). למרות שרוב המאובחנים עם SLOs מראים היפו-כולסטרולמיה, רמות כולסטרול בנסיוב בבריאים ובחולים עם SLOs יכולים להיות חופפים, בעיקר אם הלוקים במפגע הם בגיל מבוגר יותר או שהם בעלי פנוטיפ מתון של המחלה (Kelley וחב' ב-Am J Med Genet משנת 1996). יצוין שבערך ב-10% ממקרי SLOs רמות כולסטרול בנסיוב נורמאליות.
הנזק הנגרם מרמה מוגברת של DHC-7
רבים מהתסמינים ב-SLOs נובעים מההשפעה הטוקסית של DHC-7, שפוגע בעיקר בטרנספורט התוך-תאי של כולסטרול. רמה מוגברת של DHC-7 מביאה לפירוק מוגבר של האנזים HMG-CoA reductase. בנוסף, DHC-7 הוא הליפיד הפעיל ביותר בתרחיש הפראוקסידציה של ליפידים, ולכן עלול לתרום לעקה חמצונית סיסטמית. כידוע, פראוקסידציה של ליפידים פוגעת בממברנות תאים, ויכולה להרוס חלקיקים (organells) תוך-תאיים הקשורים לממברנות. למרות הדמיון המבני ביניהם, DHC-7 אינו מסוגל לבוא במקום כולסטרול ב-lipid rafts . בנוסף, חסר כולסטרול מגביר את הנזילוּת של ממברנת התא, מה שעלול להגביר הפרשה בלתי נורמאלית של גרנולות תאיות. שינויים ממברנאליים אלה עלולים להפריע לדה-גרנולציה של תאי-פיטום (mast cells) המושרית על ידי הקולטן של IgE, וליצירה של ציטוקינים, הקשורים בתגובות אלרגיות (Porter ב-Eur J Hum Genet משנת 2008). גם הקולטן שלNMDA מושפע כמו גם יכולת הקישור לקולטן של סרוטונין בהיפוקאמפוס. גם האינטראקציה בין תאים נפגעת מהשינויים הממברנאליים המופיעים ב-SLOs. נמצא שב-SLOs פוחתת גם ה-exocytosis של חלקיקים (vesicles) בסינפסה, כתוצאה מפגיעה ביכולת הקישור של חלקיקים אלה לממברנות.
הנגזר של DHC-7 המשחק תפקיד בעקה החמצונית הוא 3β,5α-dihydroxy-cholest-7-en-6-one הידוע כ-DHCEO. נגזר זה נוצר מתוצר עיקרי של פראוקסידציה של DHC-7, הידוע כ- DHC-5α,6α-epoxide-7. נמצא ש-DHCEO טוקסי לתאי עצב בקליפת המוח ולתאי glia. משערים שגם רגישות היתר לאור מגלים חולים עםSLOs , נובעת מהעקה החמצונית (Anstey ב- J Photochem Photobiol משנת 2001). מחקר של Valencia וחב' הראו ב-Free Radical Biol Med ש-DHC-7 מזרז את העקה החמצונית הנגרמת בקרטינוציטים בחשיפה ל-UVA. יש לציין שרמות מוגברות של הקודמנים של כולסטרול כגון DHC-7, יכולים להתגלות גם בנבדקים עם היפר-כולסטרולמיה או באנשים המטופלים ב-haloperidol , וכן באלה המטופלים ב- aripiprazole או ב-trazodone ללא קשר ל-SLOs (על פי Hall וחב' ב-Mol Genet Metab משנת 2013). יחד עם זאת, היחס של cholesterol/DHC-7 מוגבר רק בנבדקים עם SLOs.
לרוב מכריע של הלוקים ב-SLOs יש גם רמות נמוכות של כולסטרול במוח, שמשמעותו שריכוזו של כל נגזר סטרולי של כולסטרול במוח יהיה נמוך. לדוגמה, ניתן למצוא ב-SLOs רמות נמוכות של נוירוסטרואידים, הנוטלים חלק בהעברת איתותים בתוך המוח, וייצורם מתבצע אף הוא במוח.
נוירוסטרואידים מגיבים עם קולטנים ספציפיים במוח, ונקשרים לתעלות יונים הקשורות לפעילות של נוירוטרנסמיטורים. באופן ספציפי הם גורמים למודולציה של הקולטנים שלGABA ושל NMDA, וגורמים לשיכוך ולהרגעה, לשיפור זיכרון, ועוד. כיוון שחלק מתסמיני SLOs כגון היפראקטיביות ודאגנות מייצגים השפעות הפוכות לאלה הנגרמות על ידי נוירוסטרואידים, יש להניח שהפחתה בריכוזם של האחרונים קשורה לכך (Marcos וחב' ב-Steroids משנת 2004).
שיטות לגילוי 7DHC
יש מספר שיטות לגלות רמות של 7DHC בפלזמת הדם, ואחת מהן היא שימוש בריאגנט Liebermann–Burchard. זו שיטה קולורימטרית פשוטה שנוחה לשימוש בבדיקות סקר אוכלוסיות בהיקף גדול. הוספת ריאגנט זה לדגימת הפלזמה הנבדקת מביאה באופן מידי להופעת צבע סגול, שהופך בהדרגה לכחול כהה, כאשר בדגימות דם תקינות הוספת הריאגנט האמור מותירה את הדגימה חסרת-צבע שבהדרגה עובר לצבע תכלכל (Xiong וחב' ב-Chem Phys Lipids משנת 2002).
דרך אחרת לגילוי 7DHC נעשית בשיטה של Gas Chromatography-Mass Spectrometry (או (GC-MS על פי Kelley ב-Clin Chim Acta משנת 1995. גרסה רגישה במיוחד של גז כרומטוגרפיה המאפשרת גילוי ריכוזים נמוכים של 7DHC ידועה כ- SIM-GC/MSאו selected ion monitoring gas chromatography/mass-spectrometry. שיטות נוספות לזיהוי מקרי SLOs כוללות את time-of-flight mass spectrometry שניתן לבצע על טיפות דם מיובשות על נייר סופג (Zimmerman וחב' ב-Am J Med Genet משנת 1997), כמו גםparticle-beam LC/MS וכן electrospray ionization tandem MS (על פי Johnson וחב' ב-J Lipid Res משנת 2001), שניתן להשתמש בהן לזיהוי 7DHC בדגימות פלזמה, בנוזל מי-שפיר, בסיסי שליה ואף בשתן.
הוראות לביצוע הבדיקה
יש להיות בצום של לפחות 12 שעות לפני נטילת הדם. בתינוקות יש לקחת דם סמוך להנקה או ההזנה הבאה. את הדם יש ליטול במבחנת סודיום-הפארין (פקק ירוק) כבחירה ראשונה, אם כי גם מבחנת ספירת דם (EDTA פקק סגלגל) מתקבלת. יש לסרכז את הדם לא יאוחר מ-30 דקות מלקיחתו. ניתן לשמור את הפלזמה המופרדת עד 7 ימים בקירור, או עד 90 יום בהקפאה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק