Steroid 21-hydroxylase
| מדריך בדיקות מעבדה | |
| hydroxylase-21 | |
|---|---|
| שמות אחרים | steroid 21-monooxygenase, 21α-Hydroxylase ,
P450 21A2 |
| מעבדה | כימיה בדם |
| תחום | ברור הסיבה להיפרפלזיה אדרנלית מולדת (congenital adrenal hyperplasia-CAH). |
| טווח ערכים תקין | רמת 17α-hydroxyprogesterone בילודים נורמאליים גבוהה מ-1 ננוגרם/מיליליטר (או 3 ננומול'/ליטר). לאחר התקופה הנאו-נטאלית ערך הסף של רמת 17α-hydroxyprogesterone בדגימת דם הנלקחת השכם בבוקר נמוכה מ-0.8 ננוגרם/מיליליטר (2.5 ננומול'/ליטר) בתינוקת וילדים בגיל הרך, והיא נמוכה מ-2 ננוגרם/מיליליטר (6.0 ננומול'/ליטר) במבוגרים לשלילת אפשרות של CAH.
בדגימת דם אקראית, תוצאה של 17α-hydroxyprogesterone מעל 100 ננוגרם/מיליליטר או 300 ננומול'/ליטר בבדיקה של RIA היא אבחנתית לחסר קלאסי של 21-hydroxylase, ואילו תוצאה של 1-100 ננוגרם/מיליליטר (30-300 ננומול'/ליטר) במבוגרים מעידה על הצורה הלא-קלאסית של חסר באנזים האמור. |
| יוצר הערך | פרופ' בן-עמי סלע |
ראו גם – נוגדנים כנגד hydroxylase-21
מטרת הבדיקה
גילוי מוקדם בלידה של יילודים עם CAH בשלב ה-א-תסמיני של המפגע, אך גם בתינוקות עם פנוטיפ קליני המחשיד ל-CAH.
האנזים 21-hydroxylase
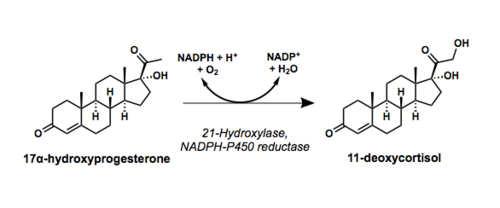
האנזים steroid 21 hydroxylase שייך למשפחת אנזימי המערכת הציטוכרומית P450, הכרוכה בביו-סינתזה של של ההורמונים הסטרואידאלים אלדוסטרון וקורטיזול (Ryan ו-Engel ב-J Biol Chem משנת 1957). ריאקציות סינתטיות אלו מתרחשות בקליפת בלוטת יותרת הכליה (אדרנל) (Guengerich וחב' ב-Trends Phamacol משנת 2016). האנזים hydroxylase-21 הופך פרוגסטרון ו-17α-hydroxyprogesterone ל-deoxycorticosterone-11 ול-deoxycortisol-11, בהתאמה, על ידי הידרוקסילציה של עמדה C21 (על פי Pallan וחב' ב-J Biol Chem משנת 2015).
תוצרי הידרוקסילציות אלה ממשיכים במסלוליהם ליצירת אלדוסטרון וקורטיזול. בדומה לאנזימי ציטוכרום P450 אחרים. hydroxylase-21 משתתף גם במעגל הקטליטי של ציטוכרום P450, ובטרנספר של אלקטרון אחד על ידי האנזים NADPH-P450 reductase. כמו כל האנזימים ממשפחת P450, גם hydroxylase-21 מכיל בתוך החלבון גרעין heme המכיל ברזל. בכל בעלי החוליות ניתן למצוא ואריאציות של אנזים זה (Graham ו-Peterson ב-Methods Enzymol משנת 2002). בשנת 2015 פוענח ופורסם על ידי קרני X המבנה הגבישי של האנזים כאשר הוא קשור לפרוגסטרון, האנזים בולט בגין הספציפיות הניכרת שלו למצע, כמו גם בגין היעילות הקטליטית היחסית גבוהה שלו.
האנזים hydroxylase-21 הוא קומפלקס של שלוש תת-יחידות זהות ועצמאיות. כל תת-יחידה של האנזים האנושי מורכבת מ-12 סלילי אלפא ו-9 גדילי בטא, הבנויים לתוך מבנה משולש דמוי-מנסרה שלישונית. גרעין ה-heme המכיל ברזל הקובע את האתר הפעיל של האנזים, ממוקם במרכז של כל אחת משלשת תת היחידות. האנזים האנושי נקשר רק למצע אחד בו-זמנית, בה בשעה שהאנזים ממקור בקר יכול לקשור 2 מצעים בעת ובעונה אחת (Zhao וחב' ב- J Biol Chem משנת 2012). האנזים ממקור אדם ובקר הם בעלי הומולוגיה ב-80% של רצף חומצות האמינו שלהם, בעיקר באזורי הלולאה הקטליטית של האנזים. האנזים -hydroxylase-21 הוא אחד מ-3 אנזימים סטרואידוגנים מיקרוזומאליים ממשפחת P450, כאשר השניים האחרים הם hydroxylase-17 ו-aromatase.
קינטיקת הריאקציה
21-הידרוקסילאזה מאוד ספציפית להידרוקסילציה של פרוגסטרון ושל hydroxyprogesterone-17. בדרך זו הוא שונה מהאנזים hydroxylase-17 הדומה לו אמנם אבולוציונית ותפקודית, אך יש לו מגוון רחב של מצעים (Auchus וחב' ב-Arch Biochem Biophys משנת 2003). מחקרים מוקדמים יותר של אנזימי אדם המבוטאים בשמרים, קבעו ש- hydroxyprogesterone-17 הוא המצע הטוב ביותר עבור hydroxylase-17 (על פי Lorence וחב' ב-Arch Biochem Biophys משנת 1989, ו-Wu וחב' ב-DNA & Cell Biol משנת 1991). לעומת אלה, אנליזה עדכנית יותר של אנזים מנוקה מאדם מצאה Km נמוך יותר ויעילות קטליטית גדולה יותר עבור פרוגסטרון כמצע, בהשוואה ל-hydroxyprogesterone-17.
אנליזה משנת 2015 מצאה לאנזים hydroxylase-21 יעילות קטליטית של בערך 1.3x107M/sec/L בטמפרטורה של C ̊ 37 להפיכת פרוגסטרון באדם ל-deoxycorticosterone-11. נתון זה הופך את hydroxylase-21 לאנזים P450 הקטליטי היעיל ביותר מבין האנזימים האחרים, ואף יותר יעיל קטליטית מהאנזים hydroxylase-17 ממקור בקר. ה-rate-limiting step של ריאקצית ההידרוקסילציה היא שבירת הקשר C-H ליצירה של רדיקל ראשוני של פחמן. פגם בגן CYP21A2 המקודד לאנזים hydroxylase-21 מפריע להתפתחות האנזים, וזהו הבסיס ל-congenital adrenal hyperplasia (להלן CAH).
מסתבר שבסמוך לגן CYP21A2 ממוקם פסבדו-גן ומתרחשים שחלופים בין הגן התפקודי והפסבדו-גן, מה שאחראי למקרים רבים של חסר של steroid 21-hydroxylase. שני הגנים האחרונים ממוקמים בכרומוזום 6 ב- major histocompatibility complex, והפסבדו-גן הוא בעל זהות אֶקסוֹנית של 98% עם הגן התפקודי (Higashi וחב' ב-Proc Natl Acad Sci USA משנת 1986, ו-White וחב' באותו כתב עת משנת 1985).
המפגע החמור של CAH מועבר בהורשה אוטוזומאלית-רצסיבית, ומתרחש בערך ב-1 מתוך 15,000 לידות-חי בעולם, בסקירה של 1.9 מיליון לידות (New ו-Wilson ב-Proc Natl Acad Sci USA משנת 1999, ו-Therrell וחב' ב-Pediatrics משנת 1998). יש מספר צורות של CAH, המתחלקות לצורות קלאסיות ולא-קלאסיות על בסיס כמות הפעילות האנזימטית הנשמרת בהן. הצורות הקלאסיות כוללת את ה-Salt Wasting CAH שהיא צורת המפגע החמורה ביותר בה רמת האנזים היא 0-1% מרמתו התקינה. חסר האנזים גורם להתייבשות ולהלם בתינוקות שנולדו זה עתה, ולעתים אף למוות. בנוסף, תינוקות ממין נקבה תיוולדנה עם איברי מין חיצוניים בלתי מוגדרים ואיברי מין פנימיים נקביים. צורה קלאסית נוספת החמורה פחות (בה רמת האנזים היא 1-10% מרמתו התקינה) היא ה-simple virilizing CAH שגם בה נקבות נולדות עם איברי מין חיצוניים בלתי מוגדרים ואיברי מין פנימיים נשיים, ואילו הזכרים יסבלו מהתפתחות מינית מוקדמת וגובה נמוך (Speiser וחב' ב- J Clin Endocrinol Metab משנת 2010, ו-New ב-Ann NY Acad Sci משנת 2004).
מוטציות המשבשות את האתר הפעיל של האנזים (או את מבנה ה-heme או את השיירים המשתתפים בקישור למצע) גורמות לביטול מוחלט של פעילות האנזים בצורת ה-salt-wasting (על פי Pallan וחב' ב-Mol Endocrinol משנת 2015). אי-יצירת קורטיזול ואלדוסטרון כרוכה באיבוד מסכן חיים של מלח (ומכאן מקור השם salt wasting), שהרי סטרואידים משחקים תפקיד בוויסות ההומאוסטאזיס של נתרן. לעומת זאת, צורת ה-simple virilizing השומרת על חלק מפעילות האנזים, כרוכה במוטציות באזורים ההידרופוביים השמורים, או ליד המקטע הטרנס-ממברנלי. אלה עם CAH מצורת ה-simple viralizing, מצליחים לשמור על חלק מההומאוסטאזיס של נתרן, אך צורה זו מייצגת גם תסמינים פנוטיפיים אחרים המשותפים לה ולצורת ה-salt wasting, כולל גדילה מואצת בשנות הילדות הראשונות, ואיברי מין בלתי-מוגדרים אצל עוברים ויילודים של המין הנקבי. הצורות הלא-קלאסיות של CAH שומרות על 20-60% של פעילות hydroxylase-21, ובצורות אלו יש ביטוי נורמאלי של קורטיזול, אך עם זאת גם עודף של פעילות אנדרוגנים לאחר גיל הבשלות המינית (Miller ו- Auchus ב-Endocrine Rev משנת 2011, ו-Haider וחב' ב-Proc Natl Acad Sci USA משנת 2013).
המושג CAH מכסה קבוצה של מפגעים הנגרמים על ידי פגיעה באנזימים הסטרואידוגניים המשתתפים בסינתזה של קורטיזול או של אלדוסטרון מכולסטרול בבלוטות האדרנל. בערך 95% מהמקרים של CAH נגרמים על ידי חסר ב-hydroxylase-21 הנובע מפגם בגן CYP21A2. סקירת יילודים לגילוי CAH מתבצעת במדינות רבות כדי למנוע משברים הנובעים מאיבוד מלח בשתן, למנוע מצבים שגויים של התייחסות לתינוקת ממין נקבה כאל תינוק זכרי, ולמנוע מפגעים לטווח ארוך כגון קומה נמוכה. 17α-hydroxyprogesterone הוא סמן של חסר באנזים hydroxylase-21 וסמן זה נמדד בשיטת RIA, או בשיטת fluoroimmunoassay. פותחה שיטת כרומטוגרפיה נוזלית (LC) משולבת ב- ,tandem mass spectrometry לצורך אנליזה מהירה, ספציפית ביותר ורגישה, של מספר גדול של דגימות במסגרת סקר היילודים (Falhammar וחב' ב- Endorine משנת 2015).
אנליזה של סטרואידים בשתן על ידי GC/MS גם כן מספקת נתונים איכותיים וכמותיים של מטבוליטים של הורמונים סטרואידים בשתן. אנליזה מולקולארית של CYP21A2 שימושית לצורך של ייעוץ גנטי, אישור האבחון וניבוי של הפרוגנוזה. כיוון שביילודים ממין זכר עם CAH אין מוצאים איברי מין בלתי מוגדרים, אין דרך מידית לזהות אצלם CAH אלא אם כן הם מתגלים בסקר היילודים בזיהוי הביוכימי (Falhammar ו-Thoren ב-Endocrine משנת 2012). כאמור, רמת 17α-hydroxyprogesteroneמשמשת סמן של hydroxylase-21, ולכן בבדיקות סקר מודדים את כמות 17α-hydroxyprogesterone בטיפות הדם המיובשות להערכת אפשרות של CAH על רקע חסר ב-hydroxylase-21 (White ב-Nat Rev Endocrinol משנת 2009). אכן יש חשיבות קריטית לאבחן חסר ב-hydroxylase-21 בלידת התינוקות ולטפל בצורות הקלאסיות והלא-קלאסיות של CAH, כדי למנוע משברים של האדרנל, ותרחיש של היפר-אנדרוגניות.
סקר יילודים לגילוי חסר ב-hydroxylase-21
מטרת הסקר לאתר או למנוע משבר של salt wasting, למנוע הלם, נזק מוחי, או אפילו מוות, ולהתחיל טיפול או טרם הופעת התסמינים. כמו כן מטרת הסקר היא למנוע מצב של זיהוי שגוי של מין היילוד במקרה של תינוקות ממין נקבי (Cavarzere וחב' ב-Horm Res משנת 2005, ו-Thil'en וחב' ב-Pediatrics משנת 1998). תפקיד חשוב נוסף הוא לזהות יילודים ממין זכר, בהם איברי המין אינם שנויים במחלוקת ולכן יש חשיבות בזיהוי CAH בשלב הא-תסמיני שלהם (Gidlof וחב' ב- Lancet Diabetes Endocrinol משנת 2013). בקוריאה, בה החלו בדיקות סקר יילודים לזיהוי CAH בשנת 2006, השכיחות של מפגע זה נקבעה כ-1 לכל 22,700 לידות-חי (Lee ב- Korean J Pediatrמשנת 2009). הסמן הביוכימי 17α-hydroxyprogesterone, מוגבר במקרי חסר של hydroxylase-21 כיוון שהוא משמש מצע עיקרי לאנזים זה ממש בשלב הסמוך לחסם במעגל המטבולי בו נדרשת פעילות האנזים החסר (White ו-Speiser ב-Endocr Rev משנת 2000).
רמת 17α-hydroxyprogesterone בילודים נורמאליים גבוהה מ-1 ננוגרם/מיליליטר (או 3 ננומול'/ליטר). לאחר התקופה הנאו-נטאלית ערך הסף של רמת 17α-hydroxyprogesterone בדגימת דם הנלקחת השכם בבוקר נמוכה מ-0.8 ננוגרם/מיליליטר (2.5 ננומול'/ליטר) בתינוקת וילדים בגיל הרך, והיא נמוכה מ-2 ננוגרם/מיליליטר (6.0 ננומול'/ליטר) במבוגרים לשלילת אפשרות של CAH (Merke ו-Bornstein ב-Lancet משנת 2005). בדגימת דם אקראית, תוצאה של 17α-hydroxyprogesterone מעל 100 ננוגרם/מיליליטר או 300 ננומול'/ליטר בבדיקה של RIA היא אבחנתית לחסר קלאסי של hydroxylase-21, ואילו תוצאה של 1-100 ננוגרם/מיליליטר (30-300 ננומול'/ליטר) במבוגרים מעידה על הצורה הלא-קלאסית של חסר באנזים האמור. בנשים בגיל הפריון, דגימות לצורך מדידת 17α-hydroxyprogesterone צריכות להימדד בשלב הפוּלקוּלארי של המחזור החודשי, כיוון שרמות 17α-hydroxyprogesterone מוגברות בשלב הלוּטֶאלי בערך במחציתן של נשים בריאות עם רמות שמעל 2 ננוגרם/מיליליטר (6.0 ננומול'/ליטר) (Azziz וחב' ב-Fertil Steril משנת 1999).
כמה טכניקות זמינות למדידת 17α-hydroxyprogesterone, בהן RIA, ELISA, ו- time-resolved fluoro-immunoassay. שיטת RIA ושיטת ELISA היו הראשונות בשימוש, אך הן איטיות ולא ידידותיות לסביבה (RIA היא שיטה רדיואקטיבית), ושיטת fluoro-immunoassay מודרנית יותר אם כי רגישותה והספציפיות אינן גבוהות. אחד החסרונות של סקר יילודים לחסר פעילות של hydroxylase-17 נעוץ בשיעור הגבוה של תוצאות חיוביות-כזובות (false positive), מה שמחייב בדיקות חוזרות, גורם מצוקה נפשית להורים, ומלווה בהוצאות נכבדות לצורך המשך המעקב. תוצאות חיוביות-כזובות מיוחסות למספר גורמים כגון אי-בשלות של הדם הנלקחות מפגים שנולדו טרם-עת, מחלת התינוק, עקה כלשהי, וספציפיות נמוכה של הנוגדנים המסחריים כנגד 17α-hydroxyprogesterone המשמשים בערכות הבדיקה שעלולים להגיב עם hydroxypregnenolone-17 (al Saedi וחב' ב-Pediatrics משנת 1996, Honour ו-Rumsby ב- J Steroid Biochem Mol Biol משנת 1993 ו-Riepe ו-Sippell ב-Rev Endocr Metab Disord משנת 2007).
שדרוג שיטות האנליזה הביוכימית להערכת סטרואידים אדרנליים
ריבוי המקרים של קבלת תוצאות חיוביות-כזובות בשיטות האימונולוגיות, חייב מעבר לשיטות בהן מדידת 17α-hydroxyprogesterone תהיה יותר ספציפית. שיטת tandem mass spectrometry (MS/MS) פותחה למטרה זו (Minutti וחב' ב- J Clin Endocrinol Metabמשנת 2004). שיטה נוספת המשלבת liquid chromatography עם MS/MS הידועה כ-LC-MS/MS היא גישה מהפכנית למדידת הורמונים סטרואידיים בנוזלי גוף כדי לשפר את הרגישות והספציפיות במערכות מדידה אוטומטיות (Rossi וחב' ב-Clin Chim Acta משנת 2010, Stanczyk ו-Clarke ב- J Steroid Biochem Mol Biol משנת 2010 ו-Kamrath וחב' ב-Endocr Dev משנת 2014). אכן, כיום LC-MS/MS היא שיטת המדידה המקובלת לאישור תרחיש של CAH, שכן שיטות גנטיות מולקולאריות גוזלות זמן והן אף יקרות לביצוע (Wooding ו-Auchus ב-Mol Cell Endocrinol משנת 2013). אמנם המגבלות של cross-reactivity וספציפיות, מוחלשות על ידי שימוש ב-LC-MS/MS, אך הבעיה של תוצאות חיוביות-כזובות אינה יכולה להיעלם באופן מוחלט בדגימות הנלקחות מפגים הנולדים טרם-עת אן מיילודים הנמצאים בעקה מסיבות שונות, על ידי מדידה בלעדית של17α-hydroxyprogesterone. שיטת LC-MS/MS יכולה למדוד רמות של17α-hydroxyprogesterone, אך יכולה כמובן למדוד חומרים רלוונטיים אחרים, כגון androstenedione, 11-deoxycortisol, 21-deoxycortisol וקורטיזול (Caulfield וחב' ב-J Clin Endocrinol Metab משנת 2002, ו-Kao וחב' ב- Ann Clin Lab Sci משנת 2001).
היחס בין אנליטים שונים (היחס בין קודמנים לתוצרים) כמו לדוגמה היחס בין -17α hydroxyprogesterone + deoxycortisol לבין cortisol, עשוי להפחית בצורה יעילה את התוצאות החיוביות-כזובות בסקר יילודים עם רמות גבוהות של 17α-hydroxyprogesterone כתוצאה מעקה, מחלה או לידה טרם-עת (Speiser ב-J Clin Endocrinol Metabol משנת 2004). ב-CAH לא-קלאסי הרמות של אנליטים שונות אך במעט בהשוואה לרמות שמוצאים ביילודים בריאים, אך היחס בין רמות אנליטים מפגין שינויים בולטים יותר מאשר האנליטים עצמם. לכן, הספציפיות והרגישות של LC-MS/MS והשימוש ביחס בין אנליטים עשויים לאפשר את האבחון של מפגעים לא-קלאסיים מתונים של CAH.
גם השתן יכול לשמש בניתוח הפרופיל הסטרואידי, על ידי דגימה של שתן וייבושו על נייר סופג , ובדיקת השתן יכולה לספק כלי אבחוני נוסף להבדיל בין צורות שונות של CAH (על פי Krone וחב' ב-J Steroid Biochem Mol Biol משנת 2010). גם GC/MS משמש באנליזה של פרופיל סטרואידים בשתן, המסייע כמבחן אבחוני (Kamrath וחב' ב-J Steroid Biochem Mol Biol משנת 2016). אכן, סמנים של פעילות 21-hydroxylase כגון מטבוליטים של 17α-hydroxyprogesterone בשתן, דוגמת 17α-hydroxypregnanolone, ,pregnanetriol ו-15β,17α-dihydroxypregnanolone, וכן מטבוליטים בשתן של deoxycortisol-21 כגון pregnanetriolone נלמדו בעזרת GC/MS (על פי Komata וחב' ב- J Clin Endocrinol Metabol משנת 2004).
השימוש ב-cosyntropin stimulation test
עלייה גדולה ברמת 17α-hydroxyprogesterone אופיינית לחסר קלאסי של hydroxylase-21. עם זאת, רמות לא חד-משמעיות של 17α-hydroxyprogesterone, אינן יכולות להבדיל בין CAH לא קלאסי לבין נשאים הטרוזיגוטיים של CAH, מה שמחייב בחינה דינאמית של גירוי corticotropin הידוע גם כ-cosyntropin (על פי New וחב' ב-J Clin Endocrinol Metabol משנת 1983). מבחן זה נחשב ל"סטנדרד הזהב" לאבחון של CAH לא קלאסי. הטסט הזה מתבצע על ידי הזרקה תוך-ורידית של cosyntropin במינון של 0.25 מיליגרם, ומדידה של רמת הבסיס של 17α-hydroxyprogesterone וכן את רמתו 60 דקות לאחר העירוי. גם רמות קורטיזול אמורות להימדד לפני תחילת העירוי ו-60 דקות לאחר השלמתו. רמת בסיס של 17α-hydroxyprogesterone הנמוכה מ-5 ננוגרם/מיליליטר ורמת שיא שלו הנמוכה מ-10 ננוגרם/מיליליטר, מצביעות באופן מסורתי על CAH לא-קלאסי (Bachega וחב' ב-Clin Endocrinol משנת 2000).
הגנטיקה של hydroxylase-21
הגן CYP21A2 המקודד לאנזים ממוקם באזור ה-HLA class III region במיקום 6p21.33 בין האזורים של HLA-B ו-HLA-DR. זהו אזור כרומוזומאלי מורכב ביותר הכולל את הגן התפקודי CYP21A2, ואת הפסבדו-גן הלא תפקודי CYP21A1P. נכון לתחילת 2017 התגלו למעלה מ-200 מוטציות בגן CYP21A2, אך רק 10 ממוטציות שכיחות אלו נמצאו בערך ב-90% מכלל המקרים של CAH (על פי White וחב' ב-Hum Mutat משנת 1994, וכן Higashi וחב' ב-Am J Hum Genet משנת 1988, ו-White וחב' ב-Proc Natl Acad Sci USA משנת 1988). בערך 70-75% מהמקרים של חסר ב-hydroxylase-21 הם כתוצאה מ-microconversion של המוטציות ב-CYP21A1P ל-CYP21A2 (על פי Morel וחב' ב-J Clin Invest משנת 1989). בערך 70% ממקרי החסר ב-21-hydroxylase נובעים על ידי תהליך לא שווה של crossing over בעת שלב ה-meiosis. 1-2% האחוזים הנותרים נובעים ממוטציות ספונטניות שאינן מגיעות מההורים (Speiser וחב' ב-J Clin Invest משנת 1992).
אנליזה מולקולארית של הגן CYP21A2
החשיבות של הניתוח המולקולארי היא בהיותו תוסף חיוני למדידות ההורמונאליות, במסירת הייעוץ להורי תינוק עם CAH. יש להדגיש שאבחון גנטי מולקולארי מסובך יותר במקרי חסר ב-hydroxylase-21, מאשר למפגעים מונוגניים אחרים בגין השוֹנוּת הגבוהה של האזור הגנומי. סיבוך זה כולל את המציאות של למעלה מ-2 מוטציות או אף יותר מכך על אותו אלל, או הנוכחות של יותר מ-repeat unit הידוע כ-CYP21/C4 על אותו כרומוזום. בנוסף, יש להקפיד לא לבצע genotyping של הפסבדוגן, כיוון שהתוצאות הגנטיות עלולות להסתבך כתוצאה מתופעות של דופליקציה, שמט (deletion), וריקומבינציה של הגן CYP21A2 באזור 6p21.33.
איסטרטגיות אחדות פותחו לאנליזה מולקולארית של CYP21A2 המבוססות על אמפליפיקציית PCR, עם אוליגונוקלאוטידים הספציפיים לגן CYP21A2, המלווה על ידי ריצוף Sanger ישיר של הגן. (Wedell ו-Luthman ב-Hum Mol Genet משנת 1993). אך ריצוף ישיר של פרגמנטים של הגן שעברו אמפליפיקציה על ידי PCR אינו יכול לגלות rearrangements גדולים בגן. שיטת ה-Southern blot שימשה באופן מסורתי לזיהוי של שמטים או conversions גדולים בגן, אך שיטה זו גוזלת זמן , כרוכה בפעילות ידנית מורכבת ודורשת probes רדיואקטיביים וכמות גדולה של DNA. בנוסף, בשיטת Southern blot יש מגבלה בזיהוי כימרים כגון CYP21A1P/CYP21A2 (על פי Lee וחב' ב-Anal Biochem משנת 2010).
לכן פותחו שיטות אחרות כגון MLPA או multiplex ligation-dependent probe amplification, שהיא שיטה קלה, מהירה ורגישה לגילוי שמטים או דופליקציות של הגן CYP21A2. שיטה זו מאפשרת גילוי מהיר של גנים כימריים באלה עם חסר ב-hydroxylase-21 ללא שימוש ב-probes רדיואקטיביים (Concolino וחב' ב-Clin Chim Acta משנת 2009, ו-Choi וחב' ב-Exp Clin Endocrinol Diabetes משנת 2012). יחד עם זאת, תוצאות חיוביות-כזובות עלולות להופיע כיוון שהמוטציות או הפולימורפיזמים קרובים מאוד לאזור הקישור של ה-probe ואתר הליגציה עלול למנוע מה-probe היברידיזציה וליגציה (Concolino וחב' ב-Clin Chem משנת 2011).
ניבוי של הפנוטיפ הקליני על סמך הגנוטיפ
קיים מתאם טוב בין הגנוטיפ והפנוטיפ הקליני. המוטציות ב-CYP21A2 יכולות להתחלק ל-3 קטגוריות (A, B ו-C) על בסיס רמת הפעילות האנזימטית שניתן לנבא על סמך ניסויים של transfection המתבצעים in vitro: קטגוריה A מורכבת ממוטציות כגון שמטים או מוטציות nonsense המבטלות לחלוטין את הפעילות האנזימטית והן כרוכות לרוב עם צורת ה-salt wasting של CAH. קטגוריה B מורכבת ממוטציות mussense כגון p.1172N עם 1-2% של פעילות אנזימטית מזו שבאנשים בריאים. מוטציות של קטגוריה B מוצאים בעיקר באלה צורת ה-simple virilizing של החסר האנזימטי. קטגוריה C כוללת מוטציות כגון p.V281L ו-p.P30L, המייצרות אנזימים השומרים על 20-60% מפעילות hydroxylase-21 באנשים בריאים, כאשר מוטציות אלו כרוכות בצורה המתונה הלא קלאסית של CAH.
הוראות לביצוע הבדיקה
באשר לשימוש בניירות פילטר לצורך ייבוש טיפות הדם הנלקחות מהעקב למדידת רמת 17α-hydroxyprogesterone ההמלצה היא שטיפות אלה תילקחנה בין 2-4 ימים מהלידה (White ב-J Pediatr משנת 2013). בגלל ההשפעה של ה- circadian rhythm על רמת קורטיזול (Gutai וחב' ב- J Clin Endocrinol Metab משנת 1977), רצוי ליטול את טיפת הדם בשעת בוקר מוקדמת.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - תפקוד בלוטת האדרנל
- בדיקות מעבדה - מפגעים הורמונאליים
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק