הבדלים בין גרסאות בדף "פונטיניב לטיפול בלוקמיה מיאלואידית כרונית קשה לטיפול - Ponatinib for the treatment of chronic myeloid leukemia - CML"
| (32 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=[[קובץ:CML.jpg|250 פיקסלים]] |
|כיתוב תמונה= | |כיתוב תמונה= | ||
|שם עברי= פונטיניב לטיפול בלוקמיה מיאלואידית כרונית קשה לטיפול | |שם עברי= פונטיניב לטיפול בלוקמיה מיאלואידית כרונית קשה לטיפול | ||
|שם לועזי= Ponatinib for the treatment of Chronic Myeloid Leukemia | |שם לועזי= Ponatinib for the treatment of Chronic Myeloid Leukemia | ||
|שמות נוספים= | |שמות נוספים= | ||
| − | |ICD-10= | + | |ICD-10= {{ICD10|C|92|1|c|81}} |
| − | |ICD-9= | + | |ICD-9= {{ICD9|205.1}} |
| − | |MeSH= | + | |MeSH= D015464 |
| − | |יוצר הערך= | + | |יוצר הערך= ד"ר איתי לוי |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| + | {{הרחבה|לוקמיה מיאלואידית כרונית}} | ||
| + | '''לוקמיה מיאלואידית כרונית (CML{{כ}}, Chronic Myelogenic Leukemia)''' מאופיינת בשגשוג לא מבוקר של תאי דם לבנים במח העצם ובדם הפריפרי. המחלה מתחילה כמחלה כרונית ובהיעדר טיפול מתאים היא מתקדמת תוך שלוש עד חמש שנים מהשלב הכרוני הראשוני, דרך שלב ביניים (שלב מואץ - Accelerated phase) לצורה של לוקמיה חריפה (שלב בלסטי). בשלבים המתקדמים נדרשים טיפולים אגרסיביים ובמרבית המקרים המחלה אינה ניתנת לריפוי{{הערה|שם=הערה1|Baccarani et al Blood. 2013 Aug 8:122(6)1872-84}}. | ||
| + | |||
| + | המחלה מהווה כ-15-20% מכלל הלוקמיות במבוגרים. ההיארעות בישראל, בדומה לזו שבעולם, היא כ-1.6 חולים חדשים ל-100,000 איש בשנה. בישראל מאובחנים כל שנה כ-70 חולים וסך הכל יש מספר מצטבר של כ-700 חולי CML בארץ. | ||
| + | |||
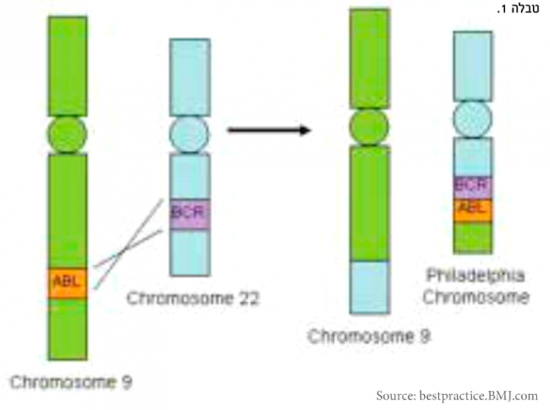
| + | CML היא מחלה הנגרמת כתוצאה משינוי גנטי אופייני בתאי הדם. השינוי מתבטא בחילוף של חומר גנטי בין כרומוזום 9 עליו נמצא הגן ABL וכרומוזום 22 עליו נמצא הגן BCR. שינוי זה מכונה טרנסלוקציה (Translocation) {{כ}}9:22. כתוצאה מכך נוצר כרומוזום בעל מבנה לא תקין עליו יושבים בסמיכות הגנים BCR-ABL (איור מספר 1). | ||
| + | |||
| + | |||
| + | [[קובץ:CML1.png|מרכז|550 פיקסלים]] | ||
| + | |||
| + | |||
| + | כרומוזום זה נקרא '''כרומוזום פילדלפיה''', על שם המדינה בארה"ב שבה התבצע המחקר שהביא לגילויו בשנת 1960. הגנים BCR/ABL המצויים כעת בסמיכות זה לזה מקודדים ליצירת חלבון בשם BCR-ABL, שהינו אנזים מסוג טירוזין קינאז (Tyrosine kinase). אנזים זה גורם לשפעול תהליכי גדילה לא מבוקרת של תאי דם לבנים, תהליך המביא בסופו להתפתחות הלוקמיה{{הערה|שם=הערה2|Nowell P. The lournal of Clinical Investigation 2007: 117(8)2033-2035}}. | ||
| + | |||
| + | CML היא המחלה הממאירה הראשונה שבה פוענח הבסיס הגנטי הגורם להתפתחותה. דבר זה אפשר לראשונה פיתוח של טיפול ביולוגי החוסם ומדכא באופן ספציפי את פעילותו של האנזים הגורם להיווצרות המחלה. דהיינו, הטיפול ב-CML מבוסס על חסימת הפעילות הבלתי מבוקרת של האנזים מסוג טירוזין קינאז. | ||
| + | |||
| + | [[t:Glivec|Glivec]]{{כ}} (Imatinib) היא התרופה הראשונה שפותחה ממשפחת התרופות מעכבות טירוזין קינאז (TKI{{כ}}, Tyrosine Kinase Inhibitor). התרופה מאושרת משנת 2001 לטיפול קו ראשון בחולי CML. כיום מאושרות לשימוש גם התרופות [[t:Tasigna|Tasigna]]{{כ}} (Nilotinib),{{כ}} [[t:Sprycel|Sprycel]]{{כ}} (Dasatinib) ו-[[t:Bosulif|Bosulif]]{{כ}} (Bosutinib), שהן תרופות מסוג TKI מדור שני. ייחודן של התרופות מדור שני שהן יעילות בחולים המפתחים עמידות לטיפול עקב התפתחות מוטציות באתר הטירוזין קינאז. לכל אחת מהתרופות פרופיל יעילות כנגד מוטציות אחרות וניתן להתאים את הטיפול בהתאם לסוג המוטציות שמתפתחות. יתרון נוסף של קבוצת התרופות TKI מדור שני הוא שניתן להשיג באמצעותן תגובה מהירה יותר בדיכוי המחלה ביחס ל-Glivec{{כ}}{{הערה|שם=הערה1}}. | ||
| + | |||
| + | על אף ההתקדמות הניכרת בטיפול ב-CML, הרי שכ-20% מהחולים המטופלים בקו ראשון ועוד כ-20% מהמטופלים בקווים מתקדמים ב-TKI מפתחים עמידות לטיפול. רוב העמידויות נגרמות כתוצאה מהיווצרות מוטציות באתר הפעילות של הטירוזין קינאז. עד היום זוהו כ-70 מוטציות, כאשר רוב המוטציות מעוכבות על ידי ה-TKI מדור שני{{הערה|שם=הערה3|Apperley J. lancet 2007 (8) 1018-1027}}. מוטציה ייחודית מסוג T315I (החלפה של טריאונין באיזולאוצין באתר 315) היא עמידה לכל סוגי ה-TKI עד כה. ייחודו של [[t:Iclusig|Iclusig]]{{כ}} (Ponatinib - פונטיניב), שהוא ה-TKI הראשון המעכב מוטציה זו{{הערה|שם=הערה4|Cortes et al. N Engl J Med. 2013 7:369(191:1783-96.}}. | ||
| + | |||
| + | ==Iclusig{{כ}} (Ponatinib) בחולי CML== | ||
| − | |||
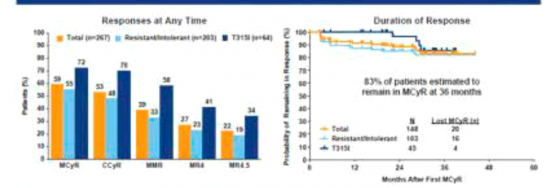
| − | + | [[קובץ:CML2.png|ממוזער|מרכז|550 פיקסלים|טבלה 2: יעילות Iclusig בחוליCML בעלי כרומוזום פילדלפיה{{ש}}Source: ASH proceedings, Cortes et al Blood 2014 (214) 21]] | |
| − | |||
| − | + | Iclusig פותחה באמצעים טכנולוגים מתקדמים במטרה להתגבר על מגוון המוטציות הידועות ב-BCR-ABL. מחקרי פאזה ראשונה ושנייה של Iclusig נערכו בחולים שעברו קווי טיפול רבים ובחלקם נשאי המוטציה העמידה. המחקרים פורסמו שניהם במגזין New England Journal of Medicine{{הערה|שם=הערה4}}. במחקרים נמצאו שיעורי תגובה והישרדות גבוהים, אף בהשוואה לתוצאות הטיפול כקווים מוקדמים יותר במחלה. | |
| − | + | מחקר ה-PACE{{כ}}{{הערה|שם=הערה4}}, מחקר הדגל של התרופה, נערך ב-499 חולים, מתוכם 270 חולי CML בשלב הכרוני, 85 בשלב המואץ ו-94 בשלב הבלסטי כולל חולי [[ALL|לוקמיה לימפואידית חריפה]] המלווה בהפרעה בכרומוזום פילדלפיה (Ph+ ALL{{כ}}, Philadelphia chromosome Acute Lymphoblastic Leukemia). {{כ}}128 חולים היו נשאים של המוטציה T315I. בעת הכניסה למחקר מעל 90% מהחולים נכשלו ב-2 קווי טיפול קודמים לפחות ו-52% מהחולים בשלב הכרוני נכשלו כבר ב-3 קווי טיפול קודמים. חלק ניכר מהחולים בשלב המואץ והבלסטי נכשלו גם הם בשלושה קווי טיפול קודמים. | |
| − | + | תגובה ציטוגנטית מג'ורית (Major cytogenetic response) הושגה ב-61% מהחולים שקיבלו Iclusig בקו שלישי וב-46% מהחולים בהם התרופה ניתנה כקו רביעי. תגובה ציטוגנטית מג'ורית הושגה ב-70% מהחולים נושאי המוטציה T315I. | |
| − | + | הזמן החציוני להשגת תגובה ציטוגנטית מג'ורית, המוגדרת כנסיגה של מעל 65% בכרומוזום פילדלפיה, היה מהיר ביותר ועמד על 2.8 חודשים בשלב הכרוני. במעקב חציוני של שנתיים שמרו 89% מהחולים על תגובה זו. תגובה מולקולרית מג'ורית (ירידה של מעל 3 לוגים בגן BCR-ABL) הושגה ב-34% מהמקרים של חולים בקווי טיפול מתקדמים והזמן החציוני להשגת התגובה היה 5.5 חודשים. גם בחולי CML בשלב המואץ ובשלב הבלסטי הושגו תגובות ראויות לציון. תגובות המטולוגיות הושגו ב-61% ו-31% מהחולים בהתאמה ונשמרו לאורך זמן. | |
| − | + | מעקב ארוך טווח של מחקר ה-PACE פורסם ב-ASH בשנת 2014{{כ}}{{הערה|שם=הערה5|Cortes et al Blood 2014(214) 21}}. במעקב חציוני של 34.8 חודשים, 83% מהחולים שמרו על תגובה ציטוגנטית וכן תגובה מולקולרית מג'ורית, עם ירידה של עד 4-5 לוגים ברמת ה-BCR-ABL בחלק מהחולים. | |
| − | + | מחקר שהשווה את יעילות הטיפול ב-Iclusig לעומת TKI אחרים מדור שני, בחולים שטופלו כבר בקו אחד או יותר של TKI מדור שני ופיתחו עמידות או אי סבילות, הראה ששיעור התגובה לטיפול ב-Iclusig היה כ-60% לעומת 22-26% בלבד ב-TKI האחרים. נתונים אלה תומכים בכך שחולה שטופל כבר ב-TKI מדור שני ונכשל על טיפול זה, הסיכוי שיגיב ל-Iclusig גבוה בהרבה לעומת הסיכוי לתגובה בטיפול עם TKI אחר מדור שני{{הערה|שם=הערה6|Upton et al, Leukemia Research 39 (2015) 58-64}}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | מינון התרופה שנבדק במחקר ה-PACE הוא 45 מ"ג (מיליגרם), אך גם במינונים התחלתיים של 30 מ"ג ו-15 מ"ג הושגה תגובה ציטוגנטית מג'ורית בשיעור דומה למינון הגבוה. | |
| − | + | {{ש}}בדומה ל-TKI מדור שני גם עם הטיפול ב-Iclusig נצפו תופעות לוואי בדרגות 3 ו-4 ובהן [[דלקת לבלב]] (Pancreatitis) בשיעור של 6% ו[[אנמיה]] ו[[טרומבוציטופניה|טרומבופניה]] (Thrombopenia) בשיעור של 2%. תופעות לוואי [[טרומבואמבוליזם|טרומבואמבוליות]] היו בשיעור גבוה יחסית (16%) והן נצפו במיוחד בחולים עם גורמי סיכון כגון [[יתר לחץ דם]], [[עישון]], [[סוכרת]], [[היפרליפידמיה|יתר שומנים בדם]] והיסטוריה של [[מחלות לב וכלי דם]]. | |
| − | + | {{ש}}לא נמצא הבדל בהישרדות הכוללת בין חולים שסבלו מתופעות לוואי טרומבואמבוליות לבין אלה שלא סבלו מתופעות אלו. נצפה קשר בין מינון התרופה לבין תופעות הלוואי. במרבית החולים שבהם מינון התרופה הורד עקב תופעות לוואי נשמרה התגובה לטיפול. עקב שיעור גבוה יחסית של תופעות לוואי טרומבואמבוליות קיימה המלצה לבצע סקירה מלאה של גורמי סיכון וסטטוס קרדיווסקולרי בחולים חדשים וכן לעקוב באופן הדוק אחר חולים המטופלים ב-Iclusig{{כ}}{{הערה|שם=הערה7|1=Iclusig" Summary of Product Characteristics, 2014, available at: www.old.health.gov.il/units/pharmacy/ t rufot/i n d ex. a sp? sa f a=h}} | |
| − | + | ||
| + | Iclusig רשומה בישראל בהתוויה לחולי CML בכל שלבי המחלה, שלהם עמידות או אי סבילות ל-Sprycel או Tasigna או שאינם יכולים להמשיך טיפול ב-Glivec, וכן לכל החולים שפתחו מוטציה מסוג T315I. התרופה רשומה גם לחולי Ph+ ALL עמידים או בעלי אי סבילות ל-Sprycel או בעלי מוטציה T315I. | ||
| − | + | Iclusig מאושרת על ידי רשות התרופות האירופאית (EMEA{{כ}}, European Medicines Agency) ורשות המזון והתרופות האמריקאית (FDA{{כ}}, Food and Drug Administration) לטיפול בחולי CML וחולי ALL עם כרומוזום פילדלפיה חיובי. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| שורה 74: | שורה 67: | ||
==קישורים חיצוניים== | ==קישורים חיצוניים== | ||
| + | |||
| + | {{ייחוס|ד"ר איתי לוי. מנהל המחלקה ההמטולוגית. המרכז הרפואי האוניברסיטאי סורוקה, באר שבע}} | ||
[[קטגוריה: המטולוגיה]] | [[קטגוריה: המטולוגיה]] | ||
גרסה אחרונה מ־09:27, 19 ביולי 2017
| פונטיניב לטיפול בלוקמיה מיאלואידית כרונית קשה לטיפול | ||
|---|---|---|
| Ponatinib for the treatment of Chronic Myeloid Leukemia | ||
| ||
| ICD-10 | Chapter C 92.1 | |
| ICD-9 | 205.1 | |
| MeSH | D015464 | |
| יוצר הערך | ד"ר איתי לוי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לוקמיה מיאלואידית כרונית
לוקמיה מיאלואידית כרונית (CML, Chronic Myelogenic Leukemia) מאופיינת בשגשוג לא מבוקר של תאי דם לבנים במח העצם ובדם הפריפרי. המחלה מתחילה כמחלה כרונית ובהיעדר טיפול מתאים היא מתקדמת תוך שלוש עד חמש שנים מהשלב הכרוני הראשוני, דרך שלב ביניים (שלב מואץ - Accelerated phase) לצורה של לוקמיה חריפה (שלב בלסטי). בשלבים המתקדמים נדרשים טיפולים אגרסיביים ובמרבית המקרים המחלה אינה ניתנת לריפוי[1].
המחלה מהווה כ-15-20% מכלל הלוקמיות במבוגרים. ההיארעות בישראל, בדומה לזו שבעולם, היא כ-1.6 חולים חדשים ל-100,000 איש בשנה. בישראל מאובחנים כל שנה כ-70 חולים וסך הכל יש מספר מצטבר של כ-700 חולי CML בארץ.
CML היא מחלה הנגרמת כתוצאה משינוי גנטי אופייני בתאי הדם. השינוי מתבטא בחילוף של חומר גנטי בין כרומוזום 9 עליו נמצא הגן ABL וכרומוזום 22 עליו נמצא הגן BCR. שינוי זה מכונה טרנסלוקציה (Translocation) 9:22. כתוצאה מכך נוצר כרומוזום בעל מבנה לא תקין עליו יושבים בסמיכות הגנים BCR-ABL (איור מספר 1).
כרומוזום זה נקרא כרומוזום פילדלפיה, על שם המדינה בארה"ב שבה התבצע המחקר שהביא לגילויו בשנת 1960. הגנים BCR/ABL המצויים כעת בסמיכות זה לזה מקודדים ליצירת חלבון בשם BCR-ABL, שהינו אנזים מסוג טירוזין קינאז (Tyrosine kinase). אנזים זה גורם לשפעול תהליכי גדילה לא מבוקרת של תאי דם לבנים, תהליך המביא בסופו להתפתחות הלוקמיה[2].
CML היא המחלה הממאירה הראשונה שבה פוענח הבסיס הגנטי הגורם להתפתחותה. דבר זה אפשר לראשונה פיתוח של טיפול ביולוגי החוסם ומדכא באופן ספציפי את פעילותו של האנזים הגורם להיווצרות המחלה. דהיינו, הטיפול ב-CML מבוסס על חסימת הפעילות הבלתי מבוקרת של האנזים מסוג טירוזין קינאז.
Glivec (Imatinib) היא התרופה הראשונה שפותחה ממשפחת התרופות מעכבות טירוזין קינאז (TKI, Tyrosine Kinase Inhibitor). התרופה מאושרת משנת 2001 לטיפול קו ראשון בחולי CML. כיום מאושרות לשימוש גם התרופות Tasigna (Nilotinib), Sprycel (Dasatinib) ו-Bosulif (Bosutinib), שהן תרופות מסוג TKI מדור שני. ייחודן של התרופות מדור שני שהן יעילות בחולים המפתחים עמידות לטיפול עקב התפתחות מוטציות באתר הטירוזין קינאז. לכל אחת מהתרופות פרופיל יעילות כנגד מוטציות אחרות וניתן להתאים את הטיפול בהתאם לסוג המוטציות שמתפתחות. יתרון נוסף של קבוצת התרופות TKI מדור שני הוא שניתן להשיג באמצעותן תגובה מהירה יותר בדיכוי המחלה ביחס ל-Glivec[1].
על אף ההתקדמות הניכרת בטיפול ב-CML, הרי שכ-20% מהחולים המטופלים בקו ראשון ועוד כ-20% מהמטופלים בקווים מתקדמים ב-TKI מפתחים עמידות לטיפול. רוב העמידויות נגרמות כתוצאה מהיווצרות מוטציות באתר הפעילות של הטירוזין קינאז. עד היום זוהו כ-70 מוטציות, כאשר רוב המוטציות מעוכבות על ידי ה-TKI מדור שני[3]. מוטציה ייחודית מסוג T315I (החלפה של טריאונין באיזולאוצין באתר 315) היא עמידה לכל סוגי ה-TKI עד כה. ייחודו של Iclusig (Ponatinib - פונטיניב), שהוא ה-TKI הראשון המעכב מוטציה זו[4].
Iclusig (Ponatinib) בחולי CML
Iclusig פותחה באמצעים טכנולוגים מתקדמים במטרה להתגבר על מגוון המוטציות הידועות ב-BCR-ABL. מחקרי פאזה ראשונה ושנייה של Iclusig נערכו בחולים שעברו קווי טיפול רבים ובחלקם נשאי המוטציה העמידה. המחקרים פורסמו שניהם במגזין New England Journal of Medicine[4]. במחקרים נמצאו שיעורי תגובה והישרדות גבוהים, אף בהשוואה לתוצאות הטיפול כקווים מוקדמים יותר במחלה.
מחקר ה-PACE[4], מחקר הדגל של התרופה, נערך ב-499 חולים, מתוכם 270 חולי CML בשלב הכרוני, 85 בשלב המואץ ו-94 בשלב הבלסטי כולל חולי לוקמיה לימפואידית חריפה המלווה בהפרעה בכרומוזום פילדלפיה (Ph+ ALL, Philadelphia chromosome Acute Lymphoblastic Leukemia). 128 חולים היו נשאים של המוטציה T315I. בעת הכניסה למחקר מעל 90% מהחולים נכשלו ב-2 קווי טיפול קודמים לפחות ו-52% מהחולים בשלב הכרוני נכשלו כבר ב-3 קווי טיפול קודמים. חלק ניכר מהחולים בשלב המואץ והבלסטי נכשלו גם הם בשלושה קווי טיפול קודמים.
תגובה ציטוגנטית מג'ורית (Major cytogenetic response) הושגה ב-61% מהחולים שקיבלו Iclusig בקו שלישי וב-46% מהחולים בהם התרופה ניתנה כקו רביעי. תגובה ציטוגנטית מג'ורית הושגה ב-70% מהחולים נושאי המוטציה T315I.
הזמן החציוני להשגת תגובה ציטוגנטית מג'ורית, המוגדרת כנסיגה של מעל 65% בכרומוזום פילדלפיה, היה מהיר ביותר ועמד על 2.8 חודשים בשלב הכרוני. במעקב חציוני של שנתיים שמרו 89% מהחולים על תגובה זו. תגובה מולקולרית מג'ורית (ירידה של מעל 3 לוגים בגן BCR-ABL) הושגה ב-34% מהמקרים של חולים בקווי טיפול מתקדמים והזמן החציוני להשגת התגובה היה 5.5 חודשים. גם בחולי CML בשלב המואץ ובשלב הבלסטי הושגו תגובות ראויות לציון. תגובות המטולוגיות הושגו ב-61% ו-31% מהחולים בהתאמה ונשמרו לאורך זמן.
מעקב ארוך טווח של מחקר ה-PACE פורסם ב-ASH בשנת 2014[5]. במעקב חציוני של 34.8 חודשים, 83% מהחולים שמרו על תגובה ציטוגנטית וכן תגובה מולקולרית מג'ורית, עם ירידה של עד 4-5 לוגים ברמת ה-BCR-ABL בחלק מהחולים.
מחקר שהשווה את יעילות הטיפול ב-Iclusig לעומת TKI אחרים מדור שני, בחולים שטופלו כבר בקו אחד או יותר של TKI מדור שני ופיתחו עמידות או אי סבילות, הראה ששיעור התגובה לטיפול ב-Iclusig היה כ-60% לעומת 22-26% בלבד ב-TKI האחרים. נתונים אלה תומכים בכך שחולה שטופל כבר ב-TKI מדור שני ונכשל על טיפול זה, הסיכוי שיגיב ל-Iclusig גבוה בהרבה לעומת הסיכוי לתגובה בטיפול עם TKI אחר מדור שני[6].
מינון התרופה שנבדק במחקר ה-PACE הוא 45 מ"ג (מיליגרם), אך גם במינונים התחלתיים של 30 מ"ג ו-15 מ"ג הושגה תגובה ציטוגנטית מג'ורית בשיעור דומה למינון הגבוה.
בדומה ל-TKI מדור שני גם עם הטיפול ב-Iclusig נצפו תופעות לוואי בדרגות 3 ו-4 ובהן דלקת לבלב (Pancreatitis) בשיעור של 6% ואנמיה וטרומבופניה (Thrombopenia) בשיעור של 2%. תופעות לוואי טרומבואמבוליות היו בשיעור גבוה יחסית (16%) והן נצפו במיוחד בחולים עם גורמי סיכון כגון יתר לחץ דם, עישון, סוכרת, יתר שומנים בדם והיסטוריה של מחלות לב וכלי דם.
לא נמצא הבדל בהישרדות הכוללת בין חולים שסבלו מתופעות לוואי טרומבואמבוליות לבין אלה שלא סבלו מתופעות אלו. נצפה קשר בין מינון התרופה לבין תופעות הלוואי. במרבית החולים שבהם מינון התרופה הורד עקב תופעות לוואי נשמרה התגובה לטיפול. עקב שיעור גבוה יחסית של תופעות לוואי טרומבואמבוליות קיימה המלצה לבצע סקירה מלאה של גורמי סיכון וסטטוס קרדיווסקולרי בחולים חדשים וכן לעקוב באופן הדוק אחר חולים המטופלים ב-Iclusig[7]
Iclusig רשומה בישראל בהתוויה לחולי CML בכל שלבי המחלה, שלהם עמידות או אי סבילות ל-Sprycel או Tasigna או שאינם יכולים להמשיך טיפול ב-Glivec, וכן לכל החולים שפתחו מוטציה מסוג T315I. התרופה רשומה גם לחולי Ph+ ALL עמידים או בעלי אי סבילות ל-Sprycel או בעלי מוטציה T315I.
Iclusig מאושרת על ידי רשות התרופות האירופאית (EMEA, European Medicines Agency) ורשות המזון והתרופות האמריקאית (FDA, Food and Drug Administration) לטיפול בחולי CML וחולי ALL עם כרומוזום פילדלפיה חיובי.
ביבליוגרפיה
- ↑ 1.0 1.1 Baccarani et al Blood. 2013 Aug 8:122(6)1872-84
- ↑ Nowell P. The lournal of Clinical Investigation 2007: 117(8)2033-2035
- ↑ Apperley J. lancet 2007 (8) 1018-1027
- ↑ 4.0 4.1 4.2 Cortes et al. N Engl J Med. 2013 7:369(191:1783-96.
- ↑ Cortes et al Blood 2014(214) 21
- ↑ Upton et al, Leukemia Research 39 (2015) 58-64
- ↑ Iclusig" Summary of Product Characteristics, 2014, available at: www.old.health.gov.il/units/pharmacy/ t rufot/i n d ex. a sp? sa f a=h
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר איתי לוי. מנהל המחלקה ההמטולוגית. המרכז הרפואי האוניברסיטאי סורוקה, באר שבע


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק