הבדלים בין גרסאות בדף "אוסטאופונטין - Osteopontin"
| שורה 112: | שורה 112: | ||
==OPN כסמן לאבחנה מבדלת בין סרטן הלבלב לבין פנקרטיטיס כרונית== | ==OPN כסמן לאבחנה מבדלת בין סרטן הלבלב לבין פנקרטיטיס כרונית== | ||
| − | Rychlíaková וחב' ב-Cancer Biomarkers משנת 2016, מדדו את ריכוזי OPN במטופלים עם pancreatic ductal adenocarcinoma (להלן PDAC), כדי להחליט האם רמת OPN שימושית להבדיל בין תרחיש של PDAC לבין פנקראטיטיס כרונית וסוכרת type 2, וכן לברר האם ריכוזי OPN קשורים לשלב של PDAC. בניסוי השתתפו 64 מאובחנים עם PDAC, 71 מאובחנים עם פנקראטיטיס כרונית ו-48 אנשים בריאים כביקורת. תוצאות הניסוי היו כדלקמן: רמות OPN היו גבוהות יותר בחולים עם PDAC בהשוואה לאלה עם פנקראטיטיס כרונית (p<0.001), ולאלה עם סוכרת type 2 (p<0.001), כמו גם בהשוואה לנבדקים הבריאים (p<0.001). בחולים עם PDAC ב-stage IV, נמצאו | + | Rychlíaková וחב' ב-Cancer Biomarkers משנת 2016, מדדו את ריכוזי OPN במטופלים עם pancreatic ductal adenocarcinoma (להלן PDAC), כדי להחליט האם רמת OPN שימושית להבדיל בין תרחיש של PDAC לבין פנקראטיטיס כרונית וסוכרת type 2, וכן לברר האם ריכוזי OPN קשורים לשלב של PDAC. בניסוי השתתפו 64 מאובחנים עם PDAC, {{כ}}71 מאובחנים עם פנקראטיטיס כרונית ו-48 אנשים בריאים כביקורת. תוצאות הניסוי היו כדלקמן: רמות OPN היו גבוהות יותר בחולים עם PDAC בהשוואה לאלה עם פנקראטיטיס כרונית (p<0.001), ולאלה עם סוכרת type 2{{כ}} (p<0.001), כמו גם בהשוואה לנבדקים הבריאים (p<0.001). בחולים עם PDAC ב-stage IV, נמצאו רמות OPN גבוהות יותר מאשר באלה עם מחלה ב-grade III{{כ}} (p<0.01). לא היו הבדלים ברמות OPN בין PDAC בדרגה III לבין מחלה בדרגה II. תוצאות הניסוי קבעו שרמות OPN מעל 102 ננוגרם/מ"ל הן בעלות פוטנציאל אבחוני של סרטן בלוטת הלבלב. |
==רמות OPN בפלזמה ותוצאים קרדיו-וסקולריים בלתי רצויים (Abdairhim וחב' ב-PLos One משנת 2016)== | ==רמות OPN בפלזמה ותוצאים קרדיו-וסקולריים בלתי רצויים (Abdairhim וחב' ב-PLos One משנת 2016)== | ||
גרסה מ־14:25, 28 בספטמבר 2018
| מדריך בדיקות מעבדה | |
| אוסטאופונטין | |
|---|---|
| Osteopontin | |
| שמות אחרים | bone sialoprotein-1 או BSP-1 וכן BNSP. כינויים נוספים הם early T-lymphocyte activator או ETA-1, ו-SPP1 או secreted phosphoprtein-1. כינוי נוסף הוא 44K BPP או bone phosphoprotein עם משקל מולקולרי של 44 קילו דלטון. |
| מעבדה | כימיה בדם |
| תחום | מדד למגוון מצבים פתולוגיים |
| טווח ערכים תקין | מתחת ל-25 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
תכונות פיזיקליות של החלבון osteopontin
Osteopontin (להלן OPN) הוא חלבון חומצי המכיל את התלת-פפטיד RGD או arginine-lysine-aspatate, והוא חבר במשפחת החלבונים הידועה כ-SIBLING או small integrin-binding ligand N-linked glycoproteins. חלבונים נוספים של משפחת SIBLING הם bone sialoprotein, וכן dentin matrix protein-I, כמו גם dentin sialophosphoprotein-1 ו-matrix extracellular phosphoglycoproein (על פי Fisher וחב' ב-Biochem Biophys Res Commun משנת 2001). גילויו של OPN התרחש בשנת 1986 כאשר התגלה באוסטאובלסטים על ידי Oldberg וחב' שדווחו על ממצאם זה באותה שנה ב-Proc Natl Acad Sci USA. הוא תואר על ידם כסיאלו-פרוטאין עיקרי של העצם, והוגדר כ-matrix protein בעל פוטנציאל גישור בין תאי עצם ו-hydroxyapatite. השם osteo-pontin מבטא את המלים "עצם" ו-pons שבלטינית פירושו גשר.
הכינוי האחר של OPN כ-secreted phosphoprotein-1 מבוסס על הזיהוי המוקדם שלו כפוספו-פרוטאין המופרש על ידי תאים בתרבית (Craig וחב' ב-Int J Cancer משנת 1990). החלבון OPN מיוצר במגוון של רקמות כגון תאי מח עצם, תאי שריר חלק (Mirza וחב' ב-Int J Cancer משנת 2008), מיובלסטים של שריר השלד, המוח, הכבד, מערכת העיכול, הריאות, העצם, פיברובלסטים של הלב (He וחב' ב-Oncogene משנת 2006), תאי האוזן הפנימית, השלייה, הכליות והפרקים, אוסטאוציטים וכונדרוציטים, וכן הוא מופיע בנוזלים ביולוגיים כדם, שתן, חלב ונוזל זרע (Denhardt ו-Noda ב-J Cell Biochem משנת 1998, ו-Sodek וחב' ב-Crit Rev Oral Biol Med משנת 2000). בנוסף, בגלל תפקידו כציטוקין המיוצר על ידי לימפוציטים ומקרופאגים משופעלים, וכן על ידי דנדריטים, יש התייחסות ל-OPN כאל early T-cell activation factor-1 (או Eta-1) על פי Patarca וחב' ב-J Exp Med משנת 1989). כמו כן מיוצר OPN על ידי תאים אנדותליאלים ואפיתליאלים (Giacelli וחב ב-Ann NY Acad Sci משננת 1995, ו-Weber ו-Cantor ב-Cytokine Growth Factor Rev משנת 1996).
החלבון OPN מורכב מ-314 שיירים של חומצות אמינו באדם, והוא מכיל כ-30 שיירי קרבוהידרטים, מתוכם 10 שיירי חומצה סיאלית, המחוברים לשלד הפפטידי של OPN בשלב ה-post-translational modification המתרחש ב-Golgi apparatus. ה-OPN עשיר בשיירי חומצות אמינו חומציות, ו-30-36% מחומצות האמינו שלו הן חומצה אספרטית או גלוטמית, מה שהופך אותו לחלבון בעל מטען חשמלי שלילי חזק (Hullinger וחב' ב-Exp Cell Res משנת 2001). בשלב המוקדם המתפתח של סינתזת OPN משקלו המולקולרי 33,000 דלטון, אך לאחר התוספת של שיירי הסוכר ב-Golgi, משקלו המולקולרי מגיע ל-44,000 דלטון. כתוצאה מהבדלים ב-post-translational modification בריאקציות כפוספורילציה, גליקוזילציה, סולפציה ופרוטאוליזה ממקורות תאיים שונים, המשקל המולקולרי של OPN יכול להיות בין 41–75 קילו-דלטון, באופן שבתאים שונים מבנהו ותפקודו יכולים להיות שונים (Christensen וחב' ב-J Biol Chem משנת 2007, וכן ב-Biochem J משנת 2005).
החלבון OPN מקודד על ידי הגן SPP1, הממוקם על הזרוע הארוכה של כרומוזום 4 באתר 4q21-4q25 ואורכו kilobase 5. שישה מתוך 7 האֶקסונים של הגן, אֶקסונים 2–7, מכילים רצפים מקודדים בגודל של 954bp, ואילו אקסון 1 אינו ניתן לתרגום (Wang ו-Denhardt ב-Cytokine Growth Factor Review משנת 2008, ו-Rangaswami וחב' ב-Trends Cell Biol משנת 2006). האקסון הראשון מכיל את האזור הבלתי ניתן לתרגום ( UTR '5) על פי Young וחב' ב-Genomics משנת 1990). אקסונים 2, 3, 4, 5, 6, ו-7 מקודדים בהתאמה ל-17, 13, 27, 14, 108 ו-114 חומצות אמינו, בהתאמה.
איזופורמים של OPN
OPN באורך מלא יכול לעבור שינויים על ידי ביקוע המתבצע על ידי האנזים תרומבין, וכך נחשף האפיטופ הקריפטי SVVYGLR בצורה המבוקעת של החלבון המוגדרת כ-OPN-R. צורת OPN מבוקעת זו חושפת אפיטופ לקולטני אינטגרין α4β1, α9β1 ו-α9β4 (Kiefer וחב' ב-Nucleic Acids Res משנת 1989, ו-Crosby וחב' ב-Genomics משנת 1995). קולטנים אלה של אינטגרינים מופיעים על פני מספר תאי חיסון כגון תאי פיטום (mast cells) (Laffón וחב' ב-J Clin Invest משנת 1991), ניטרופילים (Seiffge ב-J Rheumatol משנת 1996) ותאי T, וכן על ידי מונוציטים ומקרופאגים ( Reinholt וחב' ב-Proc Natl Acad Sci משנת 1990). קישור זה לקולטנים הללו מביאים לתגובות תאי החיסון. OPN-R יכול לעבור ביקוע נוסף על ידי האנזים carboxypeptidase B (להלן CPB) על ידי הרחקת שייר ארגינין מהקצה ה-C טרמינלי, ולהפוך ל-OPN-L (תרשים למטה):

תכונות ביולוגיות של OPN
רגולציה של הגן המקודד ל-OPN שונה בתאים שונים. ברקמת עצם רגולציה זו נשלטת על ידי אוסטאובלסטים ואוסטאוציטים, אך גם על ידי אוסטאוקלסטים (Ikeda וחב' ב-J Clin Invest משנת 1993). גורמי השעתוק Runx2 ו-osterix (או Osx) נדרשים לביטוי של OPN (Uaesoontrachoon וחב' ב-Int J Biochem Cell Biol משנת 2008). Runx2 ו-Osx קושרים promoters של גנים ספציפיים של אוסטאובלסטים כגון Col1α1, Bsp ו-Opn ועל ידי כך הם משדרגים את השעתוק של Runx2 ושל Osx (Merry וחב' ב-J Cell Sci משנת 1993).
היפוקלצמיה והיפו-פוספטמיה הגורמים לאבוביות הכליה לייצר dihydroxy-vitamin D3-1,25, גורמים אף הם להגברת השעתוק של OPN, לתרגומו ולהפרשתו (Nakashima וחב' ב-משנת 2002). זאת הודות לנוכחות של VDRE או high-specificity vitamin D response element ב-promoter של הגן המקודד ל-OPN (Ducy וחב' ב-Cell משנת 1997, Yucha ו-Guthrie ב-Nephrol Nurs J משנת 2003 ו-Prince ו-Butler ב-Coll Relat Res משנת 1987). גם פוספאט אנאורגני חוץ-תאי (ePi) זוהה כמאפנן (modulator) של ביטוי OPN (Oldberg וחב' ב-J Cell Biol משנת 1989). הגירוי לביטוי OPN מתרחש גם בחשיפת התאים לציטוקינים מעודדי-דלקת (Chang ו-Prince ב-Cancer Res משנת 1991), כגון TNFα, IL-1β, angiotensin II, TGFβ, וההורמון PTH (Fatherazi וחב' ב-J Dent Res משנת 2009, ו-Guo וחב' ב-J Immunol משנת 2001). היפרגליקמיה והיפוקסיה אף הם מגבירים את הביטוי של OPN (Recardo וחב' ב-Am J Physiol Renal Physiol משנת 2000, ו-Noda ו-Rodan ב-J Cell Biol משנת 1989).
ל-OPN יש תפקיד מרכזי במספר תהליכים פיזיולוגיים נורמליים, כולל עיצוב מחדש של העצם, וויסות התגובה החיסונית, דלקת וכן וסקולריזציה (Denhardt ו-Guo ב-FASEB J משנת 1995, ו-Cho וחב' ב-Curr Atherosclr Rep משנת 2009). אך חשוב בעיקר תפקידו של OPN בקרצינוגנזה (Coppola וחב' ב-Clin Cancer Res משנת 2004, Rittling ו-Cambers ב-Br J Cancer משנת 2004, ו-El-Tanani וחב' ב-Cytokine Growth Factor Rev משנת 2004). החלבון OPN כרוך במספר תפקודים ביולוגיים על ידי האינטראקציה עם מספר אינטגרינים וכן עם CD44. שני רצפים קריטיים במולקולת OPN לקישור עם אינטגרינים זוהו: האחד הוא הרצף RGD והאחר הוא הרצף SVVYGLR המורכב מחומצות האמינו serine-valine-valine-tyrosine-glutamate-leucine-arginine. הקולטנים של integrin המועדפים על ידי OPN הם αvβ3, αvβ1 ו-αvβ5, דרך הרצף הקלאסי RGD, או התקשרות לקולטנים,α9β1 α4β1 ו-α4β7 דרך הרצף SVVYGLR (על פי Smith וחב' ב-J Biol Chem משנת 1996, Yokosaka וחב' ב-J Biol Chem משנת 1999, ו-Scatena וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2007).
תפקידים ביולוגיים של OPN
תפקיד בביו-מינרליזציה: OPN הוא בעל מספר גדול של אתרי-רצף קונצנזוס לפוספורילציה post-translational של שיירי serine ליצירת פוספו-סרין, המעניק מטען שלילי נוסף למולקולה (Sodhi וחב' ב-Am J Physiol Renal Physiol משנת 2001). זוהו רצפים עוקבים בעלי מטען חשמלי שלילי ב-OPN ונקראו polyAsp motif וכן ASARM motif (או acidic serine- and asparate-rich motif), כאשר הרצף האחרון מכיל אתרי פוספורילציה רבים ( David וחב' ב- Am J Physiol Renal Physiol משנת 2011, ו-Martin וחב' ב-Endocrinology משנת 2008). המטען החשמלי השלילי הכולל של OPN, ביחד עם ה-motifs החומציים הספציפיים, וכן העובדה ש-OPN הוא באופן מוּבנֶה חלבון "בלתי סדיר", מאפשרים לחלבון זה מבנים "פתוחים" וגמישים, ואת היכולת להיקשר חזק ליוני סידן המצויים בשפע בביו-מינרלים רבים (Addison וחב' ב-J Bone Miner Res מהשנים 2008 ו-2010, Kurzbach וחב' ב-Biochemistry משנת 2013 ו-Kalmar וחב' ב-Bone משנת 2012).
קישור זה של OPN לסוגי המינרלים השונים המבוססים על סידן, כגון המינרל calcium-phosphate בעצמות ובשיניים (Azzopardi וחב' ב-PLos One משנת 2010), המינרל calcium-carbonate ב-otoconia של האוזן הפנימית (Hunter וחב' ב-Langmuir משנת 2010, ו-Takemura וחב' ב-Hear Res משנת 1994), והמינרל calcium-oxalate באבני הכליות (McKee וחב' ב-Bone Miner Res J משנת 1995), פועל כמעכב מינרליזציה ומווסת של צמיחת גבישים (O'Young וחב' ב- Cells Tissues Organsמשנת 2009).
תפקיד OPN ב-remoling של העצם
ל-OPN מייחסים תפקיד של גורם ב-remodeling של העצם (Steitz וחב' ב-Am J Pathol משנת 2002). באופן ספציפי, המחקר מציע ש-OPN משתתף בעיגון של אוסטאוקלסטים למשתית המינרלית של העצם. החלק האורגני של העצם מהווה בערך 20% מהמשקל היבש שלה, ובנוסף ל-OPN מורכב המשקל היבש הזה מקולאגן type I, מ-osteocalcin, מ-osteonectin, מסיאלו-פרוטאין של העצם, ומהאנזים alkaline phosphatase. מתוך כל המרכיבים הללו, קולאגן-type I מהווה כ-90% ממסת החלבון של העצם. החלק האנאורגני של העצם מורכב מהמינרל hydroxyapatite, שמבנהו Ca10(PO4)6(OH)2. אובדן של מינרל זה עלול לגרום לאוסטאופורוזיס, שכן העצם חסרה סידן, אלא אם כן יש אספקה של סידן במזון או בצורת תוספים.
OPN הוא חלבון המשמש מצע למספר אנזימים שפעילותם עשויים להשפיע מודולטיבית על תפקודו של OPN בעיכוב מינרליזציה. אחד מהאנזימים הללו הוא PHEX או phosphate-regulating gene with homologies to endopeptidases on X chromosome. אכן PHEX גורם לפירוק של OPN, אך מוטציה ב-PHEX המופיעה ב-X-linked hypophosphatemia (או XLH), אחראית לעיבוד שונה של OPN, באופן שחלבון זה אינו מתפרק ומצטבר ב-ECM של העצמות והשיניים, מה שעלול לגרום ל-osteomalcia האופיינית ל-XLH (על פי Chien וחב' ב-J Biol Chem משנת 2009, Sodek וחב' ב-Crit Rev Oral Biol Med משנת 2000, ו-McKee וחב' ב-Periodontology משנת 2013).
בנוסף לתפקידו בוויסות מינרליזציה נורמלית בתוך ה-ECM של עצמות ושיניים (Boukpessi וחב' ב-Bone משנת 2017), נמצא ש-OPN מוגבר באתרים בהם מתרחשת הסתיידות אקטופית פתולוגית כגון בתרחישי urolithiasis או הסתיידות כלי-דם, כנראה לפחות בחלקו כדי למנוע מינרליזציה הפוגעת ברקמות רכות אלו (Barros וחב' ב-J Bone Miner Res משנת 2013, McKee וחב' ב- Cells Tissues Organs משנת 2005, ו-Steitz וחב' ב-Am J Pathol משנת 2002).
OPN ושפעול תאי חיסון
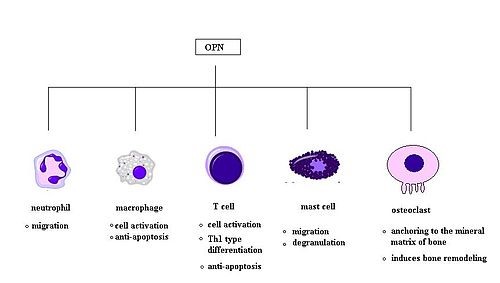
תאי T משופעלים נעזרים על ידי הציטוקינים IL-12 ו-Int-γ על מנת להתמיין לקראת הפיכתם לתאי Th1. ידוע ש-OPN מעכב את יצירת הציטוקין IL-10 המיוצר בתאי Th2, מה שמגביר את תגובת Th1. נראה ש-OPN משפיע על החסינות התאית בהיותו כולל תפקודים של ציטוקינים שמקורם ב-Th1. ידוע ש-OPN מעודד יצירת אימונוגלובולינים על ידי תאי B, ואף מעודד שגשוג של תאי B. מחקר משנת 2008 מרמז לכך ש-OPN גם משרה דה-גרנולציה של תאי-פיטום. אותו מחקר הראה ש-anaphylaxis המתווך על ידי IgE, נחלש משמעותית בעכברי knock-out משוללי OPN בהשוואה לעכברי-בר. תפקידו של OPN בשפעול של מקרופאגים נתמך על ידי ממצאי מחקר בו התגלה שגידולים סרטניים המייצרים OPN, היו מסוגלים לשפעל מקרופאגים בהשוואה לגידולים החסרים OPN (על פי Nagasaka וחב' ב-Eur J Immunol משנת 2008).
OPN וכמוטקסיס
ל-OPN תפקיד מרכזי בגיוס של ניטרופילים במחלת כבד אלכוהולית (Choi וחב' ב-Rheumatology משנת 2008), ונמצא ש-OPN גם מביא לנדידת ניטרופילים in vitro (Singh וחב' ב-Life Sci משנת 2014). בנוסף, OPN מגייס תאי דלקת למפרקים נגועים ב-arthritis במודלים של RA (Apte וחב' ב-Toxicol Appl Pharmacol משנת 2005, El Deeb וחב' ב- J Clin Exp Res Hip Pathol Ther משנת 2006 ו-Koh וחב' ב-Immunology משנת 2007). מחקר עדכני משנת 2008 של Ohshima וחב' ב-Arthritis Rheumatol מצא ש-OPN הוא בעל תפקיד מרכזי בנדידת תאי פיטום. בניסוי זה תאי פיטום נטולי OPN נזרעו בתרבית, ונמצא שיש להם דרגה נמוכה של כמוטקסיס בהשוואה לתאי פיטום wildtype. OPN נמצא גם כגורם כמוטקטי במקרופאגים (Sakata וחב' ב-J Rheumatol משנת 2001). במחקר זה נבחנה ההצטברות של מקרופאגים במוחות של קופי Rhesus, ונמצא ש-OPN מנע מתאים אלה עזיבה של אתרי הצטברותו במוח, מה שמעיד על רמת כמוטקסיס גבוהה.
וריאנטים של OPN
נראה שהווריאנט התוך-תאי של OPN (להלן iOPN), קשור במספר תהליכים תאיים כגון נדידה, איחוי ותנועתיות (Banerjee וחב' ב-J Pathol משנת 2006, Sodek וחב' ב-J Dent משנת 2006, Zohar וחב' ב-J Cell Physiol משנת 2000, ו-Suzuki וחב' ב-J Bone Miner Res משנת 2002). מחקרם של Zhu וחב' ב-J Cell Physiol משנת 2004, הראה ש-iOPN נוצר תוך שימוש באתר התחלתי לתרגום חלופי, על אותו species של RNA המשמש ליצירת האיזופורם החוץ-תאי של OPN.
סוגים שונים של סרטן באדם כולל סרטן השד, נמצאו מבטאים splice variants של OPN (על פי Junaid וחב' ב-Am J Physiol Cell Physiol משנת 2007, ו-Shinohara וחב' ב-Proc Natl Acad Sci USA משנת 2008). ה-splice variants הספציפיים לסרטן הם OPN-a, OPN-b ו-OPN-c. אקסון-5 חסר ב-OPN-b ולעומת זאת OPN-c חסר את אקסון-4, וההשערה היא ש-OPN-c מסייע לפנוטיפ שאינו תלוי בעיגון למשתית החוץ-תאית (ECM) של מספר סוגי סרטן שד, שחודרנותם מסתייעת על ידי אי היכולת ליצור אינטראקציה עם ה-ECM.
OPN ואפופטוזיס
OPN הוא גורם אנטי-אפופטוטי חשוב, והוא פועל בחסימה של מות התאים המתוכנת במקרופאגים ובתאי T כמו גם בפיברובלסטים ותאי אנדותל הנחשפים לגירויים מזיקים (Burdo וחב' ב-J Leukoc Biol משנת 2007, ו-Crawford וחב' ב-cancer Res משנת 1998).
תפקיד OPN באלרגיה ובאסתמה
OPN נכרך עם דלקת אלרגית ואסתמה, ונמצא שהביטוי של OPN גדל משמעותית בתאים אפיתליאליים ותת-אפיתליאליים בריאות של חולי אסתמה, בהשוואה לאנשים בריאים (Mishima וחב' ב-J Clin Gastroenterol משנת 2007). הצורה המופרשת של OPN (להלן OPN-s) משחקת תפקיד מעודד-דלקת בעת הריגוש של האלרגן, שכן הנטרול של OPN-s מביא לצורה מתונה בהרבה של דלקת אלרגית של דרכי האוויר. השפעה זו של OPN-s מתאפשרת בעיקר על ידי הוויסות של תאים דנדריטיים המדכאים פעילות תאי Th-2. חסר של OPN גם נמצא מגן בפני תגובה חזקה של רקמת הסמפונות (Kourepini וחב' ב-Proc Natl Acad Sci USA משנת 2014). יתרה מזו, הודגם שביטוי OPN מתחזק בתרחישי אסתמה באדם, בהתאם לחומרת ההתקף (Xanthou וחב' ב-Nat Med משנת 2007). נמצאה גם כמות מוגברת של OPN בכִּיחַ של מעשנים אסתמטיים (Simoes וחב' ב-Am J Respir Crit Care Med משנת 2009, כמו גם ברקמות הברוכניאליות של חולי אסתמה ואף של מעשנים ללא אסתמה (Samitas וחב' ב-Eur Respir J משנת 2010).
התפקיד של OPN ב-colitis
OPN משודרג במחלה דלקתית של המעי (IBD) (Steinman ב-Nat Med משנת 2007). כמו כן הביטוי של OPN מוגבר מאוד בתאים חיסוניים ולא-חיסוניים במעי, ולכן מוצאים אותו מוגבר בפלזמה של חולים עם מחלת Crohn וכן באלה עם ulcerative colitis (Gassler וחב' ב-Scand J Gastroenterol משנת 2002). רמות מוגברות של OPN בפלזמה מיוחסות לחומרה של המצב הדלקתי ב-Crohn. ל-OPN יש גם תפקיד מעודד דלקת בתרחישי colitis מושרים על ידי TNBS (או (trinitrobenzenesulfonic acid או על ידי DSS (או (dextran sulfate sodium, שהם המודלים בעכברים ל-IBD. נמצא ש-OPN מבוטא במידה רבה על ידי תת-קבוצה של תאים דנדריטים שמקורם בקשרי לימפה מזנטריים במכרסמים, והוא גורם ל-colitis באופן המסתייע בתהליך הדלקתי ( Satoוחב' ב-Gut משנת 2005). תאים דנדריטים חשובים להתפתחות דלקות מעי באדם. נמצא כמו כן ש-OPN מונע מות תאים לא-מתוכנת ב-colitis דלקתית (Denhardt ב-J Clin Invest משנת 2001).
OPN כסמן למצבי ממאירות
המנגנון על פיו OPN מעודד התפתחות גידולים ובעיקר גרורות, עדיין אינו ברור. OPN מעודד את הנדידה של סוגי תאים רבים על ידי האינטראקציה שלו עם integrins, והיכולת של תאים סרטניים לנדוד כרוכה בפעילות integrins. השפעות אחרות של OPN על תאי סרטן הולכות ומתגלות, כמו היכולת של OPN לשדרג את פעילות האנזים hyaluronic acid synthase, העשוי לתרום להישרדותם של תאים גם בהיעדר יכולת היספחות לתאים אחרים, שהיא אחת התכונות החשובות של תאים גרורתיים (Cook וחב' ב-J Biol Chem משנת 2006). ממצא זה יכול להבהיר את יכולתו של OPN לעודד נדידת תאים סרטניים במצע של אגר רך, שהיא התכונה in vitro המיוחסת לטומורוגניות (Wu וחב' ב-Br J Cancer משנת 2000). גם Tuck וחב' ב-J Cell Biochem משנת 2007, מדגישים שהיכולת של OPN להגיב עם גורמים רבים כולל קולטנים על פני תאים, כ-CD44 ו-integrins, כמו גם עם פרוטאזות המופרשות מתאים כמו MMPs ו-urokinase plasminogen activator, וכן עם גורמי גדילה כגון TGFα/EGFR ו-HGF/Met חיוניים לפעילות OPN בממאירות. אינטראקציות אלה עם גורמים מאותתים בתאים יכולים להשפיע על התבטאות גנים, המביאים לשינויים בתכונות תאים הקשורות לממאירות כמו כיכולת הספיחה של תאים, יכולת הנדידה שלהם, הישרדות תאים, אנגיוגניות של תאים סרטניים, וגרורתיות.
התפקיד של OPN בקרצינומה של תאי כבד (HCC)
סרטן הכבד, או hepatocellular carcinoma (להלן HCC) הוא הסרטן השלישי במעלה בין סוגי הסרטן הגורמים למוות בעולם כולו, והא אחד מסוגי הסרטן השכיחים ביותר באסיה, עם שיעור הישרדות ל-5 שנים של 4-6% במדינות שונות, למרות נטייה לשיפור בתחום זה (Tang וחב' ב-J Cancer Res Clin Oncol משנת 2004). גורמי סיכון ל-HCC כוללים הדבקה בנגיף הפטיטיס B והפטיטיס C, שחמת אלכוהולית, כמו גם חשיפה לקרציוגנים סביבתיים כ-alflatoxin (על פי El Serag ו-Mason ב-N Eng J Med משנת 1999), הביטוי החזק של OPN בממאירויות רבות הן ברקמות הסרטניות כמו גם בפלזמה, נכרך עם פרוגנוזה גרועה יותר בסוגי סרטן רבים, וכך גם ב-HCC (על פי Rittling ו-Chambers ב-Br J Cancer משנת 2004).
הזיהוי של OPN כסמן חדש לגילוי hepatocellular carcinoma
מחקר רב-מוסדי שכלל חוקרים מ-Seattle, Lyon, קולוראדו, Ann Arbor ו-Bangkok, של Shang וחב' ב- Hepatology משנת 2012, נערך כדי לזהות סמן שיכול לשפר את ביצועיו של α-fetoprotein במעקב אחרי HCC במטופלים עם cirrhosis. הניסוי כלל 2 מדגמי נבדקים, האחד מאזור מישיגן והשני מאזור בנגקוק. פרופיל מס-ספקטרומטרי של פלזמה שנלקחה מ-18 מטופלים עם שחמת הכבד ומ-17 מאובחנים עם HCC, זיהה את OPN כמוגבר משמעותית בחולי הקרצינומה בהשוואה לאלה עם שחמת הכבד. בהמשך נמדדו רמות OPN ב-312 דגימות פלזמה שנאספו מ-131 חולים עם HCC, מ-76 חולי שחמת הכבד, מ-52 מאובחנים עם הפטיטיס B ו-C, ומ-53 אנשים בריאים ב-2 האזורים הגאוגרפיים האמורים. נמצא שרמות OPN היו גבוהות משמעותית בחולי HCC מאשר באלה עם צירוזיס, מנבדקים עם הפטיטיס משני הסוגים או מאנשים בריאים, הן במישיגן כמו גם בבנגקוק. מדידת OPN הייתה עדיפה על זו של alfa-fetoprotein בכל התרחישים הקליניים שנסקרו. לבדיקת OPN הייתה גם בעלת רגישות טובה במקרי HCC בהם תוצאת alfa-fetoprotein התקבלה שלילית. במחקר pilot פרוספקטיבי שכלל 22 מטופלים שפיתחו HCC במהלך תקופת המעקב, נמצא ש-OPN היה כבר מוגבר שנה לפני אבחון המחלה בכל המדגמים עם HCC.
OPN כגורם פרוגנוסטי ב-HCC
בהתחשב בשיעור ההישרדות הנמוך של HCC גרורתי, יש עניין רב בזיהוי של גורמים פרוגנוסטיים. במחקרים בהם הגידול בכבד הורחק בניתוח, נעשה ניסיון לזהות גנים עם ביטוי-יתר ב-HCC בהשוואה לרקמות כבד בריאות (Gotoh וחב' ב-Pathol Int משנת 2002. ו-Pan וחב' ב-cancer משנת 2003). אמנם נמצא ש-OPN היה מבוטא ביתר ב-HCC, ורמת ביטויו הייתה במתאם טוב עם דרגת ושלב המחלה ועם ההישנות המוקדמת שלה. Ye וחב' פרסמו ב-Nat Med משנת 2003 את מחקרם לגילוי גנים שהביטוי שלהם יכול להבדיל בין מחלה ראשונית לבין HCC גרורתית. OPN זוהה על ידם כאחד מתוצרי הגנים שהביטוי שלהם היה מוגבר משמעותית ב-HCC גרורתי בהשוואה ל-HCC לא-גרורתי.
רמות OPN בפלזמה ב-HCC
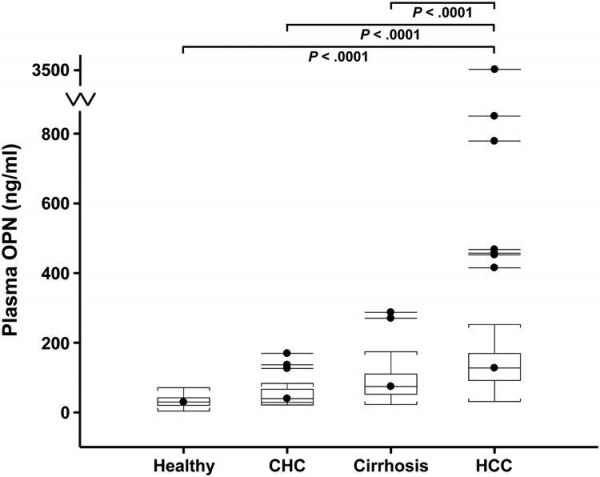
כאשר הביטוי הגֶני נמדד בערכים מוחלטים ולא כיחס בין הגידול הסרטני לרקמה בריאה, שוב זוהה OPN כתוצר גני שביטויו ברקמה הסרטנית מוגבר באופן בולט (Luo וחב' ב-Hepatology משנת 2006). ב-HCC שמקורה בהדבקה עם הנגיף הפטיטיס B, נמצאה אמפליפיקציה של הכרומוזום 4q21, בסמוך לאתר SPP, מה שמרמז לשדרוג ביצירת OPN שלפחות בחלקו נובע מאמפליפיקציה של הגן המקודד לחלבון זה (Huang וחב' ב-FEBS lett משנת 2006). נוכחות מוגברת של החלבון OPN או של ה-mRNA שלו, מצביעים על פרוגנוזה גרועה. גם Xie וחב' ב-Dig Liver Dis משנת 2007, הדגימו שזיהוי OPN על ידי צביעה אימונו-היסטוכימית במקרים של HCC על רקע הפטיטיס B חיובי, היה במתאם חיובי חזק עם גרורה של הגידול הסרטני לווריד הכבדי ולבלוטות הלימפה הסמוכות, (p<0.01), ובמתאם שלילי חזק עם הישרדות החולה (p<0.001). באופן דומה, רמות OPN בפלזמה היו גבוהות משמעותית בנבדקים עם מחלת כבד כרונית בהשוואה לאנשים בריאים.
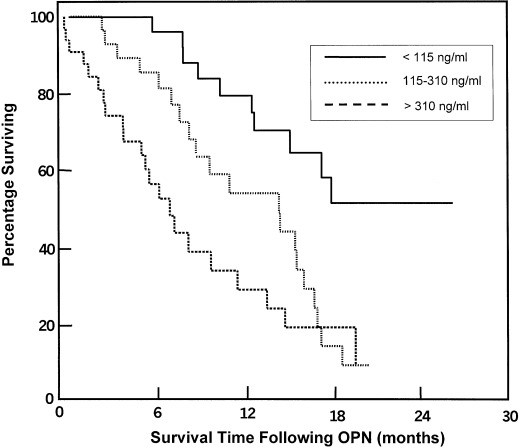
בקרב חולים עם HCC רמות מוגברות של OPN בפלזמה היו כרוכות בשלב מחלה מתקדם יותר, מה שתומך במידת רמת OPN בפלזמה כמדד פרוגנוסטי (Kim וחב' ב-Am J Gastroenterol משנת 2006). במחקר פרוספקטיבי נמדדה רמת OPN בפלזמה לפני הניתוח להרחקת הגידול, כאשר משתתפי המחקר חולקו ל-2 קבוצות המבוססות על רמת OPN שנמדדה (פחות מ-200 ננוגרם/מ"ל, ויותר מ-200 ננוגרם מ"ל): אלה עם רמות OPN הגבוהות נמצאו בעלי סיכוי משמעותית גבוה יותר להישנות הגידול 1–2 שנים לאחר הניתוח. בנוסף, רמת OPN בפלזמה הייתה מנבא בדרגת מובהקות גבוהה של סך-ההישרדות וכן של הישרדות נקייה ממחלה (0.001p<) על פי Zhang וחב' ב-J Cancer Res Clin Oncol משנת 2006). רמת OPN נמצאה כמנבא מצוין של שחמת בחולים עם הפטיטיס B (על פי Zhao וחב' ב- Int J Clin Pract משנת 2007).
סדרת מדידות תקופתיות של רמת OPN היא בעלת ערך פרוגנוסטי בסרטן שד גרורתי
כבר בשנת 1997 פרסמו Singhal וחב' ב-Clin Cancer Res על מדידת רמות OPN בפלזמה של 70 נשים עם סרטן שד גרורתי, וכן בפלזמה של 44 נשים בקבוצת ביקורת שהיו במעקב לאחר טיפול כימותרפי בעקבות אבחון של סרטן שד מוקדם, ובפלזמה של 35 נשים בריאות. החציון של OPN בפלזמה של נשים עם סרטן שד גרורתי היה 142 ננוגרם/מ"ל, שהיה גבוה משמעותית (0.0001p<) בהשוואה ל-2 קבוצות הביקורת כאשר חציון רמת OPN היה 60 ננוגרם/מ"ל, ו-47 ננוגרם/מ"ל, בהתאמה. יתרה מכך, נמצא שרמות מוגברות של OPN בפלזמה היו כרוכות במשך הישרדות נמוך יותר (p<0.001). הממוצעים של רמות OPN בפלזמה היו מוגברים משמעותית כאשר התגלו שלושה או יותר אזורים מרוחקים עם גרורות (בממוצע 232 ננוגרם/מ"ל), לעומת 1 או 2 אזורים מרוחקים עם גרורות בהם נמדדו בפלזמה רמות ממוצעות של 129 ו-130 ננוגרם/מ"ל, בהתאמה. מחקר זה הדגים הגברה משמעותית ברמות OPN בפלזמה בלמעלה מ-70% של מטופלות עם סרטן שד גרורתי, בהשוואה לנשים בריאות או לנשים שטופלו כימותרפית כאשר הגידול אובחן בשלביו המוקדמים. היה זה גם המחקר הראשון שהדגים OPN מוגבר, בהתאמה למספר האתרים המרוחקים הנגועים בגרורות של סרטן השד.
בשנת 2006 דיווחו Bramwell וחב' ב-Clin Cancer Res על ניסוי פרוספקטיבי של מדידה סדרתית של רמות OPN בפלזמה בנשים עם סרטן שד גרורתי במהלך מחלתן. לניסוי גויסו 158 נשים עם סרטן שד גרורתי שזה עתה אובחן, ורמת OPN נמדדה בשיטת ELISA בבסיס הניסוי ולאחר 3, 6 ו-12 חודשים במהלך הטיפולים ולאחרים עד לפטירה. תוצאות הניסוי היו כדלקמן: רמת OPN נמדדה ב-1,378 דגימות פלזמה, (בממוצע 9 דגימות למטופלת). תשעים ותשע מטופלות נמצאו עם ערכי OPN מוגברים בבסיס הניסוי, עם רמה ממוצעת של 177 ננוגרם/מ"ל. באנליזה חד-משתנית רמה מוגברת של OPN בבסיס הניסוי הייתה במתאם עם הישרדות קצרה (p=0.02). במודל רב-משתני בו נלקחו בחשבון גורמים פרוגנוסטיים סטנדרטיים, רמת הבסיס של OPN הייתה כרוכה משמעותית עם משך ההישרדות. רמות OPN בפלזמה מעל 250 ננוגרם/מ"ל, בכל נקודת זמן במהלך הניסוי, נמצאה כמשתנה עם הערך הפרוגנוסטי הרב ביותר להישרדות גרועה, עם סיכון יחסי של 3.26 (עם ערך משמעותי סטטיסטית של p=0.0003).
OPN וסרטן הערמונית
בשנת 2007 הופיע ב-Prostate מחקרם של Ramankulov וחב', שנועד להעריך את הערך האבחוני והפרוגנוסטי של רמות OPN בפלזמה בהשוואה לסמני עצם אחרים, בכל הקשור לגרורות לעצם בסרטן הערמונית. במחקר נמדדו רמות OPN, רמות alkaline phosphatase ספציפי לעצם, רמות PINP ורמות carboxyterminal-telopeptide of type I collagen, ב-90 גברים מאובחנים עם סרטן הבלוטה ללא גרורות מאובחנות, ב-35 מטופלים עם BPH, וב-29 גברים בריאים. תוצאות המחקר הראו ש-OPN בדומה לשלושת הסמנים למעורבות עצם במחלה, היו מוגברים במחלה גרורתית לעצם, בהשוואה ל-2 הקבוצות האחרות שנבדקו. באנליזות ROC של receiver-operating characteristics נמצא ש-OPN ושלושת סמני העצם היו יעילים בהבדלה בין אלה עם סרטן ערמונית עם או בלי גרורות לעצם, עם שטח מתחת לעקומה (AUC) של 0.8-0.88 ומובהקות של p<0.001. ל-OPN נמצא ערך AUC של 0.85 שגדל בשילוב עם בדיקת bone-ALK עד 0.93, עם דיוק אבחוני מרבי ורגישות וספציפיות של מעל 90%. אנליזות Kaplan-Meyer הראו הישרדות מופחתת בנבדקים עם רמות OPN מוגברות, מסקנת מחקר זה הייתה ש-OPN בעצמו או בשילוב עם מדידות סמני עצם אחרים, היה שימושי כסמן אבחוני לזיהוי גרורות לעצם בסרטן הערמונית, וכן כאינדיקטור פרוגנוסטי של מהלך המחלה.
הקשר של OPN להישרדות ולגרורת לעצם בחולים עם קרצינומה של הערמונית העמידה לטיפול הורמונלי (Hotte וחב' ב-Cancer משנת 2002)
מחקרים אחדים הראו ש-OPN מעודד את השגשוג של תאי אפיתל של בלוטת הערמונית עם פוטנציאל שגשוג גבוה in vitro (על פי Elgavish וחב' ב-Prostate משנת 1998). אכן, טיפול בתרבית עם OPN מעודד שגשוג של שורות תאים של קרצינומה ממקור הערמונית (Thalmann וחב' ב-Clin Cancer Res משנת 1999). במחקר האחרון נמצא שתאי קרצינומה של הערמונית היו בעלי ביטוי מוגבר של OPN mRNA, בעיקר בתאים שאינם תלויים באנדרוגן, ובגידול בדרגת Gleason גבוהה. האינטנסיביות של צביעת OPN בצביעה אימונית, הייתה במתאם טוב עם דרגת הגידול והאגרסיביות שלו. Nemoto וחב' הראו בשנת 2001 ב-J Bone Miner Res, שחסר בביטוי OPN מפחית את החודרנות של סרטן הערמונית לרקמות רכות ולעצם.
נתונים אלה הביאו את Hotte וחב' לבחון 100 גברים עם קרצינומה של הערמונית העמידה לטיפול הורמונלי (להלן HRPC), בהם נדדה רמת OPN בפלזמה. התוצאות של ניסוי זה היו כדלקמן: הנבדקים היו בגיל ממוצע של 73 שנה (בטווח שבין 50–86 שנה), וב-92% מהמקרים המחלה הייתה בשלב הגרורתי. רמת OPN הממוצעת שנמדדה הייתה 198.5 ננוגרם/מ"ל, בטווח שבין 15.0 ל-2,363 ננוגרם/מ"ל, והרמה הממוצעת של PSA הייתה 67.8 ננוגרם/מ"ל, בטווח שבין 0.1-7,550 ננוגרם/מ"ל. פרק הזמן הממוצע של הישרדות היה 13.7 חודשים. רמות OPN היו גבוהות יותר במטופלים עם מחלה גרורתית בהשוואה לאלה ללא גרורות (p=0.024). רמות מוגברות של OPN היו קשורות להישרדות נמוכה יותר בדרגת סיכון מוגברת של 2.38 (עם p<0.0001).
המשמעות הקלינית של OPN ב-esophageal squamous cell carcinoma בהשוואה לסמני סרטן מקובלים
בשנת 2005 פרסמו Shimada וחב' ב-Oncology את מחקרם על משמעות הביטוי של OPN בסוג סרטן זה של הוושט (להלן ESCC), על ידי ההשוואה של רמות OPN בפלזמה לאלה של סמנים אחרים. רמות OPN לפני הניתוח נמדדו ב-103 חולים עם ESCC. במקביל נמדדו רמות של אנטיגן קרצינו-אמבריוני (CEA), של cyfra-21-1 ושל האנטיגן SCC. בניסוי זה טווח הרמות של OPN היה 82.8-1,980 ננוגרם/מ"ל, כאשר הרמות הגבוהות היו כרוכות עם גרורות לקשרי הלימפה (p=0.05), אך לא עם ההיסטולוגיה של סוג סרטן זה או עם דרגת החודרנות של הגידול. ההישרדות של הנבדקים עם רמת OPN גבוהה הייתה קצרה מזו של אלה עם רמת OPN נמוכה (p=0.02). מבין שלושת הסמנים האחרים, SCC ו-cyfra 21-1 שיקפו את דרגת החודרנות של הגידול, את קוטר הגידול, את הגרורות לקשרי הלימפה ואת סך ההישרדות. לעומתם, CEA לא ייצג את הפרמטרים הפתולוגיים האלה. מדידה משולבת של OPN ושל cyfra-21-1, שיפרה את ההערכה הפרוגנוסטית של ESCC.
רמת OPN בפלזמה כסמן פרוגנוסטי בלתי-תלוי בסרטן ראש וצוואר
Petrik וחב' במחקרם משנת 2006 ב-J Clin Oncol בחנו את היחס בין רמות OPN בפלזמה ותוצאות הטיפול ב-SCC של הראש והצוואר (להלן HNSCC). הניסוי כלל 140 מטופלים שזה עתה אובחנו עם HMSCC, מתוכם 45 שכבר אובחנו עם המחלה ועוד 86 נבדקים חדשים שהמחלה עדיין לא אובחנה אצלם. רמת OPN בפלזמה של מאובחני המחלה לפני טיפול, נעשתה בשיטת ELISA. תוצאות המחקר היו כדלקמן: תוך שימוש בערך cut-off שנקבע קודם לכן, של 450 ננוגרם/מ"ל, נמצא מתאם משמעותי-בינוני בין OPN וחופש מהישנות המחלה (p=0.047), וכן מתאם עם ההישרדות בכללותה (p=0.019), וכן מתאם עם הישרדות חופשית מאירועים (p=0.023). בחינה של אירועי משבר במחלה בקרב כל 140 משתתפי המחקר מצאה ש-OPN הוא גורם פרוגנוסטי בלתי-תלוי במקרים של מחלה בראשית דרכה, אך גם בשלבי מחלה מתקדמים יותר.
ביטוי של OPN הוא סמן בעל ערך בניבוי של הישנוּת קצרת-טווח של מנינגיומה שפירה grade 1
היכולת לנבא הישנות של מנינגיומות שפירות היוותה תמיד אתגר נירו-כירורגי. Tseng וחב' דיווחו ב-J Neurooncol משנת 2010, על מחקר שכלל 23 מטופלים עם מנינגיומה שלא נשנתה, וכן 9 מטופלים עם מנינגיומה נשנית. כל משתתפי המחקר היו במעקב למשך 34 חודש בממוצע, לאחר הרחקה ניתוחית שלימה של הגידולים המקוריים שהוגדרו כולם כ-Simpson Grade 1 ו-Simpson Grade 2. רמת OPN בציטופלזמה של תאי הגידולים נמדדה בשיטה אימונו-היסטוכימית על בסיס שיטת Allred-8-unit. תוצאות המחקר הראו שהישנות המנינגיומה התאימה באופן משמעותי עם עוצמת הביטוי של OPN ברמת מובהקות של 0.001<p). רמת ביטוי של 0–3 של OPN על פי מדרג Allred הייתה כרוכה באי-הישנות של הגידול לתקופה של למעלה מ-25 חודש. לעומת זאת, באלה מהנבדקים עם Allred score של OPN בין 4–8, משך הזמן שחלף עד להישנות הגידול היה קצר משמעותית.
OPN כסמן לאבחנה מבדלת בין סרטן הלבלב לבין פנקרטיטיס כרונית
Rychlíaková וחב' ב-Cancer Biomarkers משנת 2016, מדדו את ריכוזי OPN במטופלים עם pancreatic ductal adenocarcinoma (להלן PDAC), כדי להחליט האם רמת OPN שימושית להבדיל בין תרחיש של PDAC לבין פנקראטיטיס כרונית וסוכרת type 2, וכן לברר האם ריכוזי OPN קשורים לשלב של PDAC. בניסוי השתתפו 64 מאובחנים עם PDAC, 71 מאובחנים עם פנקראטיטיס כרונית ו-48 אנשים בריאים כביקורת. תוצאות הניסוי היו כדלקמן: רמות OPN היו גבוהות יותר בחולים עם PDAC בהשוואה לאלה עם פנקראטיטיס כרונית (p<0.001), ולאלה עם סוכרת type 2 (p<0.001), כמו גם בהשוואה לנבדקים הבריאים (p<0.001). בחולים עם PDAC ב-stage IV, נמצאו רמות OPN גבוהות יותר מאשר באלה עם מחלה ב-grade III (p<0.01). לא היו הבדלים ברמות OPN בין PDAC בדרגה III לבין מחלה בדרגה II. תוצאות הניסוי קבעו שרמות OPN מעל 102 ננוגרם/מ"ל הן בעלות פוטנציאל אבחוני של סרטן בלוטת הלבלב.
רמות OPN בפלזמה ותוצאים קרדיו-וסקולריים בלתי רצויים (Abdairhim וחב' ב-PLos One משנת 2016)
ההשערה שרמות OPN בפלזמה כרוכות בתוצאים קרדיו-וסקולריים חמורים, במטופלים עם מחלת עורקים כליליים ומקטע פליטה (EF) שמור, הביאה לעריכת הניסוי PEACE בו נמדדו רמות OPNבפלזמה בבסיס הניסוי ב-3,567 מטופלים עם CAD מתוכם 81% גברים, כאשר הגיל הממוצע של כל משתתפי הניסוי היה 64.5±8.1 שנה. מדידת OPN נעשתה בשיטת sandwich chemiluminescence . רמות OPN נבחנו ביחס לפטירה ממחלה קרדיו-וסקולרית, להתקפי-לב לא קטלניים ולאשפוז בגלל אי-ספיקת לב. נעשתה התאמה לגיל, למגדר, ולערפלנים (confounders) פוטנציאליים. במהלך תקופת מעקב ממוצעת של 4.8 שנים התרחשו 416 אירועים קרדיו-וסקולריים בקרב 366 ממשתתפי הניסוי. רמות OPN שנמדדו בניסוי זה הראו שכלל האירועים הקליניים שנבחנו היו מוגברים בממוצע ב-56% ברמות OPN מוגברות (p<0.001), גם לאחר התאמה לגיל ולמגדר (עלייה של 31% באירועים אלה, p<0.01) או לאחר התאמה לגורמי סיכון נוספים (עלייה של 24% באירועים קרדיו-וסקולריים, p<0.04). רמה מוגברת של OPN הייתה כרוכה משמעותית (פי-2.04( באשפוזים על רקע אי-ספיקת לב (p<0.001).
OPN, סמן פרוגנוסטי במטופלים עם CHF (Rosenberg וחב' ב-Circ Heart Fail משנת2008)
בגלל מיקומו ותכונותיו המולקולריות, OPN הוצע כמעורב בקשר בין ECM לבין קרדיומיוציטים (Okamoto ב-Mol Cell Biochem משנת 2007). יתרה מכך, היו דיווחים על כך ש-OPN משודרג בחוזקה במספר מודלים בחיות של היפרטרופיה של הלב ואי-ספיקה שלו (Singh וחב' ב-Hypertension משנת 1999, ו-Graf וחב' ב-Circulation משנת 1997). בניסוי של Stawowy וחב' ב-Eur J Heart Fail משנת 2002 נמצאה עלייה ניכרת ברמת OPN בביופסיות שנלקחו משריר הלב של 10 מטופלים עם dilated cardiomyopathy בהשוואה עם רקמות לב בריאות. בדומה, גם Satoh וחב' דיווחו ב-Eur J Heart Fail משנת 2005 על מתאם טוב בין רמת OPN והקוטר של חדר לב השמאלי, בביופסיות שנלקחו מרקמות לאחר התקף לב בהשוואה לרקמות בריאות. מחקר של Suezawa וחב' ב-J Lab Clin Med משנת 2005, מצא רמות מוגברות של OPN בפלזמה במתאם עם תפקוד ירוד של החדר השמאלי ב-18 מטופלים עם התקף לב.
על בסיס ממצאים אלה העריכו Rosenberg וחב' שרמות OPN יכולות להיות לא רק מוגברות במצבי אי-ספיקת לב, אלא גם יכולות לשקף את חומרת אי-ספיקה זו, ולשמש כמדד פרוגנוסטי. לפיכך חוקרים אלה בחנו רמותOPN בפלזמה של מספר גדול של מטופלים עם אי-ספיקה כרונית הנגרמת מ-dilated cardiomyopathy. המחקר כלל 420 מטופלים עם אי-ספיקת לב כרונית, כתוצאה מפגיעה בתפקוד הסיסטולי של החדר השמאלי, ונבדק המתאם של התוצאות עם שלב המחלה, ועם הפרוגנוזה שלה במעקב שנמשך הממוצע 43 חודשים. נמצא שרמת OPN בפלזמה הייתה מוגברת באופן משמעותי בחולים עם אי-ספיקת לב, בהשוואה למתנדבים בריאים תואמי-גיל (532 לעומת 382 ננוגרם/מ"ל, p=0.008)), ללא כל קשר לסיבה לאי הספיקה, שיכלה להיות קרדיומיופתיה איסכמית או dilated cardiomyopathy.יתרה מכך רמות OPN היו גבוהות יותר במטופלים עם אי-ספיקה מתונה עד חמורה, מאשר בנבדקים ללא כל תסמינים או עם תסמינים קלים (672 ננוגרם/מ"ל באלה עם דרגת אי-ספיקה של NYHA class III/IV בהשוואה ל-479 ננוגרם/מ"ל באלה עם אי-ספיקה בדרגת NYHA class I/II, עם דרגת מובהקות של p<0.0001).
הערכה של שיעורי תמותה במהלך 4 שנים, במטופלים עם רמות OPN מעל או מתחת ערך cut-off שנקבע על פי נתוני עקומת ROC, העלתה 56.5% תמותה ו-28.4% תמותה בהתאמה. כאשר רמות מוגברות של OPN היוו גורם סיכון לתמותה מוגברת פי-3.4 (p<0.0001). במודל רב-משתני (multivariate) שכלל גורמים דמוגרפיים, קליניים וביוכימיים כגון NT-pro BNP, נמצא ש-OPN היה מנבא בלתי-תלוי של פטירה מסיבות לבביות עם HR של 2.3 (p<0.001).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק