הבדלים בין גרסאות בדף "סרטן מעי גס גרורתי - טיפול - Metastatic colon cancer - treatment"
| (46 גרסאות ביניים של 3 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה= | |תמונה= | ||
| שורה 6: | שורה 4: | ||
|שם עברי= סרטן מעי גס גרורתי - טיפול | |שם עברי= סרטן מעי גס גרורתי - טיפול | ||
|שם לועזי= Metastatic colon cancer - treatment | |שם לועזי= Metastatic colon cancer - treatment | ||
| − | |שמות נוספים= סרטן מעי גס גרורתי | + | |שמות נוספים= סרטן מעי גס גרורתי – עדכונים אחרונים בטיפול במחלה |
|ICD-10= | |ICD-10= | ||
|ICD-9= | |ICD-9= | ||
|MeSH= | |MeSH= | ||
| − | |יוצר הערך= ד"ר | + | |יוצר הערך= ד"ר שרון פלס |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | {{הרחבה|סרטן מעי גס | + | {{הרחבה|סרטן מעי גס גרורתי}} |
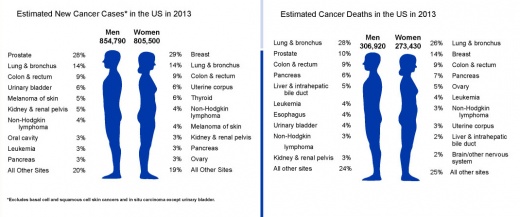
| − | + | [[סרטן המעי הגס]] הוא הגידול השלישי בשכיחותו מבין הגידולים הממאירים בקרב נשים וגברים. באוכלוסיה הכללית הסיכוי לחלות במחלה זו עומד על 1:19 בגברים ו-1:21 בנשים, לפי סיכום נתוני האיגוד האונקולוגי האמריקאי לשנת 2013. | |
| − | + | ||
| − | סרטן המעי הגס הוא | + | סיפור משפחתי של סרטן המעי הגס קשור לכ-20% ממקרי התחלואה בלבד {{הערה|שם=הערה1|NCCN Guidelines Version 3.2014}}. מרבית החולים מאובחנים בשלב מוקדם של המחלה ומטופלים באופן ניתוחי ובחלק מהמקרים מקבלים תוספת של טיפול כימותרפי מונע על בסיס [[פלאורופירימידינים]] (Fluoropyrimidine) למשך שישה חודשים. |
| + | |||
| + | כמחצית מבין החולים שטופלו במחלה מקומית יפתחו בהמשך גרורות (מחלה מטאכרונית), נוסף על כך, כרבע מכלל החולים מתייצגים עם סרטן מעי גס גרורתי כבר באבחנה (מחלה סינכרונית). חולים אלו יטופלו כחולי סרטן מעי גרורתי. | ||
| + | |||
| + | סיבת התמותה העיקרית במחלה זו הינה גרורות בכבד. מעריכים שבשליש מן המקרים הגרורות הן בכבד בלבד {{הערה|שם=הערה1}}. ממוצע ההישרדות בחמש שנים לאחר כריתת גרורות כבדיות ללא שארית מחלה עומד על 38% {{כ}}{{הערה|שם=הערה2|Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors . Clin Epidemiol. 2012;4:283-301. Kanas et al}}. במקרים נבחרים בלבד יש יתרון גם בכריתת גרורות ריאתיות. במקרים אלה ובמקרים של כריתה נוספת ,לאחר הישנות מחלה, הפרוגנוזה פחות טובה ויש לשקול בקפידה ובדיון רב צוותי לפני קבלת החלטה מסוג זה. | ||
| + | |||
| + | |||
| + | [[קובץ:Metastatic colon cancer1.jpg|ממוזער|מרכז|520 פיקסלים|תמונה 1. (מתוך www.cancer.org)]] | ||
| + | |||
| + | ==הגישה לחולה הגרורתי== | ||
| + | |||
| + | ראשית עלינו להגדיר האם מדובר במחלה נתיחה. החלטה זו דורשת כמובן דיון משותף עם כירורגים ואנשי הדמיה. מחלה נחשבת לנתיחה כאשר מעריכים שניתן להסיר את הגרורות עם שוליים נקיים (RO) ולהשאיר שייר כבדי מספק מבחינה תפקודית. במידה שהמחלה מוגדרת כנתיחה, ניתן להתחיל בניתוח. | ||
| + | |||
| + | אפשרות טיפולית נוספת מקובלת למחלה נתיחה היא מתן [[כימותרפיה טרום ניתוחית]] למשך כשלושה חודשים - כימותרפיה זו ניתנת על בסיס [[פלאורופירימידינים]] (Fluoropyrimidine) באחד המשלבים המקובלים כקו טיפולי ראשון למחלה גרורתית, אחריה מבוצע ניתוח ולאחריו יש להשלים כימותרפיה עוד שלושה חודשים. מומלץ לתת טיפול טרום ניתוחי במשך 3-2 חודשים ולא יותר מכך מחשש לנזק שומני או סינוסיאדלי שעלול להיגרם לכבד מהכימותרפיה. | ||
| + | |||
| + | הבחירה במתן כימותרפיה טרום ניתוחית, ולא בניתוח מיידי, מסייעת בטיפול במחלה מיקרו-גרורתית, אם קיימת, ומאפשרת להעריך את התגובתיות של הגידול לטיפול שנבחר, מידע שיתרום בהמשך להחלטה על טיפול בתר ניתוחי. | ||
| + | |||
| + | הגישה לחולה גרורתי עם גידול ממקור רקטלי היא זהה לזו של החולה הגרורתי ממקור מעי גס, בשונה מהגישה האונקולוגית לשתי המחלות כשמדובר במחלה מקומית. | ||
| + | |||
| + | ==טיפול מקומי לגרורות כבדיות לא נתיחות== | ||
| + | טיפול זה מתחלק לשניים בהתאם לפוטנציאל עתידי לניתוח של הגרורות. | ||
| + | |||
| + | ===גרורות עם פוטנציאל עתידי לניתוח=== | ||
| + | הטיפול המועדף הוא הטיפול הניתוחי אך במקרים שבהם האפשרות הניתוחית אינה קיימת נוכח מעורבות כלי דם חיוניים או חשש מפגיעה בתפקוד איברים חיוניים וכאשר המחלה הגרורתית מוגבלת לכבד, יש לשקול מתן טיפול כימותרפי שישיג תגובה מירבית מתוך כוונה לצמצם את גודל הגרורות ולהפוך את המחלה לנתיחה. | ||
| + | |||
| + | בעבודה אקראית ומבוקרת שפורסמה בשנה האחרונה, תוספת תרופה ביולוגית [[Erbitux]] {{כ}}(Cetuximab) למשלב כימותרפי מקובל למחלה גרורתית הניבה 57.1% שיעורי תגובה, 29% שהפכו לנתיחים תחת הטיפול המשולב ו-25.7% שבתוצאת הניתוח שלהם נצפו שוליים נקיים (RO). זמן החיים הממוצע בזרוע של אותם מטופלים עם מחלה גרורתית לא נתיחה, שטופלו ומחלתם הפכה לנתיחה והם נותחו, עמד על 46.4 חודשים {{הערה|שם=הערה3|Randomized controlled trial of cetuximab plus chemotherapy for patients with KRAS wild-type unresectable colorectal liver-limited metastases. J Clin Oncol. 2013 Jun 1;31(16):1931-8. Ye LC et al.}}. | ||
| + | |||
| + | ===גרורות לא נתיחות בשלב מתקדם של המחלה=== | ||
| + | כאשר המחלה הלא נתיחה היא בעיקרה בכבד ולאחר מיצוי קווי הטיפול המקובלים, ניתן לשקול טיפול ממוקד לגרורות בכבד. | ||
| − | + | בסל הבריאות נרשם ב-2014 תכשיר בשם [[SIR-Spheres]] המורכב מחלקיקים המכילים חומר רדיואקטיבי, איטריום 90, בהתוויה לחולי [[סרטן מעי גס]] גרורתי לכבד בלבד לאחר שמוצו קווי הטיפול המקובלים עבור חולים אלה. טיפול זה נקרא טיפול בקרינה פנימית בררנית (SIRT - {{כ}}Selective Internal Radiation Therapy) והוא למעשה [[קרינה|טיפול קרינתי]] חד פעמי וממוקד הניתן באמצעות צנטר לעורק הכבד. הגרגירים המכילים את החומר הרדיואקטיבי מגיעים לכלי הדם המזינים את הגרורות וחוסמים אותם. הגרגירים פולטים את הקרינה האצורה בהם ישירות לתוך הגרורות, תוך פגיעה מזערית וזניחה ברקמת הכבד הבריאה. הגרגירים מוזרקים באמצעות צנטר מיוחד המוחדר דרך חתך קטן בירך לעורק הכבד. בפאזה שנייה פרוספקטיבית שפורסמה השנה נבדק טיפול זה בחולי סרטן מעי גרורתי העמידים לטיפול המקובל והודגם זמן ממוצע של 2.9 חודשים עד להתקדמות המחלה {{הערה|שם=הערה4|Radioembolisation for liver metastases: results from a prospective 151 patient multi-institutional phase II study. Eur J Cancer. 2013 Oct;49(15):3122-30. Benson A et al}}. | |
| − | + | [[קובץ:Metastatic colon cancer2.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 2. חלקיקים המכילים איטריום 90 מוזרקים לגרורות בכבד]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ==טיפול כמותרפי== | |
| − | + | זה מעל כעשור התרופות הכימותרפיות המשמשות אותנו במחלה זו לא השתנו. | |
| − | + | [[t:Leucovorin|Leucovorin]]{{כ}} (Calcium folinate),{{כ}} [[t:Fluorouracil|Fluorouracil]], {{כ}}[[t:Oxaliplatin|Oxaliplatin]] ו- [[t:Irinotecan|Irinotecan]] משמשות אותנו כיחידים או במשלב: | |
| − | [[ | + | *[[FOLFOX]]- משלב המכיל Leucovorin{{כ}}, Fluorouracil{{כ}} ו- Oxaliplatin. |
| + | *[[FOLFIRI]]- משלב המכיל Leucovorin{{כ}}, Fluorouracil{{כ}} ו-Irinotecan. | ||
| + | *[[XELOX]]- משלב המכיל [[Xeloda]] {{כ}}(Capecitabine) ו-Oxaliplatin. | ||
| + | *[[XELIRI]]- משלב המכיל Xeloda {{כ}}(Capecitabine) ו- Irinotecan. | ||
| − | + | אליהן החלו להצטרף לפני כעשור התרופות הביולוגיות. | |
| − | + | ==טיפול ביולוגי== | |
| + | התרופות הביולוגיות המקובלות הן: | ||
| − | + | *[[Zaltrap]] {{כ}}(Aflibercept) | |
| + | *[[Vectibix]] {{כ}}(Panitumumab) | ||
| + | *[[Erbitux]] {{כ}}(Cetuximab) | ||
| + | *[[Avastin]] {{כ}}(Bevcizumab) | ||
| + | *[[Stivarga]] {{כ}}(Regorafenib) | ||
| − | + | את התרופות הביולוגיות ניתן לסווג לפי מנגנון הפעולה, אוכלוסיות החולים המתאימים לטיפולים אלה, הקו הטיפולי בו הן ניתנות והשילובים שבהם ניתן לתת אותן. | |
| − | |||
| − | |||
| − | + | ===מנגנוני הפעולה של התרופות=== | |
| + | #מעכבי אנגיוגנזה - Avastin {{כ}}הוא נוגדן מונוקלונלי אנושי הניתן דרך הווריד כנגד גורם גדילה וסקולרי אפיתליאלי (VEGF- Vascular Epithelial Growth Factor), {{כ}}Zaltrap הוא חלבון מאוחה (Fusion protein) הניתן דרך הווריד כנגד גורם הגדילה הוסקולרי אפיתליאלי ו- Stivarga היא תרופה פומית המשתייכת למשפחת מעכבי המולטי-קינאזות. | ||
| + | #מעכבי קולטן לגורם גדילה אפידרמלי (EGFR {{כ}}-Epidermal Growth Factor Receptor) -{{כ}}Erbitux הוא נוגדן כימרי מונוקלונלי ו-Vectibix הוא נוגדן אנושי מונוקלונלי. שניהם ניתנים דרך הווריד. | ||
| − | + | ===חולים להם מתאים הטיפול=== | |
| + | נוגדי האנגיוגנזה מתאימים לכלל החולים בסרטן המעי הגרורתי בעוד שמעכבי הקולטן לגורם גדילה אפיתליאלי מתאימים רק לחלק מהחולים וזאת על פי סמנים ביולוגיים כפי שיפורט בהמשך. | ||
| − | + | ===קווי טיפול מקובלים היום=== | |
| + | #בקו הטיפול הראשון מקובל לשלב כימותרפיה עם אחת מן התרופות הבאות: Avastin, {{כ}}Erbitux ו-{{כ}}Vectibix. | ||
| + | #בקו הטיפול השני, שהוא כמובן מושפע מקו הטיפול הראשון, מקובל להוסיף לכימותרפיה: Vectibix{{כ}} Erbitux{{כ}} Avastin{{כ}} Zaltrap | ||
| + | #בקו הטיפול השלישי ומעלה ניתן להשתמש ב- Stivarga{{כ}}, Vectibix{{כ}} ו-Erbitux. | ||
| − | == | + | ===שילובי תרופות אפשריים=== |
| + | ניתן לשלב כל אחת מהתרופות הביולוגיות Vectibix{{כ}}, Erbitux{{כ}}, Avastin{{כ}} ו-Zaltrap עם [[כימותרפיה]]. התרופות Erbitux ו-{{כ}}Vectibix יכולות להינתן במשלב עם כימותרפיה אך גם כתרופה בודדת ללא כימותרפיה. Stivarga ניתנת רק כתרופה בודדת ולא ניתן לשלבה נכון להיום עם כימותרפיה אלא במסגרת מחקר קליני. | ||
| − | + | לא מקובל לתת שתי תרופות ביולוגיות יחד באותו קו טיפול. | |
| − | + | ==סמנים ביולוגיים== | |
| + | סמנים ביולוגים (Biomarkers) הם מאפיינים מדידים המשמשים כגלאים במצבים ביולוגיים ומשמשים היום ככלי בידי האונקולוגים לצורך בחירת הטיפולים הביולוגיים. יש מספר אפשרויות טיפול ביולוגיות ב[[סרטן מעי גס]] גרורתי כשעל פי רוב חולה שאובחן בשלב זה של המחלה יטופל בקו ראשון במשלב כימותרפיה ותרופה ביולוגית אחת. לאחר כישלון של טיפול זה, בשל התקדמות המחלה או במקרה של תופעות לוואי שאינן מאפשרות המשך טיפול זה, יוחלף הטיפול הכימותרפי ויהיה צורך לשקול החלפה גם של הטיפול הביולוגי. | ||
| − | + | מיד לאחר האבחנה של סרטן מעי גס, לצורך החלטה על טיפול ביולוגי, המטופל מתבקש לחתום על טופס ויתור סודיות רפואית לצורך שליחת דגימה מרקמת הגידול שנלקחה ממנו בזמן ביצוע [[קולונוסקופיה]] או במהלך ביופסיה מכוונת מגרורה בכבד או מכל איבר אחר נגיש שממנו נלקחה הביופסיה. דגימה זו נשלחת לצורך בדיקת מוטציה בגנים ממשפחת RAS. | |
| − | + | ===גנים ממשפחת RAS=== | |
| + | RAS היא משפחה של אונקוגנים. גנים ממשפחה זו מתורגמים לחלבונים המעבירים אותות תוך תאיים המובילים בסופו של דבר לתהליכי גדילה סרטניים. במשפחה זו מוכרים [[KRAS]]{{כ}}, NRAS ו-HRAS. בעוד שמוטציות ב-HRAS כמעט אינן מופיעות בגידולי המעי הגס, הרי שמוטציות בגנים של KRAS ו-NRAS מצויות בגידולי המעי הגס ויש להן חלק בהתהוות התהליך הסרטני ובהמשך קיומו. | ||
| − | + | ידע קליני הראה שמוטציה ב-KRAS בקודון 2 הינה סמן ביולוגי המנבא עמידות לטיפול במעכבי הקולטן לגורם גדילה אפידרמלי. שימוש בסמן ביולוגי זה מסייע בידי האונקולוגים לבחור את אוכלוסיית חולים שיתאימו לטיפול בבתרופות אלו. מטופלים ללא מוטציה ב-KRAS מכונים בעגה המקצועית "KRAS-זן הבר" (Wild type) והם מועמדים טובים לטיפול במעכבי הקולטן {{כ}}(Erbitux {{כ}} ו-Vectibix). | |
| − | + | למרות שבדיקת KRAS מסייעת בבחירת מטופלים עם סבירות גבוהה לתגובה בטיפול במעכבי הקולטן לגורם גדילה אפידרמלי, עדיין מצויים, בקבוצת החולים שבהם לא היתה מוטציה בקודון 2 של KRAS, מטופלים שטופלו במעכבי הקולטן אך הרוויחו מהטיפול. נתון זה הוביל לחיפוש אחרי סמנים ביולוגיים נוספים שיסייעו באיתור מדויק יותר של המטופלים שירוויחו מהטיפול במעכבי הקולטן לגורם גדילה אפידרמלי. חיפוש זה הוא למעשה חלק מבניית רפואה מותאמת אישית, המקום אליו הולכת היום האונקולוגיה המודרנית. המטרה היא להתאים טיפול מסוים לחולים שצפויים להגיב לטיפול זה תוך הימנעות ממתן טיפול המלווה ברעילות באותם מטופלים שלא סביר שיגיבו לטיפול זה ואף עלולים להיפגע במדדי ההישרדות מטיפול זה. | |
| − | + | ===סמנים ביולוגים במחקר=== | |
| + | החידושים המשמעותיים בטיפול בסרטן מעי גס גרורתי בשנת 2013 היו גילויים של סמנים ביולוגיים נוספים מעבר לאקסון 2 של KRAS. סמנים ביולוגיים אלה כוללים מוטציות נוספות במסלול הקולטן לגורם גדילה אפידרמלי שנוכחותם יכולה לנבא לא רק חוסר תגובה לטיפול במעכבי הקולטן אלא גם תוצאות פחות טובות למול טיפול בכימותרפיה בלבד. | ||
| − | [[ | + | בספטמבר 2013 פורסמה בכתב העת האנגלי לרפואה (NEMJ - New England Medical Journal) אנליזה רטרוספקטיבית ואקספלורטורית של מחקר ה-PRIME שבדק יעילות ובטיחות של מתן תשלובת כימותרפית על בסיס [[Oxaliplatin]] {{כ}}(FOLFOX) עם או בלי מעכבי הקולטן לגורם גדילה אפידרמלי {{כ}}(Vectibix) בהתחשב במוטציות KRAS,{{כ}} NRAS ו-BRAF באוכלוסיה שכללה 639 חולי סרטן מעי גס גרורתי שבהם נשללו מראש מוטציות באקסון 2 של KRAS {{כ}}. בעבודה זו נחשפה אוכלוסיית מטופלים שתוספת מעכבי הקולטן לא תרמה להישרדותם הכללית וגם לא להישרדות ללא התקדמות מחלתם (Progression free survival) ואף פגעה בהם. באוכלוסיה זו זוהו מוטציות בגנים ממשפחת RAS שאינם באקסון 2 של KRAS אך ללא ספק מנבאות, בצורה דומה לזו המוכרת לנו ממוטציות באקסון 2 של KRAS, את חוסר התגובה למעכבי הקולטן. אוכלוסייה זו היוותה 17% מכלל הנבדקים במחקר זה. |
| − | + | ההישרדות הכללית באוכלוסיית החולים שבהם לא היו מוטציות ב- RAS וב-BRAF הגיעה ל-28.3 חודשים בתוספת של Vectibix לתשלובת הכימותרפית FOLFOX, לעומת 20.9 חודשים בלבד במתן FOLFOX בלבד. מטופלים שבהם אובחנו מוטציות אלו הגיעו להישרדות ממוצעת של 15.3 חודשים בתוספת של Vectibix לתשלובת הכימותרפית FOLFOX לעומת 18 חודשים במתן FOLFOX בלבד. גם זמן ההישרדות ללא התקדמות המחלה פחת משמונה חודשים ל-7.3 חודשים בתוספת של מעכבי הקולטן לגורם גדילה אפידרמלי לאותה קבוצת חולים עם מוטציה ב-RAS או BRAF. | |
| − | |||
| − | |||
| − | + | בכינוס האונקולוגי האירופאי השנתי באמסטרדם (ESMO- European Society for Medical Oncology) {{כ}}בשנת 2013 פורסמו נתונים נוספים מהמחקר הגרמני בראשותו של היינמן, ה-FIRE-3 , שהדגישו את חשיבותם של הסמנים הביולוגיים נוסף על אקסון 2 של KRAS. FIRE-3 הוא המחקר הגדול הראשון שהשווה ראש בראש בין התרופות הביולוגיות Avastin ו-Erbitux כתוספת למשלב הכימותרפי על בסיס [[Irinotecan]] {{כ}}(FOLFIRI). אוכלוסיית המחקר כללה 592 חולים שבהם לא היתה מוטציה באקסון 2 של KRAS. בכינוס האונקולוגי האמריקאי בשיקגו ביוני 2013 התפרסמו לראשונה תוצאות מחקר זה שהראו יתרון בהישרדות למתן Erbitux כתוספת ל-FOLFIRI וזאת למרות שלא נצפה יתרון בהישרדות ללא התקדמות מחלה או בשיעור התגובה שתוכנן מראש כמטרה עיקרית של הטיפול. | |
| − | + | באנליזה שפורסמה באגודה האירופאית לאונקולוגיה רפואית ובה נבדקו סמנים ביולוגיים הכוללים מוטציות באקסון 3 ו-4 של KRAS ואקסון 2 ו-3 של NRAS, באוכלוסיית המחקר של 'FIRE-3 הראתה שעל ידי מחיקה של כל אותם מטופלים עם מוטציה ב-RAS ניתן להגיע להישרדות ממוצעת של 33.1 חודשים במתן FOLFIRI ו-Erbitux. שוב, לא נצפה יתרון בהישרדות ללא התקדמות מחלה או בשיעור התגובה אך ללא ספק נתוני ההישרדות הכללית מרשימים והצורך בבדיקת מוטציות נוספות על אקסון 2 של KRAS, לצורך זיהוי המטופלים המתאימים לטיפול במעכבי הקולטן לגורם גדילה אפידרמלי, הוא מחויב המציאות כעת. | |
| − | + | ||
| − | + | ==בחירת קווי הטיפול בחולה הגרורתי== | |
| − | + | ההחלטה על קווי הטיפול תלויה בשיח שבין האונקולוג המטפל והמטופל עצמו היות שעדיין אין מספיק מידע מבוסס על מנת להחליט מהו סדר הטיפולים והמשלבים האופטימליים שיאריכו את חיי המטופל עם כמה שפחות תופעות לוואי. יש מספר מחקרים שאמורים להתפרסם בעתיד ותוצאותיהם הן אלו שיעזרו להחליט מהו השילוב הנכון. ביניהם עבודה של ה-80405 Intergroup שמשווה מתן Folfox/Folfiri עם Erbitux או Avastin בקו ראשון, וה-Stretegic של הקבוצה הצרפתית שבודק מהו סדר הטיפולים האופטימלי. | |
| + | |||
| + | עבודות נוספות שפורסמו השנה ותרמו להבנת הטיפול: | ||
| + | |||
| + | '''מחקר TRIBE''', פאזה שלישית - המחקר בדק תשלובת של שלוש תרופות כימותרפיות (Folfoxiri) עם תרופה ביולוגית (Avastin) למול האפשרות של שתי תרופות כימותרפיות (Folfiri) עם תרופה ביולוגית (Avastin) והדגים זמן תגובה עד להתקדמות מחלה של 12.2 חודשים ושיעור תגובה של 65% בקבוצה שקיבלה טיפול תוקפני לעומת 9.7 חודשים ו-53% בהתאמה בקבוצה השנייה. תופעות לוואי הכוללות [[שלשול|שלשולים]], [[פצעים בפה]], רעילות עצבית והמטולוגית היו יותר משמעותיות בקבוצה שקיבלה טיפול תוקפני של שלוש תרופות כימותרפיות {{הערה|שם=הערה5|FOLFOXIRI/bevacizumab (bev) versus FOLFIRI/bev as first-line treatment in unresectable metastatic colorectal cancer (mCRC) patients (pts): Results of the phase III TRIBE trial by GONO group. ASCO 2013 Falcone et al}}. | ||
| + | |||
| + | '''מחקר AVEX''' שבדק מתן [[Xeloda]]{{כ}} (Capecitabine) עם או ללא Avastin במטופלים מעל גיל 70 והראה יתרון סטטיסטי מובהק, בזמן עד להתקדמות המחלה, שעמד על 9.1 חודשים עם תוספת Avastin לעומת מתן Xeloda לבד. עבודה זו הוכיחה שמתן תשלובת זו במטופלים מבוגרים היא יעילה ובטוחה {{הערה|שם=הערה6|Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. The Lancet Oncology, Volume 14, Issue 11, Pages 1077 - 1085, October 2013. Cunningham D et al}}. | ||
| + | |||
| + | '''מחקר TML''' - עבודה שפורסמה קו שני פאזה שלישית ובה נבדק המשך טיפול ביולוגי ב- Avastin ושינוי הכימותרפיה בלבד מול כימותרפיה ללא טיפול ביולוגי אחרי התקדמות בקו ראשון על כימותרפיה ו-Avastin. בעבודה זו זמן ההישרדות הממוצע היה 11.1 חודשים לעומת 9.8 חודשים בלבד לטובת הקבוצה שהמשיכה טיפול את אותו הטיפול הביולוגי לעומת הקבוצה שטופלה בכימותרפיה בלבד בקו שני {{הערה|שם=הערה7|Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. The Lancet Oncology, Volume 14, Issue 1, Pages 29 - 37, January 2013. Bennouna J et al}}. | ||
| + | |||
| + | '''מחקר ה-CORRECT''' - מחקר פאזה שלישית שפורסם ב-LANCET בשנת 2013, שבדק מתן Stivarga מול טיפול תומך בלבד בחולים שהתקדמו למרות טיפול מקובל והוכיח יתרון מובהק סטטיסטית בזמן הישרדות ממוצע של 6.4 חודשים אל מול 5 חודשים לטובת הטיפול בStivarga {{הערה|שם=הערה8| Lancet. 2013 Jan 26;381(9863): Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Grothey A et al}}. תופעות לוואי מדרגה 3 ומעלה שנצפו בעבודה זו היו: תגובה עורית ידיים-רגליים (17%), [[עייפות]] (10%), [[יתר לחץ דם]] (7%), [[שלשול]] (7%), [[פריחה]] (6%) ורעילות כבדית קטלנית (0.3%). | ||
| + | |||
| + | ==סיכום== | ||
| + | שילוב של טיפול כימותרפי על בסיס פלאורופירימידינים, עם טיפול ביולוגי בגידולי מעי גס גרורתי, הוא הטיפול המקובל מזה כעשור. השילוב המיטבי, זה שיאפשר יעילות מרבית עם כמה שפחות תופעות לוואי, טרם הוכתר. | ||
| + | |||
| + | בשנה האחרונה למדנו שניתן לשלב את כל שלושת הכימותרפיות עם תרופה ביולוגית בקו טיפול ראשון עם תגובה טובה אך במחיר כבד של תופעות לוואי וסימן שאלה לגבי קווי הטיפול הבאים לאחר שזה ייכשל. עוד למדנו שתשלובת כימותרפיה עם ביולוגיה היא אפשרות בטוחה גם בחולים מבוגרים. למדנו שייתכן שלא צריך להחליף גם כימותרפיה וגם טיפול ביולוגי לאחר כישלון הטיפול ולעתים ניתן להסתפק בהחלפת הכימותרפיה ולשמר אותו טיפול ביולוגי גם בקו שני. | ||
| + | |||
| + | תרופה ביולוגית חדשה שהצטרפה רשמית לקו טיפולי מתקדם היא הStivarga אך לצערנו היא אינה כלולה בסל שירותי הבריאות. לעומתה כן נכללת בסל אפשרות של הזרקת חומר רדיואקטיבי לגרורות בכבד לאחר שמוצו קווי הטיפול המקובלים. | ||
| + | |||
| + | החידוש העיקרי של שנת 2013 בטיפול בסרטן המעי הגס הגרורתי הוא באיתור מוטציות ב- RASו(KRAS או NRAS) נוסף על מוטציות של KRAS באקסון 2 שהוכחו כסמנים ביולוגיים המנבאים חוסר תגובה לטיפול במעכבי הקולטן לגורם גדילה אפידרמלי. מידע זה מסייע לנו היום לבחור באופן מדויק יותר את אוכלוסיית המטופלים המתאימים לטיפול ביולוגי במעכבי הקולטן. | ||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| − | |||
<blockquote> | <blockquote> | ||
<div style="text-align: left; direction: ltr"> | <div style="text-align: left; direction: ltr"> | ||
| שורה 85: | שורה 139: | ||
</blockquote> | </blockquote> | ||
| − | {{ייחוס| ד"ר | + | ==קישורים חיצוניים== |
| + | |||
| + | * [http://www.medic-digital.com/oncology-digital/#page-4 סרטן מעי גס גרורתי – עדכונים אחרונים בטיפול במחלה], Medic | ||
| + | |||
| + | |||
| + | {{ייחוס| ד"ר שרון פלס ,רופאה בכירה, המרכז לגידולי מערכת העיכול, המרכז הרפואי תל אביב ע"ש סוראסקי}} | ||
| + | |||
| + | |||
| + | <center>'''פורסם במגזין הדיגיטלי oncology-digital, אפריל 2014, Medic'''</center> | ||
[[קטגוריה: אונקולוגיה]] | [[קטגוריה: אונקולוגיה]] | ||
[[קטגוריה: גסטרואנטרולוגיה]] | [[קטגוריה: גסטרואנטרולוגיה]] | ||
| − | [[קטגוריה: | + | [[קטגוריה:פרמקולוגיה קלינית]] |
| − | |||
[[קטגוריה: פנימית]] | [[קטגוריה: פנימית]] | ||
| − | |||
גרסה אחרונה מ־11:00, 26 בינואר 2021
| סרטן מעי גס גרורתי - טיפול | ||
|---|---|---|
| Metastatic colon cancer - treatment | ||
| שמות נוספים | סרטן מעי גס גרורתי – עדכונים אחרונים בטיפול במחלה | |
| יוצר הערך | ד"ר שרון פלס | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן מעי גס גרורתי
סרטן המעי הגס הוא הגידול השלישי בשכיחותו מבין הגידולים הממאירים בקרב נשים וגברים. באוכלוסיה הכללית הסיכוי לחלות במחלה זו עומד על 1:19 בגברים ו-1:21 בנשים, לפי סיכום נתוני האיגוד האונקולוגי האמריקאי לשנת 2013.
סיפור משפחתי של סרטן המעי הגס קשור לכ-20% ממקרי התחלואה בלבד [1]. מרבית החולים מאובחנים בשלב מוקדם של המחלה ומטופלים באופן ניתוחי ובחלק מהמקרים מקבלים תוספת של טיפול כימותרפי מונע על בסיס פלאורופירימידינים (Fluoropyrimidine) למשך שישה חודשים.
כמחצית מבין החולים שטופלו במחלה מקומית יפתחו בהמשך גרורות (מחלה מטאכרונית), נוסף על כך, כרבע מכלל החולים מתייצגים עם סרטן מעי גס גרורתי כבר באבחנה (מחלה סינכרונית). חולים אלו יטופלו כחולי סרטן מעי גרורתי.
סיבת התמותה העיקרית במחלה זו הינה גרורות בכבד. מעריכים שבשליש מן המקרים הגרורות הן בכבד בלבד [1]. ממוצע ההישרדות בחמש שנים לאחר כריתת גרורות כבדיות ללא שארית מחלה עומד על 38% [2]. במקרים נבחרים בלבד יש יתרון גם בכריתת גרורות ריאתיות. במקרים אלה ובמקרים של כריתה נוספת ,לאחר הישנות מחלה, הפרוגנוזה פחות טובה ויש לשקול בקפידה ובדיון רב צוותי לפני קבלת החלטה מסוג זה.
הגישה לחולה הגרורתי
ראשית עלינו להגדיר האם מדובר במחלה נתיחה. החלטה זו דורשת כמובן דיון משותף עם כירורגים ואנשי הדמיה. מחלה נחשבת לנתיחה כאשר מעריכים שניתן להסיר את הגרורות עם שוליים נקיים (RO) ולהשאיר שייר כבדי מספק מבחינה תפקודית. במידה שהמחלה מוגדרת כנתיחה, ניתן להתחיל בניתוח.
אפשרות טיפולית נוספת מקובלת למחלה נתיחה היא מתן כימותרפיה טרום ניתוחית למשך כשלושה חודשים - כימותרפיה זו ניתנת על בסיס פלאורופירימידינים (Fluoropyrimidine) באחד המשלבים המקובלים כקו טיפולי ראשון למחלה גרורתית, אחריה מבוצע ניתוח ולאחריו יש להשלים כימותרפיה עוד שלושה חודשים. מומלץ לתת טיפול טרום ניתוחי במשך 3-2 חודשים ולא יותר מכך מחשש לנזק שומני או סינוסיאדלי שעלול להיגרם לכבד מהכימותרפיה.
הבחירה במתן כימותרפיה טרום ניתוחית, ולא בניתוח מיידי, מסייעת בטיפול במחלה מיקרו-גרורתית, אם קיימת, ומאפשרת להעריך את התגובתיות של הגידול לטיפול שנבחר, מידע שיתרום בהמשך להחלטה על טיפול בתר ניתוחי.
הגישה לחולה גרורתי עם גידול ממקור רקטלי היא זהה לזו של החולה הגרורתי ממקור מעי גס, בשונה מהגישה האונקולוגית לשתי המחלות כשמדובר במחלה מקומית.
טיפול מקומי לגרורות כבדיות לא נתיחות
טיפול זה מתחלק לשניים בהתאם לפוטנציאל עתידי לניתוח של הגרורות.
גרורות עם פוטנציאל עתידי לניתוח
הטיפול המועדף הוא הטיפול הניתוחי אך במקרים שבהם האפשרות הניתוחית אינה קיימת נוכח מעורבות כלי דם חיוניים או חשש מפגיעה בתפקוד איברים חיוניים וכאשר המחלה הגרורתית מוגבלת לכבד, יש לשקול מתן טיפול כימותרפי שישיג תגובה מירבית מתוך כוונה לצמצם את גודל הגרורות ולהפוך את המחלה לנתיחה.
בעבודה אקראית ומבוקרת שפורסמה בשנה האחרונה, תוספת תרופה ביולוגית Erbitux (Cetuximab) למשלב כימותרפי מקובל למחלה גרורתית הניבה 57.1% שיעורי תגובה, 29% שהפכו לנתיחים תחת הטיפול המשולב ו-25.7% שבתוצאת הניתוח שלהם נצפו שוליים נקיים (RO). זמן החיים הממוצע בזרוע של אותם מטופלים עם מחלה גרורתית לא נתיחה, שטופלו ומחלתם הפכה לנתיחה והם נותחו, עמד על 46.4 חודשים [3].
גרורות לא נתיחות בשלב מתקדם של המחלה
כאשר המחלה הלא נתיחה היא בעיקרה בכבד ולאחר מיצוי קווי הטיפול המקובלים, ניתן לשקול טיפול ממוקד לגרורות בכבד.
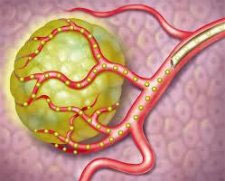
בסל הבריאות נרשם ב-2014 תכשיר בשם SIR-Spheres המורכב מחלקיקים המכילים חומר רדיואקטיבי, איטריום 90, בהתוויה לחולי סרטן מעי גס גרורתי לכבד בלבד לאחר שמוצו קווי הטיפול המקובלים עבור חולים אלה. טיפול זה נקרא טיפול בקרינה פנימית בררנית (SIRT - Selective Internal Radiation Therapy) והוא למעשה טיפול קרינתי חד פעמי וממוקד הניתן באמצעות צנטר לעורק הכבד. הגרגירים המכילים את החומר הרדיואקטיבי מגיעים לכלי הדם המזינים את הגרורות וחוסמים אותם. הגרגירים פולטים את הקרינה האצורה בהם ישירות לתוך הגרורות, תוך פגיעה מזערית וזניחה ברקמת הכבד הבריאה. הגרגירים מוזרקים באמצעות צנטר מיוחד המוחדר דרך חתך קטן בירך לעורק הכבד. בפאזה שנייה פרוספקטיבית שפורסמה השנה נבדק טיפול זה בחולי סרטן מעי גרורתי העמידים לטיפול המקובל והודגם זמן ממוצע של 2.9 חודשים עד להתקדמות המחלה [4].
טיפול כמותרפי
זה מעל כעשור התרופות הכימותרפיות המשמשות אותנו במחלה זו לא השתנו. Leucovorin (Calcium folinate), Fluorouracil, Oxaliplatin ו- Irinotecan משמשות אותנו כיחידים או במשלב:
- FOLFOX- משלב המכיל Leucovorin, Fluorouracil ו- Oxaliplatin.
- FOLFIRI- משלב המכיל Leucovorin, Fluorouracil ו-Irinotecan.
- XELOX- משלב המכיל Xeloda (Capecitabine) ו-Oxaliplatin.
- XELIRI- משלב המכיל Xeloda (Capecitabine) ו- Irinotecan.
אליהן החלו להצטרף לפני כעשור התרופות הביולוגיות.
טיפול ביולוגי
התרופות הביולוגיות המקובלות הן:
- Zaltrap (Aflibercept)
- Vectibix (Panitumumab)
- Erbitux (Cetuximab)
- Avastin (Bevcizumab)
- Stivarga (Regorafenib)
את התרופות הביולוגיות ניתן לסווג לפי מנגנון הפעולה, אוכלוסיות החולים המתאימים לטיפולים אלה, הקו הטיפולי בו הן ניתנות והשילובים שבהם ניתן לתת אותן.
מנגנוני הפעולה של התרופות
- מעכבי אנגיוגנזה - Avastin הוא נוגדן מונוקלונלי אנושי הניתן דרך הווריד כנגד גורם גדילה וסקולרי אפיתליאלי (VEGF- Vascular Epithelial Growth Factor), Zaltrap הוא חלבון מאוחה (Fusion protein) הניתן דרך הווריד כנגד גורם הגדילה הוסקולרי אפיתליאלי ו- Stivarga היא תרופה פומית המשתייכת למשפחת מעכבי המולטי-קינאזות.
- מעכבי קולטן לגורם גדילה אפידרמלי (EGFR -Epidermal Growth Factor Receptor) -Erbitux הוא נוגדן כימרי מונוקלונלי ו-Vectibix הוא נוגדן אנושי מונוקלונלי. שניהם ניתנים דרך הווריד.
חולים להם מתאים הטיפול
נוגדי האנגיוגנזה מתאימים לכלל החולים בסרטן המעי הגרורתי בעוד שמעכבי הקולטן לגורם גדילה אפיתליאלי מתאימים רק לחלק מהחולים וזאת על פי סמנים ביולוגיים כפי שיפורט בהמשך.
קווי טיפול מקובלים היום
- בקו הטיפול הראשון מקובל לשלב כימותרפיה עם אחת מן התרופות הבאות: Avastin, Erbitux ו-Vectibix.
- בקו הטיפול השני, שהוא כמובן מושפע מקו הטיפול הראשון, מקובל להוסיף לכימותרפיה: Vectibix Erbitux Avastin Zaltrap
- בקו הטיפול השלישי ומעלה ניתן להשתמש ב- Stivarga, Vectibix ו-Erbitux.
שילובי תרופות אפשריים
ניתן לשלב כל אחת מהתרופות הביולוגיות Vectibix, Erbitux, Avastin ו-Zaltrap עם כימותרפיה. התרופות Erbitux ו-Vectibix יכולות להינתן במשלב עם כימותרפיה אך גם כתרופה בודדת ללא כימותרפיה. Stivarga ניתנת רק כתרופה בודדת ולא ניתן לשלבה נכון להיום עם כימותרפיה אלא במסגרת מחקר קליני.
לא מקובל לתת שתי תרופות ביולוגיות יחד באותו קו טיפול.
סמנים ביולוגיים
סמנים ביולוגים (Biomarkers) הם מאפיינים מדידים המשמשים כגלאים במצבים ביולוגיים ומשמשים היום ככלי בידי האונקולוגים לצורך בחירת הטיפולים הביולוגיים. יש מספר אפשרויות טיפול ביולוגיות בסרטן מעי גס גרורתי כשעל פי רוב חולה שאובחן בשלב זה של המחלה יטופל בקו ראשון במשלב כימותרפיה ותרופה ביולוגית אחת. לאחר כישלון של טיפול זה, בשל התקדמות המחלה או במקרה של תופעות לוואי שאינן מאפשרות המשך טיפול זה, יוחלף הטיפול הכימותרפי ויהיה צורך לשקול החלפה גם של הטיפול הביולוגי.
מיד לאחר האבחנה של סרטן מעי גס, לצורך החלטה על טיפול ביולוגי, המטופל מתבקש לחתום על טופס ויתור סודיות רפואית לצורך שליחת דגימה מרקמת הגידול שנלקחה ממנו בזמן ביצוע קולונוסקופיה או במהלך ביופסיה מכוונת מגרורה בכבד או מכל איבר אחר נגיש שממנו נלקחה הביופסיה. דגימה זו נשלחת לצורך בדיקת מוטציה בגנים ממשפחת RAS.
גנים ממשפחת RAS
RAS היא משפחה של אונקוגנים. גנים ממשפחה זו מתורגמים לחלבונים המעבירים אותות תוך תאיים המובילים בסופו של דבר לתהליכי גדילה סרטניים. במשפחה זו מוכרים KRAS, NRAS ו-HRAS. בעוד שמוטציות ב-HRAS כמעט אינן מופיעות בגידולי המעי הגס, הרי שמוטציות בגנים של KRAS ו-NRAS מצויות בגידולי המעי הגס ויש להן חלק בהתהוות התהליך הסרטני ובהמשך קיומו.
ידע קליני הראה שמוטציה ב-KRAS בקודון 2 הינה סמן ביולוגי המנבא עמידות לטיפול במעכבי הקולטן לגורם גדילה אפידרמלי. שימוש בסמן ביולוגי זה מסייע בידי האונקולוגים לבחור את אוכלוסיית חולים שיתאימו לטיפול בבתרופות אלו. מטופלים ללא מוטציה ב-KRAS מכונים בעגה המקצועית "KRAS-זן הבר" (Wild type) והם מועמדים טובים לטיפול במעכבי הקולטן (Erbitux ו-Vectibix).
למרות שבדיקת KRAS מסייעת בבחירת מטופלים עם סבירות גבוהה לתגובה בטיפול במעכבי הקולטן לגורם גדילה אפידרמלי, עדיין מצויים, בקבוצת החולים שבהם לא היתה מוטציה בקודון 2 של KRAS, מטופלים שטופלו במעכבי הקולטן אך הרוויחו מהטיפול. נתון זה הוביל לחיפוש אחרי סמנים ביולוגיים נוספים שיסייעו באיתור מדויק יותר של המטופלים שירוויחו מהטיפול במעכבי הקולטן לגורם גדילה אפידרמלי. חיפוש זה הוא למעשה חלק מבניית רפואה מותאמת אישית, המקום אליו הולכת היום האונקולוגיה המודרנית. המטרה היא להתאים טיפול מסוים לחולים שצפויים להגיב לטיפול זה תוך הימנעות ממתן טיפול המלווה ברעילות באותם מטופלים שלא סביר שיגיבו לטיפול זה ואף עלולים להיפגע במדדי ההישרדות מטיפול זה.
סמנים ביולוגים במחקר
החידושים המשמעותיים בטיפול בסרטן מעי גס גרורתי בשנת 2013 היו גילויים של סמנים ביולוגיים נוספים מעבר לאקסון 2 של KRAS. סמנים ביולוגיים אלה כוללים מוטציות נוספות במסלול הקולטן לגורם גדילה אפידרמלי שנוכחותם יכולה לנבא לא רק חוסר תגובה לטיפול במעכבי הקולטן אלא גם תוצאות פחות טובות למול טיפול בכימותרפיה בלבד.
בספטמבר 2013 פורסמה בכתב העת האנגלי לרפואה (NEMJ - New England Medical Journal) אנליזה רטרוספקטיבית ואקספלורטורית של מחקר ה-PRIME שבדק יעילות ובטיחות של מתן תשלובת כימותרפית על בסיס Oxaliplatin (FOLFOX) עם או בלי מעכבי הקולטן לגורם גדילה אפידרמלי (Vectibix) בהתחשב במוטציות KRAS, NRAS ו-BRAF באוכלוסיה שכללה 639 חולי סרטן מעי גס גרורתי שבהם נשללו מראש מוטציות באקסון 2 של KRAS . בעבודה זו נחשפה אוכלוסיית מטופלים שתוספת מעכבי הקולטן לא תרמה להישרדותם הכללית וגם לא להישרדות ללא התקדמות מחלתם (Progression free survival) ואף פגעה בהם. באוכלוסיה זו זוהו מוטציות בגנים ממשפחת RAS שאינם באקסון 2 של KRAS אך ללא ספק מנבאות, בצורה דומה לזו המוכרת לנו ממוטציות באקסון 2 של KRAS, את חוסר התגובה למעכבי הקולטן. אוכלוסייה זו היוותה 17% מכלל הנבדקים במחקר זה.
ההישרדות הכללית באוכלוסיית החולים שבהם לא היו מוטציות ב- RAS וב-BRAF הגיעה ל-28.3 חודשים בתוספת של Vectibix לתשלובת הכימותרפית FOLFOX, לעומת 20.9 חודשים בלבד במתן FOLFOX בלבד. מטופלים שבהם אובחנו מוטציות אלו הגיעו להישרדות ממוצעת של 15.3 חודשים בתוספת של Vectibix לתשלובת הכימותרפית FOLFOX לעומת 18 חודשים במתן FOLFOX בלבד. גם זמן ההישרדות ללא התקדמות המחלה פחת משמונה חודשים ל-7.3 חודשים בתוספת של מעכבי הקולטן לגורם גדילה אפידרמלי לאותה קבוצת חולים עם מוטציה ב-RAS או BRAF.
בכינוס האונקולוגי האירופאי השנתי באמסטרדם (ESMO- European Society for Medical Oncology) בשנת 2013 פורסמו נתונים נוספים מהמחקר הגרמני בראשותו של היינמן, ה-FIRE-3 , שהדגישו את חשיבותם של הסמנים הביולוגיים נוסף על אקסון 2 של KRAS. FIRE-3 הוא המחקר הגדול הראשון שהשווה ראש בראש בין התרופות הביולוגיות Avastin ו-Erbitux כתוספת למשלב הכימותרפי על בסיס Irinotecan (FOLFIRI). אוכלוסיית המחקר כללה 592 חולים שבהם לא היתה מוטציה באקסון 2 של KRAS. בכינוס האונקולוגי האמריקאי בשיקגו ביוני 2013 התפרסמו לראשונה תוצאות מחקר זה שהראו יתרון בהישרדות למתן Erbitux כתוספת ל-FOLFIRI וזאת למרות שלא נצפה יתרון בהישרדות ללא התקדמות מחלה או בשיעור התגובה שתוכנן מראש כמטרה עיקרית של הטיפול.
באנליזה שפורסמה באגודה האירופאית לאונקולוגיה רפואית ובה נבדקו סמנים ביולוגיים הכוללים מוטציות באקסון 3 ו-4 של KRAS ואקסון 2 ו-3 של NRAS, באוכלוסיית המחקר של 'FIRE-3 הראתה שעל ידי מחיקה של כל אותם מטופלים עם מוטציה ב-RAS ניתן להגיע להישרדות ממוצעת של 33.1 חודשים במתן FOLFIRI ו-Erbitux. שוב, לא נצפה יתרון בהישרדות ללא התקדמות מחלה או בשיעור התגובה אך ללא ספק נתוני ההישרדות הכללית מרשימים והצורך בבדיקת מוטציות נוספות על אקסון 2 של KRAS, לצורך זיהוי המטופלים המתאימים לטיפול במעכבי הקולטן לגורם גדילה אפידרמלי, הוא מחויב המציאות כעת.
בחירת קווי הטיפול בחולה הגרורתי
ההחלטה על קווי הטיפול תלויה בשיח שבין האונקולוג המטפל והמטופל עצמו היות שעדיין אין מספיק מידע מבוסס על מנת להחליט מהו סדר הטיפולים והמשלבים האופטימליים שיאריכו את חיי המטופל עם כמה שפחות תופעות לוואי. יש מספר מחקרים שאמורים להתפרסם בעתיד ותוצאותיהם הן אלו שיעזרו להחליט מהו השילוב הנכון. ביניהם עבודה של ה-80405 Intergroup שמשווה מתן Folfox/Folfiri עם Erbitux או Avastin בקו ראשון, וה-Stretegic של הקבוצה הצרפתית שבודק מהו סדר הטיפולים האופטימלי.
עבודות נוספות שפורסמו השנה ותרמו להבנת הטיפול:
מחקר TRIBE, פאזה שלישית - המחקר בדק תשלובת של שלוש תרופות כימותרפיות (Folfoxiri) עם תרופה ביולוגית (Avastin) למול האפשרות של שתי תרופות כימותרפיות (Folfiri) עם תרופה ביולוגית (Avastin) והדגים זמן תגובה עד להתקדמות מחלה של 12.2 חודשים ושיעור תגובה של 65% בקבוצה שקיבלה טיפול תוקפני לעומת 9.7 חודשים ו-53% בהתאמה בקבוצה השנייה. תופעות לוואי הכוללות שלשולים, פצעים בפה, רעילות עצבית והמטולוגית היו יותר משמעותיות בקבוצה שקיבלה טיפול תוקפני של שלוש תרופות כימותרפיות [5].
מחקר AVEX שבדק מתן Xeloda (Capecitabine) עם או ללא Avastin במטופלים מעל גיל 70 והראה יתרון סטטיסטי מובהק, בזמן עד להתקדמות המחלה, שעמד על 9.1 חודשים עם תוספת Avastin לעומת מתן Xeloda לבד. עבודה זו הוכיחה שמתן תשלובת זו במטופלים מבוגרים היא יעילה ובטוחה [6].
מחקר TML - עבודה שפורסמה קו שני פאזה שלישית ובה נבדק המשך טיפול ביולוגי ב- Avastin ושינוי הכימותרפיה בלבד מול כימותרפיה ללא טיפול ביולוגי אחרי התקדמות בקו ראשון על כימותרפיה ו-Avastin. בעבודה זו זמן ההישרדות הממוצע היה 11.1 חודשים לעומת 9.8 חודשים בלבד לטובת הקבוצה שהמשיכה טיפול את אותו הטיפול הביולוגי לעומת הקבוצה שטופלה בכימותרפיה בלבד בקו שני [7].
מחקר ה-CORRECT - מחקר פאזה שלישית שפורסם ב-LANCET בשנת 2013, שבדק מתן Stivarga מול טיפול תומך בלבד בחולים שהתקדמו למרות טיפול מקובל והוכיח יתרון מובהק סטטיסטית בזמן הישרדות ממוצע של 6.4 חודשים אל מול 5 חודשים לטובת הטיפול בStivarga [8]. תופעות לוואי מדרגה 3 ומעלה שנצפו בעבודה זו היו: תגובה עורית ידיים-רגליים (17%), עייפות (10%), יתר לחץ דם (7%), שלשול (7%), פריחה (6%) ורעילות כבדית קטלנית (0.3%).
סיכום
שילוב של טיפול כימותרפי על בסיס פלאורופירימידינים, עם טיפול ביולוגי בגידולי מעי גס גרורתי, הוא הטיפול המקובל מזה כעשור. השילוב המיטבי, זה שיאפשר יעילות מרבית עם כמה שפחות תופעות לוואי, טרם הוכתר.
בשנה האחרונה למדנו שניתן לשלב את כל שלושת הכימותרפיות עם תרופה ביולוגית בקו טיפול ראשון עם תגובה טובה אך במחיר כבד של תופעות לוואי וסימן שאלה לגבי קווי הטיפול הבאים לאחר שזה ייכשל. עוד למדנו שתשלובת כימותרפיה עם ביולוגיה היא אפשרות בטוחה גם בחולים מבוגרים. למדנו שייתכן שלא צריך להחליף גם כימותרפיה וגם טיפול ביולוגי לאחר כישלון הטיפול ולעתים ניתן להסתפק בהחלפת הכימותרפיה ולשמר אותו טיפול ביולוגי גם בקו שני.
תרופה ביולוגית חדשה שהצטרפה רשמית לקו טיפולי מתקדם היא הStivarga אך לצערנו היא אינה כלולה בסל שירותי הבריאות. לעומתה כן נכללת בסל אפשרות של הזרקת חומר רדיואקטיבי לגרורות בכבד לאחר שמוצו קווי הטיפול המקובלים.
החידוש העיקרי של שנת 2013 בטיפול בסרטן המעי הגס הגרורתי הוא באיתור מוטציות ב- RASו(KRAS או NRAS) נוסף על מוטציות של KRAS באקסון 2 שהוכחו כסמנים ביולוגיים המנבאים חוסר תגובה לטיפול במעכבי הקולטן לגורם גדילה אפידרמלי. מידע זה מסייע לנו היום לבחור באופן מדויק יותר את אוכלוסיית המטופלים המתאימים לטיפול ביולוגי במעכבי הקולטן.
ביבליוגרפיה
- ↑ 1.0 1.1 NCCN Guidelines Version 3.2014
- ↑ Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors . Clin Epidemiol. 2012;4:283-301. Kanas et al
- ↑ Randomized controlled trial of cetuximab plus chemotherapy for patients with KRAS wild-type unresectable colorectal liver-limited metastases. J Clin Oncol. 2013 Jun 1;31(16):1931-8. Ye LC et al.
- ↑ Radioembolisation for liver metastases: results from a prospective 151 patient multi-institutional phase II study. Eur J Cancer. 2013 Oct;49(15):3122-30. Benson A et al
- ↑ FOLFOXIRI/bevacizumab (bev) versus FOLFIRI/bev as first-line treatment in unresectable metastatic colorectal cancer (mCRC) patients (pts): Results of the phase III TRIBE trial by GONO group. ASCO 2013 Falcone et al
- ↑ Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. The Lancet Oncology, Volume 14, Issue 11, Pages 1077 - 1085, October 2013. Cunningham D et al
- ↑ Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. The Lancet Oncology, Volume 14, Issue 1, Pages 29 - 37, January 2013. Bennouna J et al
- ↑ Lancet. 2013 Jan 26;381(9863): Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Grothey A et al
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר שרון פלס ,רופאה בכירה, המרכז לגידולי מערכת העיכול, המרכז הרפואי תל אביב ע"ש סוראסקי


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק