הבדלים בין גרסאות בדף "פוליציטמיה ורה - Polycythemia Vera"
| (118 גרסאות ביניים של 4 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=Erythromelalgia.jpg |
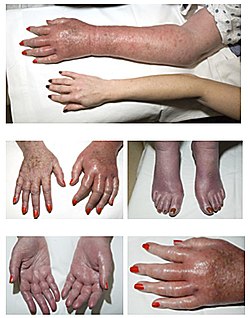
| − | |כיתוב תמונה= | + | |כיתוב תמונה=[[אריתרומללגיה]] היא תסמין של PV, מוצגת אריתרומללגיה בחולה עם פוליציטמיה ורה ארוכת שנים. שימו לב לגפיים אדמדמות ונפיחות. |
|שם עברי= פוליציטמיה ראשונית – טיפול | |שם עברי= פוליציטמיה ראשונית – טיפול | ||
|שם לועזי= Primary polycythemia– Treatment | |שם לועזי= Primary polycythemia– Treatment | ||
| − | |שמות נוספים=פוליציטמיה ורה – טיפול - | + | |שמות נוספים=PV, פוליציטמיה ורה – טיפול - Polycythemia vera – Treatment |
| − | |ICD-10= | + | |ICD-10={{ICD10|D|45||d|37}} |
| − | |ICD-9= | + | |ICD-9={{ICD9|238.4}} |
| − | |MeSH= | + | |MeSH= D011087 |
| − | |יוצר הערך= ד"ר נועה לביא | + | |יוצר הערך= ד"ר ערן זימרן על בסיס ערך שכתבה ד"ר נועה לביא. |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | {{הרחבה|מחלות מיאלופרוליפרטיביות}} | |
| − | {{הרחבה| | + | ==הקדמה== |
| − | '''פוליציטמיה ורה''' (Polycythemia | + | '''פוליציטמיה ראשונית''' או '''פוליציטמיה ורה''' (Polycythemia Vera, PV) שייכת לקבוצת המחלות המיאלופרוליפרטיביות (Myeloproliferative Neoplasms, MPN). ה-MPNs הן [[ממאירויות המטולוגיות]] בעלות מהלך כרוני ממושך ביותר והישרדות ארוכת-שנים בדרך כלל, המתאפיינות בשגשוג חריג של תאי דם צעירים שמקורם בתאי גזע המטופואטיים (Hematopoietic Stem Cells, HSCs) במח העצם, תסמינים ייחודיים, וסיבוכים כגון [[Splenomegaly|הגדלת טחול]] וסיכון גבוה לאירועי [[קרישיות יתר]], הקשורים בין השאר לשגשוג החריג ולמצב דלקתי כללי שנלווה לכך. בפוליציטמיה ורה נוצרים במח העצם יותר מידי תאי דם אדומים, תאי דם לבנים ומגהקריוצטים, ולעיתים קרובות היא מתבררת סביב הופעה של ספירות דם גבוהות. |
| + | |||
| + | ==הבנת הבסיס המולקולרי של PV והמחלות המיאלופרוליפרטיביות: עד שנת 2005, ומאז== | ||
| + | המחלות המיאלופרוליפרטיביות תוארו לראשונה בשנות ה-50 של המאה ה-20 על ידי ההמטולוג האמריקאי ויליאם דמשק, שהבחין בשגשוג חריג של תאי דם אדומים כביטוי לפעילות לא מבוקרת של תאים צעירים בלתי ממויינים במח העצם{{הערה|שם=הערה2|Vainchenker W, Kralovics R. Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms. Blood 2017;129(6):667-679}}. בעשורים שחלפו מאז, הובן שתאי דם אדומים של חולים עם PV מסוגלים לשגשג וליצור מושבות בתרבית תאים במעבדה ללא גירוי של ההורמון [[אריתרופואטין|Erythropoietin]]{{כ}} (EPO) הנחוץ במצב רגיל לשגשוגם. בנוסף, נמצאו הפרעות במבנה הכרומוזומים (בדיקת [[karyotype]]) שהן אופייניות ל-PV ול-MPN בכלל. בין ההפרעות האלו, נמצא שבחולים רבים עם PV ישנם שינויים בזרוע הקצרה של כרומוזום 9 (זרוע 9p), אך למשך מספר שנים לא נמצא הסבר ל'מוקד' כרומוזומלי זה. בשנת 2005 התגלתה מוטציה בגן Janus Kinase (JAK)-2 שנמצא בזרוע הקצרה של כרומוזום 9, המוטציה JAK2-V617F, ב-97 אחוזים מהחולים עם PV, וב-55 עד 60 אחוזים מהחולים עם סוגי ה-MPN האחרים, [[תרומבוציטוזיס ראשונית]] (ET{{כ}}, Essential Thrombocythemia) ו-[[Myelofibrosis]]{{כ}} (MF). תגלית זו היוותה פריצת דרך דרמטית בהבנה של ה-MPN, ביכולת האבחנתית, ובהמשך גם בטיפול, ותרמה להמשך הבנת הבסיס המולקולרי של ה-MPN בשנים שלאחר מכן. הגן JAK2 מקודד לחלבון קטן מסוג [[Tyrosine kinase]], הנקשר לחלק התוך-תאי בקולטנים ל-EPO ול-[[תרומבופויאטין - Thrombopoietin|Thrombopoietin]]{{כ}} (TPO) בתאים צעירים במח העצם, והוא חיוני להפעלת שרשרת העברת סיגנלים הדוחפת לחלוקת התאים. במצב רגיל, קשירה של מולקולת EPO או TPO (סיגנל מחוץ לתא, או Ligand) לרצפטור, גורמת לקשירה של JAK2 לחלק התוך תאי של הרצפטור והפעלת שרשרת העברת הסיגנלים. המוטציה JAK2-V617F גורמת לקשירת ה-Tyrosine kinase{{כ}}- JAK2 לרצפטורים גם ללא גירוי חיצוני, והפעלה רצופה של שרשרת העברת הסיגנלים לחלוקת התא. בשיעור קטן של חולים עם PV (כ-3 אחוזים) ללא המוטציה JAK2-V617F, ניתן לאתר מוטציות אחרות באקסון 12 של הגן. לחולים עם מוטציות באקסון{{כ}} 12 יש נטייה לייצור מוגבר בעיקר של השורה האדומה, וגיל מוקדם יותר באבחנה, אך מהלך המחלה והפרוגנוזה דומות לאלו עם המוטציה השכיחה. בבדיקות מולקולריות שונות ניתן לחשב את העומס האלל (Allele burden) או שיעור הופעת המוטציה (variant allele frequency), מונחים נרדפים המתארים את שיעור תאי הדם המגורענים הנושאים את המוטציה, בהשוואה לאלו שאינם נושאים. נמצא קשר בין עומס המוטציה להופעת גרד, לסיכוי יותר גבוה להתקדמות המחלה ל-Myelofibrosis, אך לא נמצא קשר להישרדות. באשר לסיכון לאירועי קרישיות ישנו מידע סותר. | ||
| + | |||
| − | ''' | + | [[קובץ:Polycythemia Vera1.png|ממוזער|מרכז|600 פיקסלים|'''תרשים מס’ 1: מערכת העברת הסיגנל דרך JAK2-STAT.'''{{ש}}קישור גורם גדילה, כמו אריתרופויטין או טרומבופויטין, לרצפטור שלו על גבי ממברנת התא (A) מביא לשינוי מבני ברצפטור באופן שמאפשר קרבה של חלבוני JAK2 זה לזה, זרחון שלהם, של הרצפטור ושל חלבוני העברת סיגנל תוך-תאיים כמו STAT. חלבוני STAT שעברו שפעול על ידי זרחון נכנסים לגרעין ופועלים כפקטורי שעתוק. המוטציה JAK2V617F גורמת לזרחון קבוע של חלבוני JAK, רצפטורים וחלבוני STAT, באופן שאינו תלוי בקישור גורם גדילה לרצפטור (B). כך מתרחשת העברת סיגנל ממושכת ושיעתוק גנים הקשורים לשגשוג תאים באופן קבוע{{הערה|Schafer AI. Molecular basis of the diagnosis and treatment of polycythemia vera and essential thrombocythemia. lood. 2006 Jun 1;107(11):4214-22.}}.]] |
| − | [[ | + | ==ביטויי המחלה== |
| + | חולים עם PV עשויים לסבול ממגוון רחב של תסמינים, אך עשויים בהחלט להיות גם א-תסמיניים (אסימפטומטיים, asymptomatic) וישנו מנעד רחב בין מטופלים שאינם חווים תסמינים כלל לאלו הסובלים מעומס תסמיני (symptom burden) גדול ופגיעה קשה באיכות החיים. ניתן להבדיל בין 3 קבוצות או מקבצים (clusters) של תסמינים: | ||
| + | #'''תסמינים סיסטמיים או כלליים''' (systemic or constitutional symptoms) כוללים [[חום]] גבוה, [[הזעות]], [[ירידה במשקל]], [[עייפות]] או [[חולשה כללית]] ו[[גרד]]. תסמינים אלו קשורים לרמות גבוהות של חלבונים מתווכי-דלקת (ציטוקינים) כגון [[IL-1α|IL1]]{{כ}} (InterLeukin){{כ}}, [[אינטרלויקין 6 Interleukin|IL6]]{{כ}}, [[IL-8|IL8]] בפלזמה של חולים, כביטוי למצב דלקתי כרוני. גרד הוא תסמין ייחודי ובולט ב-PV, שעשוי לגרום לסבל ועוגמת נפש קשה למטופלים. בביטויו הקלאסי זהו גרד שמחמיר במגע עם מים (aquagenic pruritus) ולכן מופיע לאחר מקלחת ובייחוד מקלחת עם מים חמים | ||
| + | #'''תסמינים מיקרו-וסקולריים''' (microvascular), מיקרו-איסכמיים (micro-ischemic) או וזו-מוטוריים (Vasomotor) כוללים בין השאר כאבי ראש, מיגרנות, הפרעות ראייה, תחושת כבדות של הראש או טשטוש, טינטון (צלצולים או רעשים באוזניים), סומק, נפיחות ואודם באצבעות הידיים. תסמינים אלו יוחסו באופן היסטורי לספירות הגבוהות ובייחוד [[ספירת דם - Complete blood count#כדוריות דם אדומות (אריתרוציטים)|השורה האדומה]], ולצמיגות-יתר של הדם (hyperviscosity) כתוצאה מכך. תאוריה זו הודגמה ואומתה, מצד אחד, במודלים מעבדתיים שהדגימו תופעות כמו האטות בזרימה בכלי דם קטנים או "דחיקה" של טסיות בצמוד לדופן כלי הדם על ידי הנפח המוגבר של תאי הדם האדומים. מצד שני, הובן שהסיבות התורמות לתסמינים אלו כוללות גם תכונות נוספות של תאי הדם האדומים, ה[[ספירת דם - Complete blood count#טסיות-דם (תרומבוציטים או Platelets)|טסיות]], וכן תאי האנדותל בדופן כלי הדם, שאינן קשורות לספירה הגבוהה אלא לשינויים מולקולרים הנגרמים בהשפעת המוטציה JAK2-V617F. גילויים אלו מסבירים מדוע גם מטופלים ללא [[ספירת דם - Complete blood count#המוגלובין (Hemoglobin או Hb)|המוגלובין]]/[[המאטוקריט - Hematocrit|המטוקריט]] גבוהים עשויים לסבול גם כן מתסמינים של כלי הדם וכן מאירועי [[קרישיות-יתר]] | ||
| + | # '''תסמינים הקשורים לטחול המוגדל''' (spleen-related) כגון מלאות או תחושת אי נוחות בבטן, כאבי בטן ובעיקר בבטן השמאלית העליונה, שינויים בהרגלי פעולות מעיים כגון [[שלשול]] או [[עצירות]]. התסמין הקלאסי הקשור להגדלת טחול הוא שובע מוקדם, הקשור בלחץ מקומי של הטחול הגדול על הקיבה, המגביל את מילוי הקיבה | ||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | | יש כלי יעיל שנקרא MPN (Myeloproliferative Neoplasm) Tracker - שאלון מעקב אחר התסמינים המאפשר למטופל לעקוב ולדרג את מצב התסמינים כך שיוכל לשתף בהם את הרופא לצורך ניהול נכון של המחלה. | ||
| − | + | מצורף בזאת לינק לטראקר: | |
| + | [https://www.mpntracker.com/ MPN Progress Tracker | MPN Tracker] | ||
| + | |} | ||
| − | + | ==נטייה לקרישיות יתר ודימומים== | |
| − | + | מצביים ייחודיים ב-PV: קרישיות יתר בוורידי הכבד והבטן, PV והיריון: יתווספו בסוף הסקירה. | |
| − | + | ==אבחנה ודירוג פרוגנוסטי== | |
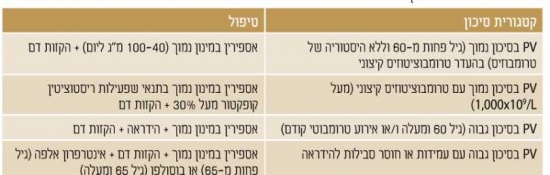
| − | + | אבחנה של PV עודכנה בשנת 2016 במסגרת קריטריונים חדשים שפרסם ארגון הבריאות העולמי לאבחנה וסיווג של כלל הממאירויות ההמטולוגיות של השורה המאילואידית (myeloid malignancies). האבחנה דורשת את קיומם של שלושה קריטריונים מג'וריים (Major) או שני קריטריונים מג'וריים וקריטריון מינורי (Minor). הקריטריונים המג'וריים הם ערכי המוגלובין או המטוקריט גבוהים, עדות לשגשוג יתר אופייני בבדיקת פתולוגיה של [[מח עצם|מח העצם]], וזיהוי המוטציה [[JAK2-V617F]]{{כ}} (Janus Kinase) או מרקר קלונלי (clonal marker) אחר (כגון מוטציה באקסון 12, מוטציה אופיינית אחרת, או הפרעות כרומוזומליות אופייניות) בבדיקות מולקולריות. הקריטריון המינורי הוא רמת [[אריתרופויאטין - Erythropoietin|Erythropoietin]] נמוכה, והוא תורם לביסוס האבחנה במצבים בהם לא ניתן למצוא מוטציה ב-JAK2 או לא ניתן לבצע בדיקת מח עצם. המונח masked PV מתייחס לחולים עם מוטציה ב-JAK2 ומאפיינים במח העצם המתאימים ל-PV, למרות ערך המוגלובין נמוך יותר. ערך המוגלובין של 16.5 גרם/דציליטר בגברים ו-16.5-15 גרם/דציליטר בנשים נקבע כערך הסף לאבחנה בין חולים עם masked PV לחולים עם ET. | |
| − | = | + | [[קובץ:פוליציטמיה1.jpg|ממוזער|מרכז|550 פיקסלים|טבלה 1. קריטריונים של ארגון הבריאות העולמי (2008) לאבחון של פוליציטימיה ורה{{ש}} המוגלובין מעל לאחוזון 99; או מעל 17 גרם/דציליטר בגברים ו-15 גרם/דציליטר בנשים, אם מלווה בעלייה קבועה של לפחות 2 גרמים/דציליטר מערך הבסיס ולא משני לתיקון של חוסר ברזל; או עלייה בנפח כדוריות דם אדומות מעל 25 אחוזים מהערך הממוצע המצופה{{הערה|שם=הערה1|Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016;127(20):2391–2405.}}]] |
| − | + | '''גורמי סיכון המשפיעים על הישרדות והתקדמות למיאלופיברוזיס או לוקמיה:''' מחקר שפורסם הדגים חציון הישרדות של 14 שנים בחולים עם PV, ובחולים צעירים מתחת לגיל 60, חציון ההישרדות הוא 24 שנים. הסיכוי להתמרה (transformation) ל[[לוקמיה לימפובלסטית חדה (חריפה)|לוקמיה חריפה]] (Acute Lymphoblastic Leukemia, ALL) במעקב של 20 שנים הוא פחות מ-10 אחוזים, והסיכוי להתמרה ל-Myelofibrosis מעט גבוה יותר{{הערה|שם=הערה3|Mesa RA, Niblack J, Wadleigh M, et al. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients. Cancer 2007;109:68-76. | |
| − | = | + | *This study provided a large cohort-based appreciation of the symptom burden and effect on quality of life of the MPNs, and led to the development of standardized tools to measure symptom burden, and their subsequent inclusion in clinical trial outcomes. Reflects the magnitude of pruritus in MPNs.}}. גורמי הסיכון המשפיעים על ההישרדות כוללים גיל מבוגר, ספירה לבנה גבוהה (Leukocytosis) ואירוע טרומבוטי ([[פקקת]], Thrombosis) קודם{{הערה|שם=הערה4|1. Marchioli R, Finazzi G, Specchia G, et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Eng J Med 2013;368:22-33.}}. גורמי הסיכון המשפיעים על הסיכון להתמרה ללוקמיה כוללים גיל מבוגר, ספירה לבנה גבוהה וקריוטיפ (Karyotype) לא תקין{{הערה|שם=הערה4}}. |
| − | + | '''גורמי סיכון לטרומבוזיס ודימום:''' חולים בסיכון גבוה לטרומבוזיס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ורידי) בעברם. טסיות דם מעל מיליון הם סיכון מוגבר לדמם. | |
| − | |||
| − | ===טיפול | + | ==עקרונות טיפול ב-PV== |
| + | מאחר ששיעורי ההישרדות גבוהים והסכנה להתמרה ללוקמיה או התקדמות ל-Myelofibrosis נמוכים מאוד, לא מומלץ לטפל (בכל טיפול) באופן שגרתי על מנת להשפיע על המהלך הטבעי של המחלה. מצד שני, הסכנה לאירוע קרישיות-יתר עולה על 20 אחוזים וחלק לא מבוטל מהחולים סובל מהפרעות וזומוטוריות; [[כאבי ראש]], [[סחרחורת]], עקצוצים בקצות האצבעות, [[Erythromelalgia]] (התקפי כאב ואודם בקצות האצבעות), כאבים לא טיפוסיים בחזה וגרד. בחולים עם מספר טסיות מעל מיליון עשויה להיות נטייה לדמם. לכן, מטרת הטיפול העיקרית היא למנוע סיבוכים טרומבוטיים או דמם, ומטרת הטיפול השניונית היא לווסת את התסמינים המיקרווסקולריים (טבלה 2){{הערה|שם=הערה5|Landolfi R, Marchioli R, Kutti J et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Eng J Med 2004;350:114-24.}}. | ||
| − | + | [[קובץ:פוליציטמיה2.jpg|ממוזער|מרכז|550 פיקסלים|טבלה 2. טיפול על פי סיכון ב-PV]] | |
| − | |||
| + | במחקר המבוקר ה-ECLAP study {{כ}}(European Collaboration study on Low-dose Aspirin in Polycythemia) הוכחה יעילות הטיפול ב[[אספירין]] במינון נמוך למניעת אירועים טרומבוטיים בחולי PV בכל דרגות הסיכון{{הערה|שם=הערה6|How J, Zhou A and Oh ST. Splanchnic vein thrombosis in myeloproliferative neoplasms: pathophysiology and molecular mechanisms of disease. Ther Adv Hematol 2017;8(3):107-118.}}. מחקרים הראו גם את היעילות של הקזות דם ([[Phlebotomy]]) בכל חולי ה- PV, כאשר מחקר CYTO-PV {{כ}}(CYTOreductive therapy in Polycythemia Vera){{כ}}{{הערה|שם=הערה7|Hoekstra J, Bresser EL, Smalberg JH, et al. Long-term follow up of patients with portal vein thrombosis and myeloproliferative neoplasms. J Thromb Haemost 2011;9(11):2208-2214.}} הראה כי לחולים ששמרו על המטוקריט של פחות מ-45 אחוזים היו פחות אירועים טרומבוטיים ותמותה קרדיווסקולרית נמוכה יותר לעומת חולים עם המטוקריט שבין 45–50 אחוזים, ולכן המטרה הטיפולית היא לשמור על המטוקריט של פחות מ-45 אחוזים. | ||
| + | גם אספירין במינון נמוך מפחית תסמינים וזומוטוריים. אם אין השפעה תחת טיפול באספירין במינון נמוך ניתן להעלות את מינון האספירין לפעמיים ביום או לטפל ב-Plavix {{כ}}([[Clopidogrel]]) או בשילוב של שתי התרופות יחד. במקרים מסוימים אספירין הניתן פעמיים ביום יעיל יותר מאשר פעם ביום ולכן, שוקלים לעיתים גישה טיפולית זו בחולים עמידים לטיפול באספירין פעם ביום או לאלו עם יותר גורמי סיכון לטרומבוזיס עורקי. | ||
| − | הפעילות | + | גרד מופיע ברוב החולים עם PV ולרוב מוחמר על ידי מים חמים. יש להתחיל טיפול באמצעים לא תרופתיים כגון הימנעות מגורמים מחמירים (הימנעות מעור יבש, טמפרטורות קיצוניות ורחצה במים חמים). תיתכן תגובה לאנטי-היסטמינים ([[Anti-histamines|Antihistamines]]). תוארה תגובה של מעל 50 אחוזים לגרד על ידי שימוש ב-[[Paroxetine]]) Seroxat, Paxxet), תרופה נוגדת דיכאון ממשפחת ה-[[SSRI]]{{כ}} (Selective Serotonin Reuptake Inhibitors). טיפולים אחרים יעילים לגרד כוללים טיפול ב-[[Interferon]], מעכבי JAK ו[[פוטותרפיה]] (Phototherapy). |
| − | טיפול בחולי PV בסיכון | + | |
| − | + | [[תסמונת וון-וילברנד]] נרכשת (Acquired von Willebrand Syndrome, AvWS), שכיחה בחולי PV ומתאפיינת באיבוד מולטימרים גדולים של פקטור Von-Willebrand, בשל פירוק מוגבר על ידי ADAMTS13 התלוי בחומרת הטרומבוציטוזיס. AvWS מביאה להפרעה תפקודית משמעותית יותר מאשר נראה כאשר בודקים את אנטיגן Von-Willebrand ורמות [[FACTOR VIII|פקטור VIII]] ולכן יש צורך בתבחינים המעריכים את תפקוד פקטור Von-Willebrand כגון פעילות Ristocetin Cofactor {{כ}}(RCo). כשרמת הטסיות מעל 109X1000/ליטר יש למדוד את פעילות RCo ולשקול הימנעות מאספירין אם הפעילות פחותה מ-30 אחוזים, מחשש לדמם. מצד שני, טרומבוציטוזיס קיצונית לא מגבירה סיכון לטרומבוזיס ואינה מהווה התוויה לטיפול ציטורדוקטיבי ([[Cytoreductive treatment|Cytoreductive]]). | |
| − | עמידות או חוסר סבילות | + | |
| − | + | ===טיפול בחולי PV בסיכון גבוה=== | |
| − | חולים | + | בנוסף לאספירין והקזות דם, חולים בסיכון גבוה (גיל 60 ומעלה או אירוע טרומבוטי קודם) צריכים לקבל גם טיפול ציטורדוקטיבי ב-[[Hydroxycarbamide]]{{כ}} (Hydroxyurea, Hydrea) על מנת להפחית סכנה לטרומבוזיס. בחולים עם אירוע טרומבוטי ורידי מומלץ לטפל בנוגדי קרישה ולשקול טיפול באספירין. טרנספורמציה לוקמית הוכחה כקשורה לטיפול ב-[[Pipobroman]] ו-P32 שאינם בשימוש, אך אינה קשורה לטיפול ב-Hydrea. |
| − | + | ||
| − | + | ===טיפול בחולי PV בסיכון גבוה עם עמידות או חוסר סבילות ל-Hydrea=== | |
| − | + | עמידות או חוסר סבילות ל-Hydrea (טבלה 3){{הערה|שם=הערה8|Harrison CN, Robinson SE. Myeloproliferative disorders in pregnancy. Hematol Oncol Clin N Am 2011;25:261-275.}} יכולה להתפתח ב-20–25 אחוזים מהחולים עם PV{{כ}}{{הערה|שם=הערה9|Vannucchi AM, Kiladjian JJ, Griesshammer M, et al. Ruxolitinib versus standard therapy for the treatment of polycytemia vera. N Eng J Med 2015;372(5):426-435.}}. עמידות קשורה לסיכון מוגבר להתמרה ללוקמיה ו-Myelofibrosis וירידה בהישרדות. ההישרדות הממוצעת בחולים עמידים ל-Hydrea היא 1.2 שנים בלבד. חוסר סבילות ל-Hydrea לא משפיע על הפרוגנוזה.{{כ}} | |
| − | + | ||
| − | + | [[קובץ:פוליציטמיה3.png|ממוזער|מרכז|550 פיקסלים|טבלה 3. קריטריונים לעמידות או חוסר סבילות ל-Hydrea{{כ}}, ELN) European Leukemia Net)]] | |
| − | + | ||
| − | + | חולים אלו יכולים להיות מטופלים בצורה יעילה על ידי Interferon או [[Busulphan]]. מחקרים קליניים הדגימו שיעור גבוה של הפוגה המטולוגית עם טיפול ב-[[t:Peginterferon alfa|Peginterferon]] ואף ירידה ב-JAK2(V617F) Allele burden. אולם, הטיפול ב-Interferon כרוך בתופעות לוואי קשות ורבים מהחולים לא סובלים טיפול זה. מנגד, קיים חשש שטיפול ב-Busulphan מגביר סיכוי להתמרה ללוקמיה ולכן מעדיפים להימנע מהשימוש בו בחולים צעירים. | |
| − | + | ||
| − | + | קבוצת החולים עם PV עם חוסר סבילות או עמידות לטיפול ב-Hydrea ואלו הממשיכים להיות סימפטומטיים למרות טיפול ב-Hydrea מהווים קבוצה של חולים עם צרכים שלרוב אין להם פתרון עם הטיפולים הקיימים. התמרה ללוקמיה מ-PV בדרך כלל מופיעה בתאים שהם שליליים למוטציה (JAK2(V617F ולכן ירידה ב-Allele burden של (JAK2(V617F על ידי תרופות לא בהכרח מתורגמת ליתרון ארוך טווח. | |
| − | + | ||
| − | + | מחקרים קליניים ב-PV שמים דגש על קבוצות חולים אלו. מבין התרופות הנחקרות, מעכבי JAK עשויים להיות בעלי ערך טיפולי בחולים עם עמידות או חוסר סבילות ל-Hydrea. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| − | + | <blockquote> | |
| − | <blockquote> | + | {{הערות שוליים|יישור=שמאל}} |
<div style="text-align: left; direction: ltr"> | <div style="text-align: left; direction: ltr"> | ||
| + | *Verstovsek S, Passamonti F, Rambaldi A, et al. Ruxolitinib for essential thrombocythemia refractory to or intolerant of hydroxyurea: long-term phase 2 study results. Blood 2017;130(15):1768-1771. | ||
| + | *Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Eng J Med 2012;366(9):799-807. | ||
| + | *Harrison C, Kiladjian JJ, Al-Ali HK et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Eng J Med 2012;366(9):787-798. | ||
| + | *Vannucchi AM, Harrison CN. Emerging treatments for classical myeloproliferative neoplasms. Blood 2017;129(6):693-702. | ||
| + | *Smalberg JH, Arends LR, Valla DC, et al. Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis. Blood 2012;120(25):4921-4928. | ||
| + | (*) A large meta-analysis providing important epidemiological data on the prevalence of MPNs and the JAK2V617F mutation in 1917 cases of splanchnic vein thrombosis. | ||
| + | *Falagna A, Marchetti M, Vignoli A, et al. Leukocyte-platelet interaction in patients with essential thrombocythemia and polycythemia vera. Exp Hematol 2005;33(5):523-530. | ||
| + | *Kreher S, Ochsenreither S, Trappe RU et al. Prophylaxis and management of venous thromboembolism in patients with myeloproliferative neoplasms: consensus stetement of the Haemostasis Working Party of the German Society of Hematology and Oncology (DGHO), the Austrian Society of Hematology and Oncology (OGHO) and society of Thrombosis and Haemostasis Research (GTHe.V.). Ann Hematol 2014;93:1953-1963. | ||
| + | *De Stefano V, Ruggeri M, Cervantes F et al. High rate of recurrent venous thromboembolism in patients with myeloproliferative neoplasms and effect of prophilaxis with vitamin K anatagonists. Leukemia 2016;30:2032-2038. | ||
| + | *Lavi N, Brenner B, Avivi I. Management of pregnant women with myeloproliferative neoplasms. Thrombosis Research 2013;131(1):S11-S13. | ||
| + | *Passamonti F, Randi ML, Rumi E et al. Increased risk of pregnancy complications in patients with essential thrombocythemia carrying the JAK2(617V>f) mutation. Blood 2007;110(2):485-489. | ||
| + | *Alimam S, Bewley S, Chappell LC et al. Pregnancy outcomes in myeloproliferative neoplasms: UK prospective cohort study. Brit J Hematol 2016;175:31-36. | ||
| − | + | (*)The only prospective study to date evaluating pregnancy outcomes in MPN patients, identified through a nation-wide survey in the UK. Includes important observations that may be less biased than previous retrospective studies. | |
| − | + | *Barbui T, Barosi G, Birgegard G et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol 2011;29(6):61-770. (pregnancy section) | |
| + | *Siegel FP, Tauscher J, Petrides PE. Aquagenic pruritus in polycythemia vera: charactersitics and influence on quality of life in 441 patients. Am J Hematol 2013;88:665-669. | ||
| + | *Saini KS, Patnaik MM and Tefferi A. Polycythemia vera-associated pruritus and its management. Eur J Clin Invest 2010;40(9):828-834. | ||
| + | *Scherber RM, Geyer HL, Dueck AC et al. The potential role of hematocrit control on symptom burden among polycytemia vera patients: Insights from the CYTO-PV and MPN-SAF patient cohorts. Leukemia and Lymphoma 2017:58(6):1481-1487. | ||
| + | *Mesa R, Jamieson C, Bhatia R, et al. Myeloproliferative neoplasms, version 2.2017: NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network 2016;14(12):1572-1611. | ||
</div> | </div> | ||
</blockquote> | </blockquote> | ||
==קישורים חיצוניים== | ==קישורים חיצוניים== | ||
| + | {{ייחוס|ד"ר נועה לביא. המכון ההמטולוגי, הקריה הרפואית רמב"ם, חיפה, עודכן בשנת 2023 על ידי ד"ר ערן זימרן, המחלקה ההמטולוגית ויחידת הקרישה במרכז הרפואי הדסה}} | ||
| − | + | [[קטגוריה:המטולוגיה]] | |
| − | [[קטגוריה: המטולוגיה]] | + | [[קטגוריה:אונקולוגיה]] |
| − | [[קטגוריה: אונקולוגיה]] | ||
גרסה אחרונה מ־12:57, 3 ביולי 2023
| פוליציטמיה ראשונית – טיפול | ||
|---|---|---|
| Primary polycythemia– Treatment | ||
| ||
אריתרומללגיה היא תסמין של PV, מוצגת אריתרומללגיה בחולה עם פוליציטמיה ורה ארוכת שנים. שימו לב לגפיים אדמדמות ונפיחות.
| ||
| שמות נוספים | PV, פוליציטמיה ורה – טיפול - Polycythemia vera – Treatment | |
| ICD-10 | Chapter D 45. | |
| ICD-9 | 238.4 | |
| MeSH | D011087 | |
| יוצר הערך | ד"ר ערן זימרן על בסיס ערך שכתבה ד"ר נועה לביא. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות מיאלופרוליפרטיביות
הקדמה
פוליציטמיה ראשונית או פוליציטמיה ורה (Polycythemia Vera, PV) שייכת לקבוצת המחלות המיאלופרוליפרטיביות (Myeloproliferative Neoplasms, MPN). ה-MPNs הן ממאירויות המטולוגיות בעלות מהלך כרוני ממושך ביותר והישרדות ארוכת-שנים בדרך כלל, המתאפיינות בשגשוג חריג של תאי דם צעירים שמקורם בתאי גזע המטופואטיים (Hematopoietic Stem Cells, HSCs) במח העצם, תסמינים ייחודיים, וסיבוכים כגון הגדלת טחול וסיכון גבוה לאירועי קרישיות יתר, הקשורים בין השאר לשגשוג החריג ולמצב דלקתי כללי שנלווה לכך. בפוליציטמיה ורה נוצרים במח העצם יותר מידי תאי דם אדומים, תאי דם לבנים ומגהקריוצטים, ולעיתים קרובות היא מתבררת סביב הופעה של ספירות דם גבוהות.
הבנת הבסיס המולקולרי של PV והמחלות המיאלופרוליפרטיביות: עד שנת 2005, ומאז
המחלות המיאלופרוליפרטיביות תוארו לראשונה בשנות ה-50 של המאה ה-20 על ידי ההמטולוג האמריקאי ויליאם דמשק, שהבחין בשגשוג חריג של תאי דם אדומים כביטוי לפעילות לא מבוקרת של תאים צעירים בלתי ממויינים במח העצם[1]. בעשורים שחלפו מאז, הובן שתאי דם אדומים של חולים עם PV מסוגלים לשגשג וליצור מושבות בתרבית תאים במעבדה ללא גירוי של ההורמון Erythropoietin (EPO) הנחוץ במצב רגיל לשגשוגם. בנוסף, נמצאו הפרעות במבנה הכרומוזומים (בדיקת karyotype) שהן אופייניות ל-PV ול-MPN בכלל. בין ההפרעות האלו, נמצא שבחולים רבים עם PV ישנם שינויים בזרוע הקצרה של כרומוזום 9 (זרוע 9p), אך למשך מספר שנים לא נמצא הסבר ל'מוקד' כרומוזומלי זה. בשנת 2005 התגלתה מוטציה בגן Janus Kinase (JAK)-2 שנמצא בזרוע הקצרה של כרומוזום 9, המוטציה JAK2-V617F, ב-97 אחוזים מהחולים עם PV, וב-55 עד 60 אחוזים מהחולים עם סוגי ה-MPN האחרים, תרומבוציטוזיס ראשונית (ET, Essential Thrombocythemia) ו-Myelofibrosis (MF). תגלית זו היוותה פריצת דרך דרמטית בהבנה של ה-MPN, ביכולת האבחנתית, ובהמשך גם בטיפול, ותרמה להמשך הבנת הבסיס המולקולרי של ה-MPN בשנים שלאחר מכן. הגן JAK2 מקודד לחלבון קטן מסוג Tyrosine kinase, הנקשר לחלק התוך-תאי בקולטנים ל-EPO ול-Thrombopoietin (TPO) בתאים צעירים במח העצם, והוא חיוני להפעלת שרשרת העברת סיגנלים הדוחפת לחלוקת התאים. במצב רגיל, קשירה של מולקולת EPO או TPO (סיגנל מחוץ לתא, או Ligand) לרצפטור, גורמת לקשירה של JAK2 לחלק התוך תאי של הרצפטור והפעלת שרשרת העברת הסיגנלים. המוטציה JAK2-V617F גורמת לקשירת ה-Tyrosine kinase- JAK2 לרצפטורים גם ללא גירוי חיצוני, והפעלה רצופה של שרשרת העברת הסיגנלים לחלוקת התא. בשיעור קטן של חולים עם PV (כ-3 אחוזים) ללא המוטציה JAK2-V617F, ניתן לאתר מוטציות אחרות באקסון 12 של הגן. לחולים עם מוטציות באקסון 12 יש נטייה לייצור מוגבר בעיקר של השורה האדומה, וגיל מוקדם יותר באבחנה, אך מהלך המחלה והפרוגנוזה דומות לאלו עם המוטציה השכיחה. בבדיקות מולקולריות שונות ניתן לחשב את העומס האלל (Allele burden) או שיעור הופעת המוטציה (variant allele frequency), מונחים נרדפים המתארים את שיעור תאי הדם המגורענים הנושאים את המוטציה, בהשוואה לאלו שאינם נושאים. נמצא קשר בין עומס המוטציה להופעת גרד, לסיכוי יותר גבוה להתקדמות המחלה ל-Myelofibrosis, אך לא נמצא קשר להישרדות. באשר לסיכון לאירועי קרישיות ישנו מידע סותר.
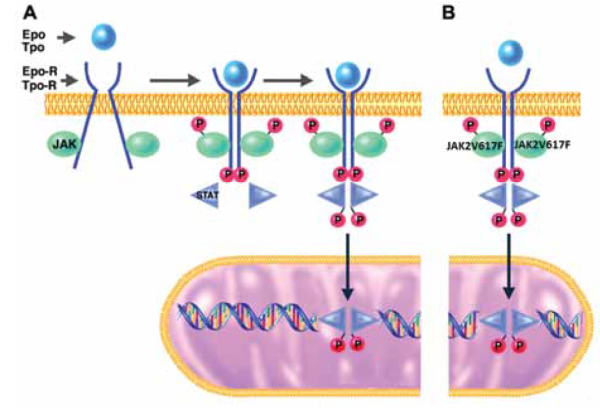
קישור גורם גדילה, כמו אריתרופויטין או טרומבופויטין, לרצפטור שלו על גבי ממברנת התא (A) מביא לשינוי מבני ברצפטור באופן שמאפשר קרבה של חלבוני JAK2 זה לזה, זרחון שלהם, של הרצפטור ושל חלבוני העברת סיגנל תוך-תאיים כמו STAT. חלבוני STAT שעברו שפעול על ידי זרחון נכנסים לגרעין ופועלים כפקטורי שעתוק. המוטציה JAK2V617F גורמת לזרחון קבוע של חלבוני JAK, רצפטורים וחלבוני STAT, באופן שאינו תלוי בקישור גורם גדילה לרצפטור (B). כך מתרחשת העברת סיגנל ממושכת ושיעתוק גנים הקשורים לשגשוג תאים באופן קבוע[2].
ביטויי המחלה
חולים עם PV עשויים לסבול ממגוון רחב של תסמינים, אך עשויים בהחלט להיות גם א-תסמיניים (אסימפטומטיים, asymptomatic) וישנו מנעד רחב בין מטופלים שאינם חווים תסמינים כלל לאלו הסובלים מעומס תסמיני (symptom burden) גדול ופגיעה קשה באיכות החיים. ניתן להבדיל בין 3 קבוצות או מקבצים (clusters) של תסמינים:
- תסמינים סיסטמיים או כלליים (systemic or constitutional symptoms) כוללים חום גבוה, הזעות, ירידה במשקל, עייפות או חולשה כללית וגרד. תסמינים אלו קשורים לרמות גבוהות של חלבונים מתווכי-דלקת (ציטוקינים) כגון IL1 (InterLeukin), IL6, IL8 בפלזמה של חולים, כביטוי למצב דלקתי כרוני. גרד הוא תסמין ייחודי ובולט ב-PV, שעשוי לגרום לסבל ועוגמת נפש קשה למטופלים. בביטויו הקלאסי זהו גרד שמחמיר במגע עם מים (aquagenic pruritus) ולכן מופיע לאחר מקלחת ובייחוד מקלחת עם מים חמים
- תסמינים מיקרו-וסקולריים (microvascular), מיקרו-איסכמיים (micro-ischemic) או וזו-מוטוריים (Vasomotor) כוללים בין השאר כאבי ראש, מיגרנות, הפרעות ראייה, תחושת כבדות של הראש או טשטוש, טינטון (צלצולים או רעשים באוזניים), סומק, נפיחות ואודם באצבעות הידיים. תסמינים אלו יוחסו באופן היסטורי לספירות הגבוהות ובייחוד השורה האדומה, ולצמיגות-יתר של הדם (hyperviscosity) כתוצאה מכך. תאוריה זו הודגמה ואומתה, מצד אחד, במודלים מעבדתיים שהדגימו תופעות כמו האטות בזרימה בכלי דם קטנים או "דחיקה" של טסיות בצמוד לדופן כלי הדם על ידי הנפח המוגבר של תאי הדם האדומים. מצד שני, הובן שהסיבות התורמות לתסמינים אלו כוללות גם תכונות נוספות של תאי הדם האדומים, הטסיות, וכן תאי האנדותל בדופן כלי הדם, שאינן קשורות לספירה הגבוהה אלא לשינויים מולקולרים הנגרמים בהשפעת המוטציה JAK2-V617F. גילויים אלו מסבירים מדוע גם מטופלים ללא המוגלובין/המטוקריט גבוהים עשויים לסבול גם כן מתסמינים של כלי הדם וכן מאירועי קרישיות-יתר
- תסמינים הקשורים לטחול המוגדל (spleen-related) כגון מלאות או תחושת אי נוחות בבטן, כאבי בטן ובעיקר בבטן השמאלית העליונה, שינויים בהרגלי פעולות מעיים כגון שלשול או עצירות. התסמין הקלאסי הקשור להגדלת טחול הוא שובע מוקדם, הקשור בלחץ מקומי של הטחול הגדול על הקיבה, המגביל את מילוי הקיבה
| יש כלי יעיל שנקרא MPN (Myeloproliferative Neoplasm) Tracker - שאלון מעקב אחר התסמינים המאפשר למטופל לעקוב ולדרג את מצב התסמינים כך שיוכל לשתף בהם את הרופא לצורך ניהול נכון של המחלה.
מצורף בזאת לינק לטראקר: MPN Progress Tracker | MPN Tracker |
נטייה לקרישיות יתר ודימומים
מצביים ייחודיים ב-PV: קרישיות יתר בוורידי הכבד והבטן, PV והיריון: יתווספו בסוף הסקירה.
אבחנה ודירוג פרוגנוסטי
אבחנה של PV עודכנה בשנת 2016 במסגרת קריטריונים חדשים שפרסם ארגון הבריאות העולמי לאבחנה וסיווג של כלל הממאירויות ההמטולוגיות של השורה המאילואידית (myeloid malignancies). האבחנה דורשת את קיומם של שלושה קריטריונים מג'וריים (Major) או שני קריטריונים מג'וריים וקריטריון מינורי (Minor). הקריטריונים המג'וריים הם ערכי המוגלובין או המטוקריט גבוהים, עדות לשגשוג יתר אופייני בבדיקת פתולוגיה של מח העצם, וזיהוי המוטציה JAK2-V617F (Janus Kinase) או מרקר קלונלי (clonal marker) אחר (כגון מוטציה באקסון 12, מוטציה אופיינית אחרת, או הפרעות כרומוזומליות אופייניות) בבדיקות מולקולריות. הקריטריון המינורי הוא רמת Erythropoietin נמוכה, והוא תורם לביסוס האבחנה במצבים בהם לא ניתן למצוא מוטציה ב-JAK2 או לא ניתן לבצע בדיקת מח עצם. המונח masked PV מתייחס לחולים עם מוטציה ב-JAK2 ומאפיינים במח העצם המתאימים ל-PV, למרות ערך המוגלובין נמוך יותר. ערך המוגלובין של 16.5 גרם/דציליטר בגברים ו-16.5-15 גרם/דציליטר בנשים נקבע כערך הסף לאבחנה בין חולים עם masked PV לחולים עם ET.

המוגלובין מעל לאחוזון 99; או מעל 17 גרם/דציליטר בגברים ו-15 גרם/דציליטר בנשים, אם מלווה בעלייה קבועה של לפחות 2 גרמים/דציליטר מערך הבסיס ולא משני לתיקון של חוסר ברזל; או עלייה בנפח כדוריות דם אדומות מעל 25 אחוזים מהערך הממוצע המצופה[3]
גורמי סיכון המשפיעים על הישרדות והתקדמות למיאלופיברוזיס או לוקמיה: מחקר שפורסם הדגים חציון הישרדות של 14 שנים בחולים עם PV, ובחולים צעירים מתחת לגיל 60, חציון ההישרדות הוא 24 שנים. הסיכוי להתמרה (transformation) ללוקמיה חריפה (Acute Lymphoblastic Leukemia, ALL) במעקב של 20 שנים הוא פחות מ-10 אחוזים, והסיכוי להתמרה ל-Myelofibrosis מעט גבוה יותר[4]. גורמי הסיכון המשפיעים על ההישרדות כוללים גיל מבוגר, ספירה לבנה גבוהה (Leukocytosis) ואירוע טרומבוטי (פקקת, Thrombosis) קודם[5]. גורמי הסיכון המשפיעים על הסיכון להתמרה ללוקמיה כוללים גיל מבוגר, ספירה לבנה גבוהה וקריוטיפ (Karyotype) לא תקין[5].
גורמי סיכון לטרומבוזיס ודימום: חולים בסיכון גבוה לטרומבוזיס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ורידי) בעברם. טסיות דם מעל מיליון הם סיכון מוגבר לדמם.
עקרונות טיפול ב-PV
מאחר ששיעורי ההישרדות גבוהים והסכנה להתמרה ללוקמיה או התקדמות ל-Myelofibrosis נמוכים מאוד, לא מומלץ לטפל (בכל טיפול) באופן שגרתי על מנת להשפיע על המהלך הטבעי של המחלה. מצד שני, הסכנה לאירוע קרישיות-יתר עולה על 20 אחוזים וחלק לא מבוטל מהחולים סובל מהפרעות וזומוטוריות; כאבי ראש, סחרחורת, עקצוצים בקצות האצבעות, Erythromelalgia (התקפי כאב ואודם בקצות האצבעות), כאבים לא טיפוסיים בחזה וגרד. בחולים עם מספר טסיות מעל מיליון עשויה להיות נטייה לדמם. לכן, מטרת הטיפול העיקרית היא למנוע סיבוכים טרומבוטיים או דמם, ומטרת הטיפול השניונית היא לווסת את התסמינים המיקרווסקולריים (טבלה 2)[6].
במחקר המבוקר ה-ECLAP study (European Collaboration study on Low-dose Aspirin in Polycythemia) הוכחה יעילות הטיפול באספירין במינון נמוך למניעת אירועים טרומבוטיים בחולי PV בכל דרגות הסיכון[7]. מחקרים הראו גם את היעילות של הקזות דם (Phlebotomy) בכל חולי ה- PV, כאשר מחקר CYTO-PV (CYTOreductive therapy in Polycythemia Vera)[8] הראה כי לחולים ששמרו על המטוקריט של פחות מ-45 אחוזים היו פחות אירועים טרומבוטיים ותמותה קרדיווסקולרית נמוכה יותר לעומת חולים עם המטוקריט שבין 45–50 אחוזים, ולכן המטרה הטיפולית היא לשמור על המטוקריט של פחות מ-45 אחוזים.
גם אספירין במינון נמוך מפחית תסמינים וזומוטוריים. אם אין השפעה תחת טיפול באספירין במינון נמוך ניתן להעלות את מינון האספירין לפעמיים ביום או לטפל ב-Plavix (Clopidogrel) או בשילוב של שתי התרופות יחד. במקרים מסוימים אספירין הניתן פעמיים ביום יעיל יותר מאשר פעם ביום ולכן, שוקלים לעיתים גישה טיפולית זו בחולים עמידים לטיפול באספירין פעם ביום או לאלו עם יותר גורמי סיכון לטרומבוזיס עורקי.
גרד מופיע ברוב החולים עם PV ולרוב מוחמר על ידי מים חמים. יש להתחיל טיפול באמצעים לא תרופתיים כגון הימנעות מגורמים מחמירים (הימנעות מעור יבש, טמפרטורות קיצוניות ורחצה במים חמים). תיתכן תגובה לאנטי-היסטמינים (Antihistamines). תוארה תגובה של מעל 50 אחוזים לגרד על ידי שימוש ב-Paroxetine) Seroxat, Paxxet), תרופה נוגדת דיכאון ממשפחת ה-SSRI (Selective Serotonin Reuptake Inhibitors). טיפולים אחרים יעילים לגרד כוללים טיפול ב-Interferon, מעכבי JAK ופוטותרפיה (Phototherapy).
תסמונת וון-וילברנד נרכשת (Acquired von Willebrand Syndrome, AvWS), שכיחה בחולי PV ומתאפיינת באיבוד מולטימרים גדולים של פקטור Von-Willebrand, בשל פירוק מוגבר על ידי ADAMTS13 התלוי בחומרת הטרומבוציטוזיס. AvWS מביאה להפרעה תפקודית משמעותית יותר מאשר נראה כאשר בודקים את אנטיגן Von-Willebrand ורמות פקטור VIII ולכן יש צורך בתבחינים המעריכים את תפקוד פקטור Von-Willebrand כגון פעילות Ristocetin Cofactor (RCo). כשרמת הטסיות מעל 109X1000/ליטר יש למדוד את פעילות RCo ולשקול הימנעות מאספירין אם הפעילות פחותה מ-30 אחוזים, מחשש לדמם. מצד שני, טרומבוציטוזיס קיצונית לא מגבירה סיכון לטרומבוזיס ואינה מהווה התוויה לטיפול ציטורדוקטיבי (Cytoreductive).
טיפול בחולי PV בסיכון גבוה
בנוסף לאספירין והקזות דם, חולים בסיכון גבוה (גיל 60 ומעלה או אירוע טרומבוטי קודם) צריכים לקבל גם טיפול ציטורדוקטיבי ב-Hydroxycarbamide (Hydroxyurea, Hydrea) על מנת להפחית סכנה לטרומבוזיס. בחולים עם אירוע טרומבוטי ורידי מומלץ לטפל בנוגדי קרישה ולשקול טיפול באספירין. טרנספורמציה לוקמית הוכחה כקשורה לטיפול ב-Pipobroman ו-P32 שאינם בשימוש, אך אינה קשורה לטיפול ב-Hydrea.
טיפול בחולי PV בסיכון גבוה עם עמידות או חוסר סבילות ל-Hydrea
עמידות או חוסר סבילות ל-Hydrea (טבלה 3)[9] יכולה להתפתח ב-20–25 אחוזים מהחולים עם PV[10]. עמידות קשורה לסיכון מוגבר להתמרה ללוקמיה ו-Myelofibrosis וירידה בהישרדות. ההישרדות הממוצעת בחולים עמידים ל-Hydrea היא 1.2 שנים בלבד. חוסר סבילות ל-Hydrea לא משפיע על הפרוגנוזה.
חולים אלו יכולים להיות מטופלים בצורה יעילה על ידי Interferon או Busulphan. מחקרים קליניים הדגימו שיעור גבוה של הפוגה המטולוגית עם טיפול ב-Peginterferon ואף ירידה ב-JAK2(V617F) Allele burden. אולם, הטיפול ב-Interferon כרוך בתופעות לוואי קשות ורבים מהחולים לא סובלים טיפול זה. מנגד, קיים חשש שטיפול ב-Busulphan מגביר סיכוי להתמרה ללוקמיה ולכן מעדיפים להימנע מהשימוש בו בחולים צעירים.
קבוצת החולים עם PV עם חוסר סבילות או עמידות לטיפול ב-Hydrea ואלו הממשיכים להיות סימפטומטיים למרות טיפול ב-Hydrea מהווים קבוצה של חולים עם צרכים שלרוב אין להם פתרון עם הטיפולים הקיימים. התמרה ללוקמיה מ-PV בדרך כלל מופיעה בתאים שהם שליליים למוטציה (JAK2(V617F ולכן ירידה ב-Allele burden של (JAK2(V617F על ידי תרופות לא בהכרח מתורגמת ליתרון ארוך טווח.
מחקרים קליניים ב-PV שמים דגש על קבוצות חולים אלו. מבין התרופות הנחקרות, מעכבי JAK עשויים להיות בעלי ערך טיפולי בחולים עם עמידות או חוסר סבילות ל-Hydrea.
ביבליוגרפיה
- ↑ Vainchenker W, Kralovics R. Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms. Blood 2017;129(6):667-679
- ↑ Schafer AI. Molecular basis of the diagnosis and treatment of polycythemia vera and essential thrombocythemia. lood. 2006 Jun 1;107(11):4214-22.
- ↑ Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016;127(20):2391–2405.
- ↑ Mesa RA, Niblack J, Wadleigh M, et al. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients. Cancer 2007;109:68-76.
- This study provided a large cohort-based appreciation of the symptom burden and effect on quality of life of the MPNs, and led to the development of standardized tools to measure symptom burden, and their subsequent inclusion in clinical trial outcomes. Reflects the magnitude of pruritus in MPNs.
- ↑ 5.0 5.1 1. Marchioli R, Finazzi G, Specchia G, et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Eng J Med 2013;368:22-33.
- ↑ Landolfi R, Marchioli R, Kutti J et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Eng J Med 2004;350:114-24.
- ↑ How J, Zhou A and Oh ST. Splanchnic vein thrombosis in myeloproliferative neoplasms: pathophysiology and molecular mechanisms of disease. Ther Adv Hematol 2017;8(3):107-118.
- ↑ Hoekstra J, Bresser EL, Smalberg JH, et al. Long-term follow up of patients with portal vein thrombosis and myeloproliferative neoplasms. J Thromb Haemost 2011;9(11):2208-2214.
- ↑ Harrison CN, Robinson SE. Myeloproliferative disorders in pregnancy. Hematol Oncol Clin N Am 2011;25:261-275.
- ↑ Vannucchi AM, Kiladjian JJ, Griesshammer M, et al. Ruxolitinib versus standard therapy for the treatment of polycytemia vera. N Eng J Med 2015;372(5):426-435.
- Verstovsek S, Passamonti F, Rambaldi A, et al. Ruxolitinib for essential thrombocythemia refractory to or intolerant of hydroxyurea: long-term phase 2 study results. Blood 2017;130(15):1768-1771.
- Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Eng J Med 2012;366(9):799-807.
- Harrison C, Kiladjian JJ, Al-Ali HK et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Eng J Med 2012;366(9):787-798.
- Vannucchi AM, Harrison CN. Emerging treatments for classical myeloproliferative neoplasms. Blood 2017;129(6):693-702.
- Smalberg JH, Arends LR, Valla DC, et al. Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: a meta-analysis. Blood 2012;120(25):4921-4928.
(*) A large meta-analysis providing important epidemiological data on the prevalence of MPNs and the JAK2V617F mutation in 1917 cases of splanchnic vein thrombosis.
- Falagna A, Marchetti M, Vignoli A, et al. Leukocyte-platelet interaction in patients with essential thrombocythemia and polycythemia vera. Exp Hematol 2005;33(5):523-530.
- Kreher S, Ochsenreither S, Trappe RU et al. Prophylaxis and management of venous thromboembolism in patients with myeloproliferative neoplasms: consensus stetement of the Haemostasis Working Party of the German Society of Hematology and Oncology (DGHO), the Austrian Society of Hematology and Oncology (OGHO) and society of Thrombosis and Haemostasis Research (GTHe.V.). Ann Hematol 2014;93:1953-1963.
- De Stefano V, Ruggeri M, Cervantes F et al. High rate of recurrent venous thromboembolism in patients with myeloproliferative neoplasms and effect of prophilaxis with vitamin K anatagonists. Leukemia 2016;30:2032-2038.
- Lavi N, Brenner B, Avivi I. Management of pregnant women with myeloproliferative neoplasms. Thrombosis Research 2013;131(1):S11-S13.
- Passamonti F, Randi ML, Rumi E et al. Increased risk of pregnancy complications in patients with essential thrombocythemia carrying the JAK2(617V>f) mutation. Blood 2007;110(2):485-489.
- Alimam S, Bewley S, Chappell LC et al. Pregnancy outcomes in myeloproliferative neoplasms: UK prospective cohort study. Brit J Hematol 2016;175:31-36.
(*)The only prospective study to date evaluating pregnancy outcomes in MPN patients, identified through a nation-wide survey in the UK. Includes important observations that may be less biased than previous retrospective studies.
- Barbui T, Barosi G, Birgegard G et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol 2011;29(6):61-770. (pregnancy section)
- Siegel FP, Tauscher J, Petrides PE. Aquagenic pruritus in polycythemia vera: charactersitics and influence on quality of life in 441 patients. Am J Hematol 2013;88:665-669.
- Saini KS, Patnaik MM and Tefferi A. Polycythemia vera-associated pruritus and its management. Eur J Clin Invest 2010;40(9):828-834.
- Scherber RM, Geyer HL, Dueck AC et al. The potential role of hematocrit control on symptom burden among polycytemia vera patients: Insights from the CYTO-PV and MPN-SAF patient cohorts. Leukemia and Lymphoma 2017:58(6):1481-1487.
- Mesa R, Jamieson C, Bhatia R, et al. Myeloproliferative neoplasms, version 2.2017: NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network 2016;14(12):1572-1611.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר נועה לביא. המכון ההמטולוגי, הקריה הרפואית רמב"ם, חיפה, עודכן בשנת 2023 על ידי ד"ר ערן זימרן, המחלקה ההמטולוגית ויחידת הקרישה במרכז הרפואי הדסה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק