הבדלים בין גרסאות בדף "Asymmetric dimethylarginine - ADMA"
בן עמי סלע (שיחה | תרומות) |
|||
| שורה 5: | שורה 5: | ||
|תמונה= | |תמונה= | ||
|כיתוב תמונה= | |כיתוב תמונה= | ||
| − | |מעבדה=כימיה בדם | + | |מעבדה=[[כימיה בדם]] |
|תחום=סמן של תחלואת כלי-דם | |תחום=סמן של תחלואת כלי-דם | ||
|יחידות מדידה= | |יחידות מדידה= | ||
| שורה 91: | שורה 91: | ||
{{ייחוס|[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]]}} | {{ייחוס|[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]]}} | ||
| − | [[קטגוריה:בדיקות מעבדה]] | + | ==ראו גם== |
| + | |||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | |||
| + | * [[תחלואת לב וכלי-דם|בדיקות מעבדה - תחלואת לב וכלי-דם]] | ||
| + | |||
| + | [[קטגוריה: בדיקות מעבדה - לב וכלי-דם]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
גרסה מ־15:23, 6 בפברואר 2014
| מדריך בדיקות מעבדה | |
| ' | |
|---|---|
| Asymmetric dimethylarginine – ADMA | |
| שמות אחרים | ADMA |
| מעבדה | כימיה בדם |
| תחום | סמן של תחלואת כלי-דם |
| טווח ערכים תקין | בגיל שמעל 14 שנה-0.4 – 0.75 מיקרומול' לליטר, או 80-150 מיקרוגרם לליטר |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידת רמת ADMA יכולה לשמש לעזר בנוסף להערכת גורמי סיכון אחרים להערכת הסיכון העתידי לאירועים כליליים, בעיקר במטופלים עם אי-ספיקת כליות. אין במדידת ADMA לנבא אירועים קרדיו-וסקולאריים באופן מוחלט, ולבטח אין במדידה זו לנבא אירועים ספציפיים.
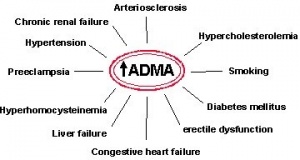
מחקרים בלתי-תלויים הראו ש-ADMA היא מנבא טוב יותר של תנגודת לאינסולין מאשר כל מדד ידוע אחר. ADMA מנבא טוב יותר של פגיעה באנדותל הוסקולארי מאשר מדידת רמת כולסטרול. רמת הומוציסטאין נמצאת במתאם טוב עם רמת ADMA, באופן שהעיכוב בסינתזה של NO עשוי להסביר מדוע רמה מוגברת של הומוציטאין נכרכה עם הפרעה להרחבת כלי-דם כתוצאה מתפקוד לקוי של האנדותל ויצירה פחותה של NO. רמה מוגברת של ADMA מהווה פוטנציאל של גורם התורם ל-pre-eclampsia, והפרעה מטבולית ברמת גלוקוזה גורמת להצטברות ADMA עלולה לגרום להפרעה בהרחבת כלי-דם כתוצאה מפגיעה אנדותליאלית בחולי סוכרת. רמה מוגברת של ADMA מרמזת גם על חסר בחומצה פולית או שיבוש במטבוליזם שלה.
במערכת הקרדיו-וסקולארית, ביוסינתזה מופחתת של NO מגבירה לחץ-דם, מגבירה צימות טסיות וספיחה מוגברת של תאי דם לבנים לדופן כלי הדם, כמו גם מגבירה שגשוג תאי שריר חלק בשכבת ה-intima של דופן העורק, משנה את יכות הצריכה של חמצן על ידי המיטוכונדריה, ומחישה את טרשת העורקים. מחקרים קליניים מצביעים על כל שרמת ADMA מוגברת על ידי היפר-כולסטרולמיה, טריגליצרידמיה, היפר-גליצמיה, והיפר-הומוציסטאינמיה. רמת ADMA מוגברת בחסימת עורקים היקפיים ובקארוטידים בהתאמה לדרגת החסימה של כלי דם אלה.
בסיס פיזיולוגי
חנקן חד-חמצני (NO) מיוצר על יד האנזים NOS או nitric oxide synthase, תוך חמצון החנקן בשייר ה-guanidino או HN=C של חומצת האמינו ארגינין, והפיכת חומצה זו ל-NO ולציטרולין. מולקולת הגז NO היא מרחיבה יעילה של כלי דם ותפקידה משמעותי בוויסות שפיעת הדם ולחץ-הדם. בנוסף, NO מעכב את צימות טסיות הדם ואת ספיחתם של לויקוציטים לאנדותל כלי הדם., ומפחית את שגשוגם של תאי שריר חלק בדופן כלי הדם. נראה אם כן, ש-NO הוא בעל פעולה נוגדת טרשת, ושיבוש ביצירתו מארגינין עלול לגרום לסיבוכים קרדיו-וסקולאריים. וכך אמנם נצפו תהליכים מואצים של טרשת עורקים ויצירת מפרצות, בעכברים טרנסגניים בהם הושרתה פגיעה באנזים NOS.
המולקולה של NO פעילה ביותר, אך משך חייה במחזור הדם קצר, לכן חיוני ייצורה הרצוף בתאי האנדותל והפרשתה לדם. בשנת 1992 היה זה Patrick Vallance בלונדון, שהצביע לראשונה על האפשרות שהמולקולה ADMA או asymmetric dimethylarginine, יכולה להיות מעכב אנדוגני של האנזים NOS, ובכך היא הופכת למווסתת את קצב הייצור של NO.
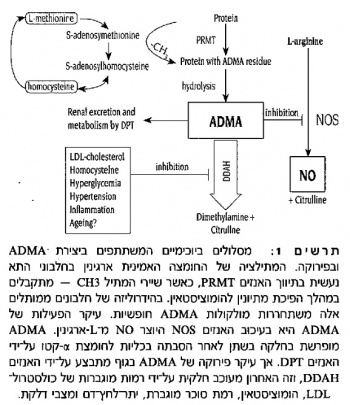
מתברר ש-ADMA נוצרת במסלול המטבולי כתוצאה ממתילציה של שיירי החומצה האמינית ארגינין, עוד בהיות האחרונה חלק בלתי נפרד מחלבונים או פפטידים, מיד לאחר יצירתם ברטיקולום האנדופלזמי בתא.
חלק מפעילותם הענפה של משפחת האנזימים N-methyltransferases protein arginine (להלן PRMTs) קשור לתהליך הדֶה-מתילציה דרכו הופך מתיונין להומוציסטאין, וכך נוצרים שיירי ארגינין המותמרים עם שייר מתיל (CH3-) אחד או שניים. לאחר מכן, בתהליך ההידרוליזה הפרוטאוליטית של חלבוני התא, מתקבלים בציטופלזמה התאית שלושה תוצרים: בנוסף ל-ADMA, נוצרים גם ארגינין חד-מתילי (MMA) וכן ארגינין דו-מתילי סימטרי (SDMA). נמצא כי למולקולת SDMA אין כל השפעה על אנזימי NOS, ואילו מולקולת MMA אמנם מסוגלת לעכב פעילות NOS בדומה ל-ADMA, אלא שריכוזה בתא נמוך פי-10-15 בהשוואה ל-ADMA, ולכן נותרת ADMA כמולקולה יחידה בעלת משמעות בוויסות פעילות NOS ליצירת NO.
מנגנונים הגורמים להעלאת רמת ADMA בדם
מולקולת ADMA נוצרת בשלב הראשוני ממתילציה של ארגינין על ידי משפחת אנזימי PRMTs, לאחר פירוק פרוטאוליטי של חלבונים בתא. האדם מייצר מדי יום כ-300 מיקרומול' ADMA (כ-60 מיליגרם), ומתוך כמות זו כ-50 מיקרומול' מדי יום מופרשת בשתן לאחר הפיכת ADMA לחומצות α-קטו על ידי האנזיםaminotransferase dimethylarginine pyruvate (להלן DPT), כאשר כ-240 מיקרומול' ADMA מפורקים מדי יום על ידי האנזים DDAH. עד כה אין כל ראייה המצביעה על עלייה ברמת ADMA בדם, הנובעת מפעילות מתילציה מוגברת על ידי אנזימי PRMT, ונראה אם כן שרמת ADMA בדם מווסתת בשתי דרכים:
- באופן רגיל ADMA מורחק מהגוף דרך הכליות, ואכן בחולים עם מחלת כליות מתקדמת או סופנית עם שיבוש בסינון הפקעתי, חלה עלייה משמעותית ברמת ADMA בדם.
- המנגנון המרתק יותר תשומת לב לאחרונה הוא זה של האנזים- dimethylaminohydrolase Dimethylarginine (להלן DDAH), המסיר את השיירים המתיליים ממולקולת ADMA, אשר פועל באנדותל הוסקולארי בשתי צורות איזופורמיות, DDAH-1 ו-DDAH-2. מבין 2 איזופורמים אלה, DDAH-2 פעיל יותר ברקמות המבטאות פעילות NOS אנדותלית. האנזים DDAH מפרק את מולקולת ADMA ליצירת אמין דו-מתילי וציטרולין, ופעילות אנזים זה ניכרת כמעט בכל רקמות הגוף, בעיקר בכליות ובכבד.
העובדה שמחקרם החלוצי של Vallance וחב' על ADMA נעשה דווקא בחולים עם אי-ספיקת כליות אינה מקרית. ריכוזו הגבוה ביותר של DDAH בין כל רקמות הגוף הוא דווקא בתאי האנדותל שבפקעיות הכליה, ובכלי הדם של הכליות, ועוד יותר מכך בתאי האבוביות. לכן באי-תפקוד כליות מתרחשת ירידה בולטת בפירוק ADMA על ידי DDAH, ולאו דווקא על ידי פינוי לקוי של מולקולה זו בשתן.
פעילות האנזים DDAH מופחתת על ידי עקה חמצונית המושרית על-ידי TNF-α ומולקולות מחומצנות של LDL. אך גם על ידי הומוציסטאין מוגבר ויתר-גליקמיה. נראה אם-כן שדווקא בהשראת מצבי דלקת או טרשת וסקולארית, קטנה פעילותו ההידרוליטית של DDAH, מה שמונע הורדת רמת ADMA, ואף גורם בעקיפין להפחתה ביצירת NO בתאי האנדותל. ממצאים אחרונים אלה יכולים להתפרש בכך שהעלייה ברמת ADMA בפלזמה אינה הגורם הראשוני לפגיעה בתפקוד האנדותל, אלא דווקא התוצאה שלו, אך בכל מקרה היא מחמירה את הנזק תוך שהיא מפחיתה את כמות NO הנוצרת ומונעת הרחבה של כלי-דם.
לאחרונה נעשו הדגמות ישירות להשפעה המיידית של הגברה ניסיונית של רמות ADMA בדם הן בחיות מעבדה והן בבני-אדם. בניסויים בעכברים טרנסגניים בהם הושרתה פעילות-יתר של הגן המקודד לאנזים DDAH, נמצא כי רמות ADMA בדם של עכברים אלה (0.5 מיקרומול' לליטר), היו ב-50% נמוכות יותר מאשר בעכבר-בר (1.0-1.1 מיקרומול' לליטר). ואמנם, הודגמה בעכברים טרנסגניים אלה עם פעילות מוגברת של DDAH יצירה מערכתית מוגברת של NO, לחץ-דם מערכתי נמוך יותר ותנגודת מופחתת של כלי-דם היקפיים. על-ידי עירוי מקומי של ADMA לתוך עורק הזרוע (brachial), הופחתה משמעותית שפיעת הדם באמת היד.
בניסוי אחר נקטו בעירוי של ADMA לתוך הווריד, עד שרמתה המערכתית הגיעה ל-2.6 מיקרומול' לליטר, בהשוואה לריכוז הממוצע באנשים בריאים שנקבע כ-0.42±0.06 מיקרומול' לליטר. עירוי זה העלה משמעותית את לחץ הדם העורקי ואת התנגודת הווסקלארית המערכתית, הפחית את תפוקת הלב ואת קצב הלב, ואף הפחית את התגובה הווסקולארית לפעילות גופנית מאומצת.
ראיות קליניות למשמעות של ADMA כגורם-סיכון קרדיו-וסקולארי
מתגברות הראיות לכך שרמה מוגברת של ADMA אינה רק סמן למפגעים וסקולאריים אפשריים, אלא גם גורם סיכון האחראי ישירות למפגעים אלה. במחקר שנערך בקרב 150 גברים שאינם מעשנים בגיל העמידה בפינלנד, נמצא כי הגברים שרמת ADMA בדמם נמצאה ברביעון העליון של מדגם זה (מעל 0.62 מיקרומול' לליטר), נמצאו בסיכון הגבוה פי-3.9 ללקות באירוע כלילי חד לעומת גברים עם רמות ADMA בשלושת הרביעונים התחתונים. רמה מוגברת של ADMA בניסוי זה נמצאה כגורם-סיכון משמעותי יותר מאנמנזה משפחתית של תחלואת לב, לחץ-דם מוגבר, סוכרת או רמת כולסטרול-LDL מוגברת.
מחקר ביפאן שכלל 116 מתנדבים בריאים היה הראשון שנחקר בו המתאם הישיר בין רמות ADMA לבין עובי שכבת האינטימה-מדיה בעורק התרדמני-מדד המקובל להתקדמות תהליך טרשתי. היצרות של העורק התרדמני מזוהה עם התרחשות אירועי מוח, ואמנם רמות גבוהות של ADMA נמצאו במבוגרים נפגעי אירוע מוחי. במחקר שנערך בסיאול, נכללו 71 גברים קוריאנים בגיל 65-85 שנה שעברו אירוע מוחי ראשון או חוזר, ושנמדדה בדמם רמת ADMA מיד עם הגיעם לחדר המיון. נמצא שהנכללים במחקר שרמת ADMA בדמם הייתה בתחום העשירון העליון, נמצאו בסיכון גדול פי-6 ללקות באירוע מוחי על רקע וסקולארי.
במחקר רב-מוסדי שהקיף 816 מטופלים עם מחלת עורקים כליליים מוכחת ואנשים בריאים תואמי-גיל, נמצא ש-ADMA הייתה סמן בעל העוצמה הגבוהה ביותר בהבדלתם של חולי לב מהפרטים הבריאים . בניתוח רב-משתנים, דרגת הסיכון למחלת עורקים כליליים עלתה פי- 2.34, ורמת ADMA נמצאה גבוהה ב-1 מיקרומול' לליטר מהרמה הממוצעת בקרב הנבדקים הבריאים.
במחקר פרוספקטיבי בקרב 90 חולים עם מחלת כליות סופנית המטופלים בדיאליזה, הודגם בדומה, כי רמות מוגברות של ADMA היו במתאם גבוה עם עובי האינטימה-מדיה, וניבאו אירועים קרדיו-וסקולאריים ותמותה. בנוסף נמצא במחקר זה במעקב שנמשך שנה, כי התקדמות התהליך הטרשתי והיצרות העורק התרדמני נצפו בצורה הטובה ביותר על-פי רמות ADMA ואלה של CRP בתחילת הניסוי. בניסוי הקליני הפרוספקטיבי המוקדם ביותר שבו נבחנה משמעות ADMA כגורם סיכון קרדיו-וסקולארי, נמדדה רמתו כמו גם רמותיהם של גורמי סיכון אחרים, בקרב 225 מטופלי דיאליזה.
לאחר תקופת מעקב ממוצעת של כ-33 חודשים נמנו 120 אירועים משמעותיים, וכן 83 מקרי מוות (מתוכם 53 מסיבות וסקולאריות). תוך הסתייעות בדגם הסיכון היחסי על פי Cox, רמת ADMA וגיל הנסקרים היוו המנבאים החזקים ביותר של אירועי כלי-דם ומוות. רמת הסיכון לתמותה במטופלי דיאליזה עם רמת ADMA בתחום הרביעון העליון במדגם ניסוי זה הייתה גבוהה פי-3 לעומת מטופלים עם רמת ADMA הנמצאת בתחום 2 הרביעונים התחתונים.
במחקר פרוספקטיבי אחר שנערך בהולנד בקרב חולים במצב קריטי ביחידות לטיפול נמרץ, נבחן הקשר בין רמות ADMA לבין הישרדותם של החולים. נמצא כי שיעור התמותה בקרב מטופלים שנמדדו אצלם מיד עם אשפוזם רמות ADMA גבוהות בתחום הרביעון העליון היה גבוה פי-17 בהשוואה לאלה עם ריכוזי ADMA בתחום הרביעון התחתון. אך הערך המוסף של מחקר זה הוא בהדגשת תפקיד הכבד בחילוף החומרים של ADMA, ובדיעבד בקביעת רמות ADMA בדם. באותם חולים בהם הוכח כישלון הכבד הן על פי רמות מוגברות של בילירובין ומצבים של חמצת מטבולית, היו רמות ADMA מוגברות במיוחד.
היבט חשוב אחר נבחן בטייוואן על 153 מטופלים עם תעוקת חזה יציבה לאחר שעברו הליך צנתור של העורקים הכליליים, והיו במעקב לאורך תקופה ממוצעת של 16 חודשים. במהלך תקופת המעקב התרחשו במדגם זה 51 אירועים קרדיו-וסקולאריים משמעותיים, מתוכם 6 בלבד באלה עם רמת ADMA בשלישון התחתון (פחות מ-0.62 מיקרומול' לליטר). הסיכון לאירוע כלי-דם משמעותי לאחר הליך אנגיופלסטי, עולה משמעותית עם העלייה ברמות ADMA, באופן בלתי תלוי לחלוטין במדדים משפיעים כגון גיל, עישון, יתר-כולסטרול או קביעת תומכן (stent). מסקנת חוקרים אלה היא שמדידת ADMA לפני ביצוע הליך אנגיופלסטי יכולה לכאורה לנבא באופן בלתי תלוי אירועים וסיבוכים שעלולים להתרחש אחריו. בבני אדם עם מחלת עורקים היקפיים, רמות ADMA בדם משקפות את חומרת המחלה. עירוי לתוך הווריד של L-ארגינין משפר משמעותית את שפיעת הדם בגפיים, ומסייע להליכה נטולת-כאבים במטופלים עם מחלת עורקים היקפית.
תחום פתולוגי אחר שנמדדה בו רמת ADMA מוגברת שמייחסים לה משמעות מנגנונית, היא תסמונת הפרעות נשימה בשינה (obstructive sleep apnea syndrome). מצב זה, המתרחש ב-2% מקרב הנשים, וב-4% מקרב הגברים מעל גיל 35 שנה, עלול להתבטא בהתקפים מרובים של הפסקות נשימה במהלך השינה, וכורכים אותו עם יתר לחץ-דם, השמנת-יתר, היפרגליקמיה ודיסליפידמיה, מדדים המהווים חלק בלתי נפרד מהתסמונת המטבולית וידועים כגורמי-סיכון למחלה קרדיו-וסקולארית.
במחקר רב-מוסדי ביפאן שנבדקו בו גברים בגילאים שבין 36-69 שנה שאובחנו עם תסמונת זו, נמדדו רמת ADMA וכושר הרחבת עורק הזרוע על-ידי שפיעת הדם (flow mediated vasodilation). מדידות אלה התבצעו לפני הטיפול ו-4 שבועות לאחר טיפול של החדרת לחץ חיובי מתמשך דרך האף (nasal Continuous Positive Airway Pressure, להלן nCPAP). הסתבר, כי במקביל לשיפור רב של כ-75% במידת שפיעת הדם בעורק הזרוע 4 שבועות לאחר טיפול nCPAP, נמדדה גם ירידה משמעותית של כ-28% ברמת ADMA בדמם של הנבדקים. ידוע שיתר לחץ-דם הוא סיבוך נפוץ של תסמונת הפרעות נשימה בשינה, וככל שלחץ-הדם גבוה יותר כן מחמירות הפרעות שינה אלו. יתרה מכך, רמת NO בפלזמה בלוקים בהפרעות נשימה בשינה, עומדת ביחס הפוך לרמת לחץ-הדם, מה שמצביע על כך ששיבוש ביצירת NO בתאי האנדותל ממלא תפקיד חשוב בדינמיקה של תסמונת זו.
היבטים טיפוליים ברמות מוגברות של ADMA
כיוון ש-ADMA נחשב מעכב תחרותי של ייצור NO, ההתערבות הטיפולית ההגיונית היא במתן חומצת האמינו L-ארגינין על מנת להתגבר על עיכוב זה, שכן חומצת אמינו זו היא המצע הטבעי של האנזים NOS. למרות ידע רב שנרכש על היתרון של מתן L-ארגינין בכמה היבטים של אי-תפקוד תאי האנדותל, רק לאחרונה גדל העניין ביחס בין ריכוזי L-ארגינין ו-ADMA בדם. אחד הממצאים החשובים בהקשר זה, פורסם בשנת 1998 ב-Circulation על ידי Hornig וחב', לפיו הזלפה של L-ארגינין לתוך הווריד, שיפרה את הרחבת כלי הדם בתלות בפעילות אנדותלית במטופלים עם מחלת לב כרונית שרמת ADMA בדמם גבוהה, לעומת זאת, טיפול זה ב-L-ארגינין לא השפיע כלל על הרחבת כלי-דם באנשים בריאים שרמת ADMA בדמם נמצאה נמוכה.
באותו הקשר כדאי לציין שבניסוי קליני שבמהלכו התבצע הליך אנגיופלסטי נמצאה הצטברות של ADMA בתאי אנדותל המתחדשים בסמוך לאזור בו נקבע תומכן או הורחב כלי הדם באמצעות בלון. אמנם ידוע שתאי אנדותל "מתאוששים" הנמצאים בקרבת קטע עורקי שניזוק, מגלים חסר בתפקוד בעיקר במסלול של יצירת NO מארגינין. לא מפתיע אם כך הממצא שמתן מקומי או מערכתי של L-ארגינין משפר את התפקוד העורקי באזור שנפגע.
מעניין לציין את השפעותיהן של מספר תרופות מקובלות על רמת ADMA. כאשר הבקרה הגליקמית בגוף משתפרת במתן metformin, נמצא שמופחתת רמת ADMAבדמם של חולי סוכרת type 2. השפעה דומה נמצאה במטופלים עם עמידות או תנגודת לאינסולין המטופלים ב-rosiglitazone. טיפולים בלחץ-דם מוגבר בעזרת מעכבי האנזים המהפך אנגיוטנסין (ACE) או בעזרת נוגדי הקולטן לאנגיוטנסין, מפחיתים אף הם את רמות ADMA בדם. קיימות ראיות לכך, שטיפול משלים באסטרוגן בנשים עם חידלון-וסת, מפחית באופן מתון רמת ADMA, כתוצאה מכך שההורמון מעודד את פעילות האנזים DDAH, המפרק את ADMA, אלא שאסטרוגן מוריד בדם גם את רמת L-ארגינין, באופן כזה שהיחס בין השניים אינו משתנה.
במספר ניסויים קליניים נבחנה ההשפעה האפשרית של סטטינים על רמות ADMA במטופלים עם רמות כולסטרול גבוהות, אך נראה שטיפול זה אינו משפיע על רמת ADMA. אמנם דווח במחקר אחד כי הטיפול עם Rosuvastatin למשך 6 שבועות כמינון יומי של 10 מיליגרם הפחית רמת ADMA ב-18%, אך לעומתו במחקרים אחרים נמצא ש-Simvastatin שניתן למשך חודשיים במינון יומי של 20 מיליגרם או Atorvastatin במינון יומי של 40 מיליגרם למשך תקופה דומה לא הביאו לשינוי ברמת ADMA.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק