הבדלים בין גרסאות בדף "סרטן השד - טיפול טרום ניתוחי - Breast cancer - neoadjuvant therapy"
| שורה 32: | שורה 32: | ||
מזה 35 שנה ידוע שטיפול משלים אחרי ניתוח אצל נשים עם סרטן שד מוקדם או אזורי, מפחית את שיעור ההישנות, ויכול לשפר את ההישרדות ללא מחלה, וכן את ההישרדות הכוללת{{הערה|שם=הערה6|Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet. 2005 May 14-20:365(9472): 1687-717.}}. | מזה 35 שנה ידוע שטיפול משלים אחרי ניתוח אצל נשים עם סרטן שד מוקדם או אזורי, מפחית את שיעור ההישנות, ויכול לשפר את ההישרדות ללא מחלה, וכן את ההישרדות הכוללת{{הערה|שם=הערה6|Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet. 2005 May 14-20:365(9472): 1687-717.}}. | ||
| − | נעשו בעבר מספר ניסיונות השוואה בין טיפול כימי ראשוני לטיפול משלים. במחקר 18-B שערך ה-NSABP{{כ}} (National Surgical Adjuvant Breast Project) קיבלו החולות שהשתתפו בו באופן רנדומלי, 4 מחזורים של טיפול כימי ב-[[t:Doxorubicin|Doxorubicin]] ו-[[t:Endoxan|Endoxan]]{{כ}} (Cyclophosphamide){{כ}}, לפני או אחרי ניתוח. מחקרים אלה לא הראו הבדלים בהישרדות הכללית או בהישרדות ללא מחלה בין שתי הקבוצות, אחרי 16 שנות מעקב. | + | נעשו בעבר מספר ניסיונות השוואה בין טיפול כימי ראשוני לטיפול משלים. במחקר 18-B שערך ה-NSABP{{כ}} (National Surgical Adjuvant Breast Project) קיבלו החולות שהשתתפו בו באופן רנדומלי, 4 מחזורים של טיפול כימי ב-[[t:Doxorubicin|Doxorubicin]] ו-[[t:Endoxan|Endoxan]]{{כ}} (Cyclophosphamide){{כ}} (AC), לפני או אחרי ניתוח. מחקרים אלה לא הראו הבדלים בהישרדות הכללית או בהישרדות ללא מחלה בין שתי הקבוצות, אחרי 16 שנות מעקב. |
| − | במחקר אחר של B-27 ,NSABP, היו 3 קבוצות של חולות. כולן קיבלו טיפול ב-AC לפני הניתוח כאשר קבוצה אחת קיבלה בנוסף | + | במחקר אחר של B-27 ,NSABP, היו 3 קבוצות של חולות. כולן קיבלו טיפול ב-AC לפני הניתוח כאשר קבוצה אחת קיבלה בנוסף [[t:Docetaxel|Docetaxel]] לפני הניתוח, וקבוצה שנייה קיבלה Docetaxel אחרי הניתוח. בתום 8 שנות מעקב, לא נמצאו הבדלים בין הקבוצות בהישרדות הכללית או בהישרדות ללא מחלה{{הערה|שם=הערה7|Rastogi P, Anderson SJ, Bear HD, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol. 2008 Feb 10;26(5):778-85. }}. עבודות אלה ואחרות שפורסמו אמנם לא הוכיחו עליונות של שיטה זו על אחרת, אך הוכח לפחות שטיפול כימי טרום ניתוחי יעיל לא פחות מטיפול כימי אחרי ניתוח, ומאפשר להעלות את שיעור הניתוחים משמרי השד. |
תוספת של תרופה מקבוצת הטקסנים (taxane) נבדקה במסגרת מחקרים אחרים, כמו 27-B וכן במטא-אנליזה שפורסמה בשנת 2008 {{כ}}{{הערה|שם=הערה8|Cuppone F, Bria E, Carlini P, et al.. Taxanes as primary chemotherapy for early breast cancer: meta-analysis of randomized trials. Cancer. 2008 Jul 15;113(2):238-46. }}. עבודות אלה לא הוכיחו יתרון מבחינת הישרדות בכלל והישרדות ללא מחלה, אך נמצא שבקרב הנשים שנכללו בקבוצה שקיבלה תוספת taxane הושג שיעור גבוה יותר של תגובה פתולוגית מלאה (PCR). תגובה זו התבססה על עבודות שהוכיחו שטיפול אחרי ניתוח (אדג'ובנטי) הניתן במנות צפופות (Dose Dense) של כימותרפיה כל שבועיים יעיל יותר לעומת טיפול בכל 3 שבועות. כמו כן, מעבודות שנערכו בנושא הטיפול הטרום ניתוחי, עולה שטיפול במנות צפופות יעיל יותר מטיפול הניתן בכל 3 שבועות, אם כי לפעמים הטיפול כרוך במחיר של רעילות יתר{{הערה|שם=הערה9|Untch M, Mobus V, Kuhn W, et al. Intensive dose-dense compared with conventionally scheduled preoperative chemotherapy for high-risk primary breast cancer. J Clin Oncol. 2009 Jun 20:27(18):2938-45. Epub 2009 Apr 13.}}. מסיבה זו טיפול כימי טרום ניתוחי (AC) נפוץ כיום והוא ניתן כל שבועיים ל-4 מחזורים, ולאחר מכן ניתן טיפול באמצעות paclitaxel כל שבועיים, 4 פעמים, או במינון נמוך יותר כל שבוע למשך 12 שבועות. | תוספת של תרופה מקבוצת הטקסנים (taxane) נבדקה במסגרת מחקרים אחרים, כמו 27-B וכן במטא-אנליזה שפורסמה בשנת 2008 {{כ}}{{הערה|שם=הערה8|Cuppone F, Bria E, Carlini P, et al.. Taxanes as primary chemotherapy for early breast cancer: meta-analysis of randomized trials. Cancer. 2008 Jul 15;113(2):238-46. }}. עבודות אלה לא הוכיחו יתרון מבחינת הישרדות בכלל והישרדות ללא מחלה, אך נמצא שבקרב הנשים שנכללו בקבוצה שקיבלה תוספת taxane הושג שיעור גבוה יותר של תגובה פתולוגית מלאה (PCR). תגובה זו התבססה על עבודות שהוכיחו שטיפול אחרי ניתוח (אדג'ובנטי) הניתן במנות צפופות (Dose Dense) של כימותרפיה כל שבועיים יעיל יותר לעומת טיפול בכל 3 שבועות. כמו כן, מעבודות שנערכו בנושא הטיפול הטרום ניתוחי, עולה שטיפול במנות צפופות יעיל יותר מטיפול הניתן בכל 3 שבועות, אם כי לפעמים הטיפול כרוך במחיר של רעילות יתר{{הערה|שם=הערה9|Untch M, Mobus V, Kuhn W, et al. Intensive dose-dense compared with conventionally scheduled preoperative chemotherapy for high-risk primary breast cancer. J Clin Oncol. 2009 Jun 20:27(18):2938-45. Epub 2009 Apr 13.}}. מסיבה זו טיפול כימי טרום ניתוחי (AC) נפוץ כיום והוא ניתן כל שבועיים ל-4 מחזורים, ולאחר מכן ניתן טיפול באמצעות paclitaxel כל שבועיים, 4 פעמים, או במינון נמוך יותר כל שבוע למשך 12 שבועות. | ||
גרסה מ־15:34, 27 במאי 2015
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| טיפול כימותרפי טרום ניתוחי בסרטן השד | ||
|---|---|---|
| preoperative chemotherapy in patients with breast cancer | ||

| ||
| יוצר הערך | ד"ר רוית אגסי ופרופ' דויד גפן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
בשנת 1983 דווח לראשונה על אפשרות טיפול חדשה בסרטן השד - מתן טיפול כימי טרום ניתוחי (Neoadjuvant). אפשרות טיפול זו נבדקה על ידי Hortobagyi וחבריו ממרכז הסרטן אנדרסון (MD Anderson Cancer Center) שבטקסס ארצות הברית, כאשר במהלך עבודתם בדקו החוקרים 52 מקרים של סרטן שד מתקדם, במטרה להפוך גידול בלתי נתיח למחלה נתיחה הניתנת לריפוי[1].
בשל התוצאות המעודדות בחולות אלה, שימש בהמשך הטיפול הכימי הטרום ניתוחי גם כטיפול בסרטן שד נתיח (במטרה לצמצם את מימדי הניתוח - מניתוח גדול הכולל כריתה מלאה לניתוח קטן יותר הכולל כריתה חלקית בלבד).
בהמשך הפך הטיפול הכימי לאופציה טיפולית גם בקרב חולות עם סרטן שד מוקדם[2]. בשנת 2013 פורסם מחקר שכלל 2,072 חולות סרטן שד שקיבלו טיפול טרום ניתוחי. רוב החולות היו בשלב מוקדם, מתוכן 67.8% עם גידול בשלב T1-T2 ו-45% עם בלוטות שליליות באופן קליני בבית השחי. חציון משך המעקב היה 62 חודשים. שיעור ההישרדות וההישרדות ללא מחלה היו 86.8% ו-66.9% בהתאמה[3].
לטיפול הטרום ניתוחי מספר יתרונות בהשוואה לטיפול המשלים (Adjuvant):
צמצום הגידול - הטיפול מצמצם את הגידול ומעלה לפיכך את שיעור הניתוחים משמרי השד. המחקר ACOSOG Z1071 בדק אם ניתן להפחית את הצורך בדיסקציה אקסילרית. התוצאות היו מבטיחות אבל לא חד משמעיות[4].
הערכה וניטור של התגובה לטיפול - הערכה זו מאפשרת לשנות את הטיפול במידת הצורך, ומספקת מידע לגבי אפשרויות טיפול עתידיות[3].
ניבוי תוצאות לטווח ארוך - התגובה לטיפול מהווה סמן פרוגנוסטי להישרדות, ומנבאת תוצאות לטווח ארוך [5]. בנוסף, באופן תיאורטי, ניתן לומר כי טיפול מוקדם יותר בגרורות מיקרוסקופיות יביא לתוצאות טובות יותר לטווח הארוך (עובדה זו טרם הוכחה מחקרית).
טיפול טרום ניתוחי לעומת טיפול לאחר ניתוח
מזה 35 שנה ידוע שטיפול משלים אחרי ניתוח אצל נשים עם סרטן שד מוקדם או אזורי, מפחית את שיעור ההישנות, ויכול לשפר את ההישרדות ללא מחלה, וכן את ההישרדות הכוללת[6].
נעשו בעבר מספר ניסיונות השוואה בין טיפול כימי ראשוני לטיפול משלים. במחקר 18-B שערך ה-NSABP (National Surgical Adjuvant Breast Project) קיבלו החולות שהשתתפו בו באופן רנדומלי, 4 מחזורים של טיפול כימי ב-Doxorubicin ו-Endoxan (Cyclophosphamide) (AC), לפני או אחרי ניתוח. מחקרים אלה לא הראו הבדלים בהישרדות הכללית או בהישרדות ללא מחלה בין שתי הקבוצות, אחרי 16 שנות מעקב.
במחקר אחר של B-27 ,NSABP, היו 3 קבוצות של חולות. כולן קיבלו טיפול ב-AC לפני הניתוח כאשר קבוצה אחת קיבלה בנוסף Docetaxel לפני הניתוח, וקבוצה שנייה קיבלה Docetaxel אחרי הניתוח. בתום 8 שנות מעקב, לא נמצאו הבדלים בין הקבוצות בהישרדות הכללית או בהישרדות ללא מחלה[7]. עבודות אלה ואחרות שפורסמו אמנם לא הוכיחו עליונות של שיטה זו על אחרת, אך הוכח לפחות שטיפול כימי טרום ניתוחי יעיל לא פחות מטיפול כימי אחרי ניתוח, ומאפשר להעלות את שיעור הניתוחים משמרי השד.
תוספת של תרופה מקבוצת הטקסנים (taxane) נבדקה במסגרת מחקרים אחרים, כמו 27-B וכן במטא-אנליזה שפורסמה בשנת 2008 [8]. עבודות אלה לא הוכיחו יתרון מבחינת הישרדות בכלל והישרדות ללא מחלה, אך נמצא שבקרב הנשים שנכללו בקבוצה שקיבלה תוספת taxane הושג שיעור גבוה יותר של תגובה פתולוגית מלאה (PCR). תגובה זו התבססה על עבודות שהוכיחו שטיפול אחרי ניתוח (אדג'ובנטי) הניתן במנות צפופות (Dose Dense) של כימותרפיה כל שבועיים יעיל יותר לעומת טיפול בכל 3 שבועות. כמו כן, מעבודות שנערכו בנושא הטיפול הטרום ניתוחי, עולה שטיפול במנות צפופות יעיל יותר מטיפול הניתן בכל 3 שבועות, אם כי לפעמים הטיפול כרוך במחיר של רעילות יתר[9]. מסיבה זו טיפול כימי טרום ניתוחי (AC) נפוץ כיום והוא ניתן כל שבועיים ל-4 מחזורים, ולאחר מכן ניתן טיפול באמצעות paclitaxel כל שבועיים, 4 פעמים, או במינון נמוך יותר כל שבוע למשך 12 שבועות.
בחולות סרטן שד עם ביטוי יתר של HER2, התברר כי תוספת של הנוגדן המונוקלונלי הרצפטין (Herceptin, trastuzumab) מעלה באופן משמעותי את שיעור ה-PCR. במחקר הראשון שפורסם בשנת 2005 טופלו חולות סרטן שד עם ביטוי יתר של HER2 בכימותרפיה טרום ניתוחית. באופן אקראי נבחרו מחצית מהחולות וטופלו ב-trastuzumab בנוסף לכימותרפיה כחלק מהטיפול הטרום ניתוחי. המחקר הופסק אחרי שרק 34 חולות סיימו את הטיפול (מתוך 164 חולות שהיו מתוכננות להיות כלולות במחקר) בגלל היתרון הגדול בהשגת PCR שבא לידי ביטוי בשלבים מוקדמים של המחקר [10].
בשנת 2011 פורסמו תוצאות מחקר TECHNO שבדק את היעילות והבטיחות של הוספת trastuzumab לטיפול נאו-אדג'ובנטי בחולות עם ביטוי יתר של HER2. במחקר השתתפו 217 חולות שסבלו מגידול שמימדיו גדולים מ-2 ם"מ שקיבלו בנוסף לטיפול הכימי, תוספת של trastuzumab לפני הניתוח. הטיפול בתרופה זו נמשך שנה לאחר הניתוח. התגובה לטיפול (PCR) הוגדרה כהיעדר מחלה חודרנית בשד או בבלוטות הלימפה. שיעור ה-PCR עמד על 39%, וניתוח משמר שד התאפשר בקרב 64% מהחולות. ההישרדות ללא מחלה עמדה על 88% בקבוצת הנשים עם PCR, לעומת 73% בקבוצה ללא PCR, ואילו ההישרדות ל-3 שנים עמדה על 96% לעומת 86%, בהתאמה. מסקנת הניסוי הייתה שתוספת trastuzumab העלתה את שיעור ה- PCR בגידולים עם ביטוי יתר של HER2, וכחולות אצלן הייתה נסיגה פתולוגית מלאה, התוצאות לטווח ארוך היו טובות יותר. לעומתן, הקבוצה שבה נמצאה שארית גידול הייתה בסיכון להישנות מחלה ואף למוות [11].
ההתפתחות האחרונה בטיפול הטרום ניתוחי בחולות עם ביטוי יתר של HER2 היא תוספת הנוגדן פרטוזומאב (pertuzumab, Perjeta). בשנת 2012 פורסם מחקר 417 :NeoSphere חולות סרטן שד עם HER2 חיובי שהיו מיועדות לקבל טיפול טרום ניתוחי טופלו באופן אקראי באחד מ-4 הטיפולים הבאים:
- docetaxel, pertuzumab הטיפול הסטנדרטי
- docetaxel, pertuzumab, trastuzumab
- pertuzumab, trastuzumab
- docetaxel, pertuzumab.
אלו שקיבלו את כל 3 התרופות, trastuzumab ,docetaxel ,pertuzumab , השיגו את שיעור ה-PCR הגבוה ביותר (45.8%) לעומת 29.0% בלבד בזרוע של הטיפול הסטנדרטי. ממצא נוסף ומעניין במחקר זה היה בזרוע של החולות שטופלו בנוגדנים בלבד, בלי כימותרפיה ציטוטוקםית (בלי 16.8% :(docetaxel מהחולות השיגו PCR - תוצאה המראה שגם כאשר נמנע מהחולות לקבל טיפול כימי בשל רעילותו, ניתן לטפל בהן באופן מוצלח יחסית ללא כימותרפיה - באמצעות נוגדנים בלבד [12].
לאחרונה אישר ה-FDA טיפול ב-pertuzumab יחד עם trastuzumab וכימותרפיה, כטיפול טרום ניתוחי בסרטן שד עם HER2 חיובי. ההגדרה והמשמעות הפרוגנוסטית של PCR לאחר טיפול טרום ניתוחי בסוגים השונים של סרטן שד נבדקה באמצעות ניתוח מסכם (pooled analysis) שכלל 7 מחקרים בטיפול טרום ניתוחי, בעבודה שנערכה בגרמניה שפורסמה בשנת 2012. להלן סוגי הסרטן שנבדקו:
- Estrogen receptor (ER)] positive pos] ו/או progesterone receptor (PgR) pos ו-HER2 neg (negative) ודרגה היסטולוגית 1 או 2 (Luminal A).
- ER pos ו/או PgR pos ו-HER2 pos או ER pos ו/או HER2 neg ,PgR pos ודרגה היסטולוגית 3 (Luminal B).
- PgR neg ,ER neg ו-HER2 pos.
- HER2 neg-1 ,ER neg, PgR neg (triple negative-TNBC).
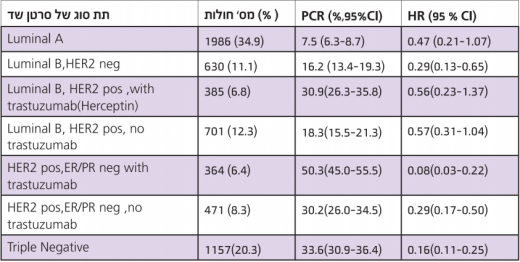
העבודה באה לענות על שתי סוגיות: האחת חוסר אחידות בהגדרה של PCR, והשנייה - העובדה שסרטן שד היא מחלה הטרוגנית. המשמעות הפרוגנוסטית של PCR שונה בתתי הסוגים השונים של סרטן השד. במחקר השתתפו 6,377 חולות במסגרת 7 מחקרים אקראיים, בהם קיבלו המשתתפות טיפול נאו-אדג'ובנטי. נמצא הבדל משמעותי בהישרדות ללא מחלה בחולות ללא שארית מחלה חודרנית או גידול מסוג in situ, לעומת אלה שנמצאה אצלן שארית גידול מסוג חודרני או מסוג DCIS. ממצא מאוד חשוב במחקר היה שהשגת PCR שיפרה את שיעורי ההישרדות ללא מחלה בחולות שסבלו מאחד מסוגי ה0רטן הללו: HER2 TNBC חיובי עם PR/ER שלילי, וסרטן מסוג Luminal B עם HER2 שלילי; אך לא בגידולים מסוג Luminal A חיובי (HER2) (ER שלילי), או מסוג Luminal B עם HER2 חיובי [5].
פורסם pooled analysis (מחקר באמצעות שאלונים) ביוזמת FDA-n של ארה"ב שאסף נתונים מ-12 מחקרים בין לאומיים (כולל 7 המחקרים מגרמניה שהוזכרו לעיל), בטיפול טרום ניתוחי בסרטן שד שכללו בסה"כ 11,955 חולות ומתוכם עבור 5,694 (52%) חולות נאסף מידע על תת הסוג של המחלה. הזמן הממוצע של המעקב היה גבוה במקצת מ-5 שנים. בדומה לממצאי המחקר הגרמני, האנליזה הראתה קשר ישיר בין PCR והישרדת בקרב חולות ב-3 תתי סוגים: סרטן שד מסוג HER2 pos ,ER neg ,PgR neg; בקבוצה של Luminal B ; ובאלו עם TNBC . אלו גם הקבוצות עם האחוזים הכי גבוהים של PCR. בנוסף לכך, העבודה זאת הראתה שלא היה הבדל משמעותי בין הגדרות של PCR שמאפשר שארית מחלה in situ, או לא מאפשר שארית בכלל, בהשלכות על ההישרדות [13]. לכן ההגדרה של PCR היא: ללא מחלה חודרנית בבלוטות או בשד, אך מחלה Situ עדיין מקובלת כסטנדרט[14]. בשתי העבודות, חלק ניכר מהחולות עם מחלת HER2 חיובי, לא קיבלו trastuzumab, מכיוון שהן חלו לפני העידן שבו טיפול זה הוכח כיעיל, בטיפול אדגובנטי או באו-אדגובנטי [5] , [13].
בטבלה אפשר לראות שאחוזי ה-PCR מגיעים ל 50% בקרב חולות שקיבלו trastuzumab עם תת סוג HER2 חיובי, 1-ER/PR שלילי. יחם הסיכון (Hazard ratio) הנמוך, 0.08 מראה שה-PCR בתת סוג זה, מעלה משמעותית את הסיכוי להישרדות [13].
עבודה שנערכה במרכז הסרטן MD Anderson בשנת 2008, השוותה תגובה לטיפול כימי נאו-אדג'ובנטי והישרדות בחולות עם סרטן שד מסוג TNBC, לעומת סוגי סרטן אחרים. נמצא, ששיעור ה- PCR היה כפול בקבוצת ה TNBC, לעומת הקבוצה שכללה חולות עם סוגים אחרים של סרטן שד non-TNBC (22% לעומת % 11), אך למרות הנתון הזה, שיעור ההישרדות ל-3 שנים היה נמוך משמעותית בקבוצת ה-TNBC. בחולות שהשיגו PCR לא נמצא הבדל בהישרדות בין שתי הקבוצות. בחולות בהן נמצאה שארית מחלה, ההישרדות ל-3 שנים הייתה נמוכה משמעותית בקבוצת ה-TNBC בהשוואה לנשים שנכללו בקבוצת ה-non-TNBC[15].
נעשו נסיונות נוספים לשפר את תוצאות הטיפול הטרום ניתוחי על ידי שימוש בתרופות חדשות וותיקות. בשנת 2012 בדקה קבוצת ^NSABP תוספת של ג'מסיטאבין (gemcitabine) וקאפסיטאבין (Xeloda ,capecitabine) לטיפול הנאו-אדג'ובנטי - לא נמצא שיפור מבחינת שיעורי PCR, שכן כתוצאה מנטילת תרופות אלה עלה שיעור הרעילות. בחלקה השני של העבודה בדקו החוקרים תוספת של אווסטין (Avastin ,bevacizumab) ־ נוגדן מונוקלונלי הפועל נגד Vasculare Endothelial Growth Factor. החוקרים מצאו שתוספת זו הביאה לעלייה מתונה אך משמעותית בשיעור ה-PCR בשד, אך לא בבלוטות הלימפה. ממצאים אלה היו תקפים בעיקר עבור חולות עם קולטנים חיוביים לאםטרוגן, מה שמרמז על אפקט הרבה פחות משמעותי מבחינת התוצאות לטווח ארוך. נוסף על כך, מתן bevacizumab העלה בצורה משמעותית את מספר האירועים הטוקסיים - בעיקר הלבביים [16].
טיפול בתרופה החדשה אקסםאבפילון (ixabepilone) מקבוצת ה - taxanes נבדק בטיפול טרום ניתוחי מול paclitaxel, אך שיעור התגובה לא עלה [17]. בשנת 2013 פרסם החוקר von Minckwitz יחד עם חוקרים נוספים, עמדה לפיה יש להחליף כימותרפיה כעבור שני מחזורים של Taxane ו- AC, במקרים בהם לא התקבלה תגובה קלינית. במחקר כל החולות קיבלו התחלת טיפול טרום ניתוחי של שני מחזורים שכללו docetaxel, doxorubicin ו-TAC) cyclophosphamide). חולות אצלן צומצם הגידול הסרטני, קיבלו בצורה אקראית עוד 4 מחזורים של TAC (הטיפול הסטנדרטי), או עוד 6 מחזורים של TAC חולות שלא הגיבו לטיפול, קיבלו עוד 4 מחזורים של TAC, או 4 מחזורים של טיפול אחר שכלל מתן vinorelbine ו- NX) capecitabine). במקרים שחולות לא הגיבו לטיפול TAC והועברו לטיפול NX, הושגה הישרדות ללא מחלה לזמן רב יותר מאשר אצל אלו שהטיפול שלהן לא הוחלף. מחקר זה (הנמצא בפאזה 3) הוא המחקר הראשון שמצביע על היתרון בשינוי הטיפול טרום ניתוחי על סמך התגובה הראשונית לטיפול [3].
טיפול ביולוגי, במעכב everolimus, mTOR, נחקר עדיין, ובשלב זה לא נראה כי הטיפול העלה את אחוז ה-PCR כאשר התווסף ל-paclitaxel בטיפול טרום ניתוחי [18].
יש להעריך את ההשלכות של טיפול כימי טרום ניתוחי על טיפול בקרינה המכוון לשד ולבלוטות הלימפה שמנקזות אותו. במשך זמן רב (מספר עשורים) ההתוויות לטיפול קרינתי הסתמכו על בדיקת הרקמה הגידולית כולה, יחד עם בלוטות הלימפה שהוצאו בניתוח לפני התחלת הטיפול הםיסטמי. יש עדות ממחקרים קליניים ש-PCR יכול להוריד את הסיכון להישנות מקומית. לכן התגובה לטיפול כימי טרום ניתוחי הפכה להיות חלק מהשיקולים בהחלטה על טיפול בקרינה, לאחר טיפול בכימותרפיה טרום ניתוחית, וניתוח. לגבי קרינה אחרי טיפול טרום ניתוחי, אין תמימות דעים בדבר הוראות לטיפול.
אחד המחקרים שטרם הסתיים, בודק האם יש צורך להקרין בלוטות בבית השחי במקרים בהם הטיפול הטרום ניתוחי הפך את הבלוטות שהיו מעורבות באבחנה, למצב ללא מחלה [(NSABP B51/RTOG 1304) (PCR)][19].
טיפול קרינתי נכון חשוב על מנת להפחית את הסיכון להישנות מקומית ואזורית, וכנראה גם לתוצאות לטווח הארוך, אך הוא כרוך בתופעות לוואי לא רצויות. כאשר הטיפול הכימי ניתן לפני הניתוח, ממדי הגידול ומעורבות הבלוטות שנמצאים בניתוח, אינם זהים לאלה שהיו בעת האבחנה.
מכאן עולה כי יש צורך בהערכה מחודשת ובחינה של ההתוויות לקרינה בעידן הטיפול הכימי הנאו-אדג'ובנטי. נכון להיום, אין מחקרים מבוקרים גדולים שמאפשרים שינוי של ההחלטה. העבודה הגדולה ביותר עד היום בנושא זה, היא של Mamounas וחבריו, בה נמצא שנשים שעברו כריתת שד ובלוטות לימפה ולא נמצאה אצלן שארית גידול בשד ובבלוטות (הדבר נכון במיוחד לקבוצה בה בלוטות חיוביות התבררו כשליליות), שיעור ההישנות המקומית היה נמוך מאד, ולכן ניתן היה לשקול האם אפשר להימנע אצל חולות אלו ממתן טיפול קרינתי משלים. לעומתן, בקרב חולות שאצלן לא הושג PCR, במיוחד כאשר שארית הגידול נמצאה בבלוטות הלימפה, שיעור ההישנות המקומית והאיזורית ללא קרינה היה גבוה (%11-22%), לכן לקבוצת חולות זו, הומלץ על טיפול בקרינה לאחר הניתוח [20].
כיוון נוסף של טיפול תרופתי טרום ניתוחי, הוא טיפול אנדוקריני ראשוני (הורמונותרפיה נאו-אדג'ובנטית), המהווה אפשרות טיפול נוספת בגידולים המבטאים רמות גבוהות של הקולטן לאםטרוגן. המטרות זהות לאלה של טיפול כימי ראשוני, קרי צמצום ממת הגידול על מנת לאפשר ניתוח בכלל וניתוחים משמרי שד בפרט. עבודות שהשוו בין מתן tamoxifen לתרופות מקבוצת מעכבי ארומטז בנשים אחרי גיל הבלות, מצאו יתרון מבחינת תגובת הגידול ושיעור הניתוחים משמרי השד, בעקבות טיפול בתרופות אלה. ברוב העבודות נמצא שכאשר משך הטיפול עולה על שלושה חודשים, התגובה טובה יותר.
כיום אין עבודות רבות המשוות בין מתן כימותרפיה לטיפול אנדוקריני טרום ניתוחי. עם זאת זוהי אופציית טיפול טובה [21], בעיקר עבור נשים מבוגרות עם גידולים גדולים בשד שמתאפיינים בקולטנים חיובים לאסטרוגנים.
על מנת למייע לחולות להחליט על טיפול כזה או אחר (נאו-אדג'ובנטי לעומת ניתוח, או טיפול כימי טרום ניתוחי לעומת טיפול אנדוקריני), נבדק שימוש בבדיקה המולקולרית 21 -gene Recurrence Score (Oncotype-DX) באמצעותה ניתן להעריך מהו המיכון להישנות הגידול על בסיס ביטוי של 21 גנים הנבדקים על ידי מדידת RNA. כבר בשנת 2005 פרסמו Gianni וחבריו עבודה בה נבדק בין היתר ה-Recurrence Score) RS) בקרב 89 חולות סרטן שד שקיבלו טיפול כימי טרום ניתוחי. התברר כי ככל שה-RS היה גבוה יותר, הסיכויים ל-PCR עלו [22].
עבודה אחרת מיפן שפורסמה בשנת 2013 בדקה קשר בין RS נמוך, בינוני, וגבוה באמצעות בדיקת 21 -gene Recurrence Scored, ( Oncotype-DX) , וטיפול אנדוקריני נאו-אדג'ובנטי בחולות סרטן שד חיובי לאמטרוגן, וכחולות פומטמנופאוזליות שטופלו ב- exemestane. החולות נבדקו במשך 24 שבועות, ולאחריהם נותחו. ה- RS בוצע על ביופמיית הגידול או הפרפרט הניתוחי. נמצא שבקרב נשים עם RS נמוך ובינוני, התגובה לטיפול האנדוקריני הייתה גבוהה, כאשר ל-59% של החולות הייתה נסיגה לפחות חלקית של המחלה בצורה משמעותית, לעומת הקבוצה עם RS גבוה, בה התגובה לטיפול האנדוקריני הייתה נמוכה - רק אצל 20% הייתה נסיגה של המחלה. כמו כן שיעור הניתוחים משמרי השד היה גבוה יותר בקרב חולות עם RS נמוך מאשר בקרב חולות בעלות RS גבוה [23].
תוצאות של 5,694 חולות מ-12 מחקרים באנליזה של Cortazar
סיכום
טיפול כימי טרום ניתוחי הוא טיפול נפוץ היום, המאפשר בעיקר ביצוע ניתוחים שמרניים יותר. השאלה האם טיפול כזה יעיל בהפחתת הסיכון להישנות המחלה והעלאת שיעורי הריפוי, אינה מוכחת. קרוב לוודאי שמחקרים בתרופות ישנות כמו cisplatin ו-carboplatin ובתרופות חדשות יביאו לשיפור ביעילות הטיפול הנאו-אדג'ובנטי והתאמתו למטופלת באופן אישי.
ביבליוגרפיה
- ↑ Hortobagyi GN, Blumenschein GR, Spanos W, et al. Multimodal treatment of locoregionally advanced breast cancer. Cancer. 1983 Mar 1;51(5): 763-768.
- ↑ Gralow JR, Burstein HL, Wood W, et al. Preoperative therapy in invasive breast cancer: pathologic assessment and systemic therapy issues in operable disease. J Clin Oncol. 2008 Feb 10;26(5):814-9.
- ↑ 3.0 3.1 3.2 von Minckwitz G, Blohmer JU, Costa SD, et al. Response-guided neoadjuvant chemotherapy for breast cancer. J Clin Oncol. 2013 Oct 10;31(29):3623-30. Epub2013 Sep 3.
- ↑ Boughey JC, Suman VJ, Mittendorf EA, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013 Oct 9;310(14):1455-61.
- ↑ 5.0 5.1 5.2 von Minckwitz G, Untch M, Blohmer JU,et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol. 2012 May 20;30(15): 1796¬804. Epub 2012 Apr 16.
- ↑ Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet. 2005 May 14-20:365(9472): 1687-717.
- ↑ Rastogi P, Anderson SJ, Bear HD, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol. 2008 Feb 10;26(5):778-85.
- ↑ Cuppone F, Bria E, Carlini P, et al.. Taxanes as primary chemotherapy for early breast cancer: meta-analysis of randomized trials. Cancer. 2008 Jul 15;113(2):238-46.
- ↑ Untch M, Mobus V, Kuhn W, et al. Intensive dose-dense compared with conventionally scheduled preoperative chemotherapy for high-risk primary breast cancer. J Clin Oncol. 2009 Jun 20:27(18):2938-45. Epub 2009 Apr 13.
- ↑ Buzdar AU, Ibrahim NK, Francis D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol. 2005 Jun 1:23(16)3676-85. Epub 2005 Feb 28.
- ↑ Untch M, Fasching PA, Konecny GE, et al. Pathologic complete response after neoadjuvant chemotherapy plus trastuzumab predicts favorable survival in human epidermal growth factor receptor 2-overexpressing breast cancer: results from the TECHNO trial of the AGO and GBG study groups. J Clin Oncol. 2011 Sep 1;29(25):3351-7. Epub 2011 Jul 25.
- ↑ Gianni L, Pienkowski T, Im YH, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomized multicentre, open-label, phase 2 trial. Lancet Oncol. 2012 Jan;13(1 ):25-32. Epub 2011 Dec 6.
- ↑ 13.0 13.1 13.2 Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014 Jul 12:384(9938); 164-72. Epub 2014 Feb 14.
- ↑ Berruti A, Generali D, Kaufmann M, et al. International expert consensus on primary systemic therapy in the management of early breast cancer: highlights of the Fourth Symposium on Primary Systemic Therapy in the Management of Operable Breast Cancer, Cremona, Italy (2010). J Natl Cancer Inst Monogr. 2011:2011(43): 147-51.
- ↑ Liedke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008 Mar 10;26(8):1275-81. Epub 2008 Feb 4.
- ↑ Bear HD, Tang G, Rastogi P, et al. Bevacizumab added to neoadjuvant chemotherapy for breast cancer. N Engl J Med. 2012 Jan 26;366(4):310-20.
- ↑ Horak CE, Pusztai L, Xing G, et al. Biomarker analysis of neoadjuvant doxorubicin/cyclophosphamide followed by ixabepilone or paclitaxel in early-stage breast cancer. Clin Cancer Res. 2013 Mar 15:19(6):1587-95. Epub 2013 Jan 22.
- ↑ Huober J, Fasching PA, Hanusch C, etal. Neoadjuvant chemotherapy with paclitaxel and everolimus in breast cancer patients with non-responsive tumours to epirubicin/cyclophosphamide (EC) ± bevacizumab - results of the randomized GeparQuinto study (GBC 44). Eur J Cancer. 2013 Jul;49(10):2284-93. Epub 2013 Mar 27.
- ↑ White J, Mamounas E. Locoregional radiotherapy in patients with breast cancer responding to neoadjuvant chemotherapy: a paradigm for treatment individualization. J Clin Oncol. 2014 Feb 20;32(6):494-5. Epub 2013 Dec 30.
- ↑ Mamounas EP, Anderson SJ, Dignam JJ, et al. Predictors of locoregional recurrence after neoadjuvant chemotherapy: results from combined analysis of National Surgical Adjuvant Breast and Bowel Project B-18 and B-27. J Clin Oncol. 2012 Nov 10;30(32):3960-6. Epub 2012 Oct 1.
- ↑ Freedman OC, Verma S, demons MJ. Using aromatase inhibitors in the neoadjuvant setting: evolution or revolution? Cancer Treat Rev. 2005 Feb;31(1):1-17. Epub 2004 Nov 18.
- ↑ Gianni L, Zambetti M, Clark K et al. Gene expression profiles in paraffin-embedded core biopsy tissue predict response to chemotherapy in women with locally advanced breast cancer. J Clin Oncol. 2005 Oct 10;23(29):7265-77. Epub 2005 Sep 6.
- ↑ Ueno T, Masuda N, Yamanaka T, et al. Evaluating the 21-gene assay Recurrence Score® as a predictor of clinical response to 24 weeks of neoadjuvant exemestane in estrogen receptor-positive breast cancer. Int J Clin Oncol. 2013 Oct 8. [Epub ahead of print]
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר רוית אגסי - כירורגית בכירה, מרכז אשכול לבריאות השד, המרכז הרפואי האוניברסיטאי סורוקה, הפקולטה למדעי בריאות, אוניברסיטת בן-גוריון בנגב, באר שבע ופרופ' דויד גפן - מנהל יחידת טיפול יום אונקולוגי, המרכז הרפואי האוניברסיטאי סורוקה, הפקולטה למדעי הבריאות אוניברסיטת בן- גוריון בנגב, באר שבע


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק