הבדלים בין גרסאות בדף "תסמונת אנצפלופתיה אחורית הפיכה - Posterior reversible encephalopathy syndrome"
רוני זליצקי (שיחה | תרומות) |
רוני זליצקי (שיחה | תרומות) |
||
| שורה 28: | שורה 28: | ||
*'''זיהום, [[ספסיס]] (Sepsis)''' - בחלק מהחולים במצבים אלה מתפתח PRES כאשר לחץ הדם הוא בתחום הנורמה. | *'''זיהום, [[ספסיס]] (Sepsis)''' - בחלק מהחולים במצבים אלה מתפתח PRES כאשר לחץ הדם הוא בתחום הנורמה. | ||
*'''השתלת מוח עצם''' - PRES מוכר ומדווח לאחר השתלות מח עצם ותאי אב. מדובר בשכיחות של כ-9-7 אחוזים לאחר השתלת מוח עצם אלוגנאית וטיפול ב-[[Ciclosporin]] (. השכיחות הגבוהה ביותר היא בחודש לאחר ההשתלה ויורדת במהלך השנה לאחר מכן{{הערה|שם=הערה3}}. | *'''השתלת מוח עצם''' - PRES מוכר ומדווח לאחר השתלות מח עצם ותאי אב. מדובר בשכיחות של כ-9-7 אחוזים לאחר השתלת מוח עצם אלוגנאית וטיפול ב-[[Ciclosporin]] (. השכיחות הגבוהה ביותר היא בחודש לאחר ההשתלה ויורדת במהלך השנה לאחר מכן{{הערה|שם=הערה3}}. | ||
| − | *'''תרופות אימונוסופרסיביות''' (Tacrolimus]] ,Ciclosporin | + | *'''תרופות אימונוסופרסיביות''' ([[Tacrolimus]] ,{{כ}}Ciclosporin) - נמצאות כחלק מגורמי הסיכון להתפתחות התסמונת לאחר השתלה. לא נמצא קשר בין רמות התרופה בדם לשכיחות PRES אך הפסקת הטיפול מביאה לרוב להפסקת התופעה. |
*'''טיפול אנטינאופלסטי''' - קיימת עלייה בדיווחים על חולים שטופלו בכימותרפיה ופיתחו PRES (תרופות רבות, ביניהן [[Carboplatin]], ציספלטין, CHOP (ציקלופוספציד, דוקסרוביצין, וינקריסטין ופרדניזון), ציטרבין, אינטרפרון אלפא, L אספרגינאז, מטוטרקסאט, אוקסליפלאטין, פאליטקסול, ריטוקסימאב ועוד){{הערה|שם=הערה4|Wu Q, Marescaux C, Wolff V. et al., Eur Neurol, 2010;64, 169}} , {{הערה|שם=הערה5|Bartynski WS, AJNR, 2008;29, 1043}}. | *'''טיפול אנטינאופלסטי''' - קיימת עלייה בדיווחים על חולים שטופלו בכימותרפיה ופיתחו PRES (תרופות רבות, ביניהן [[Carboplatin]], ציספלטין, CHOP (ציקלופוספציד, דוקסרוביצין, וינקריסטין ופרדניזון), ציטרבין, אינטרפרון אלפא, L אספרגינאז, מטוטרקסאט, אוקסליפלאטין, פאליטקסול, ריטוקסימאב ועוד){{הערה|שם=הערה4|Wu Q, Marescaux C, Wolff V. et al., Eur Neurol, 2010;64, 169}} , {{הערה|שם=הערה5|Bartynski WS, AJNR, 2008;29, 1043}}. | ||
*'''מחלות רקמת חיבור''' כגון [[לופוס]], [[סקלרודרמה]], [[בכצ'ט]], [[פוליארתריטיס נודוזה]]{{הערה|שם=הערה3}} , {{הערה|שם=הערה4}} , {{הערה|שם=הערה5}}. | *'''מחלות רקמת חיבור''' כגון [[לופוס]], [[סקלרודרמה]], [[בכצ'ט]], [[פוליארתריטיס נודוזה]]{{הערה|שם=הערה3}} , {{הערה|שם=הערה4}} , {{הערה|שם=הערה5}}. | ||
גרסה מ־19:18, 19 במרץ 2017
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
למרות דיווחים שונים בספרות על מקרים בודדים לאורך השנים, PRES (Posterior Reversible Encephalopathy Syndrome) תוארה לראשונה באופן מוגדר ב-1996 בעיתון NEJM[1]. תוארו אז 15 חולים עם תסמונת חולפת שכללה כאבי ראש, שינוי במצב הכרה, פרכוסים והפרעות בראיה בנוכחות ממצאי הדמיה שהעידו על פגיעה בחומר הלבן, בעיקרה אחורית. מתוך אותה קבוצת חולים, שבעה טופלו בתרופות מדכאות חיסון, שלוש חולות סבלו מרעלת הריון וארבעה סבלו מאנצפלופתיה על רקע יתר לחץ דם אקוטי, כנראה על רקע מחלת כליות. ל-12 חולים מתוך ה-15 הייתה עלייה חדה ופתאומית בלחץ הדם.
מאז פרסום זה, נקראה התסמונת בשמות שונים, חלקם על שם הקליניקה (Posterior reversible encephalopathy syndrome), חלקם על בסיס המנגנון המשוער ( ,Brain capillary leak syndrome Hyperperfusion encephalopathy) וחלקם על רקע ממצאי ההדמיה (Posterior leukoencephalopathy syndrome, Reversible posterior cerebral edema syndrome). בשנים שחלפו מאז 1996 נצבר ידע בנוגע לגורמים אפשריים לתסמונת אך פחות מכך לגבי המנגנונים.
סקירה זו תתמקד בגורמים האפשריים, בתמונה ההדמייתית ובסקירת המנגנונים האפשריים לתסמונת.
אטיולוגיה
מרבית המקרים, גם אם נגרמו על ידי גורם אחר (כגון דיכוי חיסון) מופיעים עם יתר לחץ דם (80-75 אחוזים)[1] , [2]. יחד עם זאת, חשוב לציין שמרבית המקרים של PRES מתרחשים בנוכחות לחץ דם מתחת לערכים בהם יש פגיעה באוטורגולציה (פחות מ-160-150 מ"מ (מילימטר) כספית לחץ עורקי ממוצע).
בנוסף ליתר לחץ דם גורמים רבים מהווים סיכון להתפתחות PRES:
- רעלת היריון - יכולה להתרחש טרם הלידה ועד מספר שבועות לאחר הלידה ומהווה גורם סיכון להתפתחות PRES.
- זיהום, ספסיס (Sepsis) - בחלק מהחולים במצבים אלה מתפתח PRES כאשר לחץ הדם הוא בתחום הנורמה.
- השתלת מוח עצם - PRES מוכר ומדווח לאחר השתלות מח עצם ותאי אב. מדובר בשכיחות של כ-9-7 אחוזים לאחר השתלת מוח עצם אלוגנאית וטיפול ב-Ciclosporin (. השכיחות הגבוהה ביותר היא בחודש לאחר ההשתלה ויורדת במהלך השנה לאחר מכן[2].
- תרופות אימונוסופרסיביות (Tacrolimus ,Ciclosporin) - נמצאות כחלק מגורמי הסיכון להתפתחות התסמונת לאחר השתלה. לא נמצא קשר בין רמות התרופה בדם לשכיחות PRES אך הפסקת הטיפול מביאה לרוב להפסקת התופעה.
- טיפול אנטינאופלסטי - קיימת עלייה בדיווחים על חולים שטופלו בכימותרפיה ופיתחו PRES (תרופות רבות, ביניהן Carboplatin, ציספלטין, CHOP (ציקלופוספציד, דוקסרוביצין, וינקריסטין ופרדניזון), ציטרבין, אינטרפרון אלפא, L אספרגינאז, מטוטרקסאט, אוקסליפלאטין, פאליטקסול, ריטוקסימאב ועוד)[3] , [4].
- מחלות רקמת חיבור כגון לופוס, סקלרודרמה, בכצ'ט, פוליארתריטיס נודוזה[2] , [3] , [4].
מנגנונים
קיימות שתי תיאוריות באשר למנגנונים הגורמים לתופעה:
הראשונה, המסתמכת על העובדה כי בחלק גדול מן המקרים לחץ הדם גבוה וכי קיימים ממצאים בהדמיה המעידים על בצקת מוח, טוענת כי הגורם הישיר לתופעה הינו לחץ דם אקססיבי אשר גורם לפגיעה באוטורגולציה של זרימת הדם למוח ובכך להיפרפרפוזיה, ובעקבותיה לבצקת וואזוגנית.
העובדה כי ברוב המקרים של PRES ישנם לחצי דם אקססיביים הופכת את התאוריה הנ"ל לאינטואיטיבית ופופולארית. תומכת בתאוריה זו העובדה כי תחת טיפול להורדת לחץ הדם נצפה שיפור קליני והדמייתי מהיר במהלך של ימים ואף שעות[5] , [6].
מחקרים בחיות שבדקו את ההשפעות של לחץ דם גבוה על המוח הדגימו כי מעבר לגבול האוטורגולציה העליון יש פגיעה בכלי הדם ובקפילרות שמובילה להיפרפרפוזיה ובצקת ואזוגנית.
בבחינה מדוקדקת של המקרים, ברור שלא די במנגנון זה כדי להסביר את התסמונת.
העובדה כי בחלק לא מבוטל מן המקרים (40-20 אחוז) אין לחץ דם גבוה ובמקרים בהם לחץ הדם כן גבוה ל"ד הממוצע איננו חורג מ-150-160 ממ"כ (גבול האוטורגולציה העליון) מדגישה את הבעיה בהסבר חד ממדי שכזה.
על בעיות אלו בתאוריה הראשונה מתבססת התאוריה השנייה, הגורסת כי המנגנון להתפתחות התסמונת הינו ואזוקונסטריקציה של הארטריולות במוח כתוצאה משפעול ופגיעה בתאי האנדותל שגורמת לאיסכמיה ובעקבות זאת להפרעה נוספת בתפקוד האנדותל ולבצקת ואזוגנית. יש עדויות לכך כי הבצקת ב-PRES לא נוטה להחמיר בקורלציה לחומרת לחץ הדם ובנוסף יש תצפית המראה כי בחולי PRES עם זיהום/שוק או ספסיס מידת הבצקת הייתה נמוכה יותר בחולים עם יתר לחץ דם קיצוני לעומת חולים שהיו נורמוטנסיביים בפרזנטציה[7].
ברוב המצבים בהם מתפתח PRES מדובר במהלך סיסטמי (השתלה, זיהום, רעלת היריון, מחלות אוטואימוניות, כימותרפיה ואימונוסופרסיה) . ההתייצגות הקלינית והתמונה ההדמייתית דומות בכל המקרים. המנגנון המוצע מתחיל בתאי אנדותל שמשופעלים במנגנונים שונים (ציטוקינים, תאי T ונזק ישיר של חומרים טוקסיים) כתוצאה מהתהליך הסיסטמי.
בשל הפרעה בתפקוד האנדותל נגרמת ואזוקונסטריקציה שגורמת להיפופרפוזיה ואיסכמיה, תאי האנדותל מתנפחים, יש פגיעה בקפילרות וזליגה של חלבון מחוץ לכלי הדם - דבר הגורם לבצקת הוואזוגנית. ב-CT angiography ו-MR angiography של המוח בחולי PRES ניתן לראות פגיעה בכלי הדם בדמות ואזוקונסטריקציה וואזודילטציה מוקדיות וממצאים נוספים המעידים על פגיעה בתפקוד האנדותל[8].
עובדה נוספת שהודגמה במיפוי Tc99m HMPAO SPECT ו-MR perfusion [9] , [10] היא שהפיזור ההדמייתי של הבצקת ב-PRES מתאים לפיזור בתבנית של Watershed.
יתכן והתפתחות PRES נגרמת ממעורבות של שני המנגנונים יחדיו; בתחילה פגיעה באנדותל שגורמת לואזוקונסטריקציה, היפופרפוזיה, איסכמיה, פגיעה בדופן קפילרות ובצקת, ובהמשך עלייה בלחץ הדם כתוצאה מתהליכים דומים ברמה הסיסטמית הגורמים במנגנון האוטורגולציה המוחי לוואזוקונסטריקציה נוספת וכך להחמרה בהיפופרפוזיה ואיסכמיה.
מנגנון משולב זה יכול להסביר את ההשפעה המיטיבה של הורדת לחץ הדם על הקליניקה ועל השיפור ההדמייתי המהיר, על אף שהסיבה הבסיסית המוצעת במנגנון התת פרפוזיה אינו יתר ל"ד[6].
השפעה סיסטמית
בחלק גדול מהחולים המציגים תמונה של PRES התהליכים שתוארו, הכוללים פגיעה באנדותל ושינויים בדופן כלי הדם, מתרחשים לא רק במוח אלא בכל מערכות הגוף. עובדה זו יכולה להסביר את העלייה בתפקודי הכבד במקרים מסויימים, את עליית לחץ הדם הסיסטמי, הפרעות קרישה וכד'.
קליניקה
בסקירה של 36 חולים (הגדולה שנעשתה עד 2008[11] הייתה הסתמנות קלינית של פרכוסים (87 אחוז), אנצפלופתיה (92 אחוז), הפרעות ראייה (39 אחוז) וכאבי ראש (53 אחוז).
לחץ הדם הסיסטולי הממוצע היה 187 מ"מ כספית והתסמינים הקליניים חלפו בממוצע לאחר 5.3 ימים.
אבחנה
תמונה הדמייתית
התמונה ההדמייתית האופיינית ב-Computed tomography) CT) או Magnetic resonance imaging) MRI) היא של בצקת מוקדית סימטרית. האונות האוקסיפיטליות והפריטאליות הן המעורבות בשכיחות הגבוהה ביותר ואחריהן האונה הפרונטאלית, החלק התחתון של החיבור בין האונה הטמפוראלית והאוקסיפיטאלית ולבסוף הצרבלום.
הממצא האופייני ב-MRI הוא היפראינטנסיות ברצף T2 הנגרמת כנראה בשל בצקת ואזוגנית תת-קליפתית של החומר הלבן. ממצאים פתולוגיים בולטים אף יותר ברצף Fluid attenuated inversion recovery) FLAIR) אשר מאפשר להבחין בשינויים עדינים.
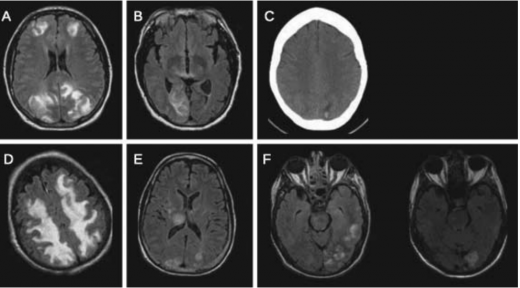
בנוסף, שימוש ברצפי Diffusion-weighted imaging) DWI) ו-Apparent diffusion coefficient) ADC), עוזר להבדיל בין בצקת ואזוגנית, שהינה המרכיב המשמעותי ב-PRES, לבין בצקת ציטוטוקסית שמאפיינת נזק מוקדי איסכמי (תמונה 1).
בבצקת ואזוגנית שהינה המרכיב העיקרי ב-PRES, האזורים ההיפראינטנסיים ב-T2 מתאימים ב-DWI לאזורים היפראינטנסיים או איזואינטנסיים. ב-ADC אזורים אלה יראו גם הם בהירים יותר, בניגוד לנזק איסכמי (המבטא בצקת ציטוטוקסית) בה יראו אזורים אלה ב-ADC כהים.
רוב הנגעים ב-PRES לא עוברים האדרה עם גדוליניום. האדרה באזורים ההיפראינטנסיים ב-T2 תתכן בחולים בודדים ויכולה להעיד על דינמיות של הנגעים וחומרתם וקשורה גם לפרק הזמן שחלף מאז תחילת התסמינים .
רזולוציה מלאה של ממצאי ההדמיה נחשבת כמעט כהגדרה של התסמונת על אף שלא ברור התזמון המיטבי לביצוע הדמיית ביקורת (תמונה 2) , אך היא מתרחשת כנראה בין פרק זמן של ימים בודדים עד שבועות [11] , [2]. על אף התמונה המתוארת כקלאסית, קיימים מקרים רבים בהם ההדמיה אינה תואמת את התיאור האופייני. תוארו מקרים עם מעורבות קדמית משמעותית. יש גם מקרים מתועדים של מעורבות קורטיקאלית, נזקים בלתי הפיכים נקודתיים, דימומים לתוך נגעים ומעורבות חד צדדית (תמונה 3).
במקרים אחרים נצפית מעורבות של גזע המוח וכן של גרעיני הבסיס. במקרים בהם מעורבות זו משמעותית, תתכן התפתחות הידרוצפלוס ולחץ על גזע המוח[11] , [2] , [12].
אזורים של רסטריקציה בדיפוזיה (המצביעים, קרוב לוודאי, על בצקת ציטוטוקסית), אינם שכיחים (26-11 אחוז) ויתכן וקשורים לפרוגנוזה גרועה .
טיפול
הטיפול כולל הורדת לחץ הדם, הפסקה או הורדה משמעותית של הגורם כגון אימונוספורסיה וטיפול בפרכוסים. הטיפול המתאים צריך להנתן במסגרת טיפול נמרץ.
לגבי לחץ הדם - מומלץ להוריד ללחץ ממוצע של 125-105 ממ"כ ולא יותר מ-25 אחוז בשעה הראשונה[13].
פרוגנוזה
הפרוגנוזה של PRES טובה מאוד ורוב החולים משתפרים קלינית והדמייתית עוד במהלך שהותם בבית החולים, יחד עם זאת, אבחנה מהירה והתחלת טיפול הינם בעלי משמעות גבוהה משום שלמרות היות התסמונת הפיכה בדרך כלל, ללא אבחנה וטיפול מהירים יתכנו סיבוכים משמעותיים כגון איסכמיה, בעיקר באזורים אחוריים בפיזור Watershed בין טריטוריות וסקולאריות של ה-Middle cerebral וה- Posterior cerebral arteries. כמו כן יכולים להופיע דימומים, סטאטוס אפילפטיקוס וכן סיבוכים מאוחרים כגון אפילפסיה מוקדית שיכולה להתפתח שבועות, חודשים ואף שנים לאחר האירוע האקוטי[13] , [14] , [15].
סיכום
PRES היא תסמונת קלינית והדמייתית שיכולה להיגרם מסיבות רבות ומגוונות. המנגנון המרכזי הגורם להתהוות התסמונת אינו ודאי ולמרות מחקרים רבים עדיין שנוי במחלוקת.
הידיעה כי התסמונת יכולה להופיע גם במקרים בהם אין לחץ דם אקססיבי ואף במקרים של לחץ דם תקין, צריכה להעלות את התסמונת באבחנה מבדלת במקרים בהם הקליניקה והתמונה ההדמייתית מתאימות .
אבחנה וטיפול מהירים מאפשרים פרוגנוזה טובה מאוד ברוב החולים.
ביבליוגרפיה
- ↑ 1.0 1.1 Hinchey J, Chaves C, Appignani B et al., N Engl J Med, 1996;334, 494
- ↑ 2.0 2.1 2.2 2.3 2.4 Bartynski WS, AJNR, 2008;29, 1036
- ↑ 3.0 3.1 Wu Q, Marescaux C, Wolff V. et al., Eur Neurol, 2010;64, 169
- ↑ 4.0 4.1 Bartynski WS, AJNR, 2008;29, 1043
- ↑ Kaplan NM, Lancet, 1994;344, 1335
- ↑ 6.0 6.1 Servillo G, Bifulco F, De Robertis E, et al., Intensive Care Med, 2007;33, 230
- ↑ Bartynski WS, Boardman JF, AJNR, 2008;29: 447
- ↑ Ito T, Sakai T, Inagawa S, et al., AJNR, 1995;16, 1344
- ↑ Bartynski WS, Grabb BC, Zeigler Z, et al., J CAT, 1997;21, 872
- ↑ Engelter ST, Petrella JR, Alberts MJ, et al., Am J Roentgenol 1999;173, 1491
- ↑ 11.0 11.1 11.2 Lee VH, Wijdicks EF, Manno EM, Rabinstein AA, Arch Neurol, 2008;65, 205
- ↑ Kitaguchi H, Tomimoto H, Miki Y et al., Neuroradiology, 2005;47,652
- ↑ 13.0 13.1 Servillo G, Bifulco F, De Robertis E, et al., Intensive Care Med, 2007;33, 230
- ↑ Roth C, Ferbert A, J Neurol Neurosurg Psychiatry, 2010;81, 773
- ↑ Fugate JE, Claassen DO, Cloft HJ, et al., Mayo Clin Proc, 2010;85, 427
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר אבי גדות, המחלקה לנוירולוגיה, המרכז הרפואי תל אביב


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק