הבדלים בין גרסאות בדף "Contactin-1 בנסיוב"
| שורה 23: | שורה 23: | ||
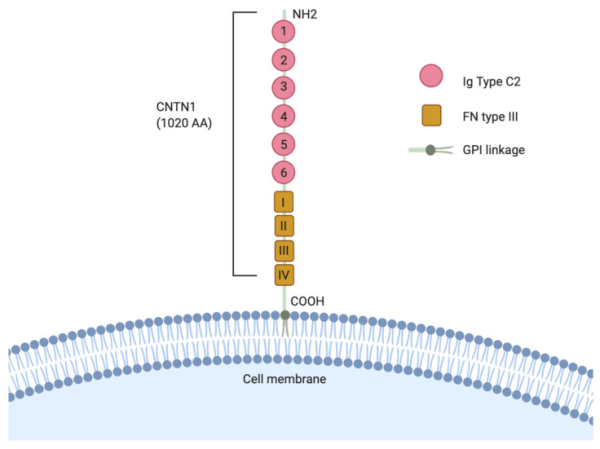
בין ששת החברים במשפחת CNTN, הראשון שזוהה הוא CNTN1 שנחקר בצורה היסודית ביותר לתפקידו במפגעים פתולוגיים (Gennarini וחב' ב-Mol Cell Neurosci משנת 2017). מולקולת CNTN1 מורכבת מששה מקטעים N-טרמינליים של אימונוגלובולין C2, המלווים על ידי ארבעה החזרים של פיברונקטין type III בקצה ה-C-טרמינלי, וכן רצף של חומצות אמינו בקצה ה-C-טרמינלי. CNTN1 מבוטא בעיקר במוח האדם וברקמות נוירונליות, אך מבוטא באופן מוגבל גם ברקמות אחרות. CNTN1 פועל בעיקר כגליקופרוטאין אקסונלי הקשור לגדילת אקסונים ונויריטים (Bizzoca וחב' ב-Cell Adhes Migr משנת 2009), אך גם משחק תפקיד חשוב בתהליכי התפתחות נוירונלית כגון התמיינות והתפתחות של תאי glia, מיאלינציה, סינפטוגנזה ותנועת התכווצות בלתי רצונית של שריר (fasciculation) ({{כ}}Çolakoğlu וחב' ב-Proc Natl Acad Sci USA משנת 2014, Dityatev וחב' ב-Neuron Glia Boil משנת 2008, ו-Hu וחב' ב-Cell משנת 2003). עכברים טרנסגניים שהם משוללים CNTN1, הם בעלי פנוטיפ של המוחון בו סיבים מקבילים של נוירונים בגרנולות תאיות פגועים באוריינטציה שלהם, במקביל להפחתה של 25% בנפח המוחון, מה שתומך בחשיבותו של CNTN1 בהכוונת האקסון (Berglund וחב' ב-Neuron משנת 1999). מוטנטים הומוזיגוטיים של CNTN1 היו קטלניים בעכברים ביום ה-18 לאחר הלידה, מה שניתן לייחס לפעילות פגועה של המוחון, המפריעה להתנהגות אכילה נורמלית. | בין ששת החברים במשפחת CNTN, הראשון שזוהה הוא CNTN1 שנחקר בצורה היסודית ביותר לתפקידו במפגעים פתולוגיים (Gennarini וחב' ב-Mol Cell Neurosci משנת 2017). מולקולת CNTN1 מורכבת מששה מקטעים N-טרמינליים של אימונוגלובולין C2, המלווים על ידי ארבעה החזרים של פיברונקטין type III בקצה ה-C-טרמינלי, וכן רצף של חומצות אמינו בקצה ה-C-טרמינלי. CNTN1 מבוטא בעיקר במוח האדם וברקמות נוירונליות, אך מבוטא באופן מוגבל גם ברקמות אחרות. CNTN1 פועל בעיקר כגליקופרוטאין אקסונלי הקשור לגדילת אקסונים ונויריטים (Bizzoca וחב' ב-Cell Adhes Migr משנת 2009), אך גם משחק תפקיד חשוב בתהליכי התפתחות נוירונלית כגון התמיינות והתפתחות של תאי glia, מיאלינציה, סינפטוגנזה ותנועת התכווצות בלתי רצונית של שריר (fasciculation) ({{כ}}Çolakoğlu וחב' ב-Proc Natl Acad Sci USA משנת 2014, Dityatev וחב' ב-Neuron Glia Boil משנת 2008, ו-Hu וחב' ב-Cell משנת 2003). עכברים טרנסגניים שהם משוללים CNTN1, הם בעלי פנוטיפ של המוחון בו סיבים מקבילים של נוירונים בגרנולות תאיות פגועים באוריינטציה שלהם, במקביל להפחתה של 25% בנפח המוחון, מה שתומך בחשיבותו של CNTN1 בהכוונת האקסון (Berglund וחב' ב-Neuron משנת 1999). מוטנטים הומוזיגוטיים של CNTN1 היו קטלניים בעכברים ביום ה-18 לאחר הלידה, מה שניתן לייחס לפעילות פגועה של המוחון, המפריעה להתנהגות אכילה נורמלית. | ||
| − | [[קובץ:CNTN1-1.png|מרכז| | + | [[קובץ:CNTN1-1.png|ממוזער|מרכז|600 פיקסלים|''' הצגה סכמטית של מבנה CNTN1, חלבון המכיל 1020 חומצות אמינו, המורכב מששה החזרים (repeats) דמויי אימונוגלובולין, המלווים על ידי ארבעה מקטעים דמויי פיברונקטין type III, וקשור על ידי עוגן glycosylphosphatidylinositol (GPI) לממברנה.''']] |
גרסה מ־03:55, 30 ביולי 2025
| מדריך בדיקות מעבדה | |
| Contactin-1 | |
|---|---|
| ' | |
| שמות אחרים | CIDP, CNTN1, CISP |
| מעבדה | כימיה בדם ובתאים. |
| תחום | ממאירות |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה: הערכה של נוירופתיות היקפיות של דה-מיאלינציה, ושל דה-מיאלינציה דלקתית כרונית של polyradiculoneuropathy. קביעה של תוצאות contactin-1 IgG כחלק מפרופיל.
מידע קליני
Chronic inflammatory demyelinating polyradiculoneuropathy (או CIDP), היא מצב נרכש בתיווך חיסוני המשפיע על עצבים היקפיים ועל שורשי עצב, מצב המאופיין על ידי מתווים אלקטרו-אבחוניים של דה-מיאלינציה כרונית המובילים למגבלות משמעותיות (Dubey וחב' ב-Neurol Neuroimmunol Neuroinflamm משנת 2020). השכיחות של CIDP מוערכת כ-2-4 מקרים לכל 100,000 אנשים. למרות הגורם הנדיר של polyneuropathy, יש להכיר בכך שמפגע זה ניתן לטיפול על ידי אימונו-מודולציה. למרות שהגריין האימונולוגי המדויק ל-CIDP נותר לא ברור, תת-קבוצה של מטופלים עם חשד ל-CIDP זוהו ככאלה עם נוגדנים עצמיים המכוונים כנגד חלבונים נודאליים (הקשורים לצומת) או פארא-נודאליים. מטופלים אלה הם בעלי מנגנוני מחלה אימונו-פתולוגית דומים, תכונות קליניות ותגובות לטיפולים, השונים ממצב של CIDP קלאסי. יעד משותף של נוגדנים עצמיים אלה הוא הקומפלקס neurofascin-155 (NF155)-contactin-1 (CNTN1) (Cortese וחב' באותו כתב עת מאותה שנה). CNF-155 מבוטא בלולאות הפארא-נודליות של תאי Schwann, שם הם מגיבים עם CNTN1, המבוטא על אקסונים סמוכים. אינטראקציה זו מייצבת ומאפשרת את הארגון הראוי של הצומת הפארא-נודלית האקסוגליאלית. הפגיעה המתווכת על ידי נוגדן של אינטראקציה זו במודלים של חיות, מסכמת את הפתו-פיזיולוגיה שמוצאים באדם (Manso וחב' ב-Brain משנת 2016). נוגדנים מסוג IgG כנגד contactin-1, מופיעים בערך ב-2% מהמטופלים עם CIDP. מקרים חיוביים של נוגדנים IgG אלה מאופיינים על ידי כאב נוירופתי, על ידי שיגשון (ataxia) סנסורית, ועל ידי דה-מיאלינציה מתקדמת תת-חריפה של polyradiculoneuropathy או polyradiculopathy (Le Quintrec וחב' ב-Kidney Int משנת 2021). רובם של מטופלים חיוביים לנוגדנים אלה, נמצאו עמידים לטיפול תוך-ורידי עם גלובולין חיסוני (IVig). עם זאת, חלק ממטופלים אלה מגיבים יפה לתרפיות המרחיקות תאי-B, כגון rituximab. תוצאה שלילית אינה שוללת מחלה עם דה-מיאלינציה המתווכת על ידי מערכת החיסון.
החלבון האונקוגני contactin-1 מסייע להתפתחות הסרטן וגרורותיו
למרות ההתקדמות העדכנית, סרטן נותר גורם המוות השני במעלה, מה שמגביר את הצורך להבין את הגורמים האונקוגניים. ישנן הצטברות של ראיות לכך ש-contactin-1 (להלן CNTN1) אחראי לפעילויות אונקוגניות אחדות במגוון של סוגי סרטן. CNTN1 היא מולקולת ספיחה תאית, המווסתת בקרצינומות רבות באדם. אנומליה בביטוי של CNTN1 כרוכה בהתקדמות התהליך הסרטני ובפרוגנוזה גרועה. מבחינה מכניסטית, CNTN1 פעיל במספר מסלולים מאותתים המשתתנים לעתים בסרטן, כגון הציר vascular endothelial growth factor C (VEGFC)-VEGF receptor 3 (VEFGR3)/fms-related tyrosine kinase 4 (Flt4), מסלול איתות Notch ותהליך epithelial-mesenchymal transition (EMT). אירועים אונקוגניים אלה מתרחשים דרך אינטרקציות בין סרטן וסטרומה, הנתרמים על ידי CNTN1, שהוא חלבון ספיחה. הביטוי של CNTN1 בסרטן השד תואם את הביטוי של גנים הפועלים באינטראקציה בין סטרומת סרטן והתפתחות מערכת השלד. יש ראיות לכך ש-CNTN1 תורם להתפתחות גרורות סרטניות במקרה של סרטן השד. מולקולות ספיחה תאיות (CAMs) הם קולטנים ממברנליים הנקשרים למולקולות משתית חוץ-תאיות (ECMs) (Makrilia וחב' ב-Cancer Invest משנת 2009). CAMs יוצרים קשרים מבניים ומתווכים באינטראקציות בין שלד התא וה-ECM הבינתאי. אינטראקציה זו מעודדת איתות תוך-תאי ומווסתת תהליכים ביולוגיים חשובים כולל חלוקת התא, נדידת תאים והתמיינות. תהליכים אלה עלולים להיות שגויים ברגולציה בטומורוגניות (Cavallaro ו-Christofori ב-Ann NY Acad Sci משנת 2004). יצירת גרורות היא סיבת המוות השכיחה ביותר בקרב חולי סרטן ברחבי העולם (Mehlen ו-Puisieux ב-Nat Rev Cancer משנת 2006). CNTN1 היא מולקולת תא עצבי, השייכת לתת-קבוצה של תאי ספיחה עצביים glycosyl phosphatidylinositol (GPI)-anchoredglycosyl anchored של משפחת העל של אימונוגלובולין (IgSF) (Low ב-Faseb J משנת 1989). העניין ב-CNTN1 כיעד לפגיעה בהתקדמות התהליך הסרטני הולך וגדל (Chen וחב' ב-World J Gastroenterol משנת 2015, Shi וחב' ב-Int J Clin Exp Pathol משנת 2015, ו-Zhang וחב' ב-Minerva Med משנת 2017).
התפקיד של CNTN1 בהתפתחות נוירונלית
בין ששת החברים במשפחת CNTN, הראשון שזוהה הוא CNTN1 שנחקר בצורה היסודית ביותר לתפקידו במפגעים פתולוגיים (Gennarini וחב' ב-Mol Cell Neurosci משנת 2017). מולקולת CNTN1 מורכבת מששה מקטעים N-טרמינליים של אימונוגלובולין C2, המלווים על ידי ארבעה החזרים של פיברונקטין type III בקצה ה-C-טרמינלי, וכן רצף של חומצות אמינו בקצה ה-C-טרמינלי. CNTN1 מבוטא בעיקר במוח האדם וברקמות נוירונליות, אך מבוטא באופן מוגבל גם ברקמות אחרות. CNTN1 פועל בעיקר כגליקופרוטאין אקסונלי הקשור לגדילת אקסונים ונויריטים (Bizzoca וחב' ב-Cell Adhes Migr משנת 2009), אך גם משחק תפקיד חשוב בתהליכי התפתחות נוירונלית כגון התמיינות והתפתחות של תאי glia, מיאלינציה, סינפטוגנזה ותנועת התכווצות בלתי רצונית של שריר (fasciculation) (Çolakoğlu וחב' ב-Proc Natl Acad Sci USA משנת 2014, Dityatev וחב' ב-Neuron Glia Boil משנת 2008, ו-Hu וחב' ב-Cell משנת 2003). עכברים טרנסגניים שהם משוללים CNTN1, הם בעלי פנוטיפ של המוחון בו סיבים מקבילים של נוירונים בגרנולות תאיות פגועים באוריינטציה שלהם, במקביל להפחתה של 25% בנפח המוחון, מה שתומך בחשיבותו של CNTN1 בהכוונת האקסון (Berglund וחב' ב-Neuron משנת 1999). מוטנטים הומוזיגוטיים של CNTN1 היו קטלניים בעכברים ביום ה-18 לאחר הלידה, מה שניתן לייחס לפעילות פגועה של המוחון, המפריעה להתנהגות אכילה נורמלית.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק