הבדלים בין גרסאות בדף "קואנזים Coenzyme Q10"
| שורה 25: | שורה 25: | ||
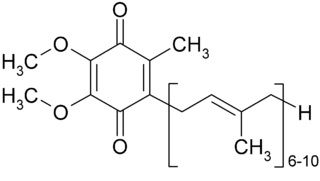
הצורה המחומצנת של CoQ10 מופיעה בתרשים. הצורות השונות של Coenzyme Q, נבדלות ביניהן על ידי מספר תת יחידות ה-isoprenoid המופיעות בשרשרת הצדדית שלהם: מסתבר שקואנזים Q הנפוץ ביותר במיטוכונדריה של האדם, הוא CoQ10. | הצורה המחומצנת של CoQ10 מופיעה בתרשים. הצורות השונות של Coenzyme Q, נבדלות ביניהן על ידי מספר תת יחידות ה-isoprenoid המופיעות בשרשרת הצדדית שלהם: מסתבר שקואנזים Q הנפוץ ביותר במיטוכונדריה של האדם, הוא CoQ10. | ||
| − | + | ||
| + | [[קובץ:קואנזים1.jpg|מרכז|ממוזער|400px|נוסחת קואנזים Q10 כאשר מס' היחידות החוזרות (בסוגריים) עומד על 10.]] | ||
| + | |||
Q10 הוא במבנהו 1,4benzoquinone, בו Q מתייחס לגרעין ה-quinone והמספר 10 מתייחס ליחידות isoprenyl. מולקולת CoQ10 נמצאת בממברנות של אברונים רבים בתא, וכיוון שתפקידו העיקרי בתאים הוא ליצור אנרגיה, אך טבעי הוא שריכוזו הגבוה ביותר הוא בממברנה הפנימית של המיטוכונדריה. אברונים נוספים בתא המכילים CoQ10 הם הרטיקולום האנדופלזמי, הפראוקסיזום, הליזוזום ובועיות (vesicles) הנוצרות בתא בתרחישים שונים. | Q10 הוא במבנהו 1,4benzoquinone, בו Q מתייחס לגרעין ה-quinone והמספר 10 מתייחס ליחידות isoprenyl. מולקולת CoQ10 נמצאת בממברנות של אברונים רבים בתא, וכיוון שתפקידו העיקרי בתאים הוא ליצור אנרגיה, אך טבעי הוא שריכוזו הגבוה ביותר הוא בממברנה הפנימית של המיטוכונדריה. אברונים נוספים בתא המכילים CoQ10 הם הרטיקולום האנדופלזמי, הפראוקסיזום, הליזוזום ובועיות (vesicles) הנוצרות בתא בתרחישים שונים. | ||
| שורה 35: | שורה 37: | ||
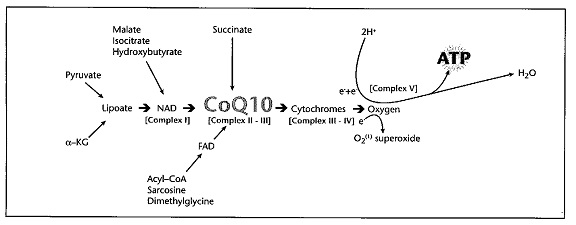
כאמור CoQ10 הוא מסיס-שומן ולכן הוא נייד בשכבה הליפידית של ממברנות, ומייחסים לו חשיבות בייצוב מבנה הממברנה. בממברנה הפנימית של המיטוכונדריון, אלקטרונים שמקורם ב-NADH וסוקצינאט (אך גם מפירובאט, Acyl CoA, ואלפא קטו גלוטראט) מועברים דרך שרשרת העברת האלקטרונים (המוכרת גם כזרחון חמצוני) למולקולת חמצן, שמתחזרת והופכת למולקולת מים. הטרנספר של אלקטרונים דרך שרשרת העברת האלקטרונים, גורמת ל"שאיבה" של +H דרך הממברנה תוך יצירת גרדיאנט פרוטונים, הנצרך על ידי האנזים ATP synthase הנמצא על הממברנה, ליצור מולקולת ATP. במנגנון זה, CoQ10 פועל כנשא אלקטרונים ומעבירם מצבר אנזימאטי I לצבר אנזימאטי II ו-III ומשם לצבר אנזימאטי III ו-IV בציטוכרומים, כאשר העברת האלקטרונים לחמצן תסתיים ביצירת ATP ומים (ראה תרשים). שום מולקולה תאית אחרת פרט ל-CoQ10 אינה משתתפת באופן פעיל בתהליך יצירת אנרגיה זה. | כאמור CoQ10 הוא מסיס-שומן ולכן הוא נייד בשכבה הליפידית של ממברנות, ומייחסים לו חשיבות בייצוב מבנה הממברנה. בממברנה הפנימית של המיטוכונדריון, אלקטרונים שמקורם ב-NADH וסוקצינאט (אך גם מפירובאט, Acyl CoA, ואלפא קטו גלוטראט) מועברים דרך שרשרת העברת האלקטרונים (המוכרת גם כזרחון חמצוני) למולקולת חמצן, שמתחזרת והופכת למולקולת מים. הטרנספר של אלקטרונים דרך שרשרת העברת האלקטרונים, גורמת ל"שאיבה" של +H דרך הממברנה תוך יצירת גרדיאנט פרוטונים, הנצרך על ידי האנזים ATP synthase הנמצא על הממברנה, ליצור מולקולת ATP. במנגנון זה, CoQ10 פועל כנשא אלקטרונים ומעבירם מצבר אנזימאטי I לצבר אנזימאטי II ו-III ומשם לצבר אנזימאטי III ו-IV בציטוכרומים, כאשר העברת האלקטרונים לחמצן תסתיים ביצירת ATP ומים (ראה תרשים). שום מולקולה תאית אחרת פרט ל-CoQ10 אינה משתתפת באופן פעיל בתהליך יצירת אנרגיה זה. | ||
| − | + | ||
| + | [[קובץ:קואנזים2.jpg|מרכז|ממוזער|600px]] | ||
| + | |||
אם קיים חסר של CoQ10 משתבש התהליך המתואר, באופן שבמקום ליצור ATP ומים, תיווצר מולקולת על-חמצן (superoxide) שהוא אניון ורדיקל חופשי. אברונים בתא בהם מתרחשים תהליכי נשימה - בעיקר מיטוכונדריה - חשופים במיוחד לנזק מיוני סופראוקסיד. | אם קיים חסר של CoQ10 משתבש התהליך המתואר, באופן שבמקום ליצור ATP ומים, תיווצר מולקולת על-חמצן (superoxide) שהוא אניון ורדיקל חופשי. אברונים בתא בהם מתרחשים תהליכי נשימה - בעיקר מיטוכונדריה - חשופים במיוחד לנזק מיוני סופראוקסיד. | ||
גרסה מ־14:22, 15 בספטמבר 2013
| מדריך בדיקות מעבדה | |
| קואנזים Q10 | |
|---|---|
| Q10 Coenzyme | |
| שמות אחרים | ubiquinone ,ubidecarenone ,coenzyme Q ,vitamin Q10 ,CoQ10 |
| תחום | מולקולה נוגדת חמצון הכרוכה באספקת אנרגיה לתאי הגוף |
| טווח ערכים תקין | CoQ10 במצב מחוזר: 320-1,376 מיקרוגרם לליטר; סך רמת CoQ10: 370-1,525 מיקרוגרם לליטר. % של CoQ10 מחוזר מסך CoQ10: 92-96%. בגיל מתקדם יש נטייה לרמות CoQ10 נמוכות ב-10-30% |
| יוצר הערך | פרופ' בן עמי סלע |
מטרת הבדיקה
אבחון של חסר CoQ10 במפגעים מיטוכונדריאלים; ניטור הסטאטוס של CoQ10 במטופלים עם מפגעים מיטוכונדריאליים, במטופלים המקבלים טיפול בסטאטינים, או באלה עם מחלות ניווניות כגון פארקינסון, אלצהיימר ואחרות. בדיקה זו יכולה להידרש במקרים של אנשים עם חסך תזונתי חמור, באלה עם רמה נמוכה במיוחד של כולסטרול-HDL או של ApoA1, וכן באלה המטופלים בסטאטינים.
גילוי CoQ10
מולקולה זו זוהתה בשנת 1957 בלבבות בקר על ידי Crane Frederick בוויסקונסין ועל ידי Morton באנגליה, כאשר האחרון הציע את השם ubiquinone(דהינו quinone נפוץ). שנה מאוחר יותר היה זה Folkers Karl באוניברסיטה של מיסיסיפי ואנשי החברה הפרמצבטית Merck שזיהו את הנוסחה הכימית של CoQ10 והחלו עומדים על תכונותיה. סינתזה וייצור תעשייתי של המולקולה בשנות ה-70 ביפאן, אפשרו ניסויים קליניים רבים במהלך שנות ה-80, והיה זה Peter Mitchell שזכה בפרס נובל בשנת 1978 על מחקריו על ATP שתרם להבנת תפקיד CoQ10 ביצירת אנרגיה במיטוכונדריה. למעשה, Mitchell הציע כבר בשנת 1961 את שרשרת העברת האלקטרונים במיטוכונדריה בה נוטל חלק CoQ10. בשנת 1972, הדגימו באופן בלתי תלוי Folkers ו-Littarru, את החסר ב-CoQ10 במחלת לב באדם.
התפקידים המגוונים של CoQ10 בריאקציות redox הן בתהליכי יצירת אנרגיה תוך-תאית והן כמולקולת הגנה ונוגדת חמצון, מבוססים על היכולת להחליף 2 אלקטרונים במסלול ה-redox בין ubiquinol (מולקולת CoQ10 במצבה המחוזר) לבין ubiquinone (המולקולה במצבה המחומצן). התפקיד נוגד החמצון של המולקולה כלוכד (scavenger) של רדיקאלים חופשיים נלמד בהרחבה על ידי Lars Emster.
הצורה המחומצנת של CoQ10 מופיעה בתרשים. הצורות השונות של Coenzyme Q, נבדלות ביניהן על ידי מספר תת יחידות ה-isoprenoid המופיעות בשרשרת הצדדית שלהם: מסתבר שקואנזים Q הנפוץ ביותר במיטוכונדריה של האדם, הוא CoQ10.
Q10 הוא במבנהו 1,4benzoquinone, בו Q מתייחס לגרעין ה-quinone והמספר 10 מתייחס ליחידות isoprenyl. מולקולת CoQ10 נמצאת בממברנות של אברונים רבים בתא, וכיוון שתפקידו העיקרי בתאים הוא ליצור אנרגיה, אך טבעי הוא שריכוזו הגבוה ביותר הוא בממברנה הפנימית של המיטוכונדריה. אברונים נוספים בתא המכילים CoQ10 הם הרטיקולום האנדופלזמי, הפראוקסיזום, הליזוזום ובועיות (vesicles) הנוצרות בתא בתרחישים שונים.
חומר דמוי-ויטמין, מסיס-שומן זה המסונתז בכבד כאשר טירוזין הוא חומר המוצא ליצירתו, נמצא ברוב תאי הגוף, בהם הוא מרוכז בעיקר במיטוכונדריה. בהיותו קשור ליצירת ATP בתאים, מולקולה המספקת 95% מדרישות האנרגיה של הגוף, לא מפתיע ש-CoQ10 נמצא בריכוזים הגבוהים ביותר באיברים בהם דרישת האנרגיה גבוהה ביותר כמו הלב, הכבד והכליות. ל-CoQ10 שלושה מצבי redox, בהם הוא מחומצן לחלוטין (ubiquinone), מחומצן למחצה (semiquinone) או מחוזר לחלוטין (ubiquinol).
תפקידו של CoQ10 בשרשרת העברת האלקטרונים במיטוכונדריון
כאמור CoQ10 הוא מסיס-שומן ולכן הוא נייד בשכבה הליפידית של ממברנות, ומייחסים לו חשיבות בייצוב מבנה הממברנה. בממברנה הפנימית של המיטוכונדריון, אלקטרונים שמקורם ב-NADH וסוקצינאט (אך גם מפירובאט, Acyl CoA, ואלפא קטו גלוטראט) מועברים דרך שרשרת העברת האלקטרונים (המוכרת גם כזרחון חמצוני) למולקולת חמצן, שמתחזרת והופכת למולקולת מים. הטרנספר של אלקטרונים דרך שרשרת העברת האלקטרונים, גורמת ל"שאיבה" של +H דרך הממברנה תוך יצירת גרדיאנט פרוטונים, הנצרך על ידי האנזים ATP synthase הנמצא על הממברנה, ליצור מולקולת ATP. במנגנון זה, CoQ10 פועל כנשא אלקטרונים ומעבירם מצבר אנזימאטי I לצבר אנזימאטי II ו-III ומשם לצבר אנזימאטי III ו-IV בציטוכרומים, כאשר העברת האלקטרונים לחמצן תסתיים ביצירת ATP ומים (ראה תרשים). שום מולקולה תאית אחרת פרט ל-CoQ10 אינה משתתפת באופן פעיל בתהליך יצירת אנרגיה זה.
אם קיים חסר של CoQ10 משתבש התהליך המתואר, באופן שבמקום ליצור ATP ומים, תיווצר מולקולת על-חמצן (superoxide) שהוא אניון ורדיקל חופשי. אברונים בתא בהם מתרחשים תהליכי נשימה - בעיקר מיטוכונדריה - חשופים במיוחד לנזק מיוני סופראוקסיד.
הביוסינתזה של CoQ10
תהליך רב-שלבי המתחיל מ-acetyl-CoA ונמשך במסלול ה-mevalonate מייצר את מולקולת farnesyl-PP, המשמשת קודמן של כולסטרול, דוליכול ו-CoQ. אנזים מפתח בתהליך זה הוא HMG-CoA reductase, שסטאטינים מעכבים את פעילותו. נראה אם כן שנטילת CoQ10 עשויה לכאורה להקל על תופעות הלוואי של סטאטינים כגון פגיעה בתאי שריר והכאבים הנלווים.
השרשרת האיזופרנואידית הצדדית הארוכה של CoQ, מסונתזת בעזרת האנזים trans-prenyltransferase, כאשר בשלב הבא יש דחיסה של השרשרת הפולי-איזופרנואידית עם שייר של 4hydroxybenzoate ליצירת המולקולה השלמה. יש לציין שפעילות אנזימטית זו מתקיימת לא רק במיטוכונדריון, אלא גם ברטיקולום האנדופלזמי ובפראוקסיזומום, מה שמדגיש את חיוניותו של CoQ10 באברונים תוך-תאיים מגוונים.
הפעילות נוגדת החמצון של CoQ10
האופי נוגד החמצון של CoQ10 נובע למעשה מפעילותו בהעברת אנרגיה, במהלכה עוברת מולקולה זו דרך מעגל של חמצון-חיזור. בצורתו המחוזרת, מולקולת CoQ10 אוחזת באלקטרונים באופן די רופף, באופן שהיא יכולה לתרום אלקטרון אחד או את שניהם, ולפעול כנוגד חמצון. CoQ10 מעכב פראוקסידציה של ליפידים, על ידי מניעת יצירה של רדיקלי peroxyl של הליפידים. כמו כן מגן CoQ10 על חלבונים מפני חמצון, ובנוסף הצורה המחוזרת של CoQ10 גורמת ביעילות לרגנרציה של ויטמין E מרדיקל α-tocopheroxyl. יתרה מכך, במצבים של עקה חמצונית נוצרים רדיקלים של הידרוקסיל על ידי אינטראקציה בין מי-חמצן לבין יוני מתכת הקשורים ל-DNA, ו-CoQ10 מונע ביעילות חמצון של בסיסי DNA, בעיקר ה-DNA המיטוכונדריאלי. בניגוד לנוגדי חמצון אחרים, CoQ10 מעכב לא רק חמצון של ליפידים כגון LDL וחלבונים, אלא אף מייצר נוגדי חמצון נוספים כוויטמין E.
ספיגה ופרמאקו-קינטיקה של CoQ10
כיוון שחומר זה אינו מסיס במים, תהליך הספיגה שלו בגוף ממזון ומנגנוני העברתו לרקמות הגוף דומה לזה של ויטמין E, שאף הוא אינו מסיס במים. תהליך זה בגוף האדם כולל הפרשת אנזימים פנקריאטיים למעי הדק וכן הפרשה של מלחי מרה המסייעים ליצור תחליב (אמולסיפיקציה) וכן מיצלות הדרושות לספיגת חומרים ליפופילים. צריכת מזון המכיל שומנים, מעודדת הפרשת חומצות מרה ומעודדת ספיגה של CoQ10. לכן אלה הנוטלים תוספי CoQ10 מעדיפים נטילתו עם הארוחה, ואמנם מדידה של רמתו בנסיוב מצביעה על רמות גבוהות יותר במצבי שובע מאשר במצבי צום. מספר מחקרים על הפרמאקו-קינטיקה של CoQ10 הראו ששיא רמתו בפלזמה מופיע 2-6 שעות לאחר נטילתו הפומית. במספר מחקרים נמצא שיא נוסף של רמת CoQ10 לאחר 24 שעות מנטילת התכשיר, כנראה כתוצאה מתהליך מחזור אנטרו-הפאטי, והפרשה מהכבד למחזור הדם. מחקר בו סומן CoQ10 גבישי עם האיזוטופ deuterium והוזרק לאדם, הראה שתקופת מחצית החיים שלו בדם היא 33 שעות. CoQ10 נישא בדם על גבי ליפופרוטינים, כאשר 60% ממנו נישאים על LDL, בעוד ש-15% נישאים על פני HDL, ו-15% על פני ליפופרוטאינים אחרים.
תכשירים חדשים של CoQ10 עם מסיסות מוגברת במים
הגברת יכולת המסיסות של תרופה במים, מגבירה את יכולת הספיגה שלה במעי, מה שנכון גם לגבי CoQ10. נוסו אמנם גישות שונות בכיוון זה, כאשר חלק מהתוצרים עם מסיסות מוגברת במים אכן נתנו תוצאות טיפול עדיפות על אלה שהושגו עם תכשירים הידרופוביים, הנתונים בתווך שמנוני בכמוסות ג'ל. דוגמאות לתכשירים אלה הם שימוש מתרחיף מימי של CoQ10 מוצק עם פולימר tyloxapol, או פורמולציות המבוססות על חומרים ממיסים כמו לציטין מחוזר, או קומפלקס עם cyclodextrins, מתוכם דווקא β-cyclodextrin נמצא יעיל במיוחד בהגברת הזמינות של CoQ10. בנוסף, שימוש בנשאים כמן ליפוזומים, ננו-חלקיקים, דנדרימרים ועוד, נבחנו להגברת הזמינות הביולוגית של CoQ10.
הערכת רמות CoQ10
למרות שנוח יותר למדוד רמת CoQ10 בפלזמה, רמה זו עלולה לשקף את מטען המולקולה הזו המגיע מהמזון, ולא בהכרח את רמתן האנדוגנית של CoQ10 ברקמות השונות. לאחרונה, רוב המרכזים הקליניים מודדים רמות CoQ10 בפיברובלטים מביופסיות עור הגדלים בתרבית, או בביופסיה מהשריר, או בתאי דם מומונוקלארים. ניתן להשתמש בפיברובלסטים בתרבית להערכה של הביוסיתזה האנדוגנית של CoQ10, על ידי מדידת הקליטה של p-hydroxybenzoate מסומן באיזוטופ C14.
רמות של CoQ10 בסוגי מזון שונים (מבוטאות במיקרוגרמים/גרם)
בקר- (לב-104-114; כבד-39-50; שריר-26-40); עוף-(לב-116-132); דגים-(סרדינים-25-64; מקרל-43-67; סלמון-4-8; טונה 4-8); בסוגי שמן שונים-(שמן סויה-54-187; שמן זית-40-160; שמן חמניות-4-15). באגוזים (אגוזי אדמה-27; אגוז המלך-19; זרעי שומשום-18-23; בוטנים-20; בוטני אִלסר -17 ; שקדים-11-17). ירקות: ענבים-6-7; תרד-6-10; ברוקולי-6-9; פטרוזיליה-8-26; כרובית-2-7; כרוב סיני-2-5. פירות: אבוקדו-10; תות שדה-1; תפוז-1-2; אשכולית-1; תפוח עץ-1.
בשר ודגים הם המקורות העשירים ביותר במזון ב-CoQ10, כאשר מוצרי חלב דלים בהרבה בחומר זה. שמן צמחי מקור עשיר יחסית ב-CoQ10, כאשר דווקא ירקות ופירות מהווים מקור צנוע יחסית צנוע שלו. בארצות המפותחות מקובל שהצריכה היומית המוערכת של CoQ10 עומדת על 3-5 מיליגרם, בעיקר כמובן מצריכת בשר ועוף. רוב האנשים מקבלים בדיאטה מאוזנת את מלוא הצריכה היומית הנדרשת של CoQ10, אם כי צריכה של תוספיו יכולה להידרש בתרחישים קליניים שונים או במקביל לצריכת תרופות מסוימות המפחיתות את רמתו בדם.
CoQ10 ויתר לחץ-דם
מטה אנליזה משנת 2007 של 12 מחקרים קליניים עם מספר כולל קטן יחסית של 362 משתתפים רמזו לכך ש-CoQ10 עשוי להפחית לחץ-דם: בממוצע, 17 מ"מ כספית בחץ הדם הסיסטולי, ו-10 מ"מ כספית בלחץ הדם הדיאסטולי. ממחקרים אלה נובע שהיה צורך להמתין 4-12 שבועות לזהות את ההשפעה האמורה. ממחקרים אלה משתמע שיפור בולט יחסית בחולי סוכרת, ומייחסים השפעה זו לתכונותיו כנוגד חמצון, מנטרל רדיקלים חופשיים ומשפר תפקוד כלי דם בשימור הפעילות מרחיבת כלי-הדם של NO. במחקרים אלה לא נרשמו תופעות לוואי משמעותיות.
CoQ10 ומחלת פרקינסון
יש ראיות לשיבוש של תפקוד מיטוכונדריאלי ונזק של עקה חמצונית שעלולים לתרום לפתו-פיזיולוגיה של מחלת פרקינסון, ואכן נמצאו שינויים ברמות של CoQ10 בלוקים במחלה זו. אין כל מידע מבוסס ומוכח על מעורבות של CoQ10 בפרקינסון, ואמנם ניסוי בו טופלו חולי פרקינסון בחומר זה במינון יומי של 1,200 עד 2,400 הופסק באוגוסט 2011, בהיעדר ראיות על השפעה מטיבה של טיפול זה בהשוואה למטופלי פלצבו.
CoQ10 ומחלה קרדיו-וסקולארית
מחקרים עדכניים הדגימו שנטילת תוסף CoQ10 הגבירה משמעותית רמות בולסטרול-HDL וכן רמות ApoA1 אפילו במטופלים הצורכים סטאטינים, מה שעשוי להפחית את הסיכון לתחלואה קרדיו-וסקולארית. כן נמצא ש-CoQ10 הפחית רמת סמנים סרטניים כמו CRP, וכן יש ראיות לכך שרמות נמוכות של CoQ10 כרוכות בנזק ניכר יותר לרקמות הרלוונטיות לאחר אוטם שריר לב און שבץ מוחי. ניסויים קליניים להערכת השפעת הטיפול ב-CoQ10 באלה עם dilated cardiomyopathy, לא הפיקו שיפור משמעותי בטיפול זה.
חולים עם מחלת לב גדושה (CHF) נמצאו בעלי רמה ממוצעת נמוכה של CoQ10 בפלזמה, ובניסוי אחד עם 236 מטופלים עם CHF אף נמצא ש-CoQ10 היה נמצא בלתי תלוי של תמותה מהמחלה. סדרת ניסויים בשנות ה-90 הסיקה שצריכת תוסף CoQ10 הפחיתה את החמצון של LDL.
ניסוי Q-SYMBIO הוא ניסוי אקראי ומבוקר לבחינת השפעת CoQ10 בקרב 422 מטופלים עם אי-ספיקת לב כרונית. אך כבר במהלך הניסוי בשנת 2013 הוחלט על הפסקתו שנתיים מתחילתו, שכן אלה ממשתתפיו שטופלו עם CoQ10, נהנו כבר בשלב זה ממחצית שיעור התמותה בהשוואה למטופלי פלצבו באותו ניסוי. הערכת מומחים על ניסוי זה שהוא אמנם היה מתוכנן ומוקפד כהלכה אלא שמדגם יחסית צנוע זה של משתתפים, מונע הסקת מסקנות גורפות לפני שניסוי דומה יורכב ממדגם משתתפים גדול בהרבה.
יש עדויות לכך ש-CoQ10 עשוי לסייע בטיפול באי-ספיקת לב כאשר הוא משולב בטיפול תרופתי קונבנציונאלי. אך בניגוד למספר ניסויים בהם הודגמה הפחתת בצקת ברגליים ובריאות, מספר דומה של ניסויים קליניים הניב תוצאות שליליות, מה שמותיר את הרעיון של טיפול ב-CoQ10 באלה עם אי-ספיקת לב שנוי במחלוקת.
הסקירה הראשונה על ניסויים בהם נבדקה השפעת CoQ10 על אי-ספיקת לב פורסמה ב-1997 , ובה דווח שטיפול זה לכאורה הוא בעל יתרונות קליניים. בשנת 2003 עודכנו הנתונים במטה-אנליזה של 9 ניסויים אקראיים על CoQ10 ואי-ספיקה, בהם נמצא שרמות מוגברות של CoQ10 בפלזמה כרוכים בכושר כיווץ משופר של הלב, ויכולת שאיבת הדם שלו. יחד עם זאת, מטה-אנליזה של 11 ניסויים אקראיים משנת 2008 הצביעה על שיפור צנוע של 4% ביכולת הכיווץ של הלב, כאשר התוצאות היותר טובות הושגו באלה שעדיין לא טופלו במעכבי ACE.
CoQ10 וניתוחי לב
מחקרים קליניים מצביעים על כך שטיפול ב-CoQ10 לפני ביצוע ניתוחים (מעקפים או השתלת לב) , הפחית את הנזק מרדיקלים חופשיים, חיזק את פעולת הלב, והפחית את תופעות של הפרעת קצב בתקופת ההתאוששות מניתוחים אלה. בין השנים 1982-2004 פורסמו 7 ניסויים מבוקרים על השפעת טיפול ב-CoQ10 בהתאוששות מניתוחים אלה שהצביעו על יתרונותיו בהיבטים שונים. בממוצע, טיפול יומי במינון של 300 מיליגרם תקופה של 30 יום קודם לניתוח, הראה שיפור בתפקוד הלב אחריו.
CoQ10 ותוחלת החיים
מחקר אחד הדגים הארכת אורך חיים בחולדות שטופלו ב-CoQ10, אך מספר מחקרים בעלי אופי דומה לא הצליחו לאשש ממצא זה בעכברים וחולדות מטופלים באותו מינון. מחקר בודד אחד שנעשה בנמטודה C. elegans הראה ש-CoQ10 האריך את חיי תולעת זו.
השפעת סטאטינים על רמת CoQ10
יש תיעוד רב לכך שצריכת סטאטינים אחראית להורדת רמת CoQ10 בדם בשיעור של עד 40%. אכן, סינתזת CoQ10 תלויה בזמינות של HMG או hydroxymethylglutarate, שהחיזור שלו עלי די HMG-CoA reductase מאפשר ייצור mevalonate שהוא הקודמן (precursor) של CoQ10. לכן פעילות סטאטינים חוסמת הפיכת HMG לא רק לכולסטרול, אלא גם ל-CoQ10. פעילות סטאטינים תביא אם כן להצטברות HMG ולהפרשתו המוגברת בשתן, מה שמחשיד לביוסינתזה מופחתת של CoQ10.
חלק מאלה המטופלים בסטאטינים וצורכים גם CoQ10 במקביל, מעידים על כך שפוחתים אצלם כאבי השרירים עליהם מתלוננים חלק מצרכני סטאטינים שאינם נוטלים CoQ10. מנגנון המיופתיה הנגרמת בחלק מצרכני סטאטינים אינו ברור, ויש אף כאלה שייחסו את המיופתיה לירידה ברמת CoQ10, אם כי ייתכן שירידה זו הנצפית ברמת CoQ10 משקפת ירידה ברמת הליפופרוטאינים (ובעיקר זו של LDL), שהם כזכור הנשאים של CoQ10 בדם, ולא בהכרח תוצאה עיכוב ישיר בסינתזה של CoQ10 על ידי הסטאטין. קיימות עדויות סותרות על משמעות CoQ10 בהפחתת כאבי השרירים הנגרמת על ידי סטאטינים.
אינטראקציה עם תרופות
מספר מחקרים הסיקו ש-CoQ10 במינונים גבוהים יכולים לפחית את יעילותם של מדללי-דם דוגמת קומאדין ו-clopididgrel, אם כי היו דיווחים שסתרו טענה זו. תרופות נוספות שנטען שהן מורידות רמת CoQ10 הן: פיבראטים (gemfibrozil), חוסמי בטא (atenolol ,labetolol ,metoprolol ו-propranolol), תכשירים טריציקליים נוגדי-דיכאון (amitriptyline ,oxepin ו-imipramine), קורטיקו-סטרואידים.
יש ראיות מחקריות אחדות לכך ש-CoQ10 עשוי להפחית את תופעות הלוואי הקרדיו-טוקסיות של daunorubicin ו-doxorubicin, אך נדרשים מחקרים נוספים להבהרת נתון זה.
יש הסכמה לכך שסטרואידים מפחיתים רמת CoQ10 בדם: טיפות חלופי בסטרואידים על ידי נשים בגיל המעבר (HRT), ונטילת גלולות למניעת הריון, נמצאו מפחיתים את רמת CoQ10. כן נמצא שרמת CoQ10 נמוכה יותר בפאזה הפוליקולארית של המחזור החודשי, בהשוואה לפאזה הלוטאלית.
בטיחות השימוש ב-CoQ10
כללית נחשב תכשיר זה בטיחותי ללא תופעות לוואי משמעותיות, מלבד תופעות בדרגת סבירות ממוצעות במערכת העיכול, כגון בחילה, מיחושים או צריבה בדרכי עיכול עליונים. כן יש דיווחים על טשטוש, רגישות לאור, נטייה לרגזנות-יתר, כאבי ראש, עייפות. לעתים מדווח על הופעה של פריחה עורית. אין מחקרים משמעותיים לגבי בטיחות השימוש ב-CoQ10 בהריון. צריכה של 300 מיליגרם של חומר זה לאורך פרק זמן ממושך, מגביר במעט את רמת אנזימי הכבד, אם כי אין ראיה לנזק ממשי בכבד. המינון היומי הגבוה ביותר המומלץ לצורכי CoQ10 הוא 1,200 מיליגרם, אם כי רמת המינון הממוצעת המקובלת לתכשיר זה הן בניסויים קליניים כמו גם בהמלצות לשימוש שגרתי היא בתחום של 90 עד 350 מיליגרם ליום.
שתי הצורות של CoQ10: המחוזרת - ubiquinone, והמחומצנת - ubiquinol:
בגוף מופיע CoQ10 בצורתו המחוזרת, ubiquinone, המיוצרת בגוף ומגיעה מהמזון, או בצורתו המחומצנת, ubiquinol, שהיא הצורה נוגדת החמצון הפעילה, ונוצרת בגוף מ-ubiquinone. עם ההתבגרות יורדת רמתן של צורות אלה של CoQ10 בגוף, ולמעשה כבר מגיל 20 שנה ומעלה מתחילה לדעוך רמת ubiquinone המיוצר בגוף. כמו בן עם הגיל פוחתת יכולת הגוף להפוך ubiquinone ל-ubiquinol.
מצבים קליניים בהם רמת CoQ10 נמוכה
יש ראיות לכך שרמות CoQ10 פוחתות במחלות כרוניות כגון מחלות לב, muscular dystrophy, מחלת פרקינסון, אלצהיימר, מחלות ממאירות, היפר-כולסטרולמיה משפחתית, היפר-תירואידיזם, סוכרת ו-AIDS, אך הן נמוכות בממוצע גם בגילים מתקדמים. בכל התרחישים הללו הסברה הייתה שהביו-סינתזה של CoQ10 פוחתת, או שדרישת הגוף לחומר זה מוגברת, ולכן רמתו פוחתת, אך אין הוכחה ניסויית חד ערכית לתמיכה בסברה זו.
משמעות CoQ10 במחלות ממאירות
החל משנת 1961 החלו להופיע פרסומים המצביעים על רמה מופחתת של CoQ10 בפלזמה של חולים במיאלומה, לימפומה, סרטן שד, ריאות, ערמונית, לבלב, מעי גס, כליות, ראש וצוואר. מחקר מוקדם הציע ש-CoQ10 עשוי לסייע למערכת החיסון של הגוף וממילא יכול לסייע כטיפול משני בסרטן. חלק מטעונים אלה התבסס על התובנה שתכונותיו של CoQ10 כנוגד חמצון עשויות להקשות על התהליך הסרטני, אך מאות מחקרים בנושא זה נכשלו עד כה בהצגת עובדות סטטיסטיות מוצקות שיצדיקו נטילת CoQ10 בגישה פרופילקטית או טיפולית במחלות סרטן שונות. באופן בולט לעין, אותם מחקרים שהניבו תוצאות "מעודדות" בטיפולים ב-CoQ10 בסרטן היו ניסויים בחיות מעבדה, רובם המכריע במדגמים קטנים, אך לא הוצגה השפעה דומה במחקרים בבני-אדם.
מספר מחקרים בחנו את האפשרות של טיפול ב-CoQ10 בחולי סרטן בתחום של הקלה על כאבים ואיבוד משקל האופייניים לתהליכים ממאירים, אך גם כאן הראיות פחות ממשכנעות. לכאורה, דווקא האפשרות שנטילת CoQ10 בד בבד עם טיפול כימותרפי או קרינתי, העסיקה אונקולוגים במחקרים אחדים, דווקא בגלל התכונות נוגדות החמצון של CoQ10, שכן חלק מטיפולים אלה מבוססים דווקא על נזק חמצוני הנגרם לתאים הסרטניים.
אמנם CoQ10 לא פגע בהשפעה ממיתת התאים הסרטניים של doxorubicin בניסויים בתרבית תאים, אך השפעת CoQ10 על ההשפעה הכימותרפית נותרה לא ברורה בטיפולים של ממש בחולי סרטן. רבים מהאונקולוגים ממליצים להימנע מצריכת CoQ10 או תוספים נוגדי חמצון אחרים במהלך טיפולים כימותרפיים או הקרנות, כמו גם להימנע מצריכת תוספים אלה מספר שבועות לפני או אחרי טיפולים אלה.
עשרות שנים שצריכת תוספי CoQ10 ניזונה בעיקר על ידי התעשייה הפרמצבטית "כתוצר שעשוי לשפר את המאזן האנרגטי של הגוף", ואף לסייע במגוון של מחלות כרוניות. אך בעידן של "Evidence based information", אין ל-CoQ10 תמיכה מחקרית וניסויית, כאשר מדובר בניסויים קליניים רחבי היקף בדרגת ביצוע גבוהה. בדומה לצריכת ויטמינים ותוספי מזון אחרים, העדות החזקה ביותר אמורה להגיע ממפגעים קליניים בהם מוכח שחסר CoQ10 הוא גורם משמעותי בהופעת המפגע, ועל אחת כמה וכמה מניסויים קליניים מהם נובע שצריכת CoQ10 מתקנת או מונעת את המפגע. בחלק גדול מהטיעונים בזכות צריכת CoQ10 עולה התכונה שלו כ-anti-oxidant, אך המסקנה הגורפת היא שמחקר רב היקף נדרש בתחום זה, שנותר שנוי במחלוקת. העובדה היא שה-FDA לא אישר עד כה טיפול ב-CoQ10 לשום מחלה או מפגע קליני, אם כי הוא נתן אור ירוק להמשך ניסויים עם CoQ10 (בצורתו המחוזרת) לטיפול במחלת Huntington בה יש פגם בתפקוד המיטוכונדריאלי, בילדים עם אי-ספיקת לב גדושה, וב-Friedreich's ataxia.
הוראות לביצוע הבדיקה
יש צורך להיות בצום של 8-12 שעות (ניתן לשתות מים) לפני נטילת דגימת הדם. הדם נלקח במבחנת הפארין (פקק ירוק) או במבחנה כימית (פקק אדום או צהוב). יש להגן על הדגימה מפני אור בשלבי הטיפול בה, או באחסון.יש להפריד את הפלזמה או את הנסיוב מן התאים תוך שעה מנטילת הדם.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק