אנקסין-Annexin-1
| מדריך בדיקות מעבדה | |
| אנקסין A1 | |
|---|---|
| Annexin A1 | |
| שמות אחרים | lipocortin 1, macrocortin, renocotin, ANXA1, LPC1 |
| מעבדה | כימיה, פתולוגיה |
| תחום | מדד רב-תחומי של מצבי דלקת, שגשוג תאים ובקרת אפופטוזיס |
| טווח ערכים תקין | בדם: 0.5-14.4 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
משפחת-על של annexin מורכבת מ-13 חלבונים הקושרים סידן או סידן ופוספוליפידים, עם דרגה משמעותית של הומולוגיה ביולוגית ומבנית (40 עד 60 אחוזים) (Raynal ו-Pollard ב-Biochim Biophys Acta משנת 1994). החלבון annexin A1 (להלן ANXA1) התגלה בסוף שנות ה-70 וזכה בתחילה להתייחסויות כאל renorcortin,macrocortin ,lipocortin או lipomodulin. ל-ANXA1 יש פעילות מעכבת חזקה של הסינתזה של eicosanoid המושרית על ידי גלוקו-קורטיקואידים וכן הוא מעכב חזק של פעילות PLA2. במרוצת השנים התגלו הפעילויות הביולוגיות המגוונות של ANXA1 בתחום מנגנוני דלקת, שגשוג תאים, והבקרה של אפופטוזיס, כמו הפינוי על ידי פגוציטוזיס של תאים מתים בתהליך האפופטוזיס. לא פחות חשובה היא פעילות חלבון זה בקרצינוגנזה (Lim וחב' ב-FASEB J משנת 2007). הגן המקודד ל-ANXA1 ממוקם על כרומוזום 19q24. בתיאוריה, החשיבות הביוכימית העיקרית של ANXA1 היא ביכולת הקישור (annexing) שלו לפוספוליפדים ממברנליים בתיווך סידן.
Annexin-A1 (להלן ANXA1) הוא חלבון מונומרי הנקשר לפוספוליפידים שמשקלו המולקולרי הוא 37 אלף דלטון, והוא מופיע ברקמות רבות כגון תאי אנדותל, תאי אפיתל, לויקוציטים ולימפוציטים, אם כי באופן בררני (Ruthhut וחב' ב-Biochim Biophys Res Commun משנת 1983, ו-Gavins וחב' ב-FASEB J משנת 2005). חלבון זה שכיח במספר תאי מפתח של מערכות החיסון הטבעית (innate) והמושרית (adaptive) וכן במערכת הנוירו-אנדוקרינית. משמעות ANXA1 היא לתגובות דחק היא בכך שהסינתזה וההפרשה שלו הן תחת רגולציה של גלוקו-קורטיקואידים. ANXA1 מופיע בתוך תאים ועל פני הממברנה שלהם (Goulding וחב' ב-Lancet משנת 1990), ולאחר שחלבון זה מופרש מהתאים לצירקולציה הוא יכול לפעול באופן אוטוקריני או פרקריני תוך קישור לקולטנים של משפחת ה-formylpeptide דרכם הוא מבצע את פעילותו הביולוגית במערכות החיסון ובמערכת הנוירו-אנדוקרינית (Cristante וחב' ב-Proc Natl Acad Sci USA משנת 2013, ו-Purvis וחב' ב-Diabetologia משנת 2017). ANXA1 התגלה לראשונה בשנות ה-80 המוקדמות, וכבר אז עלתה ההשערה שהוא מתווך בחלק מההשפעות הדלקתיות של גלוקו-קורטיקואידים. הביולוגיה של ANXA1 מסובכת ויש לו תפקידים רבים בבריאות ובתחלואה. נלמד תפקידו בשפעול הקולטן FPR2, ממצא המנוצל לתועלת טיפולית בסוכרת ובמחלה מיקרו-וסקולרית. במצבי מחלה, רמות ANXA1 מאופננים בעיקר כאשר רמות אנדוגניות של גלוקו-קורטיקואידים עוברות שינוי. במטופלים עם מחלת Addison רמות ANXA1 בלויקוציטים נמוכות יותר בגין יצירה פחותה של קורטיזול. לעומת זאת, במטופלים עם תסמונת Cushing, רמות ANXA1 מוגברות כתוצאה מעודף של יצירת קורטיזול (Mulla וחב' ב- J Clin Endocrinol Metab משנת 2005).
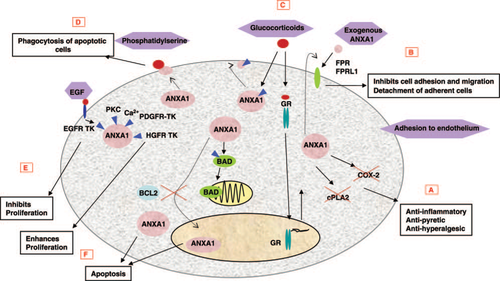
(א) נמצא ש-ANXA1 יכול לעכב את הפעילות של האנזים הציטוזולי phospholipase A2, כמו את פעילות האנזים cyclooxygenase 2 (להלן COX2), ובכך מפגין פעילות אנטי-דלקתית, מפחיתה חום, ומפחיתה כאב;
ב) ANXA1 אקסוגני פועל על הקולטן שלו שזוהה כ-formyl peptide receptor (להלן FPR) וכן על FPR-like 1 ובכך לעכב את ספיחת התאים ואת יכולת התנועה שלהם, ולהרות את ההתנתקות של תאים ספוחים. כאשר תאים (בעיקר ניטרופילים) נספחים לתאי אנדותל, מופרש ANXA1 יחד עם גרנולות המכילות gelatinase ומסוגל לפעול כמו ANXA1 אקסוגני;
ג) הביטוי של ANXA1 יכול להיות מוגבר על ידי טיפול בגלוקו-קורטיקואידים דרך הקולטן של הורמונים אלה התורם לפעילות האנטי-דלקתית של ANXA1. גלוקו-קורטיקואידים יכולים גם להשרות פוספורילציה מהירה של ANXA1 וכן את הטרנסלוקציה הממברנלית שלו;
ד) ANXA1 מגויס אל שטח פני התא, שם הוא קושר פוספטידיל-סרין (PS), ומתווך בבליעה של תאים אפופטוטיים;
(ה) ANXA1 יכול לעבור פוספורילציה על ידי מספר קינאזות כולל EGF-receptor tyrosine kinase, וכן על ידי protein kinase C (או PKC), על ידי platelet-derived growth factor receptor tyrosine kinase (או PDGFR-TK) ו-hepatocyte growth factor receptor tyrosine kinase (או HGFR-TK) כדי לתווך בשגשוג התאים;
ו) ביטוי-יתר של ANXA1 משרה אפופטוזיס, על ידי השריית דה-פוספורילציה של BAD (או Bcl-2-associated death promoter, חלבון קדם אפופטוטי), ובכך הוא מאפשר ל-BAD להגיע למיטוכונדריה. במהלך אפופטוזיס ANXA1 עצמו נודד לגרעין התא בתהליך שיכול מעוכב על ידי Bcl-2.
רגולציה, ביטוי והפרשה של ANXA1
תפקידו האנטי-דלקתי של ANXA1 תואר כבר בסוף שנות ה-80 (Cirino וחב' ב-Prostaglandins משנת 1987, ו-Solito וחב' ב-Cytokine משנת 1998). הביטוי של ANXA1 נמצא נמרץ יותר במקרופאגים אלבאולריים על ידי בדיקת נוזל ברונכו-אלבאולרי מחולים המטופלים עם גלוקו-קורטיקואידים במחלת ריאות דלקתית (De Caterina וחב' ב-J Appl Physiol משנת 1993). הוספת גלוקו-קורטיקואידים לתאים חד-גרעיניים היקפיים, הגבירה את ביטוי ANXA1 באופן לינארי לריכוז הגלוקו-קורטיקואידים (Sawmynaden ו-Perretti ב- Biochem Biophys Res Commun משנת 2006, ו-Solito וחב' ב-Endocrinology משנת 2003). ביטוי ANXA1 משודרג על ידי IL-6 וכן על ידי phobol-myristate (להלן PMA) בשורת תאים A549 שמקורה אפיתל של ריאות אדם, על ידי שפעול של גורם השעתוק C/EBPβ (Solito וחב' ב- Cell Growth Differמשנת 1998). IL-6, dexamethasone וספיחה של תאים לאנדותל גורמים ל-ANXA1 לנוע אל שטח פני התאים ולהיות מופרש (Solito וחב' ב-J Immunol משנת 2000, ו-Perretti וחב' ב-Nat Med משנת 1996).
ההפרשה של ANXA1 מתרחשת באחת משלוש דרכים:
- על ידי מערכת הטרנספורט של ATP-binding cassette (Wein וחב' ב-Biochem Pharmacol משנת 2004)
- על ידי פוספורילציה של ANXA1 בשייר serine-27 בתאי ההיפופיזה (Solito וחב' ב-FASEB J משנת 2003)
- ההפרשה של ANXA1 מתוך גרנולות של gelatinase לאחר חשיפה תאית לאיתותים משפעלים קלים כמו ספיחת תאים לאנדותל (Perretti וחב' ב- Int Cell Biolמשנת 2000, ו-Perretti וחב' ב- Nat Rev Immunol משנת 2009).
Rosengarth ו-Luecke ב- J Mol Biol משנת 2003 מצאו שריכוזי +Ca2 חוץ-תאי של מעל 1 מילימולר, נחוצים כדי לאפשר שחרור של הקצה ה-N טרמינלי, ולגרום ל-ANXA1 לעבור צימות על הממברנה באופן שיאפשר לו לאותת באופן אוטוקריני ופרקריני. ANXA1 יכול לעבור ביקוע ליצירת פרגמנט במשקל מולקולרי של 33 אלף דלטון, על ידי אלסטאזות, או על ידי metalloproteinases וכן על ידי proteinase 3 (Rescher וחב' ב-Biochim Biophys Acta Mol Cell Res משנת 2006, Vong וחב' ב-J Biol Chem משנת 2007, ו-Pedezoli-Ribeil וחב' ב-Blood משנת 2010). פרגמנט N-טרמינלי זה פעיל ביולוגית, אך הוא פי-20 פחות פעיל מהחלבון השלם. בשימוש בפפטיד Ac2-26 יש צורך להגיע לריכוזים של פי-14 גבוהים יותר במושגים מולאריים, בהשוואה לחלבון השלם, כדי להשיג אותה פעילות ביולוגית (Rodrigues-Lisoni וחב' ב-FEBS lett משנת 2006).
ANXA1 ו-Formyl Peptide Receptor 2
ההשפעות של 1 ANXA מתווכות על ידי הקישור של הקצה ה-N טרמינלי עם ה-formyl peptide receptor 2 (או ALX/FRP2) המצומד לחלבון-G (Perretti וחב' ב-Nat Med משנת 2002). בדומה ל-ANXA1, הקולטן ALX/FRP2 מבוטא על פני מגוון רחב של תאים כולל פיברובלסטים, תאי אנדותל, ותאים סטרומליים, אך הוא מבוטא באופן הנמרץ ביותר על פני לויקוציטים (Migeotte וחב' ב-Cytokine Growth Factor Rev משנת 2006). הקולטן ALX/FRP2 קשור ל-Gα ול-Gαγ. היצירה של עכברי knockout ל-ANXA1 אפשרה את התכנון של מחקרים רבים, ששיפרו את הבנת הביולוגיה של ANXA1 (Hannon וחב' ב-FASEB J משנת 2003). עכברי knockout אלה עמידים להשפעות של גלוקו-קורטיקואידים במודל של arthritis מה שמרמז ש-ANXA1 מהווה מולקולת anti-inflammatory effector המושפעת מגלוקו-קורטיקואידים (Patel וחב' ב-Ann Rheum Dis משנת 2012). עם זאת, הבנת התפקיד של FRP2 בהשפעות האנטי-דלקתיות, מאתגרת יותר. באדם יש 3 גנים של FRP, בשעה שלעכברים יש 8 גנים כאלה. לכן, למרות שיש ראיות טובות לכך שהשפעול של FRP2 מתווך בהשפעות האנטי-דלקתיות של ANXA1 באדם, ראיות אלה פחות ברורות בעכברים. רבות מהפעילויות הביולוגיות של ANXA1 ניתנות לחיקוי תוך שימוש בפפטיד Ac2-26 (Peretti וחב' ב-J Immunol משנת 1993). נמצא שעל ידי חסימת הקולטן של FPR2/ALX עם נוגדן חד-שבטי, נמנעה הספיחה של ניטרופילים אנושיים לשכבת תאי אנדותל המושרית על ידי ANXA1/Ac2-26 (Hayhoe וחב' ב-Blood משנת 2006).
הקשר בין ANXA1 לבין אפופטוזיס
מחקרים אחדים כרכו את ANXA1 לאיתות המאתחל את תהליך האפופטוזיס והפגוציטוזיס של התאים המתים. איתותים ספציפיים בתאים אפופטוטיים משמשים סמנים עבור פגוציטים לזהות תאים מתים ולפנות אותם. החשיפה של phosphatidylserine (להלן PS) על השכבה החיצונית של ממברנת התאים, מהווה סמן אופייני של תאים אפופטוטיים. ה"בליעה" בתלות של PS של תאים אפופטוטיים מעכבת את ההפרשה של ציטוקינים מעודדי-דלקת כגון TNF‐α, אך לעומת זאת IL‐1β מעודד את ההפרשה של ציטוקינים נוגדי-דלקת כגון TGFβ ו-IL-10. מחקר עדכני של Arur וחב' ב-Dev Cell משנת 2003, הדגים באלגנטיות ש-ANXA1 יכול לשמש כליגנד אנדוגני של PS, ומתווך כך בבליעה של תאים אפופטוטיים. ANXA1 מגויס לאזור העשיר ב-PS על פני התאים האפופטוטיים במנגנון המתווך על ידי האנזים caspase, והוא גם כרוך בהפרשה של סידן תוך-תאי. תמיכה בממצאים אלה מגיעה מהשתקה על ידי siRNA של ביטוי הגן המקודד ל-ANXA1, הגורמת לבלעה משובשת של תאים אפופטוטיים. ANXA1 מסוגל לקשור PS באופן דו-ולנטי (דהיינו לפעול כגשר חלבוני בין 2 מולקולות של PS דרך מספר מנגנונים אפשריים): הקצה ה-N-טרמינלי של ANXA1 חשוף על הממברנה ומסוגל בשל כך:
- להיקשר לממברנה של תא סמוך (Bitto וחב' ב-Biochemistry משנת 2000, ו-Rosengarth וחב' ב-J Mol Biol משנת 2011)
- להצמיד 2 ממברנות ביחד (Lambert וחב' ב-J Mol Biol משנת 1997).
ANXA1 מסוגל לקשור חלבונים אחרים כגון S100 ליצירה של קומפלקסים שיכולים להצמיד 2 ממברנות (Gerke ו-Moss ב- Physiol Rev משנת 2002, Mailliard וחב' ב-J Biol Chem משנת 1996, ו-Seemann וחב' ב-Biochem J משנת 1996). נוגדנים חד-שבטיים כנגד ANXA1 עיכבו פגוציטוזה של לימפוציטים שעברו אפופטוזיס בתיווך PS, הקולטן של PS נמצא רק על פני התאים הפגוציטים, בעוד שמולקולת PS עצמה מופיעה על פני תאים פגוציטים וגם על פני התאים שעברו אפופטוזיס. מכאן סביר להניח ש-ANXA1 הוא קולטן על פני תאים פגוציטים המשמש לזיהוי והכרה במציאות של PS החשוף על פני תאים העוברים אפופטוזיס, ואכן ANXA1 מבוטא אמנם ברמה נמוכה על פני פגוציטים. נראה אם כן שהחשיפה של ANXA1 על פני התא עשויה להיות רלוונטית באופן תפקודי לחיבור של תאים אפופטוטיים לתאים פגוציטים ולפגוציטוזה של תאים שעברו אפופטוזיס (Petrella וחב' ב- Cell Death Differ משנת 2005).
ANXA1 ומערכת העצבים המרכזית
ANXA1 משחק תפקיד מפתח בשמירה על שלמות מחסום דם-מוח. בעכברי -/-ANXA1 נמצאה חדירות מוגברת של מחסום דם-מוח (BBB) כפי שממצא זה אושר בבדיקות MRI. מטופלים עם טרשת נפוצה הם בעלי ביטוי מופחת של ANXA1 בקפילרות פרנכימליות במוח. לעומת זאת, ביטוי מוגבר של ANXA1 תועד במקרופאגים ובלימפוציטים פרי-וסקולריים באזורי נגעים פעילים (plaques) בחולי MS (Probst-Cousin וחב' ב-Neuropathol Appl Neurobiol משנת 2002). ניתן לשער שהגדלת החדירות של ה-BBB, מקלה על ההסננה של תאי חיסון כגון תאי T שאבדו את יכולת הזיהוי של self antigens לאזורי מוח פְּרִיבִילֶגִיים, תוקפים שם רקמה, ובכך מחמירים את המחלה. הודגם גם ביטוי מוגבר של ANXA1 במוחות של חולי אלצהיימר כמו גם במודל של חיות בשלבי אלצהיימר מוקדמים. נמצא ש-ANXA1 מפקח על תהליכי פגוציטוזה של amyloid-β בתאי מיקרוגליה על ידי הגברת תהליכי הרס אנזימטי של רקמה בסיוע של neprilysin (Ries וחב' ב-J Neurounflammation משנת 2016).
ANXA1 ומחלה קרדיו-וסקולרית
נמצא שטיפול ב-ANXA1 של עכברי -/-LDLR הפחית בהם רבדים טרשתיים (Kusters וחב' ב-PLos ONE משנת 2015). לעומת זאת, בעכברים אתרוגניים מסוג -/-ALX/FPR2 שטופלו עם ANXA1 התפתחו פחות רצועות ליפידיות באבי העורקים היורד (Petri וחב' ב-Cardiovasc Res משנת 2015). הודגם ש-Ac2-26 שהוא פפטיד סינטטי המורכב מ-25 חומצות האמינו המופיעות בקצה ה-N טרמינלי של ANXA1, מפחית שלבים מוקדמים של אתרוגניות ויצירת רבדים טרשתיים (Drechsler וחב' ב-Circ Res משנת 2015). מחקרים אלה מחזקים את התחושה ש-ANXA1 הוא בעל פוטנציאל תרפויטי במצבי טרשת עורקים השכיחים במיוחד בחולי סוכרת. Fredman וחב' דיווחו ב-Sci Transl Med משנת 2015, על שימוש בננו-חלקיקים המצופים ב-Ac2-26 בעכברים אתרוגניים מזן -/-LDLR בגישה תרפויטית. אכן, הפפטיד Ac2-26 השתחרר מקישורו לננו-חלקיקים והצטבר בנגעים הטרשתיים על דופן כלי הדם (de Jong וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2017).
נמצא ש-ANXA1 מגן בעכברי -/-ANXA1 על הדופן העורקי ומסייע לריפוי הדופן לאחר פגיעה, על ידי הגבלת היצירה של שכבת neointima בדופן ועל ידי הפחתת השגשוג של מקרופאגים. ההשפעה המגינה של Ac2-50 (שהוא פפטיד סינטטי של 28 חומצות אמינו האחרונות בקצה ה-N טרמינלי של ANXA1) אבדה בעכברי -/-FRP2/3 מה שמצביע על כך שהשפעול של ALX/FRP2 על ידי Ac2-50 מקנה הגנה רקמתית. במטופלים עם מחלה יציבה של עורקים כליליים, נמצא ש-ANXA1 הממוקם על פני שטח הפנים של מונוציטים היקפיים, משמש סמן של רגישות לגלוקו-קורטיקואידים, מה שמשקף את הפוטנציאל האנטי-דלקתי של תאים אלה (Bergsröm וחב' ב-PLos ONE משנת 2017).
ANXA1 ונזק איסכמי של זילוח מחדש (Ischemia Reperfusion injury להלן IRI)
ANXA1 והפפטיד ה-N טרמינלי שלו מספקים הגנה במספר מודלים של IRI (Ansari וחב' ב- Int J Mol Sci משנת 2018). הודגם שאינפוזיה של ANXA1 רקומביננטי הפחיתה את הגודל של אוטם בשריר הלב (D'Amico וחב' ב-FASEB משנת 2000). טיפול עם Ac2-26 הפחית את גודל האוטם ואת תכולת האנזים myeloperoxidase וכן את רמת IL-1β בלבבות שעברו אוטם (La וחב' ב-FASEB J משנת 2001). הפפטיד Ac2-26 משמר את כושר הכיווץ של שריר הלב על ידי שפעול של תעלות PKC, p38 ו-KATP (Ritchie וחב' ב- Br J Pharmacol משנת 2005). החדרת Ac2-26 לחדרי המוח בחולדות מפחיתה את גודל האוטם המוחי ואת נפח הבצקת המוחית (Relton וחב' ב-J Exp Med משנת 1991), כנראה על ידי הקטנת האינטראקציות בין הלויקוציטים לבין האנדותל (Smith וחב' ב-FASEB J משנת 2015). נמצא גם ש- Ac2-26 החליש את השפעול של ניטרופילים ושל טסיות-דם, ועל ידי כך פוחת הצימות של ניטרופילים ושל טסיות-דם בכלי הדם הקטנים במוחות של עכברים לאחר השריית נזק מוחי כתוצאה מ- cerebral ischemia-reperfusion (Vital וחב' ב-Circulation משנת 2016). ANXA1 מועבר לגרעין התא לשפעול של ביטוי גני המעודד דלקת בתאי microglia במודל in vitro של נזק איסכמי מזילוח מחדש.
ANXA1 בסוכרת
מחקר מוקדם הדגים שריכוזים פיזיולוגיים של ANXA1 הם בעלי יכולת לעכב את הפוספורוליציה של tyrosine 21 על הקולטן של אינסולין, מה שחיוני להפרשת אינסולין (Melki וחב' ב- Biochem Biophys Res Communמשנת 1994). מחקר מאוחר יותר מצא ש- ANXA1מגביר את הפרשת אינסולין בתאי לבלב של חולדה על ידי התקשרות לשטח פני תאים אלה למרות שהקולטן של ANXA1 לא תואר (Ohnishi וחב' ב-Endocrinology משנת 1995). יתרה מכך, הודגם ששייר serine ב-ANXA1 עובר פוספורילציה בחשיפה לרמות גבוהות של גלוקוזה, מה שרומז לכך שפוספורילציה נחוצה להשרות הפרשת אינסולין ברמות סוכר גבוהות. יחד עם זאת, עכברים טרנסגניים ANXA1−/− חסרי ANXA1, לא מראים הגברה ברמת סוכר בבדיקה פומית של עמידות לגלוקוזה (in vivo), ובלוטות לבלב מבודדות (ex vivo) של עכברים ANXA1−/−, מפרישות אינסולין המושרה על ידי רמת גלוקוזה באותה מידה כמו עכברי בר (WT), מה שמרמז לכך ש- ANXA1אינו חיוני להפרשת אינסולין כדי להוריד את רמת הסוכר בדם (Rackham וחב' ב-Diabetes משנת 2015). כאשר עכברי ANXA1−/− טופלו עםstreptozotocin כדי להשרות בהם סוכרת type 1 ניסויית, הם הדגימו הגברה חמורה יותר במבחן פומי של עמידות לגלוקוזה בהשוואה לעכברים WT. ממצאים אלה מרמזים (אם כי לא מוכיחים) לכך ש-ANXA1 חיוני בוויסות של רמות גלוקוזה במצבי מחלה אך לא בבריאות מלאה. הודגם ש-ANXA1 עובר אינטראקציה ישירה עם RhoA (אוRas homolog family member A שהוא חלבון קטן בעל פעילות GTPase), ומווסת את פעילות RhoA בתאי אנדותל, בה בשעה שעכברי ANXA1−/− הם בעלי RhoA משופעל באופן קונסטיטוטיבי בכליות ובכבד (Purvis וחב' ב- Front Immunolמשנת 2019). מחקר נוסף גילה קשר מנגנוני בין ביטוי ANXA1 לבין RhoA ו- IRS-1בעכברים סוכרתיים (Purvis וחב' ב-FASEB J משנת 2017, ו-Begum וחב' ב-J Biol Chem משנת 2002). IRS-1 או insulin receptor substrate 1, הוא חלבון בעל תפקיד מרכזי בהעברת איתותים מקולטנים של אינסולין ושל insulin-like growth factor-1 למסלולים תוך-תאיים מסוג PI3K/Akt וכן מסוג Erk MAP kinase. מספר מחקרים הדגימו שהביטוי של החלבון ANXA1 מופחת בסוכרת (Yoon וחב' ב- Mol Cell Proteomicsמשנת 2015). כרגע לא ברור המנגנון של איתותים אלה, האם על ידי הפרשה מוגברת של ANXA1 או שקיים וויסות שעתוקי. מחקרים אחדים הראו שרמות ANXA1 בפלזמה מוגברות במטופלים המאובחנים למעלה מ-25 שנה עם סוכרת type 1, או באלה עם סוכרת type 2 ועודף משקל בהשוואה לביקורת של אנשים בריאים באותה קבוצת גיל (Pietrani וחב' ב- Biomed Pharmacother משנת 2018). ההשפעה הביולוגית של רמות מוגברות של ANXA1 בסוכרת לא ברורה, בפרט שחלבון זה מופרש מרקמות במצבי היפר-גליקמיה והיפר-ליפידמיה. מעניין שרמות ANXA1 בנסיוב של מטופלים עם סוכרת משני סוגיה, לא היו במתאם עם מצבי דלקת מוגברת סיסטמית. באותו מודל, עכברים שטופלו עם ANXA1 לאחר שהתפתחו בהם סיבוכים מיקרו-וסקולריים, לא התדרדרו לבעיות נוספות בתפקוד הלבבי או הכלייתי. היתרונות במודל קדם-קליני של סוכרת בעכברים שטופלו עם ANXA1 הושגו על ידי שחזור על ידי הגנה רקמתית במסלולי Akt ו-MAPK (Yamada וחב' ב-Ann Surg משנת 2017). באופן בלתי-תלוי הודגם שעכברים שניזונו על ידי דיאטה עתירת-שומן וטופלו עם הקטע ה-N-טרמינלי Ac2-26, פיתחו עמידות פחות חמורה לאינסולין, הוחלשה בהם ההיפר-גליקמיה, ושוחזרה בהם הפעילות של Akt.
ANXA1ב-Diabetic Nephropathy:
ANXA1 נמצא סמן טוב לנזק גלומרולרי ובעיקר לנפרופתיה סוכרתית (Ka וחב' ב-Dis Markers משנת 2014). סיבוך נזק זה מתרחש בעיקר ברקמות בהם קליטת גלוקוזה אינה תלויה באינסולין, כגון כליות, רשתית, ואנדותל, כיוון שרקמות אלו נחשפות לריכוזי גלוקוזה הדומים לריכוזי סוכר זה בדם. בעכבריANXA1−/− , הנפרופתיה הסוכרתית חמורה יותר מאשר בעכברי WT מאותו שֶגֶר בניסויים בהם הושרתה סוכרת type 1 על ידי STZ, ובמודל בו הושרתה עמידות לאינסולין. בשני המודלים, עכברים פיתחו פרוטאינוריה חמורה יותר ונמצא בהם איבוד ניכר יותר ב-brush borders בסגמנטים S1-S2 של אבוביות הכלייה המפותלות הקריבניות (proximal convoluted tubules). המנגנון של נפרופתיה סוכרתית נובע משילוב של נזק ישיר של גלוקוזה לאנדותל, מיצירת superoxide, ומסכרוּר (glycation) מתקדם של תוצרי-קצה כתוצאה מהיפר-גליקמיה מתמשכת (Vithian ו-Hurel ב-Clin Med משנת 2010). היפרגליקמיה מגרה את היצירה של תוצרים מחמצנים ביתר (reactive oxygen species להלן ROS) הגורמים לעקה חמצונית, בעיקר בכלי-דם, שיגרמו בהמשך לניוון של שכבת האנדותל כסימן מוקדם של סיבוכים וסקולריים בסוכרת (Maeda וחב' ב-PLos ONE משנת 2015, ו-Leung וחב' ב-Life Sci משנת 2016). עודף יצירה של ROS פוגעת בפעילות האנזים nitric oxide synthase ולהפחת ייצור של NO. מה שמפחית את יכולת ההרחבה של כלי-דם ובסופו של דבר להגברת לחץ הדם. עכברי -/-ANXA1 שהוזנו בדיאטה עשירת שומן (HFD) הראו ירידה בפעילות nitric oxide synthase בכליות, שניתן היה לשחזר על ידי טיפול ב-ANXA1 אנושי רקומביננטי. יתר לחץ-דם אופייני לאנשים עם סוכרת, והוא סיבה עיקרית לפגיעה בתפקוד הכליות. רוב הטיפולים להתנהלות של נפרופתיה סוכרתית נסבים סביב הנורמליזציה של לחץ הדם על ידי טיפול במעכבי האנזים המהפך-אנגיוטנסין (ACE), או על ידי טיפול בחוסמי הקולטן לאנגיוטנסין. הודגם שעכברי -/-ANXA1 עם סוכרת type 2 סובלים מצורה חמורה יותר של re-modeling קרדיאלי כתופעה מוקדמת של יתר לחץ-דם, בהשוואה לעכברי-בר בשֶגֶר שלהם (Jelminic וחב' ב-Hear Lung Circ משנת 2018). עכברי -/-ANXA1 הם בעלי MYPT1 משופעל באופן קונסטיטוטיבי, שהוא חלבון המווסת את ההתכווצות ואת ההרפיה של שריר חלק וסקולרי ותפקידו חיוני בהתנהלות עם לחץ הדם (Qiao וחב' ב-J Biol Chem משנת 2014).
ההתפתחות של פיברוזיס כלייתית היא אירוע קלאסי של כליה סוכרתית. עכברי -/-ANXA1 בהם הושרתה סוכרת type 1 על ידי STZ, מפתחים פיברוזיס כלייתית הרבה יותר חמורה מאשר מעכברי-בר סוכרתיים מאותו שגר. בנוסף לכך, טיפול עם ANXA1 עשוי להפחית פיברוזיס כלייתית בעכברים עם סוכרת type 1 על ידי עיכוב של ERK1/2, של p38 ושל JNK. הודגם במודל של נפרופתיה על רקע של יתר לחץ-דם, שאיתות על ידי ANXA1 הוא בעל השפעות אנטי-פיברוטיות על פיברובלסטים בכליה, דרך מסלול ALX/FPR2 (Neymeyer וחב' ב-Acta Physiol משנת 2015).
ANXA1 ככלי טיפולי פוטנציאלי בסוכרת: ANXA1 רקומביננטי אנושי, והפפטיד ה-N טרמינלי שלוAc2-26 נוסו בגישה פרמקולוגית במודלים in vivo רבים של דלקת כרונית או חריפה (Gobbetti וחב' ב-Proc Natl Acad Sci USA משנת 2014, Qin וחב' ב-Pharmacol Ther משנת 2014, ו-Locatelli וחב' ב-Hepatology משנת 2014). יחד עם זה, הריכוזים של Ac2-26 הנדרשים לגרום לאותן השפעות ביולוגיות כאלה להן גורם ANXA1 השלם, גבוהים פי-20 לערך. רבות מההשפעות של ANXA1 ושל הפפטידים שלו מתווכות על ידי הציר ALX/FPR2, אך יש גם ראיות רבות להשפעת FPR1 על ריפוי פציעות, והשפעות על הגנת רקמת אפיתל של ANXA1 (Leoni ו-Nustrat ב-Biol Chem משנת 2016). עכברים בהם הושרתה סוכרת type 1 על ידי STZ, שטופלו עם ANXA1 אנושי רקומביננטי, אינם מפתחים מפגעים מיקרו-וסקולריים האופייניים לנפרופתיה ולקרדיו-מיופתיה, למרות ריכוזי גלוקוזה גבוהים בדם, מה שמצביע על השפעה הגנתית על איבר מרכזי ללא תלות בהפחתת רמת גלוקוזה.
ANXA1 כתווך אנטי דלקתי: מנגנונים מונעי דלקת ידועים נעזירם על ידי עיכוב של הפרשת תווכים מקדמי-דלקת (כגון פרוסטגלנדין E2, ולויקוטריאנים) (Sudlow וחב' ב-Br J Pharmcol משנת 1996), דרך ריפוי רקמתי, עד לחסימת הנדידה של לויקוציטים על פני אנדותליום דלקתי (Getting וחב' ב-Br J Pharmacology משנת 1997, ו-Chatterjee וחב' ב-J leukoc Biol משנת 2005). ANXA1 משרה בניטרופילים את היכולת להשיל L-selectin ולנתק מונוציטים מתאי אנדותל על ידי הפחתה של התקבצות ושפעול של α4β1. טיפול ניטרופילים אנושיים עם Ac2-26, מפחית את יכולתם להיספח ולעבור chemotaxis (Gavins ו-Hickey ב-Front Immunol משנת 2012, ו-Dalli וחב' ב-Front Pharmacol משנת 2012). כן נמצא ש-ANXA1 מדכא את יכולת הספיחה של לויקוציטים לאנדותל הווסקולרי המושרה על ידי indomethacin (Zanardo וחב' ב-Am J Physiol Liver Physiol משנת 2005).
ANXA1 גם מסייע להתפוגגות של דלקת על ידי האצה של אפופטוזיס. טרנספקציה של תאים מונוציטים מסוג U937 על ידי ANXA1 משפעלת את פעילות האנזים caspase-3 (Solito וחב' ב-Br J Pharmacol משנת 2001). יתרה מכך, ANXA1 מעודד הפרשה ציטוזולית של סידן, מה שגורם לדה-פוספורילציה של BAD, המסייע למות תאים בסיוע של Bcl-2, ובכך מסייע למנגנון האפופטוזיס. התגלה מנגנון חדש לפיו ANXA1 המשתחרר מניטרופילים אפופטוטיים הופך תאים אלה חשופים לפגוציטוזה על ידי מונוציטים מגויסים, ובכך הוא מגן על הרקמה הבריאה הסמוכה מפני נזק (McArthur וחב' ב-J Immunol משנת 2015). ממצא מעניין נוסף הוא שמקרופאגים ממח העצם של עכברי -/-ANXA1 אינם יעילים בפינוי של תאים אפופטוטיים (Maderna וחב' ב-J Immunol משנת 2005).
המשמעות של ANXA1 בסרטן:
ל-ANXA1 תפקיד רגולטורי חשוב בהתפתחות התהליך הסרטני ובהתקדמותו. ראיות לתפקיד זה נובעות מתצפיות ברורות על הביטוי של ANXA1 המוגבר בסוגי סרטן אחדים, אם כי מופחת בסוגי סרטן אחרים. Xia וחב' הדגימו את תפקידו החשוב של ANXA1 בסרטן הוושט, בו דווחה ירידה ברמת ANXA1 mRNA וברמת החלבון עצמו (Oncogene משנת 2002). מחקרים על מוטציות בסרטני הוושט הראו שאובדן אללי של ANXA1 מתרחש לעתים קרובות בעוד שמוטציות סומטיות הן נדירות. איבוד הביטוי של ANXA1 בסרטן הערמונית בולט באופן מיוחד והוא תואם את ההופעה המוקדמת של המחלה (Xin וחב' ב-Am J Pathol משנת 2003). בסרטני הראש והצוואר, הביטוי של ANXA1 נכרך בשלבי מחלה מתקדמים, ביצירת גרורות ובסטאטוס ההתמיינות (differentiation) של המחלה, והוא יכול לשמש סמן לגילוי דיספלסיה של האפיתל , ולסייע במידרוג ההיסטופתולוגיה של קרצינומת תאי הקשקש של הראש והצוואר (Garcia Pedrero וחב' ב-Am J Pathol משנת 2004). בסרטן השד ביטוי יתר של ANXA1 דווח ב-ducts מסורטנים בהשוואה ל-ducts נורמליים (Ahn וחב' ב-Clin Exp Metastasis משנת 1997). יחד עם זאת, מחקר עדכני על microarray המכיל 1,158 ליבות של היסטולוגיות שונות, כולל אזורים נורמליים, היפרפלזיות, גידולים ממאירים וגרורות לקשרי לימפה, הדגים הפחתה משמעותית בביטוי של ANXA1 ב-ductal carcinoma in situ, או ב-ductal carcinoma גרורתית, בהשוואה לרקמות נורמליות או היפר-פלסטיות (Shen וחב' ב-Hum Pathol משנת 2006). הדיווחים הסותרים על הביטוי של ANXA1 בסרטני שד, עשויים להיות קשורים לסטאטוס של הקולטנים לאסטרוגן, אם כי מתאם ברור בין השניים לא דווח עד כה. בסוגי סרטן אחדים יש דיווח על חסר או אובדן ביטוי של ANXA1, פרט לאותם סוגי סרטן הנמצאים תחת רגולציה הורמונלית (כגון סרטן שד או סרטן ההיפופיזה). נתון זה יכול להיות קשור לתפקודים הידועים של ANXA1 בשגשוג תאים אך גם באפופטוזיס, ולעובדה שתאי סרטן נוטים לדכא חלבונים אנטי-פרוליפרטיביים או כאלה הקשורים לאפופטוזיס. לפיכך, ייתכן להציע את החשיבות של ANXA1 כסמן שלילי בתהליך הסרטני. להלן מספר דוגמאות של ביטוי דיפרנציאלי של ANXA1 בסוגי סרטן שונים: א) סרטן הוושט: בקרצינומת תאי הקשקש בוושט יש חסר שלANXA1 (Paweletz וחב' ב-Cancer Research משנת 2000, Hu וחב' ב- Clin Cancer Resמשנת 2004, ו-Zhi וחב' ב-Int J Cancer משנת 2003). גם בקרצינומה בדרגת התמיינות גבוהה או מתונה יש חסר של ANXA1. ב) סרטן הראש והצוואר: בקרצינומת תאי הקשקש של סוג סרטן זה יש חסר ANXA1. ג) סרטן הלבלב: באדנוקרצינומה של בלוטה זו יש רמה מוגברת של ANXA1 (Bai וחב' משנת 2004). ד) סרטן גתות האף: Nasopharyngeal carcinoma יש חסר מוחלט של ANXA1 (Rodrigo וחב' ב- Am J Rhinol משנת 2005). ה) סרטן ההיפופיזה (Pituitary): ב- growth hormone secreting carcinomaרמה מוגברת של ANXA1 (Mulla וחב' ב- Clin Endocrinol משנת 2004). ו) סרטן הערמונית: חסר של ANXA1 בכל אחד מסוגי סרטן הערמונית הבאים: אדנוקרצינומה של הערמונית (Patton וחב' ב- Histopathologyמשנת 2006), אדנוקרצינומה חודרנית (Kang וחב' ב-Clin Cancer Res משנת 2002), סרטן ערמונית ממוקם, סרטן ערמונית שאינו מגיב להורמונים, ב-androgen stimulated prostate cancer (Smitherman וחב' ב-J Urol משנת 2004).
ז) לימפומה B cell: בסוג non-Hodgkin חסר ב-ANXA1 (Vishwanatha וחב' ב- BMC Cancer משנת 2004); רמה מוגברת של ANXA1בסוג Hairy cell lymphoma (Falini וחב' ב-Lancet משנת 2004). ח) סרטן שלפוחית השתן: בסוג transition cell carcinoma רמת ANXA1 מוגברת (Sheng וחב' ב-Proteomics משנת 2006); בסוג In situ carcinoma, low grade papillary carcinoma (Xiao וחב' ב- Int J cancer משנת 2007). ט) סרטן השד: בסוגים ductal non-invasive, סרטן שד גרורתי וקרצינומה in situ רמת ANXA1 מוגברת; בסוגים Ductal carcinoma in situ, ו- Invasive ductal carcinoma, רמת ANXA1 נמוכה. הוראות לביצוע הבדיקה: לצורך בדיקה אימונו-היסטוכימית יש צורך בקבלת רקמה על זכוכית נושא כאשר עובי חתך הרקמה הוא 4 מיקרון. ניתן לשלוח למעבדה בלוֹק רקמה מקובע בפורמלין, שעבר embedding עם פרפין. מועדף חומר שיגיע למעבדה בטמפרטורת החדר, אך גם דגימה שתגיע בקירור תתקבל (Falini וחב' ב-Lancet משנת 2004). יש לפסול דגימה רטובה/קפואה או כזו שלא קובעה עם פורמלין או עברה embedding על ידי פרפין. הגיל של החתך שטופל על ידי פרפין יכול להשפיע על ה-immunoreactivity, לכן חשוב לטפל בחתכים מעובדי פרפין טריים.
לצורך קביעה כמותית של רמת ANXA1 בדם ניתן להשתמש בשיטת ELISA או בשיטה אימונו-טורבידימטרית. יש לדגום דם ורידי במבחנת ספירת-דם (פקק בצבע ורדרד) המכילה EDTA. לאחר סרכוז למשך 15 דקות במהירות ,000g3 בטמפרטורת החדר, הפלזמה המופרדת אוחסנה בהקפאה בטמפרטורה של מינוס 80 מעלות עד לביצוע הבדיקה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 