מוקופוליסכרידוזות - Mucopolysaccharidosis
| מוקופוליסכרידוזות | ||
|---|---|---|
| Mucopolysaccharidosis | ||
| שמות נוספים | MPS I, מפ"ס | |
| יוצר הערך | פרופ' גדעון בך 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות אגירה
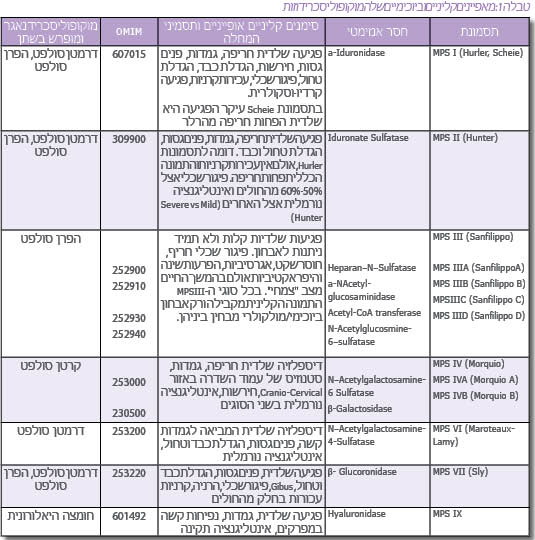
המוקופוליסכרידוזות (מפ"ס, MPS - Mucopolysacchridoses) הן קבוצה של 11 מחלות תורשתיות רצסיביות הנבדלות זו מזו בגן הפגוע בכל אחת מהן. המחלות מאופיינות כולן באגירה ליזוזומלית (Lysosomal storage) של מוקופוליסכרידים שונים (הידועים גם בשם גליקוזאמינוגליקנים - GAG - Glycosaminoglycan) בהרכב האופייני לכל אחת ממחלות אלה. האגירה הליזוזומלית משייכת את קבוצת ה-MPS לקבוצת מחלות האגירה הליזוזומליות. האגירה ב-MPS חלה בראש ובראשונה ברקמות חיבור שונות, אולם במרבית המקרים אגירה מסיבית קיימת גם ברקמות ובאיברים רבים נוספים בחולים אלה, ולכן הפגיעה בכל המחלות הללו היא רב מערכתית[1][2][3].
אגירה ליזוזומלית
המוקופוליסכרידים הם סוכרים מורכבים המכילים שרשראות ארוכות של רב-סוכרים ביחידות דו-סוכריות חוזרות ושרשראות אלה מחוברות לשלד חלבוני. סיווג רב-סוכרים אלה נעשה על פי הרכב הסוכרים ביחידות החוזרות, ובדרך כלל, נוסף על השלד הסוכרי יש קשירה גם של שיירי סולפט (SO4-). כמו כן, אחד משני הסוכרים מכיל קבוצת קרבוקסיל (-COO). מבנה זה מקנה למוקופוליסכרידים אופי חומצי ברור בתמיסה מימית, ולכן במצב של אגירה מסיבית אנו מניחים שאחד הגורמים העיקריים לפתולוגיה התאית במחלות אלה הוא האגירה המסיבית של חומרים חומציים אלה בריכוז גבוה בליזוזום.
מוקופוליסכרידים הם מרכיבי ממברנת (Membrane) התא, ופירוקם נעשה במצב תקין בליזוזום התוך-תאי. הרכב המוקופוליסכרידים המצטברים בכל אחת מהמחלות הללו נקבע על ידי הפגם המטבולי הספציפי הנובע מתפקוד לקוי או חסר של אחד מהידרולזות (Hydrolase) הליזוזומאליות המשתתפות בפירוק סוגים שונים של המוקופוליסכרידים (טבלה 1). אגירה משמעותית מתקדמת לאורך חיי החולה, באופן שעודף מוקופוליסכרידים מופרש מתאים מתים, ולכן מופיע בנוזלים חוץ-תאיים כמו פלזמת הדם, נוזל סינוביאלי (Synovial fluid), במפרקים ועוד. בנוסף, חולים עם מוקופוליסכרידוזות מפרישים בשתן כמויות ניכרות של מוקופוליסכרידים, בכמות ובהרכב האופייני לכל אחת מהמחלות.
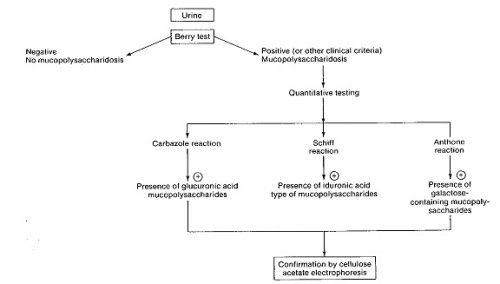
אמצעי האבחון המעבדתי הראשוני של חולים אלה הוא מדידה איכותית וכמותית של עודף המוקופוליסכרידים בשתן[4].
נוסף לאגירה ראשונית של הסוכרים, בפרופיל אופייני לכל מחלה, ניכרת גם אגירה משנית בליזוזומים של רקמות מסוימות של חומרים נוספים בעיקר גליקוליפידים (Glycolipid) מסוג גנגליוזידים (Ganglioside) הטעונים שלילית[5]. נראה שתהליך האגירה הראשוני מביא לפגיעה בתהליכי האנדוציטוזה (Endocytosis) של מעבר חומרים גבה-מולקולריים לתא ולליזוזומים. כתוצאה מכך נאגרים בהמשך התפתחות המחלה שומנים שונים, כאמור בעיקר גנגליוזידים שונים, שקשורים לפגיעה ניכרת במערכת העצבים המרכזית (CNS - Central Nervous System). אפיון חומרי האגירה במוח של חולים אלה מצביע על כך שלעיתים עיקר האגירה אינה של המוקופוליסכרידים אלא דווקא של גנגליוזידים שונים.
מוקופוליסכרידוזות, הן מחלות של רקמות חיבור, לפיכך בכולן יש פגיעות בדרגות חומרה שונות בשלד, בעור ובשיער. אך אגירה של MPSs יכולה להופיע גם באיברים אחרים כמו הכבד והטחול, הלב וכלי הדם, ובחלק ניכר מהמחלות יש פגיעה פסיכומוטורית חריפה בגלל הצטברות MPS במערכת העצבים. השוֹנוּת בחומרת מוקופוליסכרידוזות נובעת בעיקר מאופי המוטציות, כאשר מוטציות חֶסֶר (Deletion) תגרומנה לתסמינים חמורים יותר, ואילו מוטציות שחלוף חומצת אמינו (Missense) עשויות לגרום למחלה קלה יותר. בהתאם, המופע של תסמינים קליניים יכול לבוא לביטוי כרונולוגי שונה, כגון הצורה האינפנטילית/ילדות מוקדמת (Infantile, Early childhood), צורת הנעורים (Juvenile) והצורה המבוגרת, הקלה יחסית (Adult).
במרבית המחלות הללו יש פגיעה חריפה במערכת העצבים המרכזית. אפיון חומרי האגירה במוח של חולים אלה מצביע על כך שלעיתים עיקר האגירה אינה של המוקופוליסכרידים הראשוניים אלא גנגליוזידים שונים, ותהליך הפגיעה העצבית, כגון פיגור פסיכומוטורי ועוד, מתרחש כנראה מאגירה משנית זו המזרזת תהליכי דלקת, ולאו דווקא מהאגירה הראשונית[5][6], ואכן, בניסיונות טיפול בחלק מה-MPS בניסיון לתיקון מצב האגירה במוח, המעקב העיקרי הוא אחר ירידה באגירה ובתכולת הגנגליוזידים במוח החולה[7].
יחסי גנוטיפ ופנוטיפ (Phenotype, Genotype)
תהליך האגירה, הנובע מחסימה מלאה או חלקית של תהליך פירוק המוקופוליסכרידים מתרחש במשך כל חיי התאים שבהם חלה האגירה. כלומר, כמות הסוכרים הולכת ועולה בחולים והדבר מתבטא פנוטיפית בתמונה הקלינית שבה יש החמרה והתקדמות במצב המחלה במשך חיי החולה, המביאות להידרדרות בתפקודי רקמות ואיברים שונים. למעשה בכל המחלות תוחלת החיים קצרה מהתקין. במרבית המחלות התסמינים של המחלה מתבטאים כבר בגיל צעיר ביותר, ותוחלת החיים במרבית המקרים היא העשור הראשון ומקסימום העשור השני לחיים. כאמור, בחלק מהמחלות יש פגיעה חריפה במערכת העצבים המרכזית, ומכאן הקשיים הגדולים בפיתוח אמצעי טיפול מתאימים.
הורשה
ה-MPS מורשות כולן באופן רצסיבי (Recessive), כלומר נשאי המחלה, כגון הורי הילדים החולים, אינם מראים סימני מחלה כלשהם. בכל המחלות, חוץ מתסמונת Hunter (MPS II) הגנים ממוקמים בכרומוזומים אוטוזומיים, כלומר התסמונת מורשת כאוטוזומלית (Autosomal) רצסיבית, כך שילד חולה ייוולד רק אם שני הוריו נשאי מוטציות. תסמונת Hunter עוברת בהורשה בתאחיזה לכרומוזום X ולכן לאם נשאית יש סיכון של 50 אחוזים ללדת בנים שיחלו בתסמונת. הנשאיות בדרך כלל בריאות, אולם תוארו מספר מקרים נדירים של בנות חולות בתסמונת Hunter. מקרים אלה נבעו בדרך כלל מאינאקטיבציה לא אקראית של כרומוזום X לאישה נשאית (Unrandom imprinted X-inactivation).
היסטוכימיה (Histochemistry) ואולטרה-סטרוקטורה ( Ultrastructure)
בבדיקות היסטוכימיות של תאים שבהם מתרחשת האגירה אנו רואים וקואוליזציה (Vacuolization) מרובה בכל שטח התא. בצביעה היסטוכימית בעזרת צבעים קושרי קבוצות חומציות - סולפט ו/או חומצה אורגנית, שניהם ממרכיבי המוקופוליסכרידים - מתקבלת תגובה אופיינית של Metachromasia שהיא צביעה סגולה חזקה. באנליזה בעזרת מיקרוסקופ אלקטרוני נראה כל התא מלא בווקואולות מוגדלות (ליזוזומים מוגדלים מאוד), מוקפות בממברנה יחידה והתוכן בעיקרו הוא חומר אמורפי (Amorphic) גרנולרי (Granular) האופייני לאגירת הסוכרים השונים[3]. תמונה זו היא התוויה ברורה לאבחון מחלות בקבוצה זו. כמוזכר למעלה, במוח ייראו גם למחלות ממברנליות של אגירת הגנגליוזידים.
קליניקה
מחלות ה-MPS השונות הן כולן מחלות של רקמות החיבור, ולכן בכולן יש פגיעות משתנות בשלד, בעור, בשיער ועוד. אולם האגירה מתרחשת גם באיברים רבים אחרים ובדרך כלל הכבד והטחול, הלב וכלי הדם פגועים, ובחלק ניכר מהמחלות יש פגיעה פסיכומוטורית חריפה (טבלה 1).
בכל המחלות אנו מוצאים כי המחלה מתבטאת בחומרה משתנה, כלומר - הטרוגניות (Heterogenic) קלינית - פגיעה באותו גן המביא לביטוי קליני משתנה. וריאביליות זו נובעת בראש ובראשונה מאופי המוטציות, מוטציות חסר וכדומה גורמות להסתמנות קשה של המחלה, ואילו מוטציות שחלוף חומצה אמינו עשויות לעיתים לגרום להופעת מחלה קלה יותר. אמנם ניתן למצוא חולים בכל ספקטרום החומרה, אולם כללית ניתן לחלק את החולים בכל אחת ממחלות ה-MPS לצורה האינפנטילית/ילדות מוקדמת, צורת הנעורים והצורה המבוגרת, הקלה יחסית. לדוגמה, תסמונת MPS I, הצורה הקשה ידועה כתסמונת Hurler (MPS I-H), והצורה הקלה של התסמונת מוכרת כ-תסמונת Scheie (MPS IS) וצורת ביניים (Hurler-Scheie, MPS H-S). כך, תסמונת Hurler היא תסמונת קשה, פגיעה רב-מערכתית הכוללת פיגור שכלי ותוחלת חיים שאינה עולה על 7–10 שנים, ואילו תסמונת Scheie היא קלה יחסית, עיקר הפגיעה היא שלדית ותוחלת החיים ארוכה יחסית[2][3].
קיים גם מצב של הטרוגניות גנטית, כלומר, אותה מחלה ואותו ביטוי קליני כתוצאה ממוטציות בגנים שונים. לדוגמה, תסמונת Sanfilippo (MPS III) מחולקת ל-4 תת-קבוצות - MPS III - D ,C ,B ,A (טבלה 1). בכל אחת מהן פגוע אנזים אחר כתוצאה ממוטציות ספציפיות בגן הרלוונטי, אולם כל ארבעת האנזימים הפגועים משתתפים בפירוק הפרן סולפט (Heparan sulfate), אחד מה-MPS, וכך חוסר פעילות של כל אחד מהאנזימים מביא לאגירת אותו רב-סוכר - הפרן סולפטן ומכאן לאותה מחלה מבחינת הביטוי הקליני. מצב דומה קיים בתסמונת Morquio (MPS IV – A, B) שבה קיימת אגירת המוקופוליסכריד - קרטן סולפט (Keratan sulfate) עקב חסר בשני אנזימים המשתתפים בפירוקו (טבלה 1).
בכל המחלות התמונה הקלינית הולכת ומחריפה עם הגיל, תוך הידרדרות במצבו של החולה, ורובם מסיימים במצב וגטטיבי (Vegetative). הצטברות המוקופוליסכרידים ברקמות השונות מביאה במרבית החולים לשקיעתם במפרקים ומכאן לנפיחות מפרקים ונפיחות אצבעות. כמו כן, יש פגיעה ריאתית במרבית החולים עם הזמן, חירשות ופגיעה בראייה.
אבחון
האבחון הראשוני של החולים חייב להיעשות במרפאה, ומכיוון שבכל המחלות הללו חולים בעיקר ילדים, בדרך כלל הרופא המאבחן לראשונה הוא רופא ילדים ו/או רופא גנטיקאי. לאבחון מדויק ומשמעותי קיים צורך בניסיון קודם ובהיכרות מעמיקה עם מחלות אלה, ולכן כשמועלה חשד לנוכחות אחת מה-MPS, החולה מופנה בדרך כלל לרופא מומחה בתחום זה. בישראל, המחלקה לגנטיקה של האדם בבית החולים הדסה בירושלים מתמחה בתחום זה יותר מ-30 שנה, ומהווה מרכז אבחנות ארצי למחלות אלה, כמו גם למחלות ליזוזומליות אחרות.
חשד לנוכחות MPS מבוסס בשלב הראשון בבדיקת שתן המצביעה על הפרשה מוגברת של מוקופוליסכרידים אופייניים. אולם, אפיון הפרשת הסוכרים אינו מדויק דיו ואינו מאפשר אבחון מדויק של ה-MPS. לדוגמה, הן בתסמונת Hurler והן בתסמונת Hunter מופרשים אותם MPS בשתן (טבלה 1). כמו כן, קיימת חפיפה גבוהה מאוד בתסמינים הקליניים האופייניים בכל גיל בין התסמונות השונות ולכן האבחון המדויק והמשמעותי מבוסס רק לאחר בדיקות מעבדתיות ספציפיות והדגמת חוסר פעילות האנזים הרלוונטי. יש להעיר שבתסמונת Sanfilippo, הפגיעה העיקרית היא פיגור שכלי חריף ומינימום פגיעות שלדיות וכדומה, ולכן האבחון הקליני של תסמונת זו קשה במיוחד ועשוי לקחת זמן רב עד להעלאת חשד מתאים.
אבחון התסמונת מבוסס על הדגמה של חסר משמעותי (ירידה של לפחות 90 אחוזים) בפעילות האנזים מהרמה הנורמלית. לכן למשל, במצב של הטרוגניות גנטית כמו בתסמונת Sanfilippo, רק לאחר האבחון האנזימטי ניתן לשייך את החולה לתסמונת המתאימה[8][9], האבחון המדויק הוא בעל חשיבות עליונה שכן ללא שיוך חד-משמעי אין אפשרות למשל להציע אבחון טרום לידתי ואין אפשרות להציע טיפול אם קיים טיפול. האבחון האנזימטי של החולים הוא חד-משמעי, אולם אבחון מצב נשאות (הטרוזיגוטיות - Heterozygote) פחות מדויק בבדיקה האנזימטית ועומד על דיוק של 90 אחוזים. לכן בהמשך לאבחון האנזימטי השלב הבא מחייב איתור של המוטציה/מוטציות המאפשר זיהוי נשאות במדויק. האבחון האנזימטי נעשה בדגימת דם, והאבחון מבוצע בתמצית תאי דם לבנים (לויקוציטים) לאחר בידודם מהדם המלא. אבחון ניתן לבצע גם בתרביות תאים, כגון תאי פיברובלסטים בתרבית, תאים אמניוציטים (Amniocyte) בתרבית לאחר בדיקת מי שפיר או דגימת סיסי השליה (Chorionic Villi). שני האחרונים מהווים מקור לאבחון טרום לידתי במשפחות בסיכון, ברמת דיוק מרבית. אבחון מוטציות מהווה כלי עזר רב חשיבות הן באבחון הטרום לידתי ועוד יותר בזיהוי נשאות. בישראל מרוכזים חולים בחלק ניכר מתסמונות אלה בחמולות ערביות גדולות ובמקרים רבים המוטציה הספציפית למשפחות מסוימות זוהתה בעבר. מחלות MPS שונות באוכלוסייה הערבית בצפון הארץ מראות לעיתים ריבוי מוטציות למרות הימצאות חולים בכפרים סמוכים זה לזה[10].
המניעה היא השירות הרפואי החשוב ביותר המוצע למשפחות בסיכון. אמנם פותחו דרכי טיפול לחלק ממחלות אלה (ראו להלן), אולם נכון לשנת 2017, טיפולים אלה בחלקם הם עדיין ניסיוניים, האפקט התרפויטי מוגבל, אין אפשרות לתקן פגיעות שלדיות המהוות במרבית המחלות תסמין מרכזי, ואין אפשרות לתיקון הפגיעה במערכת העצבים המרכזית עקב מחסום דם-מוח (Blood Brain Barrier). לכן, זיהוי הפגם האנזימטי וזיהוי המוטציות חשובים ביותר. באבחון הטרום לידתי יש להוסיף טכנולוגיה יחסית חדשה - אבחון טרום השרשה, PGD (Preimplantation Genetic Diagnosis) המבוססת על אבחון התסמונת בעוברים, לאחר הפריה חוץ-גופית (IVF - In Vitro Fertilization), ברמת תא בודד המבודד מהעובר המתפתח בשלב של 6–8 תאים. אבחון זה דורש אפיון מוקדם של המוטציה (מוטציות) אצל ההורים, מכיוון שרק בשיטה המולקולרית ניתן להשיג אבחון מדויק ורגיש בכמות חומר כה קטנה. אותם עוברים המאובחנים שאינם הומוזיגוטיים למוטציות המחלה יוחזרו לרחם להמשך ההיריון. בשיטה זו אנו נמנעים מהצורך להפלות של עוברים פגועים.
החשד שמדובר במחלת אגירה של MPSs צריך להתעורר במקרה של נבדקים צעירים עם תווי פנים גסים, כבד וטחול מוגדלים (Hepatomegaly, Splenomegaly), נסיגה שכלית, קוגניטיבית ומוטורית, התעכרות הקרנית (Corneal opacity), קישיון מפרקים ו-Dystosis multiplex. בבדיקות היסטוכימיות בעזרת מיקרוסקופ אלקטרוני של תאים עם אגירת MPS, ניכרת וקואוליזציה תאית משמעותית, עם ליזוזומים מאוד מוגדלים. צביעה היסטוכימית בעזרת צבעים הקושרים קבוצות חומציות או סולפט, ממרכיבי מוקופוליסכרידים, תתקבל תגובת מטאכרומזיה סגולה חזקה אופיינית. באנליזה מיקרוסקופית התוכן הליזוזומאלי בעיקרו הוא חומר אמורפי גרנולארי האופייני לאגירת הסוכרים השונים.
טיפול
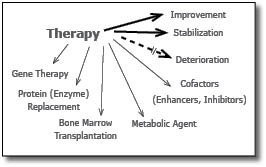
אמצעי הטיפול בחולים אלה נמצא במרכז המחקר העולמי בתחום זה. מגוון אפשרויות נחקרות ונמצאות בשימוש בטיפול בחולים אלה והן מסוכמות בתרשים 1 [9][11][12].
הזרקת האנזים החסר (ERT - Enzyme Replacement Therapy) - אמצעי זה פותח לאחר הטיפול היעיל והמוצלח שהתקבל בטיפול חולי Gaucher סוג 1[13]. פותחו תכשירים מתאימים לטיפול בחלק ניכר מה-MPS. כיוון שהאנזים המוזרק אינו יציב זמן ממושך, יש צורך בהזרקות חוזרות, בדרך כלל פעם בשבועיים, או גם הזרקות שבועיות לקבלת אפקט טיפולי. הכנת התכשיר האנזימטי מותנית בזמינות כמויות מספקות הדרושות בכל הזרקה לכל אחת מהמחלות, ובהכנת האנזים כך שיוכל להיות מכוון (Targeting) לרקמות השונות הפגועות אצל החולים. הכנה זו מבוססת על כך שהאנזים יחדור לתא ויגיע לליזוזום רק אם הוא מכיל "אתר הכרה", כלומר מבנה סוכרי מסוים שיתקשר לקולטן המתאים (Receptor) האופייני לכל רקמה. לגבי רקמות חיבור יש צורך בנוכחות מנוז-6-פוספט (M6P) סופי (Terminal) כדי להיקשר לקולטן מתאים ולחדור לליזוזום. ברקמות כגון תאי Parenchyma בכבד, יש צורך בנוכחות מנוז או גלקטוז חופשי טרמינלי. ללא נוכחות אתר ההכרה אין לטיפול אפקט תרפויטי. פותחו התכשירים הבאים: Aldurazyme or Laronidase עבור תסמונת Hurler (MPS I), Idursulfase or I2S עבור מחלת Hunter (MPS II), ו-Galsulfase עבור חולים בתסמונת Maroteaux-Lamy (MPS VI). תכשירים אלה עברו את שלבי הניסוי הקליני והוכנסו לשימוש בארצות הברית, באירופה ובישראל[9][11].
הבעיה המרכזית בטיפול זה היא העובדה שהאנזים המוזרק אינו מגיע למוח החולים, ומכאן שהאפקט שלו מוגבל לתסמינים הוויסצרליים (סומטיים) בלבד. מתעוררת שאלה אתית בטיפול זה: האם נכון יהיה להקל מספר תסמינים סומטיים לחולים הממשיכים לסבול מפיגור שכלי ומהידרדרות נוירולוגית. לכן, מומלץ לשקול טיפול בעיקר לחולים שאינם פגועים נוירולוגית.
העלויות הכספיות של הטיפולים הללו גבוהות ונדרשת זמינות קבועה של החולה במשך כל חייו להזרקות החוזרות. עם זאת, לגבי שלושת הטיפולים שפורטו לעיל, נמצא שבדרך כלל הטיפול בטוח. אומנם התקבלו בכולם תגובות חיסוניות ברמות שונות בחלק מהחולים, אולם בדרך כלל ניתן לשלוט בתגובות אלה וחלקן חולפות עם הזמן. ללא ספק טיפולים אלה הביאו בכל המחלות הללו שיפור של לפחות חלק מהתסמינים הקליניים ויש להניח שגם להארכת תוחלת החיים של החולים. פותחו תכשירים מקבילים גם לטיפול בחולי Sanfilippo (MPS III) מסוג A וסוג B וכן לתסמונת Morquio (MPS IV), אולם העובדה שטיפול זה אינו אפקטיבי לגבי מערכת העצבים המרכזית וכן בתיקון מומי השלד האפקט במקרים אלה היה מוגבל מאוד, מעלה את השאלה האם ראוי לפתח תכשירים אלה. בישראל מטופלים חולי MPS I ו-MPS II, ונכון למועד כתיבת מאמר זה מאתרים חולי MPS VI לתחילת הטיפול.
תרפיה גנית - Gene Therapy
עיקר הניסיונות בכיוון זה נעשו בחיות מודל הקיימות לכל אחת מה-MPS. ניסיונות לתרפיה גנית מבוססים על הזרקת וקטור מתאים, על פי רוב וקטור ויראלי ספציפי המכיל במקום חלק מהגנום הוויראלי את גן ה-MPS התקין שבו אנו מבקשים לבטא את החלבון הנורמלי. הגן הוא למעשה החלק המקודד בכל גן (cDNA) שכן אין אפשרות להחדיר את הגן כולו עקב גודלו העצום. ניסיונות נעשו הן בתרביות רקמה והן בחיות מודל - עכברים, חתולים וכלבים - שבהן הוזרק הגן התקין בדרך כלל באמצעות וקטור ויראלי מסוג Retrovirus או AAV (Adeno-Associated Virus) או Lentivirus. בכל המקרים דווח על חדירה יעילה לתאים וביטוי משמעותי של החלבון המקודד על ידי הגן המתאים. ההזרקות לחיות נעשו או על ידי הזרקות IV או הזרקות צפקיות (Peritoneal) או הזרקת הווקטור לתאי מח עצם מבודדים והחזרתם לחולה לאחר הטרנספקציה הגנית. הודגמו הן בטיחות נדרשת והן יעילות[9][11], לצורך תיקון הפגיעה הנוירולוגית דווח על הזרקות הגן החסר ישירות למוח החיות החולות, לרוב באתרי מוח שונים וגם פה התקבלו תוצאות לתיקון הפגם[7], וככל הנראה מתוכנן להתחיל בטיפולים בכיוון זה לחולים בחלק מסוגי ה-MPS; בניגוד ל-ERT, בשיטות אלה מספיקה הזרקה יחידה שעשויה להספיק לזמן רב, כלומר ייצור מתמיד ונמשך גם לשנים, של החלבון על ידי הגן המוזרק.
השתלת מח עצם
השתלת מח עצם מהווה למעשה שילוב של הזרקות האנזים (ERT) והטיפול בתרפיה גנית (Gene Therapy). מטופלים חולים בתסמונות שונות של ה-MPS באמצעות השתלת מח עצם או השתלות דם טבורי[14]; יש לזכור את הסיכון הגבוה בטיפול מסוג זה. אולם על פי רוב זו הדרך היחידה לעזור לחולים אלה. טיפול זה נעשה כבר שנים רבות, בעיקר לחולי Hurler (MPS I) בעולם כולו, כולל בישראל. נעשו גם השתלות לחולי MPS II ובתסמונות האחרות, אולם הניסיון כאן יותר מוגבל אף שבדרך כלל נרשמו הצלחות. ההשתלה מבוצעת מתורם בריא, רצוי לא נשא. תאי מח העצם המתבגרים לתאי דם שונים מגיעים לכל אזורי הגוף, כולל גם העברה למוח (מקרופגים). התאים מהתורם הבריא מייצרים את האנזים התקין המופרש בחלקו מהתא ונקלט על ידי התאים השונים. נוכחות או חדירה של אנזים ברמות העולות על 10 אחוזים מהרמה הנורמלית מספיקות לתיקון האגירה הליזוזומלית והתאים נראים אז ללא אגירה ולמעשה לא נבדלים מתא תקין[15].
את כל הטיפולים בשלוש הטכנולוגיות שהוזכרו מומלץ לעשות בשלבים המוקדמים ביותר, רצוי לפני שהתפתחו באופן ניכר סימני המחלה השונים, שכן באספקטים שונים של תסמיני המחלה הטיפולים רק עוצרים או מאיטים את התקדמות המחלה, ולאו דווקא מביאים חזרה למצב תקין. לפיכך הועלתה האפשרות לבצע בדיקות אבחנתיות מוקדמות באמצעות סקר יילודים לאיתור חולים כבר מיד לאחר הלידה; אבחון יילודים לאיתור תינוקות חולי MPS מבוצע באוסטרליה ובמדינות מסוימות בארצות הברית[16][17], טיפול קיים ורלוונטי רק לחלק מה-MPS, ולכן איתור תינוקות חולים לא תמיד יסייע להורים ועשוי לגרום ללחצים נפשיים כבר בשלב מוקדם של חיי התינוק.
שיטות טיפול אלטרנטיביות
פותחו שיטות לטיפול במחלות האגירה הליזוזומליות, כולל חולי ה-MPS השונים. שיטות אלה כוללות עיכוב ביצירת ה-Substrate ושימוש בסוככים כימיים (Chemical Chaperones).
עיכוב יצירת הסובסטרט, SRT (Substrate Reduction Therapy) - בשיטה זו מוסף מבחוץ חומר המגיב עם המערכת הביוסינתטית באופן ספציפי, בעיקר על ידי אינטראקציה ועיכוב של אחד האנזימים במסלול הביו-סינתזה. הכיוון המבטיח ביותר בתחום זה הושג באמצעות החומר Genistein (Trihydroxyisoflavone)[4][5][7], שנמצא כמעכב יצירת MPS שונים[18]. הוספת חומר זה הביאה לירידה משמעותית בתכולת MPS שונים בתאים בתרבית. חומר זה נוסה הן במערכת תרביות תאים של חולי MPS שונים והן בחיות מודל, ונמצא שיפור ברור במצב האגירה הלא תקינה (Abnormal) עקב הירידה ההתחלתית בתכולת המוקופוליסכרידים. חומר זה הוא בעל משקל מולקולרי נמוך, חודר את מחסום הדם-מוח, ולכן עשוי להיות יעיל גם לגבי הפגיעות הנוירולוגיות. החומר נוסה בתרבית של חולי MPS IIIA ,II ,I ו-IIIB, ובכולם נמצאה ירידה חדה בתכולת האגירה (18). עוד מוקדם לקבוע את השפעת החומר בטיפול בחולים עצמם.
שפרונים כימיים - טיפול זה מתייחס בעיקר למוטציות מסוימות בלבד. למעשה הוא ישים בעיקר למוטציות שחלוף חומצות אמינו אחת באחרת – Missense Mutations. במוטציות מסוג זה ייצור החלבון (המוטנטי) עדיין קיים ובדרך כלל לא נפגעת רמתו, אולם כאשר חלבון מוטנטי מגיע בתהליך ייצורו למערכת הרטיקולום האנדופלזמטי (Endoplasmic reticulum) בשלב מעברו לליזוזום קיימת שם מערכת "בקרה" המאתרת חלבון בעל מבנה לא תקין (מוטנטי) ומערכת זו מביאה לכך שהחלבון בעל המבנה הפגום מתפרק על ידי מערכת ה-Proteasome [19]. כך, למרות ייצור החלבון הוא אינו מגיע לליזוזום. חומרים מסוימים, על פי רוב מעכבים ספציפיים לאנזים בכמויות קטנות נקשרים באופן ספציפי לחלבון האנזימטי ומביאים בעקבות הקשירה לשינויים מבניים כך שמערכת הבקרה הזו לא מאתרת את הפגם, ועל ידי כך "מתחמק" החלבון מפירוק ומגיע לליזוזום. לחלבון זה יש בדרך כלל פעילות אנזימטית ברמה משתנה, ולמעשה במצב זה ניתן להגיע אכן לתיקון מצב האגירה[20]. היתרון של חומרים אלה הוא שברובם הם קטנים מבחינה מולקולרית, ולכן גם עשויים לעבור בקלות מהדם למוח ולפעול גם שם.
דגלים אדומים
ביבליוגרפיה
- ↑ Mukusick VA. The genetic mucopolysaccharidoses. Medicine 1965;445-483
- ↑ 2.0 2.1 Neufeld EF, Muenzer J. The mucopolysaccharidoses. In; The Online Metabolic and Molecular Bases of Inherited Diseases. Eds. Scriver CR, Beaudet Al, Sly WS, Valle D. Chapter 136, McGraw Hill. http:genetics.accessmedicine.com/vmbid/public
- ↑ 3.0 3.1 3.2 Neufeld EF, Muenzer J. The mucopolysaccharidoses In; The Metabolic and Molecular bases of Inherited Diseases. 8th Eds. Scriver CE Beaudet AL. Sly WS, Valle D. McGraw Hill, NY 2001;3421-3452
- ↑ 4.0 4.1 Berman ER, Vered J, Bach G. A reliable spot test for mucopolysaccharidoses. Clin Chem 1971;17:886-890
- ↑ 5.0 5.1 5.2 Walkley SU, Zeruas M, Wiseman S. Gangliosides as modulators of dendtritogenesis in normal and storage disease – affected pyramidal neurons. Cereb Cortex 2000;10:1028-1037
- ↑ Taylor EK, Gallo RC. Glycosaminoglycans and their proteoglycans: host associated molecular pattern for initiation and modulation of inflammation. Faseb J 2006;20:9-22
- ↑ 7.0 7.1 7.2 Ciron C, Dermaris N, Colle MA, et al. Gene therapy of the brain in the dog model of Hurler's Syndrome. Ann Neurol 2006;60:204-213
- ↑ Bach G. Prenatal diagnosis of disorders of mucopolysaccharide metabolism. In; Genetic disorders and the Fetus. Diagnosis, prevention and treatment. Ed. Milunsky A, John Hopkins University Press 1998;429-444
- ↑ 9.0 9.1 9.2 9.3 Clarke LA. The mucopolysaccharidoses: a success of molecular medicine. Expert reviews in Molecular Medicine 2008;10:1-18
- ↑ Bach G, Moskowitz SM, Tieu PT, et al. Molecular analysis of Hurler syndrome in Druze and Muslim Arab patients in Israel. Multiple allelic mutations of the IDUA gene in a small geographic area. AM J Hum Genet 1993;33:330-338
- ↑ 11.0 11.1 11.2 Beck M. New therapeutic options for lysosomal storage disease: Enzyme therapy, small molecules and gene therapy. Hum Genet 2007;121:1-22
- ↑ Ponder KP, Haskins ME. Gene therapy for mucopolysaccharidosis. Expert Opinion Biological Therapy 2007;7:1333-1345
- ↑ Grabowski GA, Leslie N, Wenstrup R. Enzyme therapy in Gaucher disease: the first 5 years. Blood Rev 1998;12:115-133
- ↑ Staba SL, Escolar ML, Poe M, et al. Cord blood transplants from unrelated donors in patients with Hurler's Syndrome. NEJM 2004;350:1960-1969
- ↑ Elihau R, Sekeles E, Cohen R, et al. The correction of Hunter fibroblasts by exogenous iduronate sulfatase: Biochemical and ultrastructural studies. Am J Hum Genet 1981;33:576-583
- ↑ Meikle PJ, Grasby DJ, Dean CJ, et al. Newborn screening for lysosomal disorders. Mol Genet Metab 2006;88:307-314
- ↑ Gelb MH, Turecek F, Scott CR, et al. Direct multiplex assay of enzyme in dried blood spots by tandem mass spectrometry for newborn screening of lysosomal storage disorders. J Inherit Metab Dis 2006;29:397-404
- ↑ Piotrowska E, Jacolkiewicz-Banecka J, Branska S, et al. Genistein-mediated inhibition of glycosaminoglycan synthesis as a basis for gene expression – targeted isoflavone therapy for mucopolysacchardes. Eur J Hum Genet 2006;14:846-852
- ↑ Bernier V, Lagace M, Bichet DG, et al. Pharmacological chaperons : Potential treatmental for confromational diseases. Trends Endocrinol Metab 2004;15:222-228
- ↑ Tropak MB. Pharmacological enhancement of beta hexoaminidase activity in fibroblasts from adult Tay Sachs and Sandhoff patients. J Biol Chem 2004;279:13478-13487
קישורים חיצוניים
- מוקופוליסכרידוזות, מדיקל מדיה
המידע שבדף זה נכתב על ידי פרופ' גדעון בך - המחלקה לגנטיקה של האדם, המרכז הרפואי האוניברסיטאי הדסה, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק