בירור גנטי באוטיזם - Genetic testing for autism
| בירור גנטי באוטיזם | ||
|---|---|---|
| Genetic testing for autism | ||
| יוצר הערך | ד"ר דורית לב
|
|
אוטיזם היא הפרעה נוירו-התפתחותית שכיחה והטרוגנית עם מרכיב גנטי חשוב.
מדובר בתסמונת קלינית המתאפיינת בהפרעה בתחום החברתי, השפתי והתקשורתי, בהתנהגות סטראוטיפית וחזרתית, ובהפרעה בכישורים החברתיים, המאובחנת לפני גיל 3 שנים. שכיחות התסמונת 1 ל-150 לידות.
הסיבות לאוטיזם אינן ברורות, ויש מחקרים רבים מאוד המנסים למצוא את הגורמים האטיולוגיים. הפרעות תקשורת בטווח האוטיסטי מורכבות, ועד כה לא זוהה גן ספציפי האחראי לאוטיזם. יש מספר פקטורים, הן גנטיים והן סביבתיים.
אוטיזם הוא תסמונת ולא הפרעה אחת מוגדרת; מכאן המונח "הפרעות מקשת האוטיזם" (ASD - Autism spectrum disorder), הכולל צורות קשות וקלות עם שונות קלינית רבה.
לפחות ל-50% מהילדים האוטיסטים מנת משכל של פחות מ-70. לא נמצאה פתולוגיה מוחית אחידה בחולים, אבל זוהו שינויים במסלולי המוח ומעורבות של האונות המצחית (פרונטלית) והרקתית (טמפורלית). בעתיד יש צורך באפיון טוב יותר של תת-הקבוצות מבחינה קלינית וביולוגית, כדי ליעל את המחקרים הגנטיים ולהשוות את הממצאים הגנטיים לקבוצות ביקורת, במיוחד לגבי ממצאים של שוני במספר העותקים בגנום (CNVs - Copy-number variations).
כיום עובדים על סמנים ביולוגיים שיאפשרו גילוי מוקדם של ילדים בסיכון לפתח אוטיזם כדי להתחיל לטפל בהם מוקדם. טיפול הוכח כיעיל ככל שמתחילים בו מוקדם יותר.
כיום, ניתן למצוא שינויים גנטיים בכ-10-20% מהמקרים. במרבית המקרים מדובר בשוני במספר העותקים. בדרך כלל כל מוטציה ספציפית בגן שתוארה עד היום, נמצאה בפחות מאחוז אחד מהמקרים.
המחקר הגנטי בשנתיים האחרונות מדגיש את ההטרוגניות הגנטית הרבה וכן את העובדה שמדובר במספר רב של שינויים גנטיים שכל אחד אחראי רק על אחוז קטן מהמקרים. כמו כן, בעבודות רבות נמצאו שינויים ברמת הגנום בילדים עם אוטיזם.
קיימים חידושים בתחום זה וגובשו המלצות לבירור הגנטי באוטיזם.
סיווג הפרעות מקשת האוטיזם
קבוצת ההפרעות מקשת האוטיזם היא קבוצה שכיחה והטרוגנית של הפרעות נוירו-התפתחותיות. מדובר בתסמונת קלינית המתאפיינת בהפרעה בתחום החברתי, השפתי והתקשורתי, בהתנהגות סטראוטיפית וחזרתית ובהפרעה בכישורים החברתיים המאובחנת לפני גיל 3 שנים. הקשת כוללת:
- אוטיזם קלאסי
- תסמונת אספרגר, המוגדרת כהפרעה אוטיסטית פחות חמורה, בה השפה פחות פגועה ואין חסר קוגניטיבי משמעותי
- הפרעה התפתחותית נרחבת ללא הגדרה נוספת (PDD NOS - Pervasive developmental disorder not otherwise specified) - אבחנה זו ניתנת לחולים עם הפרעה בתפקוד החברתי שאינם עונים על כל הקריטריונים לאוטיזם בגלל גיל התחלה או תסמינים לא אופייניים.
- אוטיזם עם תפקוד גבוה[1] [2].
במשך השנים חלו שינויים בהבנת קשת האוטיזם. במאמרים האחרונים מדובר בשינוי בתפיסה שמשפיע גם על ייעול המשך המחקרים. בשנתיים האחרונות חלו שינויים משמעותיים במודל הגנטי המקובל עבור אוטיזם בקהילה המדעית.
לאחרונה, נשאלת השאלה האם הפרעות מקשת האוטיזם הן הקצה של תחום הנורמה, ומדובר בעצם בוריאנט התנהגותי קוגניטיבי, או שמא מדובר בהפרעה נוירוביולוגית מוגדרת.
תמיכה בכך שמדובר בהפרעה מוגדרת אפשר לקבל מהמחקרים על מוטציות בגנים בודדים שגורמות לאוטיזם. עם זאת, כל הגנים האלה גורמים גם בדרך כלל לדרגות שונות של פגיעה אינטלקטואלית, ממצא שמעלה את השאלה אם ניתן בכלל להפריד את שני תחומים אלה[1].
אפידמיולוגיה
תסמונת האוטיזם הקלאסי תוארה לראשונה על ידי ד"ר ליאו קנר לפני 60 שנה. אז דובר על שכיחות נמוכה יחסית של אוטיזם[3].
לאחרונה, יש עלייה מתמדת בשכיחות, וכיום מדובר בשכיחות של 1 ל-150 לידות. נשאלת השאלה האם מדובר בעלייה אמיתית או שמא האבחון השתפר ומאבחנים כיום יותר מקרים בקשת האוטיזם גם בקרב ילדים שבעבר אובחנו כלוקים בפיגור שכלי. חלק מהחוקרים מאמינים שלפחות חלק מהעלייה בשכיחות היא אמיתית. יש לציין שבכ-50% מהחולים מנת המשכל גבוהה מ-70[1].
היחס בין בנים לבנות הוא 4:1, והיחס עולה כאשר מדובר במקרים של אוטיזם עם תפקוד גבוה ואפילו מגיע ל-7:1, ואף 23:1 במקרים של אוטיזם ללא סימנים דיסמורפיים וללא ממצאים בדימות תהודה מגנטית (MRI - Magnetic resonance imaging).
בתסמונת אספרגר היחס הוא 1:10. יש לזכור שבמקרים של פיגור שכלי היחס הוא 2:1 [4].
אטיולוגיה
הסיבות להפרעות תקשורת מקשת האוטיזם מורכבות, ועד כה לא זוהה גן ספציפי האחראי לאוטיזם למרות מחקר רב בתחום. מדובר במספר גורמים אטיולוגיים:
- גורמים גנטיים
- גורמים ויראליים
- גורמים של חיסון עצמי (אוטואימוניים)
- סיבוכים מיילדותיים
סיכון החזרה במשפחה שבה ילד אחד עם אוטיזם הוא כ-5% בכל היריון. כאשר יש שני ילדים, הסיכון עולה ל-25-35%. כלומר, יש מרכיב תורשתי ברור. עובדה נוספת המדגימה שלמרכיב התורשתי תפקיד חשוב היא ש-80-90% מתאומים זהים, כאשר לתאום אחד יש אוטיזם, גם אצל התאום השני מאובחן אוטיזם[2],[4],[5]. עובדה נוספת המעידה על חשיבות המרכיב הגנטי היא שבמשפחות בהן יש מקרה של אוטיזם, ניתן למצוא קווים אוטיסטיים קלים או הפרעות נפשיות בשכיחות מוגברת אצל קרובי המשפחה[6].
לאחרונה, יש דיווחים על עלייה בשכיחות האוטיזם כאשר גיל האב גבוה[1]. עם זאת, העובדה שאין 100% אוטיזם בתאומים זהים, מדגישה שלגורמים סביבתיים ואפיגנטיים (Epigenetic) תפקיד חשוב בביטוי האוטיזם. אפיגנטיקה היא השינויים ב-DNA שנוצרים לא בעקבות מוטציה ב-DNA אלא דרך השפעה על תפקוד ושינוי פעילות החלבון.
בהבט הנוירופתולוגי אין פנוטיפ דימותי אופייני, אבל יש מספר מאפיינים הראויים לציון, כמו גדילה מואצת של המוח בתחילת החיים וכן שינויים עדינים במבנה האונות הפרונטליות והטמפורליות והאמיגדלה בחלק גדול מהמקרים [1].
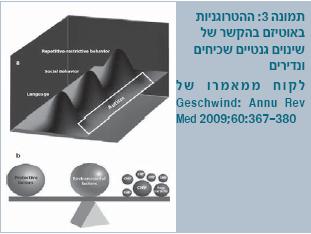
אין ספק, שהגורמים הגנטיים הם מרכיב בעל משקל רב, אולם כיום לא ניתן לקבוע מה מהחלקים הגנטיים מורש, ואיך נקבע הפנוטיפ. מדובר, קרוב לוודאי, באטיולוגיה רבת-גורמים עם פקטורים גנטיים, אפיגנטיים וסביבתיים (תמונה 1).
התפתחויות בהבנת המרכיב הגנטי
מחקרים במשפחות של לוקים בהפרעות מקשת האוטיזם תומכים בגישה שההפרעה האוטיסטית מורכבת ממספר מרכיבים נפרדים הקיימים בדרגות שונות בבני המשפחה הבריאים של החולים האוטיסטים. הפרעות קלות בתכונות אלה שהן המרכיבים של ההפרעה האוטיסטית, כמו: שפה, תפקוד חברתי והתנהגות, קיימות בשכיחות גדולה יותר אצל הורים ואחאים של אוטיסטים מאשר באוכלוסייה הכללית[7]. הדבר נכון גם לגבי אבחנות פסיכיאטריות, ביניהן הפרעות קשב וריכוז והיפראקטיביות, הנמצאות בשכיחות גבוהה יותר בחולים עם אוטיזם כתחלואה נלווית.
מכאן עולה ההנחה שחלק משמעותי מהנטייה הגנטית לפתח הפרעות מקשת האוטיזם קשור לאותם גורמים המווסתים את התפקוד הקוגניטיבי וההתנהגותי באוכלוסייה הכללית. לכן, ניתן לומר ששילוב של פקטורים גנטיים המעורבים בשפה ובכישורים חברתיים והתנהגותיים מהווה נטיית יתר להתפתחות אוטיזם, כמו שמודגם בתמונה 3.
מודל זה נתמך על ידי התצפית שמרכיבי הליבה של אוטיזם, דהיינו: הפרעות השפה, כישורים חברתיים וההתנהגות החזרתית, גם הם עוברים בתורשה באוכלוסייה הכללית[1] [8].
מודל זה, המבוסס על תפיסה פנוטיפית כמותית, הוביל במספר מקרים לזיהוי גנים ספציפיים, כמו הגן CNTNAP2 (Contactin-associated protein-like 2), המעורב באוטיזם עם פנוטיפ אופייני של פגיעה שפתית ספציפית. אותו אזור בגנום המכיל גן זה נמצא קשור לאותה הפרעת שפה ללא קווים אוטיסטיים[7]. החוקרים ממליצים לשים את הדגש על הפנוטיפים השונים הן מבחינה קלינית, הן מבחינה אלקטרו-פיזיולוגית והן מבחינה דימותית, ולחקור את הקשר שלהם לביטוי הגנים השונים. באמצעות מחקר כזה תתאפשר הבנה של הבסיס הגנטי לאוטיזם והבנה של הפתופיזיולוגיה בהקשר להפרעות אחרות של מערכת העצבים המרכזית.
מחקרים גנטיים רבים העוסקים באסוציאציה (Genome association) ובארגון מחדש (Genome rearrangements) בגנום מתבצעים במקומות שונים בעולם כדי לזהות גנים או פולימורפיזם המעלים את הסיכון לפתח אוטיזם[6],[9],[10],[11].
בספרות יש מאמרים ודיונים רבים של נוירולוגים, רופאים התפתחותיים, פסיכיאטרים וגנטיקאים לגבי הבירור הגנטי באוטיזם, במיוחד בשנים האחרונות עם הופעת הטכנולוגיות המולקולריות החדשות ובעקבותיהן הממצאים הגנטיים החדשים באוטיזם.
יש להתעדכן במחקרים האחרונים בתחום זה, ולעקוב אחר הגישה המומלצת לבירור.
תסמונות גנטיות בהן ניתן לראות סממנים אוטיסטיים (Syndromic autism)
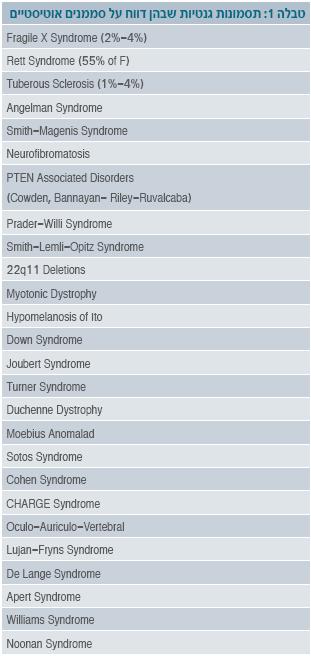
בכ-10% מהמקרים של אוטיזם ניתן למצוא את האטיולוגיה, והיא קשורה בדרך כלל לתסמונת או למום מולד. יש תסמונות רבות שבהן דווח על תסמינים אוטיסטיים (טבלה 1). הבולטות מבין התסמונות הן תסמונת ה-X השביר, תסמונת רט וטרשת קרשתית (Tuberous sclerosis).
בתסמונת ה-X השביר ניתן למצוא קווים אוטיסטיים בכ-30% מהמקרים. עם זאת, רק אצל 2-3% מהילדים עם אוטיזם הסיבה היא מוטציה בגן FMR1 (Fragile X mental retardation 1) האחראי לתסמונת ה-X השביר. מומלץ לבצע בדיקה של הגן בכל מקרה עם אוטיזם.
בתסמונת רט, השכיחה יותר בבנות, דווח על אוטיזם באחוז גבוה, לכן מומלץ לבדוק את הגן MECP2 (Methyl CpG binding protein 2) אצל בנות עם אוטיזם, במיוחד כאשר יש ממצאים נוספים, כמו עצירה בגדילת הראש.
אולם, אצל מרבית הילדים עם אוטיזם לא מוצאים קווים דיסמורפיים, אין ממצאים בעור או במערכות אחרות, ומדובר בהפרעה מבודדת. במקרים אלה הסיכוי למצוא את האטיולוגיה הוא נמוך.
לאחרונה דווח על ילדים עם אוטיזם והקף ראש גדול על רקע מוטציה בגן PTEN (Phosphatase and tensin homolog). גן זה אחראי על מספר תסמונות, וביניהן תסמונת קאודן (Cowden syndrome) ותסמונת בנייאן-ריילי-רובלקאבה (Bannayan-riley-ruvalcaba syndrome)[12].
שינויים כרומוזומליים באוטיזם
מחקרים רבים בשנתיים האחרונות שנעשו על דנ"א שנלקח מחולים עם אוטיזם בשיטות מערך דנ"א של כל הגנום (Whole genome DNA microarray) הראו ממצאים משמעותיים הקשורים בשינויים כרומוזומליים בחלק מהחולים. במחקרם של Sebat וחב' נמצאו שינויים במספר העותקים (CNVs - Copy-number variations) ב-10% מהמקרים הספורדים של אוטיזם, ורק ב-2% ממקרים משפחתיים[9]. Jacquemont וחב' מצאו שינויים כאלה בכ-20% מחולים עם אוטיזם שהיו גם דיסמורפיים ולקו בפיגור שכלי[10]. כלומר: נמצאו שינויים כאלה הן במקרים של אוטיזם המלווה בפיגור שכלי והן במקרים ללא פיגור שכלי וללא סימנים דיסמורפיים.
יש מספר אזורים כרומוזומליים ששינויים בהם נמצאים בשכיחות רבה יותר בחולים עם אוטיזם - נמצאו 0.5-1% מהמקרים בכל אחד מהאזורים הבאים:
- חסרים והכפלות בכרומוזום 15 באיזור q11-13
- חסרים בכרומוזום 22 באזור q11-13
- חסרים בכרומוזום 16 באיזור p11-1
אולם, עדיין במרבית המקרים מדובר בשינויים רבים הייחודיים לכל חולה. נוסף על כך, לא ברור אם שינויים אלה הם הגורמים היחידים לאוטיזם, כי מדובר בשינויים שכיחים יחסית הקיימים אצל שני המינים, עובדה שלא יכולה להסביר את היחס המוטה של זכרים לנקבות.
יכול להיות ששינויים אלה מהווים נטייה מוקדמת כגורמי סיכון, ונחוצים גורמים נוספים, סביבתיים ואפיגנטיים שמשפיעים על הופעת האוטיזם.
לאחרונה פורסם בכתב העת Nature מחקר על כ-100 ילדים עם אוטיזם בהשוואה ל-1,200 ילדים בריאים תואמי גיל שבדק שינויים נדירים במספר העותקים בגנום (<1%), בשתי הקבוצות בשיטות מולקולריות חדשות - מערכי בדיקת גנטית בצפיפות גבוהה (Dense genotyping arrays). אצל החולים נמצא אחוז גבוה יותר של שינויים במספר העותקים בגנום, במיוחד באתרים שכבר דווחו קודם במקרים של אוטיזם ו/או של פיגור שכלי.
חלק מהשינויים היו שינויים חדשים (De novo) וחלקם משפחתיים. חלקם כללו גנים ספציפיים הקשורים לאוטיזם וכן שינויים במספר העותקים בגנום שגרמו להפרעה בתפקוד של גנים המעורבים בשגשוג (פרוליפרציה), הטל (פרויקציה) ותנועתיות וכן של גנים במסלול של GTPase/Ras[13].
בניגוד למחקרים העוסקים בשינויים כרומוזומליים מבניים, מחקרי התאחיזה והאסוציאציה לא הוכיחו פריצת דרך בנושא. יכול להיות שהסיבה היא ההטרוגניות הרבה של האוטיזם מבחינה פנוטיפית וגנטית וכן גודל המדגמים. ניתן להשוות זאת למחקרים הגנטיים בסוכרת מסוג 2.
סיבות מונוגנטיות לאוטיזם
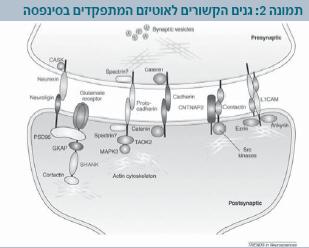
יש דיווחים על מספר גנים שמוטציות בהם נמצאו בחולים עם אוטיזם. יש קבוצה של גנים שמתפקדים בסינפסה (תמונה 2) ביניהם:
- נוירוליגינים: אלו הן מולקולות מסוג צמדני תא (Cell adhesions), הנמצאות באזורים הבתר-סינפטיים הקשורים גם לגלוטמט וגם לרצפטורים של GABA (Gama amino butiric acid). הם מעורבים ביצירת מבנים בתר-סינפטיים באקסונים.
ידועים חמישה גנים המעורבים ביצירת חלבונים אלה: NLGN1 ,NLGN3 ,NLGN4 ,NLGN4Y (4Y ,4 ,3 ,Neuroligin-1) הקשורים לרצפטורים של גלוטמט, ו-NLGN2 הקשור ל-GABA.
הגנים נוירוליגין 3 ו-4 נמצאים על כרומוזום X.
יש לציין שמוטציות בגנים אלה נמצאו באחוז קטן מאוד של אוטיסטים וגם בחולים עם פיגור שכלי ללא אוטיזם, בחולים עם תסמונת אספרגר וכן בהפרעה התפתחותית נרחבת ללא הגדרה נוספת. בכולם לא היו סימנים דיסמורפיים. לנוכח השכיחות הנמוכה מאוד של המוטציות והיעדר ממצאים המחשידים למעורבות של גנים אלה, אין המלצה לבדוק גנים אלה בחולים עם אוטיזם לא תסמונתי[2]. - גן נוסף שנמצאו בו מוטציות בחולים עם אוטיזם הוא SHANK3 (SH3 and multiple ankyrin repeat domains 3). במקרה זה הפנוטיפ התאפיין בהפרעות קשות בדיבור ובעיה חברתית[2].
- נוירואקסינים: אלו גנים המתפקדים גם הם בסינפסה ביחסי גומלין עם הנוירוליגינים. בגן Neuroexin 1 נמצאו מוטציות באוטיסטים עם בעיית שפה וללא בעיית שפה.
- HOXA1 (Homeobox A1): גן אשר נמצאו בו מוטציות רצסיביות, ולכן ניתן לחשוב עליו כאשר ההורים קרובי משפחה.
- MECP2: גן שתוארו בו מוטציות רבות בחולות בתסמונת רט וגם במקרים של אוטיזם ובמקרים של פיגור שכלי הקשור בכרומוזום X.
- PTEN: גן שתואר במקרים של אוטיזם וענקות הראש (מקרוצפליה)[12].
יש לציין שכל מוטציה ספציפית בגן ספציפי שתוארה עד היום נמצאה בפחות מאחוז אחד מהמקרים. ממצא המעיד שמדובר בהטרוגניות רבה ביותר.
ממצאים אלה תומכים במנגנון המדבר על מוטציות נדירות בעשרות גנים שגורמים להופעת האוטיזם. כלומר, אצל כל ילד אוטיסט יש שינוי נדיר אחר, שגרם אצלו לתופעה.
לאחרונה, מדובר גם על התפקיד של מוטציות חדשות (De novo mutations) באוטיזם ובסכיזופרניה, ובעבודות האחרונות, המנצלות את ההתקדמות הטכנולוגית הרבה בתחום הריצוף (Deep sequencing), בודקים את השכיחות והקצב של הופעת המוטציות האלה לעומת אוכלוסייה בריאה[14].
המלצות לבירור בילדים עם אוטיזם
- לקיחת אנמנזה מפורטת
- בדיקה גופנית ונוירולוגית טובה, כולל בדיקת העור במנורת וודס (Woods lamp) בשאלה של טרשת קרשתית ומדידת היקף הראש.
- בדיקת X שביר.
- בדיקת קריוטיפ ובהמשך בדיקת היברידיזציה השוואתית (CGH-Microarray - Array-comparative genomic hybridization). כיום בדיקת ההיברידיזציה ההשוואתית אינה בסל הבריאות והיא מתבצעת במספר מקומות בארץ בעלות של כ-3,000 שקלים.
- בדיקת הגן MECP2 בבנות עם אוטיזם ופיגור שכלי.
- בדיקת הגן PTEN בילדים עם אוטיזם והיקף ראש הגדול ב-3 סטיות תקן ומעלה מהמתאים לגילם.
- בדיקת הגן HOXA1 במקרים של קרבת דם בין ההורים.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Geschwind DH. Advances in autism. Annu Rev Med 2009;60:367-380
- ↑ 2.0 2.1 2.2 2.3 Muhle R, Trentacoste SV, Rapin I. The genetics of autism. Pediatrics 2004;113(5):472-486
- ↑ Kanner L. Autistic disturbances of affective contact. Nerv Child 1943;2:217–250
- ↑ 4.0 4.1 Folstein SE, Rosen-Sheidley B. Genetics of autism: complex aetiology for a heterogeneous disorder. Nat Rev Genet 2001;2(12):943-955
- ↑ Lintas C, Persico AM. Autistic phenotypes and genetic testing: state-of-the-art for the clinical geneticist. J Med Genet 2009;46(1):1-8
- ↑ 6.0 6.1 Abrahams BS, Geschwind DH. Advances in autism genetics: on the threshold of a new neurobiology. Nat Rev Genet 2008;9:341–355
- ↑ 7.0 7.1 Constantino JN, Lajonchere C, Lutz M, et al. Autistic social impairment in the siblings of children with pervasive developmental disorders. Am J Psychiatry 2006;163:294–296
- ↑ Geschwind DH. Autism: many genes, common pathways? Cell 2008;135(3):391-395
- ↑ 9.0 9.1 Sebat J, Lakshmi B, Malhotra D, et al. Strong association of de novo copy number mutations with autism. Science 2007;316:445–449
- ↑ 10.0 10.1 Jacquemont ML, Sanlaville D, Redon R, et al. Array-based comparative genomic hybridisation identifies high frequency of cryptic chromosomal rearrangements in patients with syndromic autism spectrum disorders. J Med Genet 2006;43:843–849
- ↑ Szatmari P, Paterson AD, Zwaigenbaum L, et al. Autism Genome Project Consortium. Mapping autism risk loci using genetic linkage and chromosomal rearrangements. Nat Genet 2007;39:319–328
- ↑ 12.0 12.1 Herman GE, Henninger N, Ratliff-Schaub K, et al. Genetic testing in autism: how much is enough? Genet Med 2007;9(5):268-274
- ↑ Pinto D, Pagnamenta AT, Klei L, et al. Functional impact of global rare copy number variation in autism spectrum disorders. Nature 2010;466(7304):368-372
- ↑ Awadalla P, Gauthier J, Myers RA, et al. Direct measure of the de novo mutation rate in autism and schizophrenia cohorts. Am J Hum Genet 2010;87(3):316-324
קישורים חיצוניים
- הבירור הגנטי באוטיזם, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר דורית לב, המכון הגנטי, המרכז הרפואי ע"ש אדית וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק