מחלת גושה - Gaucher's disease
| מחלת גושה | ||
|---|---|---|
| Gaucher's disease | ||
| 250px | ||
Acid beta-glucosidase
| ||
| ICD-10 | Chapter E 75.2 (ILDS E75.220) | |
| ICD-9 | 272.7 | |
| MeSH | D005776 | |
| יוצר הערך | פרופ' איין כהן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות אגירה
מחלת גושה היא מחלת אגירה ליזוזומלית המועברת בתורשה אוטוזומלית רצסיבית. זוהי מחלה פן-אתנית עם שכיחות גבוהה במיוחד ביהודים אשכנזים. למרות שכיחותה הגבוהה יחסית באוכלוסיה היהודית אשכנזית ומודעות בקרב הקהילה הרפואית, עדיין ניתן להיתקל במקרים של אבחון מאוחר.
מחלת גושה נגרמת כתוצאה מפגם בתפקוד האנזים הליזוזומלי גלוקוצרברוזידאז (glucocerebrosidase). פגיעה זו גורמת לאגירה של חומר שומני סוכרי בשם גלוקוצרברוזיד (glucocerebrosidase) בתאים מקרופאג'יים, הנקראים תאי גושה. תאי גושה מצטברים בעיקר בטחול, בכבד ובעצמות וגורמים לתסמיני המחלה המתאפיינים באנמיה, טרומבוציטופניה, הגדלה של הכבד והטחול ומחלת עצם המתבטאת בכאבי עצמות, אוסטיאופרוזיס, שברים, עיוותי עצם ותמת של עצמות עקב נקרוסיס.
משנת 1991 הטיפול המקובל במחלת גושה הוא הטיפול באנזים חליפי. טיפול זה שינה את פני המחלה והיווה פריצת דרך מדעית בתחומו. מאז, התפתחו טיפולים נוספים באנזים חליפי למחלות שונות ואף למחלת גושה. בשנה האחרונה אושר בעולם טיפול חדשני נוסף למחלת גושה. טיפול פומי במעכב סובסטרט. אבחון המחלה הוא פשוט ומבוצע על ידי בדיקת דם פשוטה הבודקת את רמת פעילות האנזים בתאי הדם. לאור שכיחותה הגבוהה בקרב יהודים והטיפול היעיל והבטוח, יש חשיבות גבוהה לרמת חשד גבוהה על ידי הרופאים בישראל.
פתופיזיולוגיה
מחלת גושה נגרמת כתוצאה מפגיעה בייצורו של האנזים הליזוזומלי גלוקוצרברוזידאז. אנזים זה אחראי לפירוקו של הגלוקוצרברוזיד. הגלוקוצרברוזיד הוא ספינגוליפיד המהווה מרכיב חשוב של ממברנות התאים. בתאים נורמליים יפורק הגלוקוצרברוזיד לגלוקוז וצרמיד בליזוזום התא. הפגיעה בגלוקוצרברוזידאז גורמת לאגירת הגלוקוצרברוזיד בעיקר במקרופאג'ים המשמשים כנקאים (scavengers) של הגוף ובולעים ומפרקים תאים מתים. המקרופאג'ים העמוסים בחומר שומני נקראים תאי גושה והם נאגרים בכבד, בטחול במח העצם ולעתים אף בריאות. כתוצאה מכל סובלים חולי גושה מסימפטומים כמו הגדלה של הכבד והטחול, אוסטיאופורוזיס, כאבי עצמות, תמת של מפרק הירך וקריסת חוליות עמ"ש, אנמיה ותרומבוציטופניה. עדיין לא ברור כיצד, אבל נראה כי הגלוקוצרמיד שלא פורק הופך לחומר בשם גליקוזילספינגוזין (Lyso-GL-1) אשר רמתו גבוהה במיוחד בפלזמה של חולי גושה [1]. חומר זה גורם לירידה בפעילותם של תאים שונים.
מחלת גושה משפיעה על תאי מערכת החיסון ונמצא כי חולי גושה סובלים יותר ממיאלומה נפוצה וממצבים של גאמופאתיה (מונוקלונלית או פוליקלונלית) [2]. בחולי גושה יש ירידה בפעילותם של אוסטיאובלסטים, המתבטאת בדלדול מסת העצם ובהופעת עיוותי שלד כמו ה-Erlenmeyer flask deformity. עדות להשפעתם הטוקסית של הליפידים הנאגרים בפלזמה של חולי גושה ניתן למצוא במחלת גושה המערבת את מערכת העצבים (סוג 2 ו-3) בה נראה כי ההשפעה על המוח נובעת מהשפעתם הטוקסית של ליפידים ביואקטיביים [1].
גנטיקה ופנוטיפ
מחלת גושה מועברת בתורשה אוטוזומלית רצסיבית. מזוהות היום למעלה מ-300 מוטציות בגן כאשר הקשר בין הגנוטיפ לפנוטיפ הוא חלקי[1], [3].
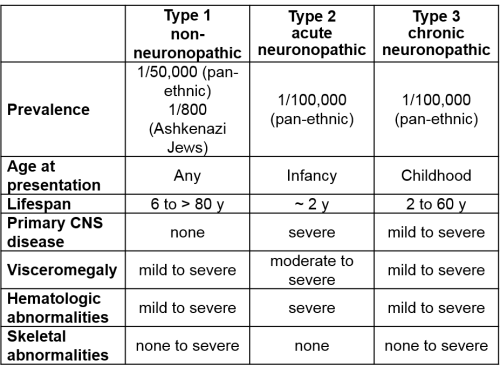
למחלה שלושה פנוטיפים עיקריים המתחלקים על בסיס רמת המעורבות של מערכת העצבים המרכזית (תמונה מס' 1). הפנוטיפים הקשים מתאפיינים במוטציות חסר הגורמות לירידה חמורה ברמת פעילות האנזים גלוקוצרברוזידאז. כאשר לפחות אחד האללים נושא מוטציה קלה המאפשרת פעילות שאריתית משמעותית תופיע תמיד מחלה קלה (מסוג 1).
- מחלת גושה מסוג 1 - non neuropathic gaucher disease - אשר אינה מערבת את מערכת העצבים ומהווה 94% ממקרי הגושה. שכיחותה בקרב האוכלוסיה היהודית אשכנזית היא 1:850 בקירוב ,לעומת 1:40,000-60,000 בעולם. המחלה מתאפיינת בסימפטומים: אנמיה, טרומבוציטופניה, הגדלה של הכבד והטחול ומחלת עצם הכוללת אוסטיאופניה, אוסטיאופרוזיס, שברים, משברי עצמות, עיוותי שלד והסננה של מח העצם בתאי גושה. שכיחותה של מחלת גושה מסוג 1 בקרב האוכלוסיה האשכנזית גבוהה משכיחותן של ממאירויות המטולוגיות (Mistry 2011).
- מחלת גושה מסוג 2 - acute infantile neuropathic Gaucher disease - מחלה עם מעורבות קשה של מערכת העצבים המרכזית המהווה כ-1% ממקרי הגושה [4]. שכיחותה מוערכת כ-1:150,000 ותוחלת החיים אינה עולה על שלוש שנים. במחלה זו מתגלים הסימנים הנוירולוגיים במהירות והתקדמות המחלה מהירה עם מוות כעבור תשעה חודשים בממוצע. הסימפטומים האופייניים כוללים: ניוון מהיר של חלקו הקדמי של גזע המוח, פיגור פסיכומוטורי קשה, התקפים הכוללים רעידות ופרכוסים, פזילה או חוסר תיאום של העיניים, אשר יכול לגרום להפסד בחדות ראייה, כמו גם סימנים בולברים (bulbar signs) הכוללים התקפי חנק, דום נשימה וקושי בבליעה וסימנים פירמידליים הכוללים opisthotonus (גב קמור), retroflexion (כיפוף לאחור) וצביטת לסתות. בחולים אלה נראה גם הגדלה של הכבד והטחול ולעתים גם אנמיה ותרומבוציטופניה. חולים אלה לא סובלים ממחלת העצם האופיינית לגושה מסוג 1 או 3.
- מחלת גושה מסוג 3 - מחלה המערבת את מערכת העצבים המרכזית אך מתפתחת לאט. פנוטיפ זה יופיע אצל כ-5% מחולי הגושה [4]. חומרת המחלה הנה וריאבילית. לעתים יאובחנו חולים אלה כחולים עם Type-1 ויפתחו סימנים נוירולוגיים אופייניים רק בהמשך החיים. בחולים אלה ניכרת מחלה ויסרלית הדומה לזו המופיעה בחולים מסוג 1 (כולל מחלת עצם). הסימפטומים הנוירולוגיים כוללים: שיתוק של עצב הראייה, עיניים מרצדות, התקפי עוויתות ואפילפסיה מיוקלונית מתקדמת אשר עלולים להופיע בחלק מהחולים. דמנציה ואטקסיה נצפו בשלבים המאוחרים יותר [5].
תת סוג של מחלה זו אופייני לחולים הומוזיגוטים למוטציה D409H ומתאפיין בהסתיידות של המסתמים המיטרליים והאורטליים, הגדלה של הטחול, עכירות של הקרנית ו-supranuclear ophthalmoplegia[3]. תועדו מספר מקרים של מחלה זו בקרב ערביי ישראל.
המוטציות השכיחות ביותר בישראל הן: N370S, 84GG, IVS2+1, D409H, L444P, V394L[6] כאשר הנפוצה ביותר היא ה-N370S המצויה בקרב 70% מנושאי המוטציות בגן. מוטציה זו גם מגנה מפני פנוטיפ עם מעורבות נוירולוגית. לעומתה, המוטציה L444P, המופיעה ללא מוטציה נוספת מסוג N370S, תגרום בהכרח למחלת גושה מסוג 3.
מהלך המחלה
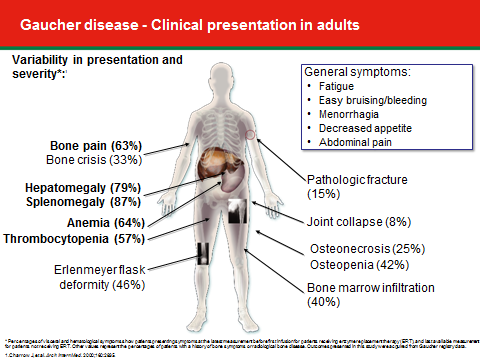
מחלת גושה מסוג 1 היא מחלה רבגונית. תיתכן שונות בעוצמת הופעת הסימפטומים גם בין שני אחים הנושאים אותן מוטציות ואף בין אחים תאומים מונוזיגוטיים [7]. חולים סימפטומטיים נחשבים חולים שבהם מופיע אחד או יותר מהסימפטומים הבאים (תמונה מס' 2): הגדלה של הכבד ו/או הטחול מעבר לנורמה, אנמיה, טרומבוציטופניה, ירידה בצפיפות העצם, אוסטיאופניה או אוסטיאופורוזיס, הסננה של מח העצם עם תאי גושה (ניתן לבחון באמצעות MRI), עיוותי עצם, כאשר האופייני ביותר הוא ה-erlenmeyer flask deformity , שברים, תמת מפרקים (בעיקר מפרק הירך), עיכוב בגדילה ובהתפתחות המינית בילדים, הפלות או דמם בזמן מחזור ועייפות הנפוצה מאוד בקרב חולי גושה. בחולים שעברו כריתת טחול תיראה הסננה חמורה יותר של תאי גושה למח העצם ועל כן מחלת העצם תחמיר [8]. גם בחולים שלכאורה ייחשבו לאסימפטומטיים ניתן יהיה למצוא חלק מהסימפטומים שצוינו בדרגת חומרה קלה.
מחלת גושה יכולה להתבטא בגילאים שונים, בעוצמות שונות ובאיברים שונים. היא יכולה להופיע כמחלת עצם דומיננטית או כמחלה המטולוגית [9].
מן המידע שהצטבר ב-22 שנות טיפול באנזים החליפי imiglucerase, נראה כי מרבית הסימפטומים משתפרים באופן משמעותי ואף נמנעים תחת הטיפול באנזים זה [10].
אבחון
במחקר שבחן את המודעות למחלת גושה בקרב המטולוגים נמצא כי רק 20% מההמטולוגים העלו חשד לגושה באבחנה המבדלת של חולה המתייצג עם טרומבוציטופניה, טחול וכבד מוגדלים וכאבי עצמות. החשד העיקרי היה לוקמיה, לימפומה ומאלומה נפוצה [11]. גם בישראל ולמרות המודעות הגבוהה יחסית למחלת גושה, עדיין ניתן למצוא חולים אשר מאובחנים באיחור וסובלים במשך שנים מתסמיני המחלה. בשנים האחרונות פורסמו אלגוריתמים דיאגנוסטיים לאבחון מחלת גושה [12], [13] ולאחרונה פורסם מאמר אשר עשה שימוש באלגוריתם האבחוני במבוגרים ומצא כי 4% מהחולים המופיעים עם טחול מוגדל עם או בלי טרומבוציטופניה הם חולי גושה [7]. מאמר זה עסק באוכלוסיית חולים באיטליה. בישראל, שבה שכיחות המחלה גבוהה באופן משמעותי מזו הקיימת בעולםף אחוזים אלה עלולים להיות גבוהים יותר.
מעבר לסימפטומים שתוארו בתמונה מס' 2, ניתן למצוא סימנים מחשידים לגושה גם בבדיקות הדם. מרבית חולי גושה יבטאו ערכים גבוהים של serum Angiotensin Converting Enzyme, עלייה בפריטין ורמות נמוכות של HDL-Cholesterol[14].
יש לשלול מחלת גושה בחולים המופיעים עם טחול מוגדל עם או בלי טרומבוציטופניה במקביל לשלילת מחלות כמו ממאירויות המטולוגיות, טלסמיה, אנמיה המוליטית, טרומבוציטופניה פורפורה ו-Portal hypertension.
ביופסיית מח עצם אינה מהווה את ה-gold standard לאבחון מחלת גושה ובאספירציה ניתן לפספס תאי גושה. לשם אבחון מחלת גושה יש לבצע בדיקת דם הבוחנת את רמות פעילות האנזים בלויקוציטים [13]. בדיקת זו ניתן לבצע גם באמצעות דם יבש על ניירות גוטרי (Dry blood spots)[15]. בדיקת הדם אינה יעילה לאבחון נשאים למחלה ולפיכך נשאות ניתן לבדוק רק בבדיקה גנטית [1].
טיפול
קיימות שתי אפשרויות טיפוליות במחלת גושה הפועלות בשני מנגנונים שונים: טיפול באנזים חליפי או טיפול במעכב סובטרט. בישראל, בינתיים רק הטיפול באנזים חליפי זמין, אך טיפול פומי חדש במעכב סובסטרט אושר לאחרונה בארצות הברית, באירופה וביפן.
הטיפול באנזים חליפי - קיים באופן מסחרי משנת 1991 והוכיח עצמו כיעיל ובטוח. הטיפול באנזים החליפי סרזיים נמצא כמונע את רוב הסיבוכים של המחלה [16], [17]. הוא ניתן פעם בשבועיים בעירוי ומגיע באופן סלקטיבי לליזוזום, שם נאגר הגלוקוצרברוזיד. ניתן לקבל את הטיפול במסגרת טיפולי בית.
טיפול זה שינה את פני המחלה, מנע את הצורך בכריתת הטחול והפך אותה למחלה שניתן לחיות עימה. מהמידע רב השנים שהצטבר במהלך שנות קיומו של הטיפול בסרזיים נראה כי בחולים המקבלים טיפול הודגמה הקטנה של הכבד והטחול, שיפור (לעתים עד תחום התקין) בספירת דם, במסת העצם במבוגרים וילדים, שיפור בגדילה בילדים ותיקון גיל העצמות. חולים אלה מפסיקים לסבול מנטייה לדמם, התקפי העצמות החריפים נוטים להיעלם (אם היו בעבר), למרות שכאבי עצמות יכולים להמשיך להופיע. החשוב מכל הוא שלרוב לא מופיעים שברים חדשים ונמנע נזק בלתי הפיך בעצמות. נזק שכבר קיים, כגון תמט של ראש הפמור או שברים בחוליות, הינו נזק בלתי הפיך שלא ייעלם עם הטיפול התרופתי. עדיין יש צורך בהתערבות אורטופדית בחולים שלא זכו לקבל טיפול אנזימתי בזמן ופיתחו סיבוכים אלה.
בנוסף ליעילות המרשימה יש לציין את רמת הבטיחות הטובה מאוד, מיעוט תופעות לוואי משמעותיות, יכולת לקבל האנזים בבית ואף לנשים בגיל הפוריות אפשר (ולעתים מומלץ למניעת סיבוכים מילדותיים) לקחת את האנזים במהלך ההריון וההנקה.
בחמש השנים האחרונות נוספו בנוסף לסרזיים (Cerezyme) עוד שני אנזימים: ויפריב (Vpriv) ואלליזו (Elelyso). בשלושת הטיפולים, המינון מותאם לחולה תוך בחינת מתמדת של עצירת ההידרדרות ושיפור המדדים ההמטולוגיים, הויסרליים והגרמיים. בישראל הטיפול באנזים החליפי ממומן על ידי משרד הבריאות. מטרת הטיפול היא, בין היתר, למנוע נזקים בלתי הפיכים, ולכן חשיבות רבה לאבחון מוקדם.
הטיפול במעכב סובסטרט - הטיפול במעכב סובסטרט מתבסס על מתן אנאלוג לא פעיל לאחד ממרכיבי הסובסטרט אשר מתחרה על האנזים המייצר את הסובסטרט ובעצם מפחית את כמות הסובסטרט המיוצרת. באופן זה הכמות המעטה של האנזים המוטנטי המפרק את הסובסטרט בגופו של החולה מספיקה כדי לפרק את מעט הסובסטרט שנוצר. הגלוקוצרברוזיד מורכב מגלוקוז וצרמיד. בעבר אושר מעכב הסובסטרט מיגלוסטט, miglustate, אשר הוא אנלוג של גלוקוז, אך פרופיל הבטיחות שלו היה לא טוב ולכן הוא אינו בשימוש בישראל והשימוש בו בעולם הינו מועט ביותר. בשנת 2014 אושרה התרופה Cerdelga המכילה מעכב סובסטרט שהוא אנאלוג של צרמיד ונקרא Elisglustat. טיפול זה ניתן בישראל רק במסגרת מחקרית.
קיימים נסיונות נוספים לייצר טיפולים פומיים או טיפולים החודרים את מחסום הדם מוח, אך בינתיים ללא הצלחה.
טיפולים סימפטומטיים שאינם ספציפיים לגושה - חולי גושה סובלים ממחלת עצם הנובעת מהסננת מח העצם בתאי גושה. ניתן לטפל באוסטיאופורוזיס על רקע גושה על יד מתן BISPHOSPHONATES.
לצורך טיפול בהתקף עצמות חריף, בנוסף לטיפול באנזים החליפי, חשוב להתחיל מיד במינונים גבוהים של סטרואידים שמפחיתים מיידית את הכאב החריף. טיפול זה יכול למנוע שבועות של אשפוזים עם כאבים בלתי נסבלים אשר יציבים אפילו לטיפול במורפין [18]. המחשבה היא כי הסטרואידים מפחיתים את הבצקת שמתחת לפריאוסט וכך מורידים משמעותית ומיידית את הכאב החריף בעצמות.
לרופא המשפחה תפקיד חשוב במעקב התקופתי אחרי חולה הגושה ואף חשוב לשמור על קשר עם מרפאת הגושה וחשוב לדאוג שהחולה יבקר במרפאת הגושה לפחות פעם בשנה להערכת מצב מחלתו ובאים הוא מטופל באנזים חליפי, תיערך גם בדיקת הגעתו ליעדים הטיפוליים. קשר זה יאפשר מתן טיפול אופטימלי.
- מרכזי טיפול בישראל
בגלל השכיחות הגבוהה של חולי גושה ביהודים אשכנזים, קיימים שלושה מרכזים המטפלים בחולים בבתי החולים שערי צדק, בילינסון ורמב"ם ומרפאת גושה נוספת בצפון אשר מטפלת בחולי גושה של קופות החולים כללית ומכבי. במרכזים אלה עובדים רופאים המתמחים בטיפול בחולי גושה ושמחים לסייע באבחון ובטיפול של חולים מכל רחבי הארץ.
סיכום
מחלת גושה היא מחלה גנטית נדירה השכיחה בישראל באופן יוצא דופן. נכון להיום ידועים בערך 1,000 חולים מאובחנים כאשר בערך שליש מהם סימפטומטיים כדי להיות מטופלים באנזים חליפי. תפקידו של רופא המשפחה או ההמטולוג הוא הן בחשד הראשוני אשר יכול לסייע באבחון ובבחינת הצורך לטיפול והן בסיוע בניהול המעקב אחרי חולים מאובחנים מטופלים ושאינם מטופלים. החולים במחלת גושה, שהיתה "מחלה יתומה", זוכים היום לשלושה טיפולים יעילים באנזים חליפי ועוד מספר טיפולים המצויים בשלבי מחקר שונים.
דגלים אדומים
ביבליוגרפיה
- Charrow J, Andersson HC, Kaplan P, Kolodny EH, Mistry P, Pastores G, Rosenbloom BE, Scott CR, Wappner RS, Weinreb NJ, Zimran A. The Gaucher registry: demographics and disease characteristics of 1698 patients with Gaucher disease. Arch Intern Med. 2000 Oct 9; 160(18):2835-43
- ↑ 1.0 1.1 1.2 1.3 Baris HN, Cohen IJ, Mistry PK. Gaucher disease: the metabolic defect, pathophysiology, phenotypes and natural history. Pediatr Endocrinol Rev. 2014;12 Suppl 1:72-81
- ↑ Hughes D, Cappellini MD, Berger M, Van Droogenbroeck J, de Fost M, Janic D, Marinakis T, Rosenbaum H, Villarubia J, Zhukovskaya E, Hollak C. Recommendations for the management of the haematological and onco-haematological aspects of Gaucher disease. Br J Haematol. 2007;138(6):676-86.
- ↑ 3.0 3.1 Pastores GM, Hughes DA. Gaucher Disease. In: Pagon RA, Bird TD, Dolan CR, Stephens K, editors. GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. 2000 Jul 27 [updated 2011 Feb 01].
- ↑ 4.0 4.1 Tylki-Szymańska A1, Vellodi A, El-Beshlawy A, Cole JA, Kolodny E. Neuronopathic Gaucher disease: demographic and clinical features of 131 patients enrolled in the International Collaborative Gaucher Group Neurological Outcomes Subregistry.J Inherit Metab Dis. 2010;33(4):339-46.
- ↑ Stirnemann J. Clinical study of the French cohort of Gaucher disease patients. Rev Med Interne 2006;27 Suppl 1:S18-21.
- ↑ Horowitz M1, Pasmanik-Chor M, Borochowitz Z, Falik-Zaccai T, Heldmann K, Carmi R, Parvari R, Beit-Or H, Goldman B, Peleg L, Levy-Lahad E, Renbaum P, Legum S, Shomrat R, Yeger H, Benbenisti D, Navon R, Dror V, Shohat M, Magal N, Navot N, Eyal N. Prevalence of glucocerebrosidase mutations in the Israeli Ashkenazi Jewish population. Hum Mutat. 1998;12(4):240-4.
- ↑ 7.0 7.1 Motta I1,2, Filocamo M3, Poggiali E1,2, Stroppiano M3, Dragani A4, Consonni D5, Barcellini W6, Gaidano G7, Facchini L8, Specchia G9, Cappellini MD1,2; Splenomegaly Gaucher Disease study group. A multicentre observational study for early diagnosis of Gaucher disease in patients with Splenomegaly and/or Thrombocytopenia. Eur J Haematol. 2015
- ↑ van Dussen L, Biegstraaten M, Dijkgraaf MG, Hollak CE. Modelling Gaucher disease progression: long-term enzyme replacement therapy reduces the incidence of splenectomy and bone complications. Orphanet J Rare Dis. 2014; 9:112.
- ↑ Taddei TH, Kacena KA, Yang M, Yang R, Malhotra A, Boxer M, Aleck KA, Rennert G, Pastores GM, Mistry PK. The underrecognized progressive nature of N370S Gaucher disease and assessment of cancer risk in 403 patients. Am J Hematol. 2009;84(4):208-14.
- ↑ Weinreb NJ, Goldblatt J, Villalobos J, Charrow J, Cole JA, Kerstenetzky M, vom Dahl S, Hollak C. Long-term clinical outcomes in type 1 Gaucher disease following 10 years of imiglucerase treatment. J Inherit Metab Dis. 2013 May;36(3):543-53.
- ↑ Mistry PK1, Sadan S, Yang R, Yee J, Yang M. Consequences of diagnostic delays in type 1 Gaucher disease: the need for greater awareness among hematologists-oncologists and an opportunity for early diagnosis and intervention. Am J Hematol. 2007;82(8):697-701.
- ↑ Di Rocco M, Andria G, Deodato F, Giona F, Micalizzi C, Pession A. Early diagnosis of Gaucher disease in pediatric patients: proposal for a diagnostic algorithm. Pediatr Blood Cancer. 2014 Nov;61(11):1905-9.
- ↑ 13.0 13.1 Mistry PK1, Cappellini MD, Lukina E, Ozsan H, Mach Pascual S, Rosenbaum H, Helena Solano M, Spigelman Z, Villarrubia J, Watman NP, Massenkeil G. A reappraisal of Gaucher disease-diagnosis and disease management algorithms. Am J Hematol. 2011;86(1):110-5.
- ↑ Thomas AS1, Mehta AB, Hughes DA. Diagnosing Gaucher disease: an on-going need for increased awareness amongst haematologists. Blood Cells Mol Dis. 2013;50(3):212-7.
- ↑ Legnini E1, Orsini JJ, Hung C, Martin M, Showers A, Scarpa M, Zhang XK, Keutzer J, Mühl A, Bodamer OA. Analysis of glucocerebrosidase activity in dry blood spots using tandem mass spectrometry. Clin Chim Acta. 2011 30; 412(3-4):343-6.
- ↑ Weinreb N, Taylor J, Cox T, Yee J, vom Dahl S. A benchmark analysis of the achievement of therapeutic goals for type 1 Gaucher disease patients treated with imiglucerase. Am J Hematol. 2008;83(12):890-5.
- ↑ Kaplan P, Baris H, De Meirleir L, Di Rocco M, El-Beshlawy A, Huemer M, Martins AM, Nascu I, Rohrbach M, Steinbach L, Cohen IJ. Revised recommendations for the management of Gaucher disease in children. Eur J Pediatr. 2013 Apr;172(4):447-58.
- ↑ Cohen IJ.Re: The effect of enzyme replacement therapy on bone crisis and bone pain in patients with type 1 Gaucher disease. Clin Genet. 2007;72(2):160
קישורים חיצוניים
- מחלת גושה בילדים בישראל, מדיקל מדיה
- מחלת גושה, האבחון והטיפול בה
המידע שבדף זה נכתב על ידי פרופ' איין כהן - מרפאת גושה, המכון הגנטי ע"ש רקאנטי, המרכז הרפואי בילינסון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק