אינטרלויקין 5 Interleukin
| מדריך בדיקות מעבדה | |
| אינטרלויקין 5 | |
|---|---|
| Interleukin 5 | |
| שמות אחרים | IL-5, EDF, BCDFII, TRF, eosinophil differentiation factor, T-cell ,replacing factor B cell differentiation factor I. |
| מעבדה | ביוכימיה בדם |
| תחום | ציטוקין המעורב בתפעול מערכת החיסון |
| טווח ערכים תקין | ריכוז ערכים ממוצע של IL-5 במבוגרים הוא 4.4 פיקוגרם/מ"ל בטווח שבין 2.99 ל-6.51 פיקוגרם/מ"ל. ממוצע ערכים בילדים בטווח הגילים שבין 5-15 שנה, 0.544 פיקוגרם/מ"ל. על פי Mayo Clinib Labs הטווח התקין בילדים נמוך מ-1 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכה של מפגעים הכרוכים עם היפר-אאוזינופיליה, ובירורים הקשורים לאבחון וניטור אסתמה.
המבנה של IL-5
IL-5 הוא פוליפפטיד בן 134 חומצות אמינו ומשקל מולקולרי של 12,500 דלטון. IL-5 מופרש על ידי מספר מוגבל של תאים מזנכימאליים (Yokuta וחב' ב-Proc Natl Acad Sci USA משנת 1987 ו-Tavernier וחב' ב-DNA משנת 1989). בצורתו הטבעית, IL-5 בשל מסונתז כמולקולה בת 115 חומצות אמינו, שהיא מונומר בגודל 22,000 דלטון, עם שיירים סוכריים מאוד נרחבים, היוצר עם מונומר זה הומודימר במשקל מולקולרי של 40-50,000 דלטון עם קישור די-סולפידי (Proudfoot וחב' ב-Biochem J משנת 1990). ל-IL-5 מונומרי אין כל פעילות, כאשר ההומודימר נדרש לפעילות הביולוגית (Takatsu ו-Tominaga ב-Prog Growth Factor Res משנת 1991). זאת בניגוד לציטוקינים IL-3 ו-GM-CSF הקיימים רק כמונומרים (Schrader ב-Ann Rev Immunol משנת 1986, ו-Wong וחב' ב-Science משנת 1985). הומודימר אחד של IL-5 נקשר לקולטן בודד אחד, והוצע שדימר של IL-5 עובר שינויי מבנה לאחר שהוא נקשר לקולטן בודד, ושינוי מבנה זה מאפשר קישור לקולטן נוסף (Verschelde וחב' ב-FEBS Lett משנת 1998). קיימת הומולוגיה של 71% בין חומצות האמינו של אדם ועכבר (Azuma וחב' ב-Nucleic Acid Res משנת 1986, ו-Kinashi וחב' ב-Nature מאותה שנה). בעוד ש-IL-5 ממקור עכבר פעיל מאוד על תאי אדם, IL-5 ממקור אדם פעיל רק באופן שולי בתאי עכבר (Plaetinck וחב' ב-J Exp Med משנת 1990).
ביטוי רקמתי של IL-5
הגן המקודד ל- IL-5 ממוקם על כרומוזום 11 בעכבר, ועל כרומוזום 5 באדם (בעמדה 5q31.1), בקרבת הגנים המקודדים לציטוקינים ,IL-3 IL-4 ו-GM-CSF (Lee וחב' ב-Somat Cell Mol Genet משנת 1989, ו-van Leeuwen ב-Blood מאותה שנה), שגם הם מבוטאים תדירות יחדיו על ידי תאי TH2. הגן מכיל 6 אקסונים. IL-5 מבוטא על ידי אאוזינופילים (Dubucquoi וחב' ב-J Exp Med משנת 1994), וכן נתגלה בשיטות אימונו-היסטוכימיות בתאי פיטום של דרכי האוויר בחולי אסתמה (Bradding וחב' ב-Am J Respir Cell Mol Biol משנת 1994). הביטוי של IL-5 מווסת על ידי מספר פקטורי שעתוק (transcription factors) כולל GATA3 (Kaminuma וחב' ב-Int Arch Allergy Immunol משנת 2005).
משמעות קלינית
IL-5 נכרך עם גרימת מספר מחלות אלרגיות כולל אסתמה ו-allergic rhinitis, בהן מוצאים עלייה במספרם של אאוזינופילים בדרכי האוויר ובכיח (Shen וחב' ב-J Immunol משנת 2003). בהתחשב בהתאמה הגבוהה בין מספר האאוזינופילים והפתולוגיה של אסתמה אלרגית, נולדה ההשערה שאאוזינופילים הם בעלי תפקיד מרכזי במנגנון הקשור לאסתמה (Sanderson ב-Blood משנת 1992). תאים אלה הם תוצר סופי של התמיינות גרנולוציטים הנמצאים ברוב היונקים. תפקידם העיקרי של אאוזינופילים בבריאות מלאה, הוא בפינוי של טפילים עליהם ספוחים נוגדנים, על ידי שחרור של חלבונים ציטוטוקסיים מתוך גרנולות התאים (Giembycz ו-Lindsay ב-Pharmacol Rev משנת 1999). כיוון שאאוזינופילים הם התאים העיקריים המבטאים את הקולטן IL-5Rα, אין זה מפתיע שהם מגיבים ל-IL-5. למעשה, IL-5 שהתגלה במקור כ-eosinophil colony stimulating factor (Lopez וחב' ב-J Exp Med משנת 1986), הוא מווסת מרכזי של הצטברות אאוזינופילים ברקמות, ואף עשוי להיות מודולטור של התנהגות האאוזינופיל בכל שלב מהבשלות ועד להישרדות. אכן, הנוגדן החד-שבטי mepolizumab המכוון כנגד IL-5, יכול להפחית אאוזינופיליה מוגזמת. בלימפומה ע"ש Hodgkin, האאוזינופיליה האופיינית הנצפית במפגע זה, מיוחסת ליצירה מוגברת של IL-5 (Di Biagio וחב' ב-Int Arch Allergy Immunol משנת 1996).
הקולטנים של IL-5
הקולטן של IL-5 שייך למשפחת type I cytokine receptors, והוא הטרודימר כאשר אחד המונומרים הוא subunit IL-5 receptor α, והמונומר השני הוא CSF2Rβ, דהיינו הקולטן מורכב משרשרת α ומשרשרת βc (Tavernier וחב' ב-Cell משנת 1991). תת היחידה α ספציפית למולקולת IL-5 (Woodcock וחב' ב- EMBO J משנת 1994, Johanson וחב' ב-J Biol Chem משנת 1995 ו-Murata וחב' ב-J Exp Med משנת 1992), ואילו תת היחידה βc מזוהה גם על ידי IL-3 וכן על ידי GM-CSF (Takaki וחב' ב-J Exp Med משנת 1993), והיא מכילה מקטעים (domains) המשמשים להעברת איתותים. הגליקוזילציה של השייר Asn196 של תת היחידה Ra חיונית לקישור של IL-5 לקולטן שלו.
תת-יחידה α: שרשרת IL-5Rα מבוטאת על ידי אאוזינופילים, חלק מהבזופילים, וכן על ידי תאי B1 או על ידי קודמנים של תאי B בעכברים. בדומה לקולטנים של ציטוקינים רבים אחרים, התהליך של alternative splicing של הגנים המקודדים לשרשרות α, גורם לביטוי של צורה הקשורה לממברנה או לצורה מסיסה של שרשרות bα. הצורה המסיסה אינה קשורה להעברת האיתותים, ולכן יש לה השפעה אנטגוניסטית על האיתות שאמור להיות מועבר על ידי IL-5 בהיקשרו לקולטן שלו על פני הממברנה. שתי הצורות המונומריות של IL-5Rα הם קולטנים בזיקה נמוכה, אך בדימריזציה עם שרשרות β נוצר קולטן עם זיקה גבוהה. בכל מקרה, שרשרת α קושרת IL-5 באופן בלעדי, והחלק התוך-ציטופלזמי של IL-5Rα קשור ל-Janus kinase 2 (להלן (JAK2, שהוא טירוזין קינאז החיוני להעברת האיתות של IL-5 (Milburn וחב' ב-Nature משנת 1993 ו-Quelle וחב' ב-Mol Cell Biol משנת1994 ).
תת-יחידה β: תת-יחידה זו אחראית להעברת האיתות, ומכילה מספר מקטעים תוך תאיים. בניגוד לשרשרת α, שרשרת β אינה קושרת IL-5, אינה ספציפית לציטוקין זה, והיא מבוטאת באופן מעשי בכל הלויקוציטים. למעשה, תת היחידה β של הקולטן ל-IL-5 נמצאת גם בקולטנים של IL-3 ושל GM-CSF, שם היא קשורה עם תת היחידות IL-3Rα ו-GM-CSFRα. לכן, תת היחידה β ידועה כקולטן β הכללי או כ-βc. בדומה לתת היחידה IL-5Rα, גם המקטע הציטופלזמי של תת היחידה β קשור באופן קונסטיטוטיבי עם JAK2, כמו גם עם Lyn, שאף הוא טירוזין קינאז, כאשר שני האחרונים חיוניים להערת האיתות של IL-5 (Ogata ב-Blood משנת 1998).
פיזיולוגיה של IL-5
IL-5 הוגדר במקור כ-"T-cell replacing factor", המופרש מתאי T לגרות יצירת נוגדנים מתאי B משופעלים (Takatsu וחב' ב-J Immunol משנת 1980). IL-5 מיוצר על ידי תאי Th2 לאחר גירוי על ידי חיידקים דוגמת M. tuberculosis או Toxocara canis או על ידי אלרגנים ועל ידי תאי פיטום ((mast cells אחר גירוי עם הקומפלקס אלרגן-IgE (Takatsu וחב' ב-Growth Factors & Cytokines in Health & Disease משנת 1997). בצורתו הפעילה, IL-5 הוא הומודימר, שה-mRNA שלו מבוטא באאוזינופילים, בתאי γδT ובתאי NK ו-NKT וכן בתאים שאינם המטו-פויאטיים (Desreumaux וחב' ב-J Exp Med משנת 1992, Moon וחב' ב-J Immunol משנת 2004, Sakuishi וחב' באותו כתב עת משנת 2007, ו-Takatsu וחב' ב-Adv Immunol משנת 1994). תאי -CD3ε, -c-kit, -CD4 ותאי +IL-2Rα ב-Peyer's patch מייצרים כמויות גדולות של IL-5 כאשר הם מגורים על ידי IL-2 (Kuraoka וחב' ב-Eur J Immunol משנת 2004).
IL-5 פועל על תאי המטרה על ידי התקשרות לקולטן הספציפי שלו IL-5R. קולטן זה מורכב משרשרת אלפא ייחודית (IL-5Rα/CD125) ומשרשרת β המשותפת לציטוקינים אחדים (βc/CD131) והוא מבוטא על פני סוגי תאים רבים, בהם הוא מעביר איתותים למגוון פונקציות (Takaki וחב' ב-EMBO J משנת 1990 ו-1991, Murata וחב' ב-J Exp Med משנת 1992, ו-Sakamaki וחב' ב-EMBO J משנת 1992). מקטע הקולטן IL-5Rα נקשר ל-IL-5, ואילו מקטע βc היא מולקולה המשותפת גם לקולטנים של ציטוקינים אחרים, כולל IL-3R והקולטן של GM-CSF. המקטע βc כשלעצמו אינו קושר אף ציטוקין, ויש לו חלק ציטופלזמי יחסית ארוך ומספר מקטעים פונקציונליים (Sato וחב' ב-EMBO J משנת 1993), והוא כרוך באופן בולט בהעברת איתותים (תמונה 1).
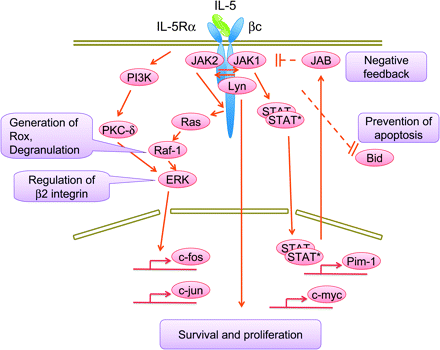
המקטע הציטופלזמי של IL-5Ralfa, , ובעיקר הרצפים שלו העשירים ב-proline הקרובים לממברנה, נדרש לשגשוג התאי המושרה על ידי IL-5, וכן להעברת האיתותים (Takaki וחב' ב-Mol Cell Biol משנת 2004, Kouro וחב' ב-Unt Immunol משנת 1996, Ogata וחב' ב-Blood משנת 1998, ו-Moon וחב' ב-Immunology משנת 2001).
IL-5 משרה את ההתמיינות הטרמינלית של תאי B משופעלים לתאים יוצרי נוגדנים בעכברים, ומעודדים שגשוג והתמיינות של תאים קודמניים לאאוזינופילים להפוך לאאוזינופילים בשלים בעכברים ובאדם. תאי B-1 נבדלים מתאי B-2 בסמני שטח הפנים שלהם, במיקומם האנטומי וביכולת של התאים לחדש את מספרם, ושני תת-סוגי תאי B אלה מבטאים באופן קונסטיטוטיבי את IL-5Rα, ובהתאם הם מגיבים ל-IL-5 להישרדות, לשגשוג ולהתמיינות לתאי פלזמה מפרישי נוגדנים (Takatsu ב-Cytokines & Growth Factor Rev משנת 1998, ו-Hitoshi וחב' ב-J Immunol משנת 1990). עכברים הומוזיגוטיים לחסר של IL-5 ולחסר של-IL-5Rα, מראים ירידה במספר תאי B-1 בפריטונאום כמו גם ירידה בתאי +slgA+ שמקורם בתאי B-1, ב-lamina propria ( (על פי Kopf וחב' ב-Immunity משנת 1996, ו-Yoshida וחב' באותו כתב-עת מאותה שנה). תאי B-2 משופעלים על ידי אנטיגן או על ידי מיטוגנים בנוכחות של תאי Th, מבטאים את הקולטן IL-5Rα והופכים לתאים המגיבים ל-IL-5 לצורך בשלותם (Mizoguchi וחב' ב-J Immunol משנת 1999, ו-Takatsu וחב' ב-Adv Immunol משנת 2009). עדיין לא ברור האם תאי B משופעלים באדם, מבטאים את הקולטן IL-IL-5Rα, , ומגיבים ל-IL-5 לצורך בשלות. אך בעכברים כמו באדם, IL-5Rα מבוטא על פני אאוזינופילים ובזופילים בשלים.
מקורם של אאוזינופילים בתאי גזע המטופויאטיים. ההשפעות של IL-5 על אאוזינופילים נכללות ב-4 קטגוריות שונות, דהיינו התמיינות, תנועתיות, שפעול והישרדות. באשר להתמיינות, IL-5 מהווה גורם המחיש התמיינות ושגשוש של תאי-אב (progenitors) (Tominaga וחב' ב-J Exp Med משנת 1991, Dent וחב' באותו כתב-עת משנת 1990, ו-Lee וחב' ב-J Immunol משנת 1997). למרות שהדבקה עם תולעים פוגעת בהשריה של יצירת אאוזינופילים, בחסר של-IL-5 או ב-IL-5R בעכברים נמצאה יצירה של אאוזינופילים, מה שמצביע על כך שגורמים או ציטוקינים אחרים מאשר IL-5 יכולים להיות כרוכים ביצירת אאוזינופילים תוך שהם מפצים על החסר ב-IL-5 או בקולטן שלו. IL-5 פועל על תאי המטרה על ידי התקשרות לקולטן הספציפי שלו IL-5R. קולטן זה מורכב משרשרת α ייחודית (IL-5Ralfa/CD125) ומשרשרת β המשותפת לציטוקינים אחדים (βc/CD131) והוא מבוטא על פני סוגי תאים רבים, בהם הוא מעביר איתותים למגוון פונקציות (Takaki וחב' ב-EMBO J משנת 1990 ו-1991, Murata וחב' ב-J Exp Med משנת 1992, ו-Sakamaki וחב' ב-EMBO J משנת 1992).
IL-5 ואסתמה
מחלות אלרגיות כולל אסתמה, מאופיינות על ידי דלקת עם הסננה בולטת של אאוזינופילים ותאי +T CD4 (על פי Kay ב-N Eng J Med משנת 2001, ו-Murphy ו-Reiner ב-Nat Rev Immunol משנת 2002). באשר לתאי הדלקת שמייחסים לאסתמה, הגיוס של תאי +Th2CD4 ושל אאוזינופילים הוא מאפיין מרכזי של התגובה האלרגית בשלביה המאוחרים (Wills-Karp ב-Ann Rev Immunol משנת 1999). ראיות מצטברות מצביעות על כך שהציטוקינים הקלאסיים הנובעים מתאי Th2 והם IL-13 ,IL-9 ,IL-5 ,IL-4 ,IL-3 ו-GM-CSF , ביחד עם eotaxin משחקים תפקידים קריטיים בהשריית ריאקטיביות-יתר בדרכי האוויר ובהתפתחות של remodeling כרוני של דופן דרכי האוויר (Asquith וחב' ב-J Immunol משנת 2008, Rothenberg ו-Hogan ב-Ann Rev Immunol משנת 2006, ו-Kay וחב' ב-Trends Immunol משנת 2004). בנוסף, ציטוקינים שזוהו, הכוללים לימפופויאטין של הסטרומה של הטימוס, וכן IL-25 ו-IL-33, כרוכים בהשריה של דלקת אלרגית באסתמה (Pandey וחב' ב-Nat Immunol משנת 2000, Lu ב-J Exp Med משנת 2006, ו-Nakajima ו-Takatsu ב-Int Arch Allergy Immunol משנת 2007).
אאוזינופילים מכילים בגרנולות שלהם חלבונים ייחודיים, הכוללים חלבון בסיסי עיקרי, פראוקסידאזה אאוזינופילית ונוירוטוקסין אאוזינופילי. בעכברים ובאדם, IL-5 משרה בשלות טרמינלית של אאוזינופילים, מאריך את ההישרדות של אאוזינופילים על ידי דחיית התהליך האפופטוטי, משתלט על הפעילות הכמוטקטית של אאוזינופילים, מגביר את הספיחה של אאוזינפילים לתאי אנדותל ומגביר את הפעילות האפקטורית של תאים אלה (Yamaguchi וחב' ב-J Exp Med משנת 1988). עם זאת, הניסיון לעכב הצטברות של אאוזינופילים בדרכי האוויר של חולי אסתמה על ידי בלימת הפעילות של IL-5, זכה להצלחה מועטה (Takatsu ו-Nakajima ב-Curr Opin Immunol משנת 2008).
רמות IL-5 בנסיוב של חולי אסתמה עיקשים קלים או מתונים גבוהות משמעותית מאלו בביקורת של נבדקים בריאים. ניסוי שכלל 32 חולי אסתמה אטופיים ו-24 חולי אסתמה לא-אטופיים, מצא רמה ממוצעת של IL-5 של 9.5 פיקוגרם/מ"ל בחולים האטופיים, ו-8.1 פיקוגרם/מ"ל בחולים הלא-אטופיים, כאשר רמתו הממוצעת בנבדקים בריאים נקבעה כ-4.4 פיקוגרם/מ"ל (0.003p<). רמות IL-5 בנבדקים אסתמתיים אטופיים ולא אטופיים לא היו שונות משמעותית. הרמה הממוצעת של IL-5 הייתה באופן לא משמעותי בקרב 14 חולי אסתמה מתונים (10.6 פיקוגרם/מ"ל, בהשוואה לרמתו ב-42 חולי אסתמה קלים (7.3 פיקוגרם/מ"ל) (p=0.13) (Joseph וחב' ב-BMC Pulm Med משנת 2004).
העברת איתותים בתיווך IL-5
מקובל שהביטוי של IL-5Rα על פני תאי מח עצם, הוא אחד הנושאים הקריטיים ביותר במחוייבות של אאוזינופילים. החלבונים הקושרים DNA ממשפחת פקטור X הרגולטורית (להלן RFX) נמצאו נקשרים ל-cis element של הפרומוטר של IL-5Rα (Iwama וחב' ב-Mol Cell Biol משנת 1999). למרות ש-Oct2 נמצא הכרחי לביטוי של IL-5Rα בתאי B (Emslie וחב' ב-J Exp Med משנת 2008), משפעל ספציפי של שעתוק IL-5Rα באאוזינופילים נותר עלום כרגע. באשר לאַסְדָרָה (downregulation) של IL-5Rα, נמצא ש-חומצה רטינואית (all-trans) מדכאת את האאוזינוגנזה על ידי אַסְדָרָה של IL-5Rα הקשור לממברנה, ומשדרגת את הצורה המסיסה של IL-5Rα (Denberg וחב' ב-Int Arch Allergy Immunol משנת 2001). סטימולציה על ידי IL-5 משרה פוספורילציה מהירה של טירוזין בחלבוני תא שונים. בין החלבונים האחרונים ניתן להזכיר את βc, HS1, SHc ו- Src-homology-2. חלבונים נוספים העוברים פוספורילציה הם JAK1 או Janus kinase 1,JAK2, Btk או Bruton agammaglobulinemia, tyrosine kinase STAT1 (או signal transducer and activator of transcription 1) STAT3 ו-STAT5, PI3K (או phosphoinositide 3-kinase) Lyn tyrosine kinase ו-MAPKs (או mitogen-activated protein kinases). פוספורילציה של מולקולות אלו לשפעול של מולקולות איתות בתוך התא (downstream) (Pazdrak וחב' ב-J Exp Med משנת 1998, ו-Sato וחב' באותו כתב עת משנת 1994). בנוסף, IL-5 משפעל את Raf-1 ואת phosphatase SHP2 (או Src-homology-2-domain-containing protein tyrosine phosphatase) (Pazdrak וחב' ב-J Exp Medicine משנת 1997).
מסלול נוסף המזוהה עם איתות של IL-5 הוא המסלול Ras-ERK (או Ras GTPase-extracellular regulated signal ) (Hall וחב' ב-Blood משנת 2001), מסלול החיוני להישרדות, שגשוג והתמיינות של אאוזינופילים המושרית על ידי IL-5. JAK2 ו-Lyn חשובים לשגשוג והישרדות התא, ואילו Raf-1 הוא בעל תפקיד מרכזי ברגולציה של תפקוד התא כגון בתהליך הדה-גרנולציה. אנליזה של המקטעים הציטופלמיים התפקודיים הקשורים לקולטן האנושי IL-5Rα , המווסתים את השפעול של JAK kinase, מגלה ש-JAK2 כרוך באופן קונסטיטוטיבי עם IL-5Rα האנושי ללא קשר לסטימולציה של IL-5. בניגוד לכך, JAK1 כרוך באופן קונסטיטוטיבי עם βc ללא קשר עם סטימולציה על ידי IL-5, והוא כרוך עם IL-5Rα אנושי רק כאשר התאים עברו סטימולציה עם IL-/5 JAK1 ו-JAK2 משופעלים על ידי סטימולציה עם IL-5. תוצאות אלו מצביעות בבירור על כך ש-JAK1 ו-JAK2 כרוכים באופן קונסטיטוטיבי עם IL-5Rα אנושי ועם βc ועל כך ששני אלה יוצרים קומפלקס IL-5Rα -βc בנוכחות IL-5. האזור ב-IL-5Rα אנושי הדרוש לקישור של JAK2 ממוקם ברצף חומצות אמינו 346-387 הכולל רצפים עשירים ב-proline במקטע הציטופלזמי.
האיתות על ידי βc מסתיים באופן חלקי על ידי ubiquitination ופירוק בפרוטאזום של המקטע הציטפלזמי של βc ליצירת תוצרים של βc שעברו truncation בתהליך המכונה βc intra-cytoplasmic proteolysis (להלן betaIP) (Martinez-Mczygemba וחב' ב-J Leuk Biol משנת 2007). יתרה מכך, עיכוב של דגרדציה של βc בפרוטאזום הביאה לשפעול ממושך יותר של β ,JAK2 ,STAT5 ושל SHP2 . הפעילות של JAK kinase נדרשת ל-ubiquitination ישיר של האזור הציטופלזמי של βc והדגרדציה שלו בפרוטאזום.
Spred-1 הוא רגולטור שלילי של שפעול ERK התלוי ב-Ras. עכברים החסרים Spred-1 סובלים מאאוזינופיליה מוגברת של דרכי האוויר המושרית על ידי אלרגנים. אנליזה ביוכימית גילתה ש-Spred-1 מדכא את שגשוג התאים התלוי ב-IL-5 וכן מדכא את שפעול ERK (Inoue וחב' ב-J Exp Med משנת 2005), מה שמצביע על כך ש-Spred-1 הוא רגולטור שלילי של שפעול אאוזינופילים המושרה על ידי IL-5. שפעול של IL-5R על ידי קישור IL-5 לקולטן זה, מגרה פוספורילציה של טירוזין של מולקולות איתות במסלולים אחדים השונים בין תאי B ואאוזינופילים. שפעול של Btk חיוני לשגשוג תאי B בעכברים ולהתמיינותם המושרה על ידי IL-5. כמו כן נמצא ש-IL-5 מעודד ביטוי גנים של c-fos ,c-jun ,Cis ,Cysh1/Jab ו-c-myc, לפחות בתאי B משופעלים (Horikawa ו-Takatsu ב-Immunology משנת 2006). האזור הדיסטלי מהממברנה של βc כרוך במעבר מ-G1 ל-S הנדרש לשפעול של Ras ,Raf-1 ושל MAPK כמו גם לשעתוק של c-fos ו-c-jun אך לא לאלה של pim-1 ושל c-myc. האזור הפרוקסימלי מהממברנה של βc חשוב לשגשוג התא ולהשריה של pim-1 ו-c-myc. לפיכך, השפעול של המסלול Ras-MAPK ביחד עם השעתוק של pim-1, ב –c-fos, c-myc ו-c-jun חיוני לשגשוג של אאוזינופילים. מסלול איתות זה מתחלק לשניים: האחד הוא מסלול התלוי ב-JAK-STAT ומביא להשרייה של pim-1 והמסלול השני אינו תלוי JAK-STAT ומביא להשרייה של c-myc (Stout וחב' ב-J Immunol משנת 2004).
ההתמיינות של תאי-אב (progenitors) של אאוזינופילים (להלן EoPs)
למרות המעורבות האפשרית של IL-5 בהתפתחות אאוזינופילים, עדיין לא ברורה במלואה המחויבות של ה-EoPs ל-IL-5 .GATA-1 גורם שעתוק המבוטא באאוזינופילים, נחשב כמשחק תפקיד בהתפתחות של אאוזינופילים, כיוון שעכברים בהם נהרס ה-motif הכפול של GATA, חסרים לחלוטין אאוזינופילים (Yu וחב' ב-J Exp Med משנת 2002). בהמשך זוהו ה-EoPs המחוייבים ל-IL-5 הפרימיטיביים ביותר במח העצם בין תאי האב של גרנולוציטים ומונוציטים (להלן GMPs) (Iwasaki וחב' ב-J Exp Med משנת 2005). בכבד העוברי זוהו שתי קבוצות של אוכלוסיות תאים חיוביים ל-IL- 5Rα. אחת משתי קבוצות אלו נובעת מתאי-אב מסוג B-1, והיא מבטאת IL-5Rα ברמות מאוד נמוכות, והקבוצה השנייה היא בעלת פוטנציאל של תאי-אב, והיא מבטאת IL-5Rαalfa ברמה גבוהה (Kouro וחב' ב-Immunol Lett משנת 2009).
הישרדות ותפקוד של אאוזינופילים בשלים
באשר לנדידה של אאוזינופילים מאתרי ההתמיינות במח העצם לזרם הדם ובסוף התהליך לאתרים האפקטורים, IL-5 גם כן מאיץ שלב זה בהשתתפות מולקולות ספיחה כגון CD11b/CD18, ו-Αm/β2 integrin (להלן Mac-1) (Walsh וחב' ב-Immunology משנת 1990). IL-5 משרה ספיחה זו המתווכת על ידי β2 integrin דרך מסלול ה-PI3K-protein kinase Cδ-MAPK (Sano וחב' ב-Am J Respir Cell Mol Biol משנת 2005). כמו כן מגדיל IL-5 את מספר האאוזינופילים בדם וברקמות על ידי עיכוב של אפופטוזיס (Yamaguchi וחב' ב-Blood משנת 1991, ו-Simon וחב' ב-J Immunol משנת 1997). IL-5 עשוי לדכא ישירות את האפופטוזיס באאוזינופילים על ידי אינאקטיבציה של Bid, שכן דווח ש-IL-5 חוסם את השפעול in vitro של Bid (Segal וחב' ב-Immunol Cell Biol משנת 2007).
IL-5 ודלקת המתווכת על ידי אאוזינופילים
הביטוי של IL-5 mRNA בביופסיות ברונכיאליות של מטופלים אסתמטיים מוגבר בהשוואה למתנדבים בריאים והמקור העיקרי של IL-5 mRNA הם תאי T + CD4 (Robinson וחב' ב-N Eng J Med משנת 1992). אכן, השפעול של תאי T + CD4 באסתמה מלווה על ידי רמות IL-5 מוגברות בנסיוב (Corrigan וחב' ב-Am Rev Respir Dis משנת 1993). IL-5 נמצאים גם בתאי פיטום הממוקמים ברקמות המאותגרות על ידי אלרגן. הקשר המיידי של אאוזינופילים באסתמה משתמע מההסננה המסיבית של תאים אלה בדרכי האוויר של חולי אסתמה (O'Byrne ב-J Allergy Clin Immunol משנת 1988), וכן מהרמות הגבוהות של אאוזינופילים בצירקולציה, ברירית הברונכיאלית וב-lavage הברונכיאלי (Bousquet וחב' ב-N Eng J Med משנת 1990, ו-Shi וחב' ב-Am J Respir Cell Mol Biol משנת 1997). תפקיד המפתח של IL-5 ב-LAR (או late-phase allergic response) הוכח ביכולת לעכב תגובה של רגישות-יתר המושרית על ידי נגיפים או אלרגנים בדרכי האוויר של עכברים וחזירי-ים והסננה של אאוזינופילים, תוך שימוש בנוגדן חד-שבטי המנטרל אתIL-5 (Akutsu וחב' ב-Immunol Lett משנת 1995, ו-Van Oosterhout וחב' ב-Am J Respir Dis משנת 1993).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 