סרטן בלוטת התריס - טיפול - Thyroid cancer - treatment
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| סרטן בלוטת התריס - טיפול | ||
|---|---|---|
| Thyroid cancer - treatment | ||

| ||
סמל המודעות לסרטן בלוטת התריס
| ||
| שמות נוספים | חידושים בטיפול בסרטן בלוטת התריס | |
| יוצר הערך | ד"ר איל רובינשטוק
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן בלוטת התריס
סרטן בלוטת התריס הוא הסרטן האנדוקריני השכיח ביותר אשר קצב אבחונו כמעט והוכפל במהלך 20 השנים האחרונות. במקביל לעלייה בשכיחות המחלה חלו שינויים משמעותיים בטיפול בעקבות התקדמות בהבנת מהלך המחלה, עלייה בהתעניינות בטיפול מותאם אישית, וכניסת תרופות חדשות לשימוש. בעוד הטיפול המסורתי כלל ניתוח, יוד רדיואקטיבי ודיכוי TSH בכל החולים, בשנים האחרונות משתנה הגישה לטיפול מוכוון סיכון אשר מצד אחד יביא לטיפול אגרסיבי בחולים בסיכון גבוה, ומצד שני ימנע טיפולים מיותרים בחולים בסיכון נמוך. שינויי גישה אלו באים לידי ביטוי בהנחיות איגוד התירואיד האמריקאי מ-2009, וצפויים להיות בולטים אף יותר בהנחיות הנמצאות בכתיבה בימים אלו. סקירה זו תעסוק בחידושים בטיפול בסרטנים ממוינים של בלוטת התריס מסוג פפילרי (papillary), פולקולרי (follicular) ותת-סוגיהם.
העלייה בשכיחות המחלה
שכיחות אבחון סרטן בלוטת התריס מוערכת בכ-48,000 מקרים חדשים בשנה בארצות הברית וכ-500 מקרים חדשים בשנה בישראל, עם קצב עלייה שנתי של כ-3%. הדעות חלוקות באשר לסיבה לעלייה בשכיחות המחלה בעשורים האחרונים. ללא ספק השימוש ההולך וגובר באמצעי הדמיה רגישים ובראשם אולטרסאונד ו-CT הביא לעלייה משמעותית באבחון גושים בבלוטת התריס. אם לפני 30 שנה גושים בבלוטת התריס אובחנו בבדיקה גופנית, ברור שמציאת גושי סרטן קטנים היא בין היתר תוצר של שיטות אבחון משופרות. עם זאת, מחקרים אחדים הראו עלייה ממשית בשכיחות המחלה גם לאחר תיקון למידת השימוש בהדמיה[1] ייתכן שהעלייה בשכיחות המחלה נובעת מחשיפה לקרינה (למשל בדיקות CT), זיהום סביבתי, השמנה, שינויים בתזונה או גורמים אחרים שטרם הובררו.
השאלה הנובעת מהשיפור באמצעי ההדמיה היא האם ברצוננו לאבחן כל גוש סרטני בבלוטה, גם אם הוא קטן ולא צפוי לגרום לבעיות רפואיות במהלך חיי המטופל. מענה לשאלה זו, לפחות חלקי, מסופק בקווי ההנחיה של איגוד התירואיד האמריקאי (ATA) לטיפול בקשריות וגידולים בבלוטת התריס, הממליצים לברר רק גושים גדולים מ-1 ס"מ (פרט לחולים בסיכון גבוה).[2] זאת מאחר שגידולים מיקרוסקופיים "תת-קליניים" שכיחים באוכלוסייה ונוטים להיות יציבים שנים רבות,[3] כך שאיתור וטיפול בכולם אינו נחוץ ויגרום ליותר נזק מתועלת. בשלב זה אין בידינו סמנים בשימוש שוטף המאפשרים לצפות אילו גושים סרטניים יהפכו למשמעותיים קלינית. ייתכן שבעתיד יהיו בידינו פאנלים של סמנים (כגון BRAF, RAS ואחרים) שבעזרתם נוכל להחליט בצורה מושכלת באילו גושים יש לטפל ובאילו לא.
מי זקוק לטיפול ביוד רדיואקטיבי?
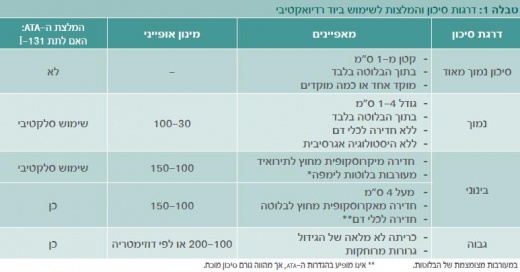
יוד רדיואקטיבי מהווה מרכיב מרכזי בטיפול בסרטן בלוטת התריס כבר יותר מ-50 שנה, ובשנות השישים והשבעים פורסמו כמה עבודות פורצות דרך שהדגימו ירידה בחזרת המחלה ובתמותה בחולים שקיבלו טיפול זה.[4] עבודות אלו הובילו לשימוש נרחב בחומר, ובמשך שנים הוצע טיפול זה לכל מטופל הסובל מסרטן בלוטת התריס. עם זאת, בשנים האחרונות מתרבות הדעות שחולים בסיכון נמוך ואף חלק מהחולים בסיכון בינוני אינם מפיקים תועלת משמעותית מטיפול ביוד רדיואקטיבי. שינוי הגישה נובע בעיקרו מהבנה טובה יותר של מהלך המחלה והכרה בתופעות הלוואי הכרוכות בטיפול[5]. שינויים אלו באו לידי ביטוי בהנחיות ה- ATA משנת 2009, שהגדירו קבוצה גדולה של חולים כמועמדים לשימוש סלקטיבי ביוד רדיואקטיבי (טבלה 1).
- על מנת להגדיר בצורה טובה יותר למי יש לתת יוד רדיואקטיבי, מקובל להתייחס לאינדיקציות הבאות לטיפול
אבלציה – הרס רקמת התריס התקינה שנותרה בצוואר לאחר הניתוח, לצורך שיפור יכולת המעקב תוך שימוש בתירוגלובולין (TG) ומיפוי כלל גופי.
מרכיב אדג'ובנטי - הרס תאי סרטן שנותרו בצוואר על מנת להפחית את הסיכון לחזרת המחלה. פעמים רבות האבלציה תכלול מרכיב אדג'ובנטי (למשל, כאשר יש עדות לקליטת החומר בבלוטות לימפה צוואריות).
טיפול במחלה גרורתית או שארית – כאשר יש עדות מבנית לרקמה סרטנית בצוואר או בגרורות מרוחקות.
השימוש הנרחב ביוד רדיואקטיבי נובע מהדעה שטיפול אבלטיבי ואדג'ובנטי נחוץ במרבית החולים לשיפור יכולת המעקב והפחתת הסיכון לחזרת המחלה, ומתוך ההנחה שטיפול ביוד רדיואקטיבי הוא בטוח וגורם לתופעות לוואי חולפות בעיקרן. טיעונים אלו נתונים לביקורת הולכת וגוברת בשל סיבות אחדות. ראשית, השימוש באולטרסאונד (US) ככלי מעקב אחר חולי סרטן בלוטת התריס עלה משמעותית בשני העשורים האחרונים. מעבר להיותו כלי זמין, לא יקר ושאינו כרוך בחשיפה לקרינה, ה-US נמצא יעיל במיוחד בקבוצת החולים בסיכון נמוך המהווים חלק הולך וגדל מאוכלוסיית החולים. בקבוצה זו נמצא ה-US יעיל יותר מ-TG בזיהוי חזרת המחלה, עם יכולת זיהוי מוקדמת יותר ורגישה יותר.[6] כמו כן, אף שיש מקרים שבהם לא ניתן יוד רדיואקטיבי אין דרך לדעת אם מקור ה-TG הוא מרקמת גידול או מרקמה נורמלית, הדינמיקה לאורך המעקב יכולה לשמש לזיהוי התפתחות רקמה סרטנית. לאור זאת, גם ללא אבלציה אפשר לזהות בצורה יעילה את חזרת המחלה.
גם לגבי המרכיב האדג'ובנטי עולה ספק אם הוא נחוץ בכל החולים: ייתכן שהסיכון הנמוך לחזרת המחלה כיום נובע מהמהלך הטבעי של המחלה המאובחנת ומטופלת בשלב מוקדם ולא מהטיפול ביוד רדיואקטיבי. כדאי לציין בשלב זה שהמינוח "חזרת המחלה" משמש בסקירה זו הן למחלה שארית (persistence) והן למחלה חוזרת (recurrence). במחקר רב מרכזי בארצות הברית (של קבוצת ה-NTCTCSG) נבדקו תוצאות הטיפול ב-2,936 חולים עם או ללא טיפול ביוד רדיואקטיבי לאחר כריתת בלוטת התריס.[7] בעוד בחולים בסיכון גבוה ובינוני (NTCTCSG stage 3-4) הייתה תועלת ברורה לטיפול, בחולים בסיכון נמוך שיעור חזרת המחלה היה דומה בחולים שטופלו ובחולים שלא טופלו.
במחקר של וייסמן ואח' דווחו תוצאות הטיפול ב-289 חולים שלא קיבלו טיפול ביוד רדיואקטיבי לאחר ניתוח בבית החולים Memorial Sloan-Kettering.[8] החולים שנכללו במחקר היו ב-stage 1-2 ואף כמה חולים ב-stage 3 (חדירה מינימלית מחוץ לבלוטה ומעורבות מינימלית של בלוטות לימפה). אחוזי חזרת המחלה בקבוצה זו היו 2.3% לאחר כריתה שלמה של הבלוטה ו-4.3% לאחר כריתת מחצית הבלוטה, בדומה לדיווחים מעבודות קודמות שתיארו אחוזי חזרת מחלה של 5%-2% בחולים בסיכון נמוך שטופלו ביוד רדיואקטיבי.[9] דיווחים אלו ואחרים מעידים על כך שבחולים בסיכון נמוך (ראו "הערכת סיכון" בהמשך) הטיפול ביוד רדיואקטיבי אינו משנה מהותית את הסיכון לחזרת המחלה.
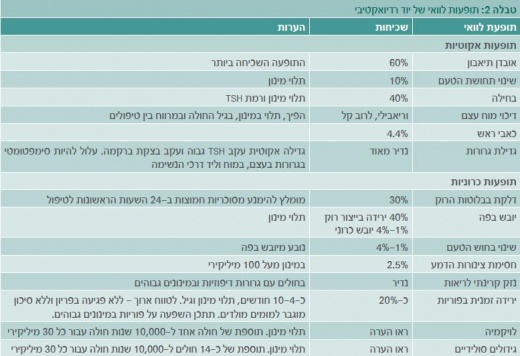
הטיעון שלישי שהוביל לשימוש הנרחב ביוד רדיואקטיבי הוא ההנחה שמדובר בטיפול בטוח עם תופעות לוואי קלות וחולפות. במקרים שבהם הטיפול מאריך חיים ומונע חזרת מחלה, תופעות הלוואי הן מחיר קטן לשלם בעבור תועלת ניכרת, ואין ספק שהטיפול קל לאין שיעור מטיפולים כימותרפיים. לעומת זאת, במקרים שבהם יעילות הטיפול מוטלת בספק יש לבחון בצורה מדוקדקת את תופעות הלוואי, כך שהטיפול לא יהיה גרוע מהמחלה. פרופיל תופעות הלוואי מתועד בצורה טובה, כאשר כמות וחומרת התופעות תלויות במינון המצטבר (טבלה 2).[10] בניתוח הסיכון לתופעות לוואי יש לקחת בחשבון הן פגיעה אפשרית באיכות החיים והן את הסיכון לממאירויות משניות אשר פעמים רבות מסוכנות יותר מסרטן בלוטת התריס. כדאי לציין שאחת מתופעות הלוואי העלולה לפגוע בצורה הקשה ביותר באיכות חיי המטופל היא יובש כרוני בפה. לחולים עם יובש בפה קשה לדבר זמן רב ברציפות (כפי שנדרש ממורים, עורכי דין וכו'), טעם המזון משתנה (משמעותי לעוסקים בתחום המזון וכאחת מהנאות החיים), והם סובלים מעששת מואצת. לאור זאת, עיסוקו והעדפותיו של החולה צריכים לבוא בחשבון בניתוח העלות-תועלת ובהתאמה אישית של הטיפול.
מהי מנת היוד הרדיואקטיבי המומלצת?
המינונים המומלצים על פי ה-ATA לטיפול אבלטיבי לאחר כריתת בלוטת התריס הם 100-30 מיליקירי לחולים בסיכון נמוך, ו- 200-100 מיליקירי בחולים בסיכון גבוה יותר (טבלה 1). טווחים רחבים אלו נובעים ממיעוט במחקרים השוואתיים, בעוד מרבית המחקרים תיארו תוצאת טיפול תוך שימוש במינונים אמפיריים קבועים מראש, השונים ממחקר למחקר. באחרונה הסתיימו כמה מחקרים רנדומליים מבוקרים (Randomized controlled trials) הנותנים מענה טוב לשאלת המינון המומלץ לטיפול אבלטיבי. ראשית, מחקר מאיטליה השווה 50 ו-100 מיליקירי יוד רדיואקטיבי תוך שימוש ב-rhTSH, והדגים שיעורי הצלחה דומים.[11] שנית, שני מחקרים רנדומליים שהסתיימו לאחרונה, HiLo מאנגליה ו-ESTAMBL מצרפת, השוו טיפול ב- 30 ו-100 מיליקירי עם הכנה בעזרת rhTSH או היפותירוידיזם, והדגימו שיעורי הצלחה שווים בכל הקבוצות.[12] לאור נתונים אלו, העדויות תומכות באפשרות לביצוע אבלציה תוך שימוש במינונים נמוכים של 50-30 מיליקירי. עם זאת, למחקרים אלו יש חסרונות אחדים. ראשית, הם בדקו את היעילות בהרס רקמת תריס תקינה (טיפול אבלטיבי) לצורך שיפור יכולת מעקב, ולא העריכו יעילות הטיפול בהפחתת סיכון לחזרת המחלה (המרכיב האדג'ובנטי של הטיפול). כמו כן, החולים שנכללו במחקרים אלו הם אותם חולים שייתכן שכלל אינם זקוקים לטיפול ביוד רדיואקטיבי (בקבוצת השימוש ה"סלקטיבי" בהנחיות ה-ATA.
בחולים בסיכון בינוני או גבוה לחזרת המחלה המינונים המומלצים הם גבוהים יותר: 150-100 מיליקירי בחולים עם גרורות לבלוטות לימפה אזוריות, ו-200-100 מיליקירי בחולים עם גרורות מרוחקות או עם מחלה שלא ניתנת לכריתה מלאה. בקרב חולים הזקוקים למינונים גבוהים עולה השאלה האם שימוש בדוזימטריה עדיף על מינונים קבועים מראש (מינונים אמפיריים). עד היום אין תשובה ברורה לשאלה זו, ופרט למקרים יוצאי דופן, השימוש במינונים אמפיריים נחשב דומה ביעילותו לשימוש בדוזימטריה כאשר מגיעים למינון מצטבר דומה. עם זאת, בהיבט הבטיחות ייתכן שלדוזימטריה יש יתרון בחולים קשישים שבהם המינון האמפירי פעמים רבות חוצה את סף הבטיחות למוח העצם.
את העלייה ברמת TSH הדרושה לטיפול ביוד רדיואקטיבי אפשר להשיג בעזרת השראת היפותירוידיזם או שימוש ב-TSH רקומביננטי (rhTSH). השימוש ב-rhTSH חוסך לחולה את הסבל שבהיפותירוידיזם ממושך, ושיפר באופן משמעותי את איכות החיים של חולי סרטן בלוטת התריס. בעוד יש עדויות מוצקות ליעילות דומה של שתי השיטות בטיפול אבלטיבי, קיים חשש שבמחלה גרורתית יעילות ה-rhTSH תפחת בהשוואה לזו של היפותירוידיזם. הכנה לטיפול עם rhTSH מאושרת לשימוש בארצות הברית ובאירופה בכלל החולים עם סרטן בלוטת התריס, פרט לאלו עם גרורות מרוחקות.
הערכת הסיכון לחזרת המחלה
הערכת הסיכון הראשונית לאחר הניתוח צריכה לסייע לנו להחליט אם החולה יפיק תועלת משמעותית מטיפול ביוד רדיואקטיבי. בקווי ההנחיה של ה-ATA נכללת קבוצה גדולה של חולים בקטגוריית הטיפול ה"סלקטיבי" ביוד רדיואקטיבי. עם זאת, אין קריטריונים ברורים במסמך כיצד לקבוע את הצורך בטיפול בחולה ספציפי, פרט לציון שיש לטפל בחולים שבהם התועלת עולה על הסיכון. מאז פרסום קווי ההנחיה עוסקים חוקרים רבים וצוותי עבודה של ה-ATA בהגדרה טובה יותר של הסיכון לחזרת המחלה. אף ששיטת ה-TNM (על פי ה-AJCC) הנמצאת בשימוש רווח לדירוג המחלה מנבאת בצורה סבירה את הסיכון לתמותה מהמחלה, היא אינה טובה בניבוי הסיכון לחזרת המחלה.
הערכת הסיכון מבוססת בעיקרה על הדוח הפתולוגי. בדוח זה מרכיבים רבים המעידים על דרגת הסיכון: גודל, וריאנט הגידול, חדירה לכלי דם, חדירה מחוץ לבלוטה, מספר וגודל בלוטות לימפה. כמה עבודות שפכו אור חדש על החשיבות היחסית של כל אחד מרכיבים אלו: אף על פי שלחדירה מינימלית מחוץ לבלוטה אין משמעות פרוגנוסטית רבה (בתנאי שהושגה כריתה ניתוחית טובה), יש חשיבות גדולה לחדירת הגידול לתוך כלי דם. מרבית החוקרים בתחום מסכימים שבחולים שבהם נצפית חדירה לכלי דם יש לתת טיפול ביוד רדיואקטיבי. וכן, בעוד סף הגודל שבו משתמשים רופאים רבים הוא סביב 1 ס"מ, ככל הנראה אין תוספת סיכון משמעותית גם בגידולים עד 4-3 ס"מ, בתנאי שהושגה כריתה ניתוחית טובה ואין ממצאים מדאיגים אחרים.[8]
בימים אלו הסתיימה עבודה של צוות מומחים מטעם ה-ATA לבחינת הסיכון מבלוטות לימפה גרורתיות בצוואר, אשר הסיקה כי מדובר בספקטרום של דרגות סיכון (בשלבי פרסום). מעורבות של בלוטות אחדות (פחות מ-5-3) הקטנות מ-1 ס"מ כמעט שלא משפיעה על הסיכון, אך כאשר מדובר ביותר מ-10 בלוטות הגדולות מ-1 ס"מ הסיכון לחזרת המחלה הוא גבוה (כ-30%). ככל שהניתוח הראשוני יהיה נרחב יותר (למשל אם מבוצעת דיסקציה מניעתית של הצוואר המרכזי) הסיכוי למצוא גרורות מיקרוסקופיות עולה. ממצאים מקריים אלו, ככל הנראה, אינם משנים משמעותית את פרוגנוזת החולה, ולא בהכרח מצדיקים טיפול ביוד רדיואקטיבי.
לאור הנתונים שהוצגו עד כה אין ספק שהמעבר לטיפול סלקטיבי ביוד רדיואקטיבי הופך את הטיפול למורכב יותר, ובשלב זה קווי ההנחיה מותירים מקום רב לשיקול דעת הרופא המטפל. חשוב שניהול המקרה יבוצע על ידי רופאים המיומנים בטיפול בחולים אלו תוך שקילת התועלת הצפויה, תופעות הלוואי האפשריות, ותוך שיתוף המטופלים בהחלטה הטיפולית.
במהלך המעקב לאחר טיפול ביוד רדיואקטיבי, יש חשיבות עליונה להערכת סיכון מתמשכת על פי התגובה לטיפול (restatification). במקרים רבים התגובה לטיפול משמעותית יותר לפרוגנוזה מאשר הערכת הסיכון הראשונית. למשל, הגישה לטיפול תהיה שונה בחולה בסיכון בינוני שהגיב היטב לטיפול הראשוני ולאחר שנה ה-TG אינו מדיד וה-US תקין (תגובה מצוינת), בהשוואה לחולה בסיכון בינוני שלאחר שנה TG=3 ויש ממצאים חשודים ב-US (תגובה לא מלאה). טבלה 3 מפרטת את הגדרת התגובה לטיפול שאותה מבצעים שנה עד שנתיים לאחר הטיפול הראשוני ואת תוצאות הטיפול לאחר מעקב חציוני של 7 שנים.[12] התגובה לטיפול מכתיבה במידה רבה את אופי המעקב אחר חולים אלה ואת הצורך בטיפולים נוספים. יש להדגיש שהערכת התגובה לטיפול מבוצעת רק בחולים שטופלו ביוד רדיואקטיבי.
נוסף לשיטות המסורתיות להערכת סיכון, השימוש ב-PET/CT נמצא יעיל ביותר בהערכת הסיכון בחולים עם מחלה שארית, בעיקר בחולים בסיכון גבוה. גרורות חיוביות בבדיקה (קולטות FDG) נוטות להיות אגרסיביות יותר, ולהראות סיכון מוגבר לגדילה ולחדירה לאיברים סמוכים. נגעים חיוביים ב-PET אינם קולטים יוד רדיואקטיבי ולא יגיבו לטיפול נוסף. בחולים אלו הנטייה תהיה לטיפול אגרסיבי יותר, למשל הפניה לניתוח חוזר, קרינה חיצונית או טיפולים מקומיים.
חולים שלא טופלו ביוד רדיואקטיבי
הערכת הסיכון והמעקב בחולים שלא טופלו ביוד רדיואקטיבי דורשת התייחסות ייחודית. בקבוצה זו אין משמעות לגירוי TG על ידי תירוגלובולין ולמיפוי כלל גופי, שכן קיימות בצוואר שאריות מיקרוסקופיות של רקמת התריס התקינה. במקרים אלו עיקר המידע מתקבל מבדיקות ה-US של הצוואר ודינמיקת TG לאורך זמן. מאחר שבדיקת ה-US לאחר ניתוח שונה מבדיקה בצוואר תקין, חשוב שהבדיקה תבוצע על ידי רופא המיומן בהערכת הצוואר. עם זאת, צפוי שבקבוצת חולים זו, חזרת מחלה תאובחן בשלב מאוחר יותר, שכן זיהוי המחלה יהיה לרוב על פי התקדמות מבנית (בבלוטות לימפה או במיטת הבלוטה) ולא ביוכימית. [6] על פי עבודות קטנות שפורסמו עד כה, במקרים אלו גם אם אכן חזרת המחלה מאובחנת בשלב מאוחר יותר, יעילות הטיפול (salvage therapy) דומה בהשוואה לחולים שטופלו בעברם ביוד רדיואקטיבי.
טיפול במחלה גרורתית
הכלי היעיל ביותר לטיפול בגרורות של סרטן בלוטת התריס הוא יוד רדיואקטיבי במנות חוזרות, וזאת אם הנגעים קולטים את החומר ומגיבים לטיפול. במקרים שבהם הגרורות אינן מגיבות ליוד רדיואקטיבי (כ-50% מהמקרים) יש בידינו כיום כמות הולכת וגדלה של כלים טיפוליים, הכוללים שיטות להרס מקומי של גרורות במקומות קריטיים, טיפולים לחיזוק העצם במקרים של גרורות גרמיות, ותרופות סיסטמיות לבלימת התקדמות הגידול. כמות המחקרים הקליניים בתחום גדולה מאי פעם, עם יותר מ-20 מחקרים קליניים פעילים לבחינת תרופות חדשות למחלה גרורתית. אף שהטיפולים הזמינים כיום טרם הוכיחו יעילות בפרמטר החשוב מכולם של הארכת חיים, יש מקום לתקווה שאחת מהתרופות הנבחנות כיום תימצא יעילה בכך.
מרבית התרופות הסיסטמיות לטיפול בסרטן בלוטת התריס שייכות לקבוצת מעכבי טירוזין קינז (TKI). שלוש התרופות הנמצאות בשימוש מחוץ למסגרת מחקרים קליניים (אך אינן מאושרות FDA לאינדיקציה זו) כוללות את Sorafenib, Sunitinib, Pazopanib. קצרה היריעה בסקירה זו לפרט את מאפייני כל אחת מתרופות אלו, אולם נוכל לציין עקרונות טיפוליים אחדים. הטיפול בתרופות אלו אינו מביא לריפוי, כי אם לייצוב המחלה ב-50%-40% ולנסיגה חלקית של הנגעים ב-20%-10%. עם זאת, השפעת התרופות היא זמנית ונמשכת כשנה עד שנה וחצי, ולאחר מכן לרוב מופיעה התקדמות מחודשת של המחלה. לאור משך ההשפעה המוגבל של התרופות, אחת ההחלטות החשובות ביותר היא מתי להתחיל טיפול על מנת להפיק את מרב התועלת. [13] גם בחולים עם מחלה גרורתית נרחבת, כל עוד המחלה יציבה מומלץ להמתין עם הטיפול עד להוכחת התקדמות מבנית משמעותית. ההמלצה במרבית ההנחיות הקליניות היא להפנות חולים עם מחלה גרורתית מתקדמת להשתתפות במחקר קליני בעדיפות ראשונה, מתוך תקווה שתרופות חדשות יהיו יעילות יותר ויביאו להפחתה בתמותה.
כשלב מעבר או בשילוב עם טיפולים סיסטמיים, טיפולים מקומיים יכולים לסייע בטיפול בגרורות באזורים קריטיים המאיימים על מבנים סמוכים או הגורמים לסימפטומים. מגוון הטיפולים הזמין כיום הוא גדול, וכולל אמבוליזצית כלי דם, הרס בעזרת גלי רדיו (RF), קרינה סטראוטקטית, הזרקת אתנול לגרורות צוואריות, וכמובן ניתוח להוצאת הנגע הבעייתי. מאחר שחולים עם גרורות סרטניות בבלוטת התריס יכולים לחיות שנים רבות עם המחלה, טיפולים אלו בעלי חשיבות גדולה לשמירה על איכות חיי המטופלים, ויש לנסות ולאתר נגעים אלו. בחולים עם גרורות גרמיות שבהן לא נמצאה אינדיקציה לטיפול מקומי, יש לשקול טיפול בתרופות לחיזוק העצם מקבוצת הביספוספונטים התוך ורידיים או ב-denosumab. תרופות אלו מוכחות היטב כמפחיתות סיכון לשברים בגרורות גרמיות מסרטנים אחרים, ויש עבודות המעידות על יעילות גם בסרטן בלוטת התריס,[14] אם כי אינן רשומות לאינדיקציה זו. המינונים המומלצים דומים לפרוטוקולים בסרטנים גרורתיים אחרים.
סיכום
מטרת הטיפול בחולי סרטן בלוטת התריס היא לתת את הטיפול היעיל ביותר תוך צמצום תופעות הלוואי. עבודות מהשנים האחרונות מראות שאפשר לצמצם את היקף השימוש ביוד רדיואקטיבי בחולים בסיכון נמוך, בעוד לחולים עם מחלה גרורתית אפשר להציע מגוון הולך וגדל של טיפולים מקומיים וסיסטמיים. לנוכח פריחת המחקר בתחום, נוכל לצפות לפריצות דרך טיפוליות במהלך העשור הקרוב אשר יאפשרו לתת מענה טוב יותר לחולים עם מחלה מתקדמת.
ביבליוגרפיה
- ↑ Morris LG, Myssiorek D. 2010. Improved detection does not fully explain the rising incidence of well-differentiated thyroid cancer: a population-based analysis. American journal of surgery 200:454-61.
- ↑ Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, et al. 2009. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 19:1167-214.
- ↑ Ito Y, Miyauchi A, Inoue H, Fukushima M, Kihara M, et al. 2010. An observational trial for papillary thyroid microcarcinoma in Japanese patients. World journal of surgery 34:28-35.
- ↑ Mazzaferri EL, Young RL, Oertel JE, Kemmerer WT, Page CP. 1977. Papillary thyroid carcinoma: the impact of therapy in 576 patients. Medicine 56:171-96.
- ↑ Hay ID. 2006. Selective use of radioactive iodine in the postoperative management of patients with papillary and follicular thyroid carcinoma. Journal of surgical oncology 94:692-700.
- ↑ 6.0 6.1 Durante C, Filetti S. 2011. Management of papillary thyroid cancer patients in absence of postoperative radioiodine remnant ablation: tailoring follow-up by neck sonography. The Journal of clinical endocrinology and metabolism 96:3059-61.
- ↑ Jonklaas J, Sarlis NJ, Litofsky D, Ain KB, Bigos ST, et al. 2006. Outcomes of patients with differentiated thyroid carcinoma following initial therapy. Thyroid 16:1229-42.
- ↑ 8.0 8.1 Vaisman F, Shaha A, Fish S, Tuttle R. 2011. Initial therapy with either thyroid lobectomy or total thyroidectomy without radioactive iodine remnant ablation is associated with very low rates of structural disease recurrence in properly selected patients with differentiated thyroid cancer. Clinical endocrinology 75: 112-119.
- ↑ Ross DS, Litofsky D, Ain KB, Bigos T, Brierley JD, et al. 2009. Recurrence after treatment of micropapillary thyroid cancer. Thyroid 19(10):1043-8.
- ↑ Tala H, Tuttle RM. 2010. Contemporary post surgical management of differentiated thyroid carcinoma. Clinical oncology 22:419-29.
- ↑ Pilli T, Brianzoni E, Capoccetti F, Castagna MG, Fattori S, et al. 2007. A comparison of 1850 (50 mCi) and 3700 MBq (100 mCi) 131-iodine. administered doses for recombinant thyrotropin-stimulated postoperative thyroid remnant ablation in differentiated thyroid cancer. The Journal of clinical endocrinology and metabolism 92:3542-6.
- ↑ 12.0 12.1 1Comparison of Four Strategies of Radioiodine Ablation on 752 Low-Risk Thyroid Cancer Patients: Final Results of the Estimabl Study 2011. Abstracts of the 81st Annual Meeting of the American Thyroid Association. October 26-30, 2011. Indian Wells, California, USA. Thyroid 21 Suppl 1:A6-110.
- ↑ Gild ML, Bullock M, Robinson BG, Clifton-Bligh R. 2011. Multikinase inhibitors: a new option for the treatment of thyroid cancer. Nature reviews. Endocrinology 7:617-24.
- ↑ Orita Y, Sugitani I, Toda K, Manabe J, Fujimoto Y. 2011. Zoledronic acid in the treatment of bone metastases from differentiated thyroid carcinoma. Thyroid 21:31-5.
קישורים חיצוניים
- חידושים בטיפול בסרטן בלוטת התריס, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר איל רובינשטוק
- המכון לאנדוקרינולוגיה ומטבוליזם, מרכז רפואי רבין, קמפוס בילינסון
- Endocrine service, Memorial Sloan-Kettering Cancer Center, New York


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק