חומצה אורוטית - Orotic acid
| מדריך בדיקות מעבדה | |
| חומצה אורוטית | |
|---|---|
| Orotic acid | |
| שמות אחרים | ויטמין B13 , pyrimidinecarboxylic acid |
| |
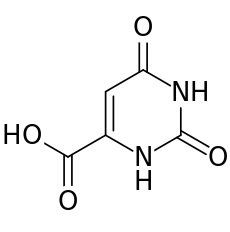
חומצה אורוטית, משקל מולקולרי 146.1
| |
| מעבדה | כימיה בשתן |
| תחום | הערכה מבדלת של היפר-אמונמיה, מפגעי מעגל השתנן (urea) ושל orotic aciduria תורשתית |
| טווח ערכים תקין | (הערכים מבוטאים ב-מילימול'/מול' קראטינין: מתחת גיל שבועיים-1.4-5.3; גיל שבועיים עד שנה-1.0-3.2; גיל שנה עד 10 שנים-0.5-3.3; מעל גיל 11 שנה-0.4-1.2. נשים הרות מפרישות בשתן באופן נורמאלי עד פי-2 מסף הנורמה העליון של חומצה אורוטית בשתן. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידה כמותית של חומצה אורוטית בשתן, נועדה לסייע באבחון מפגעים במעגל ה-urea, לזהות אפשרות של orotic aciduria תורשתית, או לברר סיבות אחרות להיפראמונמיה בלתי-מוסברת. בדיקה זו מתבצעת לאישוש של ממצאים של סקר-יילודים, לבצע בירור בילדים עם אפיזודות עיקשות של הקאות או רדמת, המרמזים למפגע מטבולי, וכן מתבצעת הבדיקה כמעקב אחר מטופלים מאובחנים עם OTC להערכת ההתנהלות הטיפולית וההיענות (compliance) של המטופל לדיאטה שנכפתה עליו.
בסיס פיזיולוגי
חומצה אורוטית היא תרכובת הטרוציקלית שהתגלתה במקור במי-גבינה (whey) של חלב פרה על ידי Biscara ו-Belloni בשנת 1905, אך הנוסחה המדויקת שלה פוענחה רק ב-1930 על ידי Bachstez.
חומצה אורוטית בודדה בהמשך גם מרקמת כבד, ואף משמרים. ב-1944 התפרסמה על ידי Loring ו-Pierce הראייה הראשונה לחשיבות של חומצה אורוטית בביוסינתזה של חומצות גרעין, בניסוי קלאסי בו הראו שחומצה אורוטית מסוגלת להחליף פירימידינים כגורם גדילה במוטנט של neurospora וכן בזנים מסוימים של סטרפטוקוקוס. היסטורית היו סבורים שחומצה אורוטית היא חלק מקומפלקס של ויטמיני B, ושמה אף נקבע כוויטמין B13, אך כיום אין מתייחסים לחומצה אורוטית כאל ויטמין, בעיקר כיוון שהיא מיוצרת על ידי הפלורה של חיידקי המעי.
המקורות העיקריים של חומצה אורוטית פרט לכמות קטנה הנוצרת על ידי חיידקי מעי, הם חלב פרה ומוצרי חלב, וירקות שורש כמו תפוח אדמה, בצל, שום, גזר וסלק (Motyl ןחב' משנת 991 ב-Endocr Regul). בעבר הייתה השערה שמקורות המזון תורמים יחסית תרומה משמעותית לרמת חומצה אורוטית בגוף, שכן צום מפחית ב-50% את רמת חומצה זו בשתן. אך כיום ברור שעיקר החומצה האורוטית בשתן מקורו בתהליכים מטבוליים בגוף, ובעיקר זה של ביוסינתזה של פירימידין.
ערכים גבוהים של החומצה קשורים לרוב למצבי עודף אמוניה, שמובילים להפיכת אמוניה ל-carbamoyl phosphate, ובהמשך לחומצה אורוטית. ערכים גבוהים של אמוניה יכולים להיווצר במצבי רעילות בכבד, זיהום נגיפי של הכבד, דימום בדרכי העיכול, או כתוצאה ממעבר חריג של דם מהמערכת הפורטלית למערכת הדם הכללית, מצריכה לא מושכלת של תרופות, בתסמונת Reye, וכן כתוצאה מפגמים מולדים במטבוליזם של אמוניה. ערכי חומצה אורוטית מוגברים יכולים להופיע גם בסוגי לויקמיה שונים וכן בלימפומות, כתוצאה מהייצור המוגבר של פירימידינים.
היחס בין orotic aciduria לסינתזה של שתנן (urea)
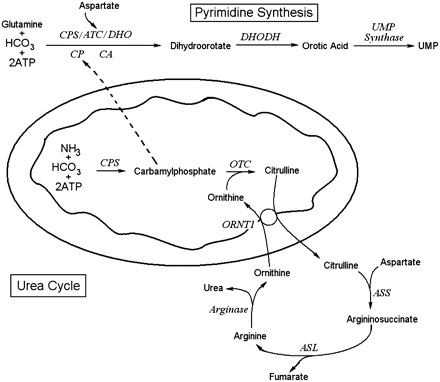
לחומצה אורוטית אין כל תפקיד בתפעול של מעגל השתנן. אף על פי כן הפרשת חומצה אורוטית מוגברת במספר מפגעים של מעגל זה. השלב הראשון של סינתזת שתנן בכבד, היא הסינתזה של carbamoyl phosphate, בעזרת האנזים carbamoyl phosphate synthetase I (או CPS I), שהוא אנזים מיטוכונדריאלי הדוחס ביקרבונאט, אמוניה ו-ATP ליצירה של carbamoyl phosphate. האנזים CPS I דורש לפעילותו NAG או N-acetylglutamate, בתור משפעל אלוסטרי הכרחי. הסינתזה של NAG מ-acetyl CoA וחומצה גלוטמית, מתבצעת על ידי האנזים NAG synthase, שאף הוא אנזים מיטוכונדריאלי הדורש ארגינין בתור משפעל.
לכן, כמות מוגברת של ארגינין במיטוכונדריה תחיש את היצירה של carbamoyl phosphate במיטוכונדריה, מה שיספק כמות מספקת של אורניטין לשלב הבא במעגל השתנן. האנזים OTC מקטלז את את הדחיסה של אורניטין ו-carbamoyl phosphate ליצירת ציטרולין, אשר ביחד עם פרוטון עובר טרנספורט אל מחוץ למיטוכונדריה בתמורה לאורניטין, זאת בעזרת הטרנספורטר ORNT 1, הממוקם בחלק הפנימי של ממברנת המיטוכונדריה. כאן נכנס לתמונה האנזים argininosuccinate synthetase, המייצר argininosuccinate מציטרולין וחומצה אספרטית. Argininosuccinate עובר ביקוע על ידי- agininosuccinate lyase ליצירה של ארגינין וחומצה פוּמארית. שתי התרכובות האחרונות עוברות הידרוליזה על ידי האנזים arginase I ליצירה של urea ואורניטין, מה שמסיים את שלבי מעגל ה-urea.
סינתזה של חומצה אורוטית
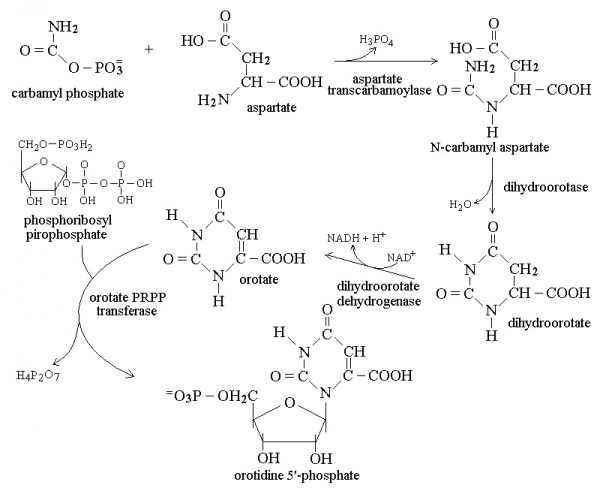
מסלול הביוסינתזה של פירימידין כולל בתוכו את שלב יצירת חומצה אורוטית. המסלול מתחיל כאשר מולקולת גלוטמין בתוספת 2 מולקולות ATP יוצרת קרבמואיל-פוספאט, כאשר האחרון נקשר לחומצה אספרטית ליצירת קרבמואיל-אספרטאט. חומר ביניים זה בעזרת האנזים dihydroorotase יוצר את התרכובת dihydroorotate, והאחרונה הופכת לחומצה אורוטית בעזרת האנזים המיטוכונדריאלי dihydroorate dehydrogenase. החומצה האורוטית מתחברת עם PRPP או phosphoribosyl pyrophosphate בעזרת האנזים orotate PRPP transferase, ליצירה של OMP או orotidine-5'-monophosphate. התוצר האחרון הזה יהפוך בשלב האחרון ל-uridine-5’-monophosphate. תכונה ייחודית של סינתזת פירימידין היא בכך שטבעת הפירימידין עוברת סינתזה מלאה לפני שהיא נקשרת ל-ribose sugar, ואילו סינתזה של פורין (purine) מתרחשת על ידי בניית הבסיס ישירות על פני הסוכר.
Orotic aciduria
ההפרשה בשתן של חומצה אורוטית שהיא תוצר ביניים בביו-סינתזה של פירימידין, מוגברת במפגעים רבים של מעגל ה-urea, ובמספר מפגעים אחרים הכרוכים במטבוליזם של ארגינין. קביעת רמת חומצה אורוטית בשתן, עשויה להיות שימושית באבחנה מבדלת בין מספר סיבות להיפר-אמונמיה, שהיא אמנם אופיינית לכל מפגעי מעגל ה-urea, אך חומצה אורוטית מוגברת רק בחלק ממפגעים אלה.
תרחיש של orotic aciduria מתייחס להפרשה מוגברת של חומצה זו בשתן. בתרחיש זה אחד המאפיינים היא צורה אופיינית של אנמיה, והוא יכול להיות כרוך גם עם פיגור שכלי ובעיות של פיגול בשגשוג הגופני. כיוון שחומצה אורוטית היא תוצר ביניים במסלול הסינתזה של פירימידין, שמשחק תפקיד בהמרה ההדדית בין dihydrofolate ו-tetrahydrofolate, מצב של orotic aciduria עלול להיות כרוך באנמיה מגלובלסטית בשל החסר בחומצה פולית. מצב זה של אנמיה מגלובלסטית אינו ניתן לטיפול על ידי מתן חומצה פולית או ויטמין B12. עודף חומצה אורוטית בשתן, עלול לעכב סינתזה של DNA ושל RNA וממילא לפיגור בשגשוג.
תרחיש של orotic aciduria יכול לנבוע מפגמים מולדים של הטרנספורטר המיטוכונדריאלי של אורניטין/ציטרולין, וכן כתוצאה ממוטציות באנזימים arginase, וכן ב-argininosuccinate synthetase וב-argininosuccinate lyase. תרחיש תורשתי נוסף של orotic aciduria עלול לנבוע מחסר האנזים UMP synthase. כמו כן תהיה הגברה של הפרשת חומצה אורוטית בשתן במצבים של היפו-ארגנינמיה כגון במצב של lysinuric protein intolerance. יחד עם זאת, אין לראות ב-orotic aciduria מדד לחסר ארגינין, שכן ניתן למצוא תרחיש זה גם באלה עם חסר האנזים arginase, בהם מופיעה דווקא hyper-argeninemia.
Lysinuric protein intolerance
מפגע זה נגרם על ידי מוטציה בגן SLC7A7, המקודד ל-y+LAT-1, שהוא הטרנספורטר של חומצות האמינו הקטיוניות. מוטציה זו גורמת להפרעה בטרנספורט במעי וכן בספיגה מחדש בכליות של ליזין, ארגינין ואורניטין. במצב זה של חסר בארגינין ובאורניטין, גורמים להפרעה במעגל ה-urea באופן שעיכול ארוחות המכילות חלבון, עלול לגרום להיפר-אמונמיה ול-orotic aciduria. תינוקות עם מפגע זה טופלו באופן יעיל על ידי מתן פומי של ציטרולין, שכן חומצת אמינו זו נספגת במעי על ידי טרנספורטר שונה, ומתן ציטרולין יכול לתקן את הפגיעה במעגל ה-urea. מתן ציטרולין מתקן את ההפרשה המוגברת של חומצה אורוטית בילדים אלה.
חומצה אורוטית מוגברת גם במפגעי טרנספורט של חומצות אמינו דו-בסיסיות (lysinuric protein intolerance, ותסמונת HHH או hyperornithinemia, hyperammonemia, homocitrullinuria), ועולה באופן בולט במיוחד באלה עם orotic acuduria תורשתית הנובעת מחסר של האנזים UMPS או uridine monophosphate synthase.
מצבים קליניים נוספים שיכולים להיות קשורים לחסר בחומצה אורוטית: תקופת התאוששות מהתקף לב; טרשת נפוצה, הפאטיטיס כרונית, סיבוכי מחלת כבד, הזדקנות טרם-עת (progeria).
הגורמים ל-Orotic aciduria
ההורשה של orotic aciduria היא אוטוזומאלית-רצסיבית. הצורה המורשת של מפגע זה, יכולה להיגרם מחסר האנזימים UPMS שהוא חלבון דו-תפקודי הכולל את הפעילויות האנזימטיות של orotate phosphoribosyltransferase ושל orotidine 5'-phosphate decarboxylase. המפגע של orotic aciduria יכול להופיע באופן שניוני לחסימה במעגל ה-urea, בעיקר זו של האנזים OTC או ornithine transcarbamylase deficiency. ניתן להבדיל בין עליה בחומצה אורוטית שהיא שניונית לחסר ב-OTC, לבין זו הנגרמת באופן תורשתי, על ידי מדידת רמות אמוניה ואוריאה: בחסר האנזים OTC נמצא היפר-אמונמיה וירידה ברמת אוריאה.
חסר ב-OTC
חסר באנזים OTC או Ornithine transcarbamylase הוא המפגע השכיח ביותר מבין מפגעי מעגל ה-urea באדם. אנזים זה הוא האנזים הסופי הפועל בחלק הקריבני (פרוקסימאלי) של מעגל ה-urea, והוא אחראי להמרה של carbamoyl phosphate ואורניטין לציטרולין. חסר ב-OTC מועבר בהורשה רצסיבית שהיא X-linked, באופן שבא לביטוי באופן מועדף בזכרים. בחסר האנזים OTC מצטבר carbamoyl phosphate ומוסב באופן חלופי ליצירת חומצה אורוטית. כך נוצרת רמה מוגברת של אמוניה בדם, ורמה מוגברת של חומצה אורוטית בדם ובשתן, ולרמות מופחתות של אוריאה בדם. המצב של היפר-אמונמיה גורם לחסר של α-ketoglutarate, מה שמביא לעיכוב מעגל חומצת הלימון (מעגל חומצות טריקרבוקסיליות), מה שמפחית את יצירת ATP.
בפרטים הלוקים בחסר זה, רמות אמוניה עולות באופן מהיר ותלול תוך גרימת שגשון (ataxia), רדמת (לתרגיה) ומוות אם טיפול מהיר אינו ניתן. OTC מאובחן על ידי שיחלוב של ממצאים קליניים ותוצאות מבחנים ביוכימיים, אך האישור הסופי מתבצע על ידי טכניקות מולקולאריות-גנטיות. מטרת הטיפול לאחר אבחנה של חסר ב-OTC היא למנוע אפיזודות של היפר-אמונמיה. הטיפול היעיל ביותר משלב דיאטה דלת חלבון עם תכשירים קולטי חנקן, ואף השתלת כבד נשקלת לעתים.
הטיפול ב-orotic aciduria
הטיפול ב-orotic aciduria הוא במתן של cytidine monophosphate ו- uridine monophosphate, מה שמפחית את רמת החומצה האורוטית בשתן ואת האנמיה. טיפול ב-uridine, המוסב ל-UMP, יכול לעקוף את החסם המטבולי ויספק לגוף מקור ליצירת פירימידין.
Allopurinol מעכב את האנזים orotidine monophosphate decarboxylase, וכאשר נותנים תכשיר זה לנשאים של חסר OTC (שיכולים להיות בעלי רמות תקינות של חומצה אורוטית בשתן), פעולה זו גורמת להפרשה מוגברת של חומצה אורוטית. מתן מנוטר באופן מוקפד של התכשיר (allopurinol challenge) לנשאי החסר ב-OTC, מאפשר את הזיהוי שלהם, על ידי מדידה סדרתית של רמת חומצה אורוטית בשתן. למבחן זה יש חשיבות שכן בערך 20% מהמוטציות ב-OTC אינן ניתנות לגילוי על ידי השיטות גנטיות-מולקולאריות המקובלות כיום. יש לציין שגם 6azauridine מעכב את האנזים המעוכב על ידי allopurinol.
הוראות לביצוע הבדיקה
מומלץ להשתמש בשתן ראשון של בוקר. יש להקפיא את דגימת השתן שהייתה בקירור אם הבדיקה אינה מתבצעת תוך 24 שעות מלקיחתה. הבדיקה מתבצעת בשיטה של Liquid Chromatography-Tandem Mass Spectrometry. רוב המקרים יש להשתמש באותה דגימת שתן לאנליזה של פרופיל חומצות האמינו בשתן.
ראו גם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק