כאב פנטום - Phantom pain
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| כאב פנטום | ||
|---|---|---|
| Phantom pain | ||
| יוצר הערך | ד״ר ארנולד שטיין |
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – כאב
פנטום (Phantom) הוא החלק הקטוע של הגפה אשר אינו קיים עוד בגוף. תופעת פנטום (Phantom Phenomena) תוארה כבר במאה ה־16 ע״י Ambroise Pare, שתיאר חיילים המתלוננים על תחושה בחלקים חסרים של הגפיים לאחר קטיעה. בשנת 1871 קיבץ Mitchel את מכלול התופעות שחוו חולים לאחר קטיעות וטבע את המושג גפת פנטום (Phantom limb).
אפידימיולוגיה
השכיחות של כאבי פנטום בספרות נעה בין 2-80%[1]. אולם, מחקרים אפידמיולוגיים אחרונים נוטים להציג מספרים גבוהים יותר (60-80%): במחקר רטרוספקטיבי בחולים עם קטיעות טראומטיות קרביות צוינה שכיחות כאבי פנטום של 78%[2]. עבודה פרוספקטיבית נוספת בקטועי גפיים על רקע מחלה בכלי הדם מצאה שיעור של 78% של כאבי פנטום ו-51% של כאבים גרמיים, חצי שנה לאחר הניתוח לקטיעת הגפה[3].
כאבי פנטום נוטים להפוך לכאבים ממושכים: בעבודה פרוספקטיבית על 58 חולים נמצא כאב ב-72%, 65% ו-59% מהחולים לאחר שבוע, שישה חודשים ושנתיים לאחר הניתוח, בהתאמה[4]. עם זאת, התדירות של ההתקפים ועוצמתם יורדים באופן משמעותי עם השנים וכמחצית מהחולים מדווחים על כאבים קלים בלבד וחלקם אף על העלמות הכאב לחלוטין כ-5 שנים לאחר הקטיעה[1] , [5].
בילדים, מהלך המחלה מתון יותר: שכיחות כאבי פנטום בילדים ומתבגרים לאחר קטיעה ניתוחית או טראומתית היא כ-48% ובילדים עם חסר גפה מולד כ-3.7% בלבד[6].
בניגוד לדעה הרווחת שכאבי פנטום מוגבלים לגפיים בלבד, כאבים אלו יכולים להופיע אחרי כריתה של איברים נוספים: הנפוצה ביותר היא התפתחות תופעת פנטום אחרי ניתוח לכריתת שד. כ-50% מהנשים יפתחו תחושת פנטום בשד (Phantom breast sensation) וכ־20% יסבלו מכאב. כאב פנטום באזור פי הטבעת נפוץ בכ-15% מהחולים אחרי כריתת פי הטבעת. מצבים נוספים בהם נצפו תופעות פנטום כוללים ניתוח לכריתת תוספתן, עקירות עיניים ועקירות שיניים.
אטיולוגיה
מספר מחקרים ניסו לבדוק האם קיים קשר בין גיל, מין, סיבת הקטיעה ועוצמת הכאבים טרם הקטיעה לבין כאבי הפנטום. הספרות הרפואית בנושא איננה חד משמעית. רוב המחקרים מצביעים על כך שככל הנראה אין השפעה למין החולה, לגילו או למצב בריאותו ולסיבת הקטיעה (טראומטית, צבאית או ניתוחית)[1] , [7] , [8]. עם זאת, כאב פנטום שכיח יותר בחולים עם קטיעה דו-צדדית וככל שהקטיעה נעשית גבוה יותר בגפה[9].
גם הנושא האם עוצמת הכאב לפני הניתוח מהווה גורם סיכון מנבא לפתח כאב פנטום הוא שנוי במחלוקת[4] , [10] , [11]. באחת העבודות הפרוספקטיביות שנעשתה על חולים שעברו קטיעה על רקע פתולוגי של כלי דם, נמצא קשר בין כאב פנטום לבין הכאב לפני הניתוח רק בבדיקה לאחר שבוע ולאחר שלושה חודשים, אך לא לאחר תקופה של שישה חודשים[11].
בנוסף, תוארו מקרים בהם חולים דיווחו על כאב פנטום שהיה דומה מאוד באופיו ובמיקומו לכאב שהיה להם לפני הניתוח. ברוב המקרים הדמיון בין הכאבים התקיים רק בתקופה המיידית לאחר הקטיעה[4] , [11]. בעבודה פרוספקטיבית שנעשתה על 54 חולים, 42% טענו לדמיון בין כאב הפנטום לכאב הקודם, אך לאחר ניתוח הנתונים של מאפייני הכאב לא נמצא כל הבדל בין הקבוצה שטענה שיש זהות בכאבים לזו שתיארה כאב שונה מזה שנחווה טרם הניתוח. ממצא זה מצביע על השפעה חזקה של הזיכרון ושל סיבות נפשיות על האופן שבו חולים מאפיינים את הכאב בהמשך[11].
תופעת פנטום וכאב פנטום יכולים להיות מושפעים גם מגורמים סביבתיים ונפשיים. תוכנית שיקום יעילה או שימוש בפרוטזה יכולים להפחית את הכאב. לעומת זאת, שינויים במזג אוויר, גירוי חיצוני של הגדם, לחץ נפשי, מתח ופעולות אוטונומיות כמו מתן שתן יכולים להוות גורם גירוי לעוצמה מוגברת של התקף כאב (טבלה 2).
| Genetic predisposition |
| Anxiety/emolional distress |
| attention / distruction |
| unrination / defaecation |
| Other disease - ciebral haemorrhage, prolapsed intervertebral disc |
| Weather change |
| Touching the slump |
| Use of prosthesis |
| Spinal anaesthesia |
| Rehabilitation |
| Treatment |
המנגנונים מאחורי תופעת הפנטום
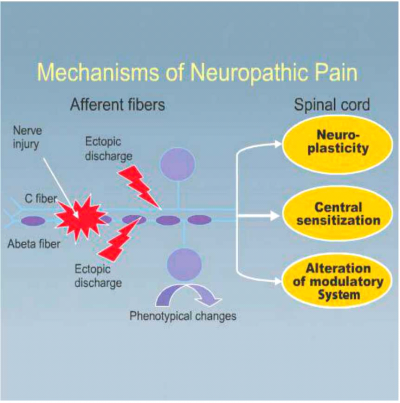
המנגנונים בבסיס תופעת הפנטום וכאב הפנטום הם מסובכים ואינם מובנים במלואם. מעדויות ניסיוניות וקליניות ברור שקיימת מעורבות משולבת של גורמים במערכת העצבים ההיקפית ובמערכת העצבים המרכזית, הן בחוט השדרה והן במוח[1], [12] , [13]. לאחר חיתוך העצב נוצרות הסתעפויות ופקעות בקצוות הסיבים המוליכים תחושת כאב - C ו- Aδ החתוכים, הנקראות נוירומות (Neuroma), נוירומה היא פקעת של קצה עצב קטוע והיא רגישה ביותר לכל מגע, גירוי ולחץ. נוירומות אלו, המופיעות בקצות הגדם, מהוות מקור לפעילות חשמלית אקטופית (Ectopic) ולא מתוכננת (Spontaneously) לאורך העצב. פעילות זו מושרית ע"י גירויים מכאניים וכימיים בגדם, ומקורה בריבוי תעלות נתרן חדשות שמופיעות בנוירומה ולאורך העצב לאחר קטיעה. שינויים דומים מתרחשים גם בתאים בשורש הגנגליון האחורי (Dorsal root ganglion), אשר מציגים דפוס דומה של פעילות חשמלית אקראית ורגישות יתר לגירויים מכניים וכימיים.
הקשה על נוירומה או גירוי שלה יכולים לעורר כאב עז בגדם ובפנטום. הזרקת Lidocain (חוסם תעלות נתרן) לנוירומה יכולה לחסום כאב זה. קיים קשר גם למערכת העצבים הסימפטטית (Sympathetic nervous system). עצבים תחושתיים C ו-Aδ שאינם רגישים כלל לקטכולאמינים (Catecholamines), מפתחים רגישות לנוירואפניפרין (Norepinephrine) לאחר טראומה או פגיעה. הזרקת נוירואפיניפרין לגדם או עלייה בפעילות סימפyטית עקב מתח גורמים להגברת הכאב.
קיימות עדויות המצביעות על יחס הפוך בין דרגת החום של הגדם לעוצמת הכאב. כתוצאה מריבוי פעילות אקטופית תופרש כמות רבה של מוליכים עצביים מעוררים (Excitatory neurotransmitters) בחוט השדרה [גלוטמט (Glutamate), אספרטט (Aspartate), חומר P (Substance P)]. הפעלה של קולטנים מסוג NMDA ע"י חומרים אלו תגרום לריגוש מרכזי (Central sensitization) של הקרן האחורית בחוט השדרה. יחד עם הקטנה של פעילות מעכבת בחוט השדרה, יתקבל מצב פתופיזיולוגי (Pathophysiology) אשר יבוא לידי ביטוי קליני בהרחבת שדות הקליטה של התאים בקרן האחורית, כאב מוגבר (Hyperalgesia, היפראלגזיה) לגירוי מכני וכאב אקראי והתקפי (תמונה 4).
בנוסף לשינויים פיזיולוגיים, מתרחשים גם שינויים אנטומיים רבים כמו שינוי המבנה ומספר המיסנפים (סינפסות, Synapses) בקרן האחורית של חוט השדרה, מה שיוצר קשרים מיסנפיים חדשים וירידה בפעילות המעכבת. שינויים אלה, לכשיווצרו, הם לרוב בלתי הפיכים.
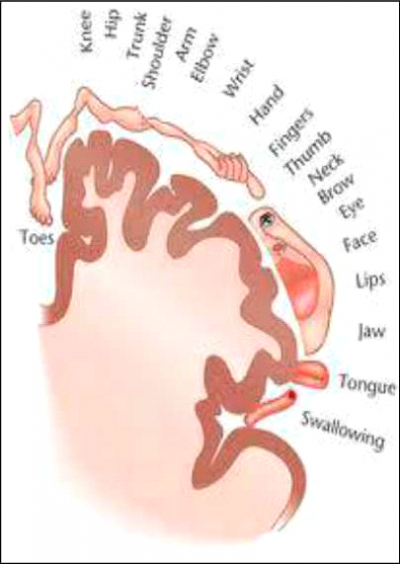
במוח קיימת תמונה ייצוגית של כל אברי הגוף (המונה 5). כך, למשל האזור המייצג כף רגל לא נעלם אחרי שהרגל נכרתת, ומבחינת המוח האיבר עדיין קיים. בעקבות קטיעה ודי-אפרנטציה (De-afferentation), חלה ירידה של תשדורת אפרנטית (Afferent input) מהגפה וסידור מחדש של קליפת המוח הסומטו-סנסורית (Somatosensory cortex), של אזורים תת-קורטיקליים (Subcortical) ושל התלמוס (Thalamus). כך, הייצוג הקורטיקלי של איברים שונים משתנה. למשל, נצפתה תזוזה של הפה לכיוון היד הקטועה שאיבדה את התשדורת האפרנטית. קיים קשר בין גודל הסידור מחדש בקליפת המוח לבין עוצמת הכאב.
תאוריות אחרות המנסות להסביר את מנגנון תופעת הפנטום, שמות דגש על תופעת חוסר העיכוב (Disinhibition) במערכת העצבים המרכזית ועל גורמים פסיכולוגיים (Psychological) והתנהגותיים.
קליניקה
תופעת הפנטום כוללת שלושה מצבים קליניים:
- כאב בגדם
- תחושות הפנטום
- כאב פנטום
כאב בגדם (Stump pain)
כאב בגדם קיים אצל כל החולים לאחר הקטיעה ולרוב חולף תוך מספר שבועות. ב-5-20% מהחולים הכאב נשאר והופך לממושך. זהו כאב חד, עוויתי, דוקר ושורף ומלווה לעיתים בקפיצות בלתי-רצוניות של הגדם. הסיבות העיקריות לכאב זה הן זיהום בגדם, אספקת דם ירודה, בליטות עצם ונוירומות בקצה הגדם. כאב בגדם וכאב פנטום לעיתים קרובות הולכים יחד- מעל מחצית החולים עם כאבי פנטום סובלים גם מכאבים בגדם[14]. מניעת הכאב כוללת טיפול מתאים בגדם והתאמת תותבת נוחה.
תחושת פנטום (Phantom sensation)
כמעט כל החולים לאחר קטיעה חווים את התחושה שהחלק החסר של הגפה עדיין קיים. החוויות יכולות להיות מאוד אמיתיות, עם הרגשת מגע, חום, לחץ, עקצוץ, גודל וצורה. שכיחות מאוד הן תחושת תנועה של הגפה או האצבעות החסרות ותנוחות מוזרות ומעוותות של הגפה. הפנטום יכול להיות רפה ותלוי בצד הגוף, יכול להיות מקובע ומכווץ, או להימצא בתנוחה מעוותת שלעתים דומה לתנוחה בה היה האיבר לפני הקטיעה[15].
תופעה מעניינת נוספת היא קיצור הפנטום (Telescoping), כאשר עם הזמן הקצוות של הפנטום מתקרבים לגדם ונעלמים בתוכו. קצוות הגפיים, כפות הידיים והרגליים, האצבעות וחלקים נוספים עם ייצוג גדול יותר בקליפת המוח הסומטו-סנסורית, מורגשים יותר. תופעה זו היא סימן טוב והיא מלווה בשכיחות ובעוצמה נמוכים יותר של כאבי פנטום (תמונה 1).
כאב פנטום (Phantom pain)
כאב פנטום הוא כאב ותחושות דיסאטזיה (Diastasis) המורגשים בחלק החסר של הגפה הקטועה. קיים קשר הדוק בין כאב פנטום, תחושת פנטום וכאב בגדם. לרוב הכאב מתחיל מיד לאחר הניתוח או בימים הראשונים לאחריו: כ-50% מהחולים מתחילים לסבול מכאבי פנטום כבר ביממה הראשונה ועד 75% יסבלו מכאב תוך מספר ימים. בחלק קטן מהחולים יכולה הופעת הכאב להשתהות למספר שבועות או חודשים לאחר הניתוח ובפחות מ-10% מהם יופיע הכאב לאחר שנה.
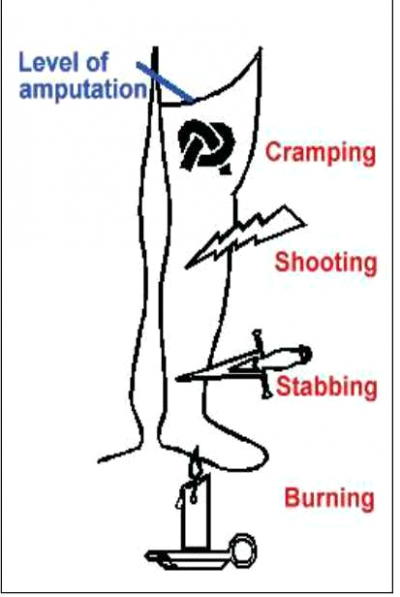
הכאבים מופיעים על פי רוב לסירוגין, אך במיעוט מהחולים הם יכולים להיות קבועים. התקפי הכאב נמשכים מספר שניות, מספר דקות או אף שעות ויכולים להופיע מספר פעמים ביום או במרווחים של מספר ימים או שבועות. אופי הכאב דומה לכאב עצבי (Neuropathic pain) ומרבית החולים מתארים אותו ככאב יורה, דוקר, מוחץ, מפלח, עוויתי, צובט ושורף (תמונה 3).
במקרים רבים ניתן למצוא בגדם נקודות הדק (Myofascial trigger points) שמגע בהם משרה כאב. מרבית החולים חשים את הכאב באזורים המרוחקים של הגפיים - בכפות הידיים והרגליים ובאצבעות והבהונות. אזורים אלו הם בעלי עצבוב צפוף במיוחד ובעלי ייצוג קורטיקלי (Cortical) גדול יותר[12].
טיפול
כאב פנטום הוא אחד הכאבים העקשניים ביותר לטיפול. למרות מגוון רחב של ניסיונות ושיטות שדווחו, על פי הספרות ההצלחה מועטה, ופחות מ-10% מהחולים משיגים ריפוי מלא. נכון להיום אין מסקנות או מוסכמות באשר ליעילותם של טיפולים שונים והדיווחים על הצלחה הם נקודתיים בלבד.
טיפולים תרופתיים
היות שכאב פנטום מוגדר ככאב ממקור עצבי והמנגנון הפתופיזיולוגי והקליניקה שלו דומים לאלה של כאבים ממקורות עצביים אחרים, עיקרי הטיפול התרופתי נצמדים להנחיות הטיפול בכאב עצבי. בבסיס הטיפול התרופתי נמצא נוגדי דיכאון (Antidepressants), נוגדי פרכוס (Anticonvulsants), אופייטים, אופייטים סינתטיים (Tramadol) ואנטגוניסטים לקולטן ל-NMDA.
נוגדי דיכאון-Antidepressants
נוגדי דיכאון הן תרופות הבחירה בטיפול בכאב בעל גוון עצבי. מנגנון הפעולה שלהן כולל עיכוב קליטה מחדש של מוליכים עצביים המעכבים נוראדרנלין (Noradrenaline) וסרוטונין (Serotonin) במערכת העצבים המרכזית. השפעות נוספות של חלק מהתרופות בקבוצה זו הן חסימה חלקית של תעלות הנתרן ותעלות הסידן. נוגדי דיכאון תלת-טבעתיים (Tricyclic antidepressants) כגון Amitrityline ותרופות חדשות מvסוג SNRI(Serotonin–norepinephrine reuptake inhibitor) כגון Duloxetine או Venlafaxine נמצאו יעילות מאוד בטיפול בתסמונות כאב ממקור עצבי.
ההשפעה נוגדת הכאב מושגת במינון נמוך בהרבה מזה הנחוץ לטיפול בדיכאון: 150-25 מ"ג ליממה של Amitrityline לטיפול בכאב לעומת 300-150 מ״ג לטיפול בדיכאון. ההשפעה המרדימה של תרופות אלו תורמת לשיפור איכות השינה. ההשפעה הנוגדת דיכאון רצויה אף היא, שכן אחוז ניכר מהחולים עם כאב ממושך סובלים מדיכאון.
נוגדי פרכוסים-Anticonvulsants
תרופות נוגדות כפיון (אנטי-אפילפטיות) מפחיתות את הפעילות והירי האקטופי בעצב הפגוע ע"י חסימת תעלות נתרן, ומדכאות התפתחות של סנסיטיזציה ע"י חסימת תעלות סידן מסוג Voltage dependent Ca channels וע"י עיכוב שחרור של מוליכים עצביים מעוררים. התרופה הידועה והוותיקה ביותר היא Tegretol (Carbamazepine). תרופות נוספות הן Depalept (Valproic acid), Lamotrigine ו-Topiramate. תרופות חדשות ופופולרית הן ה-Gabapentin וה-Lyrica (Pregabalin). התרופות נמצאו יעילות ובעלות סבילות גבוהה ומעט תופעות לוואי בהשוואה לתרופות ישנות יותר מקבוצת נוגדי הפרכוסים. טיטור Gabapentin הוא איטי- נעשה במשך 4-8 שבועות עם העלאת מינון הדרגתית של בין 600-3,600 מ"ג ליממה. הליריקה ניתנת לטיטור (Titration) מהיר יותר במינונים של 75-300 מ"ג פעמיים ביום. ההשפעה נוגדת הכאב מושגת כבר כעבור שבוע או שבועיים מתחילת הטיפול.
אופיואידים Opioids
האופיואידים משתמשים במנגנונים טבעיים של הגוף לצורך שיכוך הכאב. מנגנוני דיכוי הכאב בגזע המוח משפיעים על אזור עיבוד הכאב דרך המסילות העצביות היורדות, ישירות ובאמצעות שחרור נוירואדרנלין וסרוטונין בקרן האחורית בחוט השדרה. הליגנדים (Ligands) הטבעיים המופעלים הם אנדורפינים (Endorphins), אנקפלינים (Enkephalins) ודינורפין (Dynorphin).
קיימים שלושה סוגים מרכזיים של קולטנים לאפיואידים: δ , μ ו-κ. קישור של אופיואידים לקולטנים אלu גורם לדיכוי השחרור של מתווכים עצביים מעוררים כגון חומר P (Substance P) וחומצה גלוטמית (Glutamate) מקצה העצב שלפני הסינפסה ודיכוי הדפולריזציה בעצב שאחרי הסינפסה.
כאשר מתחילים טיפול באופיואידים צריך לדעת שהתגובה לטיפול, הן מבחינת ההשפעה נוגדת הכאב והן מבחינת תופעות הלוואי, היא מאוד אישית. בשל מתאר פרמקוקינטי (Pharmacokinetics) ופרמקודינמי (Pharmacodynamic) שונה של התכשירים השונים, יש חולים שיגיבו טוב יותר לתרופה מסוימת מאשר לתרופה אחרת מאותו סוג. לכן, כשמתגלה חוסר יעילות או ירידה ביעילות הטיפול, יש צורך להעלות את המינונים או להחליף לתרופה אחרת עם מינון אקוויאנלגטי (Equianalgesic). לאופיואידים שונים סבילות צולבת (Cross tolerance) לא מלאה ולכן חלק מהחולים יהנו יותר מ-Oxycodone או מ-Methadone בהשוואה ל-Morphine. שיטת טיפול זו נקראת Opioid rotation.
הטיפול באופיאטים הוא המבוסס ביותר והיעיל ביותר. נמצא שתוספת של אופיאט לתרופות נוגדות דיכאון ונוגדות פרכוסים מורידה את שכיחות הכאבים מ-60% ל-30% שנתיים אחרי הקטיעה[16]. הזלפה תוך-ורידית של NMDA) Ketamine Antagonist) - נמצאה יעילה לזמן קצר בלבד.
בעבודה אחת דווח שטיפול בהזרקה פרינויראלית (בצמוד לעצב) של Enbrel (Etanercept) שהוא נוגד TNFa, גרם לשיפור בחמישה מתוך שישה חולים מבחינת כאב, תפקוד והמצב הפסיכולוגי[17].
תרופות רבות נוספות נוסו במשך שנים, אך רובן ללא יעילות מוכחת.
טיפולים פולשניים
הרדמה אפידורלית (Epidural) סביב ניתוח וחסימות של עצבים מספקים הפוגה והטבה בכאב רק בתקופה המידית שלאחר הניתוח. לא נמצאה השפעה של הזרקות אלו מעבר לטווח המיידי. לעומת זאת, הזרקת פנול (Phenol) לנוירומה מסתמנת כיעילה מאוד במרבית החולים, עם תופעות לוואי מועטות בלבד[18].
ניסיון טיפול בגלי רדיו (Pulsed radiofrequency) לנוירומה או ל-Dorsal root ganglion דווח במספר חולים עם תוצאות משתנות.
כמו-כן, טיפול באלקטרודה לגירוי חוט השדרה (Spinal cord stimulation) נמצא יעיל בשישה מתוך 19 חולים, עם הקלה משמעותית בכאב לתקופה העולה על שנתיים[19].
התערבויות ניתוחיות כמו Neurectomy או Stump revision יכולות להיות מועילות בחולים עם בעיה בגדם או באלו בעלי נוירומות גדולות. התערבויות כירורגיות נוספות הדגימו תוצאות מאכזבות ורובן לא נמצאות יותר בשימוש בטיפול בכאב פנטום.
סיכום
שכיחותו הגבוהה של כאב הפנטום והיעילות הנמוכה של הטיפולים המקובלים בכאב זה, הופכים את הטיפול בחולים לאתגר קשה ומסובך. ככל הנראה, טיפול משולב ואגרסיבי באמצעים תרופתיים, התערבויות פולשניות וטיפולים פסיכולוגיים וקוגניטיביים מהווים את הדרך היחידה להשגת תוצאה טיפולית שתאפשר שיפור בכאב ובאיכות חיים למטופלים.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה3- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה4- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה5- ↑ 4.0 4.1 4.2 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה6- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה7- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה8- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה9- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה10- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה11- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה12- ↑ 11.0 11.1 11.2 11.3 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה13- ↑ 12.0 12.1 שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה14- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה15- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה1- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה2- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה16- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה17- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה18- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה19
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר ארנולד שטיין, מנהל היחידה לטיפול בכאב, המרכז הרפואי וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק