פוליציטמיה ורה - Polycythemia Vera
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| פוליציטמיה ראשונית – טיפול | ||
|---|---|---|
| Primary polycythemia– Treatment | ||
| שמות נוספים | פוליציטמיה ורה – טיפול - Polycytemia vera – Treatment | |
| יוצר הערך | ד"ר נועה לביא | |
עמוד 27, הערות לעורכים: ויקיזיציה.
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פוליציטמיה
פוליציטמיה ורה (Polycythemia vera, pv) שייכת לקבוצת המחלות המילופרוליפרטיביות המתאפיינות בשגשוג אנומלי של תאים מילואידים שמקורם בתאי אב. בפוליציטמיה ורה נוצרים במח העצם יותר מדי תאים אדומים, לבנים ומגהקריוציטים. תאים אלו מצטברים בדם וגורמים לו להיות צמיגי יותר מהרגיל. כמעט כל החולים עם פוליציטמיה ודה נושאים מוטציה ב-2 JAK2) Janus kinase) הגורמת לשפעולו - 96% מהחולים נושאים מוטציה באקסון 14-JAK2V617F ו-3% באקסון 12. עומס המוטציה (Aaliele (burden ב-jAK2v617F לא משפיע על הישרדות או מעבר ללוקמיה, עומס גבוה של המוטציה קשור עם גרד וסיכוי מוגבר יותר למעבר למילופיברוזיס, לחולים עם מוטציה באקסק 12 נטייה לייצור מוגבר בעיקר של שורה אדומה וגיל מוקדם יותר באבחנה, אך פרוגנוזה דומה לאלו עם המוטציה השכיחה JAK2V617F.
אבחנה - האבחנה של PV נעשית על פי קריטריונים קליניים ומעבדתיים של ארגון הבריאות העולמי ודורשת את קיומם של שני קריטריונים מג'ורים וקריטריון מינורי אחד או קריטריון ראשק מגיורי ו-2 קריטריונים מינוריים (טבלה 1)[1]. זיהוי מוטציה ב- jAK2v617F מאוד רגישה וספציפית על מנת להבדיל בין PV לסיבות אחרות לעליית המטוקריט. רמת אריתרופויטין היא מתחה לערכי הנורמה במעל ל־85% מהחולים עם PV. רמת אריתרופויטין במוכה בהעדר מוטציה ב-JAK2V617F מצריכה אנליזה של JAK2 Exon12 mutation.
משתמשים במונח "masked pv" לחולים עם מוטציה ב-JAK2 ומאפיינים במח העצם המתאימים ל- pv, למרות ערך המוגלובין נמוך יותר, ערך המוגלובין 16.5g/dl לגברים ו-15-16.5g/dl לנשים נקבע כערך הסף להבדל בין חולים עם מוטציה a־jAK2 ואבחנה של essential thrombocytosis לעומת masked PV[2].
- גורמי סיכון המשפיעים על הישרדות ומעבר ללוקמיה או מילופיברוזיס
מחקר שפורסם הדגים חציון הישרדות של 14 שבים בחולים עם PV ובחולים צעירים מתחת לגיל 60, חציון הישרדות - 24 שנים. הסיכוי למעבר ללוקמיה חריפה במעקב של 20 שנה הוא פחות מ־10%, הסיכוי למעבר למילופיברוזיס מעט גבוה יותר[3]. גורמי סיכון המשפיעים על ההישרדות בוללים גיל מבוגר, ספירה לבנה גבוהה ואירוע טרומבוטי קודם[4]. גורמי סיכון המשפיעים על סיכון למעבר ללוקמיה כוללים גיל מבוגר, ספירה לבנה גבוהה וקריוטיפ לא תקין[4].
- גורמי סיכון לטרומבוזיס ודימום
חולים בסיכון גבוה לטרומבוזס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ודדי) קודם. טסיות דם מעל מיליון הם סיכון מוגבר לדמם.
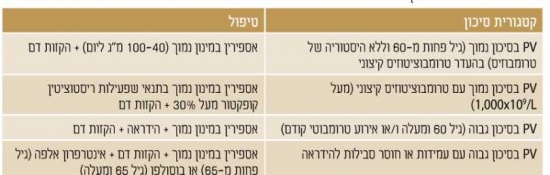
טיפול
מאחר ושיעורי ההישרדות גבוהים והסכנה למעבר ללוקמיה או למילופיברוזיס נמוכים מאד, לא מומלץ ביום לתת באופן רוטיני טיפול כלשהו על מבת להשפיע על המהלך הטבעי של המחלה. מאידך, הסכנה לאירוע טרומבוטי עולה על 20% וחלק לא מבוטל מהחולים סובל מהפרעות וזומוטוריות (כאבי ראש, סחרחורת, עקצוצים בקצות האצבעות, erythromeiaigia - התקפי כאב ואודם בקצות האצבעות, כאבים לא טיפוסיים בחזה) וגרד. בחולים עם טסיות דם מעל מיליון עשויה להיות נטייה לדמם. לכן, מטרת הטיפול העיקרית היא למנוע סיבוכים טרומבוטיים או דמם, ומטרת הטיפול השניונית היא לווסת את התסמינים המיקרווסקולריים (טבלה 2)[5].
טיפול בחולים בסיכון נמוך, בהעדר רמת טסיות קיצונית
מחקר מבוקר (ECLAP study) הוכיח את יעילות הטיפול באםפירין במינון נמוך למניעה אירועים טרומבוטים בחולי PV בכל דרגות הסיכון[6]. מחקרים הראו גם את היעילות של הקזות דם לכל החולים עם PV, כאשר מחקר CYTO-PV[7] הראה שבjולים ששמרו על המטוקריט מטרה פחות מ-45% היו פחות אירועים טרומבוטים ופחות תמותה קרדיווסקולרית לעומת חולים עם המטוקריט 45%-50% ולכן המטרה הטיפולית היא לשמור על המטוקריט פחות מ-45%.
גם אספירין במינון נמוך מפחית סימפטומים וזומוטורים. אם אין השפעה תחת טיפול באספירין, ניתן להעלות מינון אספירין לפעמיים ביום או לטפל בפלביקס במקום או בשילוב עם אספירין. יש סברה שמתן אספירין פעמיים ביום עשוי לעבוד טוב יותר מאשר פעם ביום במקרים מסוימים ולכן, שוקלים לעיתים גישה טיפולית זו בחולים עמידים לטיפול באספירין פעם ביום או לאלו עם יותר גורמי סיכון לטרומבוזיס עורקי.
גרד מופיע ברוב החולים עם PV ולרוב מוחמר על ידי מים חמים. יש להתחיל טיפול באמצעים לא תרופתיים כגון הימנעות מגורמים מחמירים (הימנעות מעור יבש, טמפרטורות קיצוניות ורחצה במים חמים). תיתכן תגובה לאנטי-היסטמינים. תוארה תגובה של מעל 50% לגרד על ידי שימוש ב-paroxetine (סרוקסט/פאקסט), תרופה נוגדת דיכאון ממשפחת SSRIS. טיפולים אחרים יעילים לגרד כוללים טיפול באינטרפרון, מעכבי JAK ופוטותרפיה.
טיפול במולים במיכון נמוך עם רמת מםיות קיצונית או נטייה לדמם
(Acquired von-wilibrand syndrome, (AvWS שכיחה בחולי PV ומתאפיינת באיבוד מולטימרים גדולים של פקטור von-willibrand, בשל פירוק מוגבר על ידי ADAMTS13 התלויה בחומרת הטרומבוציטהיס. Avws מביא להפרעה תפקודית משמעותית יותר מאשר נראה כאשר בודקים אנטיגן von-wilibrand ורמות פקטור vm ולק יש צורך כתבחינים המעריכים תפקוד של פקטור -von wilibrand ככרן פעילות ריסטוציטץ קופקטור. כשרמת הטסיות מעל.1000x1071 יש למדוד פעלות ריסטוציטין קופקטוו־ ולשקול הימנעות מאספירין אם
הפעילות פחות מ-30% מחשש לדמם. מצד שני, טרומבוציטודם קיצונית לא מגבירה סיכון לטרומכודם ואינה מהווה התוויה לטיפול ציטורדוקטיבי, טיפול בחולי PV בסיכון נבוה(גיל 60 ומעלה או אירוע טרומבוטי קודם) בנוסף לאספירץ והקזות דם, חולים בסיכון גבוה צריכים לקבל גם טיפול ציטורדוקטיבי עם הידראה על מנת להפחית סכנה לטרומבוזים, בחולים עם אירוע טרומבוטי ורידי מומלץ לטפל בבוגרי קרישה ולשקול טיפול באספירין. טרנספורמציה לוקמית הוכחה כקשורה עם טיפול pipobroman-a ו-32ק שאינם בשימוש כיום אך לא עם טיפול בהידראה. עמידות או חוסר סבילות לטיפול בהידראה -עמידות או חוסר סבילות להידראה (טבלה 3)5 יכולה להתפתח ב-20%-25% מהחולים עם PV'. עמידות קשורה עם סיכון מוגבר לטרנספורמציה ללוקמיה ומילופיברריס וירידה בהישרדות. ההישרדות הממוצעת בחולים עמידים להידראה הינה 1.2 שנים בלבד. חוסר סבילות להידראה לא משפיע על הפרוגנוזה, טיפול בחולי PV בסיכון גבוה עם עמידות או חוסר סבילוח להידראה חולים עם עמידות או חוסר סבילות להידראה יכולים להיות מטופלים בצורה יעילה על ידי אעטרפרון או בוסולפן. מחקרים קליניים הדגימו שיעור גבוה של הפוגה המטולוגית עם טיפול PEG-interferon-a ואף ירידה AK2V617F-a| allele burden. אולם, הטיפול באינטרפרון כרוך בתופעות לוואי קשות ורבים מהחולים לא סובלים טיפול זה. מנכד, קיים חשש שטיפול בבוסולפן מגביר סיכוי לטרנספורמציה ללוקמיה ולכן מעדיפים להימנע מהשימוש בו בחולים צעירים. קבוצת החולים עם PV עם חוסר סבילות או עמידות לטיפול בהידראה ואלו הממשיכים להיות סימפטומטיים למרות טיפול בהידראה מהווים קבוצה של חולים עם צרכים שלרוב אין להם פתרון עם הטיפולים הקיימים. חשוב לזכור גם שמעבר ללוקמיה 3!־PV בדר׳׳כ מופיע בתאים שהם שליליים למוטציה JAK2V617F ולכן ירידה allele burden-a של AK2V617F! על ידי תרופות לא בהכרח מתורגמת ליתרון ארוך טווח. מחקרים קליניים pv-n שמים כעת דגש על קבוצות חולים אלו. מבין התרופות הנחקרות, מעכבי 1AK עשויים להיות בעלי ערך טיפולי בחולים עם עמידות/חוסר סבילות להידראה. ד"ר נועה לביא. המכון ההמטולונ׳, הקריה הרפואית רמב"ם, חיפו
- המוגלובין מעל לאחוזון 99; או מעל 172/dl מבו־ים, 1-I5g/dl בנשים אם מלווה בעליי־ קבוע־ בלפחות 2g/dl מערך הבסיס ולא בכלל תיקון של חסר בחל; או עלייה בנפח כדוריות דם אדומות מעל %25 מהערך הממוצע המצופה
טבלה 3. קויטריונים לענדדות או חוטר סבילות להידראה ELN) European Leukemia Net) Hematology, 2015 6. Landolfi R, Marchioli R, Kutti J, et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med. 2004 7. Marchioli R, Finazzi G, Specchia G, etal. Cardiovas¬cular events and intensity of treatment in polycythe-mia vera. N EnglJ Med 2013 8. Barosi G,Birgegard G, Finazzi G, et al. A unified definition of clinical resistance and intolerance to hydroxycarbamide in polycythaemia vera and primary myelofibrosis; results of a European LeukemiaNet (ELN) consensus process. BrJHaematol 2010 9. Sever M, Newberry K, Verstovsek S.Therapeutic options for patients with polycythemia vera and essential thrombocythemia refractory/resistant to hydroxyurea. Leukemia & Lymphoma Dec 2014 10. Vannucchi,etal. Ruxolitinib versus Standard Ther- apy for the Treatment of Polycythemia Vera N Engl J Med 2015 טבלה 2. טיפול 0ל פי סיכון pv-n
1. Tefferl A, Vardiman JW: Classification and diagnosis of myeloproliferative neoplasms; the 2008 World 2. Health Organization criteria and point-of-care diag¬nostic algorithms. Leukemia 2008 2. Barbui T,Thiele J, Carobbio A, etal. Discriminating between essential thrombocythemia and masked polycythemia vera in JAK2 mutated patients. Am J Hematol2014 3. Tefferi A, Guglielmelli P, Larson DR, et al. Long-term survival and blast transformation in molecularlyanno-tated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood 204ו 4. Tefferi A, Rumi E, Finazzi G, etal. Survival and prognosis among 1545 patients with contemporary polycythemia vera: An international study. Leukemia 2013 5. Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2015 update on diagnosis, risk stratification and management American Journal of
ביבליוגרפיה
- ↑ Tefferl A, Vardiman JW: Classification and diagnosis of myeloproliferative neoplasms; the 2008 World 2. Health Organization criteria and point-of-care diag¬nostic algorithms. Leukemia 2008
- ↑ Barbui T,Thiele J, Carobbio A, etal. Discriminating between essential thrombocythemia and masked polycythemia vera in JAK2 mutated patients. Am J Hematol 2014
- ↑ Tefferi A, Guglielmelli P, Larson DR, et al. Long-term survival and blast transformation in molecularlyanno-tated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood 2014
- ↑ 4.0 4.1 Tefferi A, Rumi E, Finazzi G, etal. Survival and prognosis among 1545 patients with contemporary polycythemia vera: An international study. Leukemia 2013
- ↑ Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2015 update on diagnosis, risk stratification and management American Journal of Hematology, 2015
- ↑ Landolfi R, Marchioli R, Kutti J, et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med. 2004
- ↑ 7Marchioli R, Finazzi G, Specchia G, etal. Cardiovas¬cular events and intensity of treatment in polycythe-mia vera. N EnglJ Med 2013


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק