תרומבומודולין - Thrombomodulin
| מדריך בדיקות מעבדה | |
| תרומבומודולין | |
|---|---|
| Thrombomodulin | |
| שמות אחרים | THBD, CD141, BDCA3, fetomodulin |
| 250 פיקסלים | |
| מעבדה | כימיה בדם |
| תחום | תפקודי קרישה |
| טווח ערכים תקין | תחת ל-10 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
האנטיגן שתואר כ-BDCA3 או כ-CD141, התגלה למעשה כזהה ל-TM 0 (על פי Dzionek וחב' ב-Human Immunol משנת 2002). כך התגלה שמולקולה זו מופיעה על פני תת-קבוצה נדירה ביותר (0.02%) של תאים דנדריטים באדם הקרויה MDC2 אם כי תפקידו של TM בתאים אלה אינו ידוע.
מוטציות ב-TM (Thrombomodulin) חשובות יותר במחלות עורקיות מאשר במחלות ורידיות (Fareed ו-Iqbal ב-Diagn Mol Pathol משנת 2017). פולימורפיזם של TM, של שחלוף נוקלאוטיד G על ידי A בעמדה 127 של הגן נחקר בהקשר של הרלוונטיות שלו במחלה עורקית. האלל 25Thr נמצא שכיח יותר בגברים עם אוטם שריר הלב, מאשר באוכלוסיית ביקורת. פולימורפיזם נדיר ב-promoter של הגן ל-TM הידוע כ-33G/A-, משפיע על רמות ה-TM המסיס בפלזמה ומגביר את הסיכון למחלת לב כלילית. נשאים של האלל 33A- נמצאו בעלי שכיחות מוגברת של תהליכי טרשת בעורקים התרדמניים (carotids) בנבדקים מעל גיל 60 שנה.
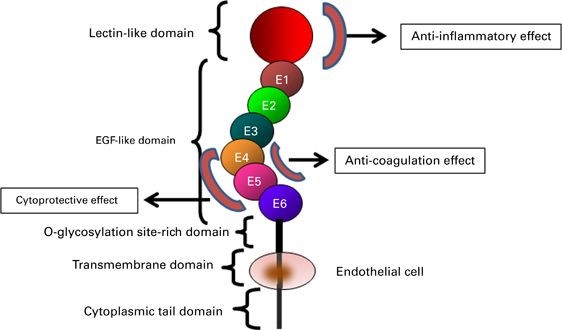
המבנה של TM
TM התגלה בשנת 1982 על ידי Esmon וחב' ב-J Biol Chem, ונמצא שבנוסף להיותו מצפה את שכבת האנדותל הווסקולרי, הוא מופיע באופן נרחב במספר רקמות נוספות, מה שמרמז למספר תפקידים נוספים לאלה המקובלים שלו, כאנטי-קואגולנט וכנוגד דלקת (Van de Wouwer ו-Conway ב-Crit Care Med משנת 2004). TM זוהה ברקמות רבייה באדם כגון בשלייה וב-myometrium (Uszyński וחב' ב-Adv Med Sci משנת 2006), באפיתל החניכיים (Matsuyama וחב' ב-J Periodontal Res משנת 2000), בקרטינוציטים (Senet וחב' ב-Arch Dermatol Res משת 1997), בניטרופילים רב-מורפו-נוקלאריים (Conway וחב' ב-Blood משנת 1992), במונוציטים (Tsai וחב' ב-Shock משנת 2010), בדנדריטים (Yerkovich וחב' ב-J Allergy Clin Immunol משנת 2001), באוסטאובלסטים (Maillard וחב' ב-Endocrinology משנת 1993) ואפילו בטסיות-דם (Suzuki וחב' ב-J Biochem משנת 1988). TM זוהה גם במגוון של תאים בתרבית, כולל תאי שריר חלק (Soff וחב' ב-Blood משנת 1991), בתאי A549 של SCLC (Fujiwara וחב' ב-Pathol Int משנת 2002), ותאי NIH 3T3 (Dittman וחב' ב-J Biol Chem משנת 1988), בעוד שווריאנטים מסיסים של TM התגלו בשתן (Nakano וחב' ב-Thromb Haemost משנת 1988) ובנסיוב (Zycinska וחב' ב- Eur J Med Res משנת 2009).
גליקו-חלבון טרנס ממברנלי זה מכיל מקטע N-טרמינלי דמוי לקטין C-type, C מקטעים דמויי EGF, מקטע עתיר serine/threonine עם נקודות קישור של שרשרות סוכריות בקשר O-גליקוזידי, מקטע טרנסממברנלי ומקטע ציטופלזמטי קצר. התרומבין נקשר למקטעים 5-6, כאשר המקטעים 4-6 נדרשים לשפעול של protein C, ואילו המקטעים 3-6 נדרשים לשפעול של TAFI או thrombin-activatable fibrinolysis inhibitor.
הגליקופרוטאין TM הוא פוליפפטיד מונומרי type 1 המכיל 557-9 חומצות אמינו ומכיל חמישה מקטעים חוץ-תאיים (Suzuki וחב' ב-EMBO J משנת 1987, ו-Sadler ב-Thromb Hemost משנת 1997). למרות שמקטע הקצה דמוי לקטין C אינו בעל פעילןת אנטי-קואגולנטית, הוא משחק תפקיד חשוב בתיווך הפעילויות נוגדות הדלקת של TM (על פי Conway וחב' ב-J Exp Med משנת 2002). המקטע הבא של TM מכיל 6 מקטעים דמויי-EGF החוזרים על עצמם. מקטע זה נמצא בעל פעילות מיטוגנית על פיברובלסטים בתרבית ועל תאי שריר-חלק בדופן כלי דם. פעילויות אלה תווכו על ידי שפעול האנזים protein kinase C ועל ידי protein kinase המשופעל על ידי מיטוגן (MAPK) על פי Tohda וחב' ב-Arteriosclr Thromb Vasc Biol משנת 1998. האינטראקציה של הקטעים EGF5-6 עם תרומבין מונעת את הקישור של תרומבין עם מצעים המשתתפים בתהליך הקרישה כמו פקטור V או פיברינוגן (Esmon וחב' ב-J Biol Chem משנת 1982, Hofsteenge וחב' ב-Biochem J 1986 משנת 1986 ו-Tsiang וחב' ב-J Biol Chem משנת 1992). הקטעים החוזרים על עצמם EGF4-6, דרושים לשפעול של protein C, ואילו הקטעים EGF3-6 נחוצים לשפעול של TAFI (על פי Wang וחב' ב-J Biol Chem משנת 2000, ו-Wu וחב' באותו כתב עת משנת 2009).
המקטע השלישי, זה העתיר ב-serine וב-threonine, נושא שיירי OH-, אליהם נקשרות שרשרות סוכרים בקשר O-glycosidic. מקטע זה מסייע לקישור של chondroitin sulfate (להלן CS). מחקרים הראו שכאשר CS נקשר ל-TM הוא מגביר את היכולת של TM לשפעל את protein C (על פי Koyama וחב' ב-Eur J Biochem משנת 1991, ו-Elisen וחב' ב-Blood משנת 1998). בנוסף, קישור CS ל-TM מזרז את הנטרול של תרומבין ומעודד את הקישור של platelet factor 4 (להלן PF4) ל-protein C (על פי Mosnier ב-J Biol Chem משנת 2011). השייר של CS עשוי לחזק את הקשר תרומבין-TM, על ידי התקשרותו עם החלק קושר האניונים של תרומבין, אותו חלק אליו נקשר הפארין. נמצא שהפארין מעכב את הקשר תרומבין-TM, כנראה על ידי תחרות עם הקומפלקס TM-CS על קישור עם תרומבין (De Cristfaro וחב' ב-Circulation משנת 1998).
המקטע המשומר היטב הטרנס-ממברנלי, מלווה על ידי מקטע זנב ציטופלמי קצר. שייר ציסטאין במקטע זנב זה, כנראה מתווך ב-multimerization של TM (על פי Conway וחב' ב-J Cell Physiol משנת 1994). בתאי אנדותל של וריד האדם בתרבית, קישור של תרומבין ל-TM השרה אירועי איתות שהובילו לשפעול של nitric oxide synthase-3 אנדותליאלי דרך מודולציה של הקולטן הקשור לחלבון G (על פי David-Dufilho וחב' ב-J Biol Chem משנת 2005). למרות שעכברי knockout החסרים לחלוטין TM מתים עוד ברחם בגלל פגם בהתפתחות השלייה (Healy וחב' ב-Proc Natl Acad Sci USA משנת 1995), עכברי knock-in המבטאים TM מוטנטי החסר את המקטע הציטופלזמי של TM, לא מראים כל אנומליה בהתפתחות העוברית, בהישרדותם וביכולת הקרישה שלהם (Isermann וחב' ב-Developement משנת 2001, ו-Conway וחב' ב-Blood משנת 1999).
תרומבומודולין (להלן TM) הוא גליקופרוטאין ממברנלי המבוטא על פני תאים אנדותליאליים (Lougheed וחב' ב-Protein Sci משנת 1995). גליקופרוטאין זה מבוטא בגוף ב-2 צורות: לצורה הראשונה משקל מולקולרי גבוה יותר (150,000 דלטון) והיא קשורה לממברנה הציטופלזמית של תאי האנדותל, בעוד שלצורה השנייה משקל מולקולרי נמוך יותר (69,000 דלטון) והיא מבטאת את הצורה המסיסה או הפלזמטית (Ohlin וחב' ב-Tromb Res משנת 1996, ו-Tomura וחב' ב-Clin Nephrol משנת 1994). המרכיב החלבוני של TM מכיל מספר מקטעים, שכל אחד מהם מכיל כ-40 חומצות אמינו, המשפיעים על המבנה השלישוני של TM, ואחראיים לספציפיות הפעולה שלו. רצפי חומצות אמינו אלו, יכולים לשמש כקו-פקטורים בשפעול של protein C, ויש להם פעילות נוגדת-קרישה על ידי התקשרות לתרומבין. TM עשוי לעודד שגשוג של תאי אנדותל כאשר תכונה זו של TM תלויה במבנה המקטע של המולקולה הידוע כמקטע דמוי-EGF.
המבנה המולקולרי של TM
הגן המקודד ל-TM ששובט באופן בלתי-תלוי על ידי Wen וחב' ב-Biochemistry משנת 1987, ועל ידי Suzuki וחב' ב-EMBO J מאותה שנה, מספריית cDNA באדם. TM על פי מחקרים שונים הוא בעל משקל מולקולרי של 70-100 אלף דלטון. הגן המקודד ל-TM ממוקם על כרומוזום 20 בעמדה 20p12 (Espinosa וחב' ב-Genomics משנת 1989). גן זה אינו מכיל כלל introns (על פי Norlund וחב' ב-Thromb Haemost משנת 1997, ו-Ireland וחב' ב-Haemostasis משנת 1996). המקטעים עם המבנה דמוי-EGF, משחקים תפקיד חשוב כקו-פקטורים, והם מכילים שלושה שיירי ציסטאין בתוך הרצף של 40 חומצות אמינו, המייצרים שלושה קשרים דיסולפידיים. הרצף של חומצות האמינו של TM כולל את המקטעים הבאים: אלמנט דמוי-לקטין N-טרמינלי המכיל את שיירי חומצות אמינו 1-154, אזור הידרופובי עם שיירי חומצות אמינו 155-222, שישה מודולים דמויי-EGF עם שיירי חומצות אמינו 223-462, אזור אחד עשיר בחומצות האמינו serine ו-threonine עם שיירי חומצות אמינו 463-497, מקטע טרנס-ממברנלי אחד מורכב מ-24 חומצות אמינו (498-521), ו"זנב" של 36 חומצות אמינו ציטופלזמטיות (522-557). תרומבין נקשר למקטעים דמויי-EGF וקשר זה מתחזק על ידי הנוכחות של cosaminoglycans בחוליה העשירה ב-serine ו-threonine.
המבנה של אזור המקטעים דמויי-EGF, מכיל 2 טבעות המורכבות מ-9-15 חומצות אמינו. הטבעת ה-N טרמינלית מורכבת מחומצות האמינו הממוקמות בין שיירי ציסטאין השלישי והרביעי, היוצרים 2 קשרים די-סולפידיים בין שיירי ציסטאין הראשון והשלישי, וכן בין שיירי ציסטאין השני והרביעי, בהתאמה. הטבעת ה-C טרמינלית נוצרת על ידי חומצות האמינו בין שיירי ציסטאין החמישי והשישי היא טבעת פשוטה עם קשר די-סולפידי בודד. אזור התרומבו-מודולין הנמשך בין המקטעים החמישי והשישי, מעכב את פירוקו של פיברינוגן, אך גם משחק תפקיד כמעכב תחרותי של שפעול protein C. פעילות ה-co-factor של המקטעים הרביעי והשישי דמויי-EGF, תלויה בנוכחות של המקטע הרביעי דמוי-EGF. העובדה שמקטע רביעי זה אינו נקשר היטב לתרומבין, למרות חיוניותו לשפעול של protein C, מצביעה על חשיבות פעילותו המשותפת עם המקטע החמישי דמוי-EGF. נראה אם כן שהאזור ב-TM החיוני בקשר של האחרון עם תרומבין, ממוקם במקטע החמישי דמוי-EGF.
ההתקשרות בין תרומבין ו-TM משפעלת את החלבון protein C, כאשר הקומפלקס האמור פועל הן כנוגד קרישה וגם נוגד-דלקת (Esmon ב-Hematologica משנת 1995). גורמים רבים כגון ציטוקינים (IL-1 ו-TNF), וכן ניטרופילים, יכולים להיות בעלי תפקיד רגולטורי בפעילות TM. ציטוקינים מפחיתים את הביטוי של TM על פני תאי האנדותל, ומבקעים את המולקולה כאשר מתקיים שפעול של פעילות דלקתית (MacGregor וחב' ב-Am J Respir Crit Care Med משנת 1997). לעומת זאת, ניטרופילים משפיעים על פעילות TM על ידי האנזים elastase.
תכונות גנטיות
החשיבות של המבנים הראשוני, שניוני ושלישוני ביצירת המבנה התלת-ממדי של TM, באה לביטוי בנבדקים עם מוטציה בגן המקודד ל-TM. בני-אדם עם מוטציה כזאת, הם בעלי סיכון מוגבר לאירועים קרדיו-וסקולריים. המוטציה בגן המקודד ל-TM, של שחלוף 127guanine- על ידי adenine-127, מביא ל-TM המכיל שחלוף של חומצת אמינו ala25thr, המגביר הסיכון של מחלה קרדיו-וסקולרית בגברים. סיכון אחרון זה גדל באופן טבעי בהקשר של פקטורים מטבוליים נוספים (Doggen וחב' ב-Thromb Haemost משנת 1998). מחקר שהתבצע במטופלים ששרדו התקף-לב, מצא שהדי-מורפיזם C/T (או cytosine/thymine) בעמדת נוקלאוטיד 1418 בגן המקודד ל-TM, הוא מדד ניבוי חשוב של התקף-לב בגיל צעיר. די-מורפיזם זה המביא לשחלוף של valine על ידי alanine בעמדה 455 של TM, הממוקמת במקטע השישי דמוי-EGF, כרוכה בשכיחות גבוהה יותר של התקפי-לב. השחלוף של valine ב-alanine מייצר מולקולת TM עם תפקוד שונה, ועם שינוי במבנה המרחבי באזור הקשור לתרומבין והשפעול של protein C. מוטציות במבנה המולקולרי יכול גם להשפיע על רגישות TM לפעילות פרוטאוליטית ומשפיעה גם בריכוז בנסיוב של הפרגמנטים תוצרי הפעילות הפרוטאוליטית. הקומבינציה האללית C/T, C/C ו-T/T בעמדה 1418, מביאה להפחתה בשפעול של protein C, ולהגברת פעילות תרומבין.
בנבדקים עם אירוע קודם של התקף-לב, ההבדל בריכוז של alanine 455 ו-valine 455, היה שונה משמעותית מההבדל בריכוזים אלה בפרטים בריאים. מוטציות בעמדה 455 שכיחות יותר באוכלוסייה אסיאתית. המוטציה בעמדה 9,10 מ-GG ל-AT זוהתה רק באלה שעברו התקף-לב, ואף לא באחד מהנבדקים הבריאים, ומוטציות אלה נמצאו ב-4.8% מחולי הלב. כל המוטציות הללו הופיעו במקטעים TM2 ו-TM3.
מטבוליזם של TM
ריכוזי TM בנסיוב תלויים ב-turnover של תאי אנדותל, הגורם להפרשת TM לנסיוב. הפינוי של TM מהנסיוב מתבצע דרך הכליות, ובמהלך מטבוליזם בכבד (Boffa ב-Haemostasis משנת 1996). ריכוזי TM בנסיוב מוגברים בתרחישים של כשל כליות, ונמצאים במתאם עם רמות קראטינין בנסיוב. תקופת מחצית החיים שלו היא 10 דקות (Kuasako וחב' ב-Int Angiol משנת 1997). רמת בנסיוב של TM יכולה לבטא את היחס בין רמת TM מסיס לבין רמת קראטינין בנסיוב, מה שיכול להבדיל בין רמות TM מוגברות בגלל כשל כליות, לבין רמות TM מוגברות בגין נזק לתאי אנדותל. יצירת TM על ידי תאי אנדותל מווסתת בעיקר על ידי cAMP, חומצה רטינואית וכן על ידי הציטוקינים IL-4 ו-IL-13.
הפיזיולוגיה של TM
ייצור של TM מווסת על ידי רצפים הקרובים לגן שלו. והוא מושפע גם על ידי המיקרו-סביבה הווסקולרית, וגורמים רבים כגון נוכחות שלtPA או ,tissue plasminogen activator ונוכחות של PAI-1 או plasminogen activator inhibitor (Wada וחב' ב-American Journal of Hematology משנת 1998). כמו כן, ציטוקינים דלקתיים, ריאקציות חיסוניות וה-cascade של הקרישה, גם כן משפיעים על רמות TM. קיים שיתוף של הקולטן לתרומבין וזה של מולקולת TM (Esmon ב-Circulation משנת 1997). כאשר TM מגיע לריכוזים גבוהים, הוא נקשר לתרומבין ביחס של 1:1, ובכך חוסמים את השפעול של מפל הקרישה ואת protein C. פיברינוגן ופקטור VII משתתפים ביצירה של קריש הדם. רמות גבוהות של פקטור VII מעודדות את יצירת תרומבין שהוא אנזים מפתח ביצירת פקקת עורקית, וגם פקטור מעודד מיטוזה בתאי שריר חלק, ובפיברובלסטים. תרומבין הוא גם משפעל עוצמתי של טסיות דם, על ידי שפעול של ניטרופילים, ומעודד הופעתם של מולקולות ספיחת ליקוציטים על פני תאי אנדותל.
על ידי האינטראקציה עם TM, תרומבין יכול להתחיל מפל אנטי-קואגולנטי, על ידי שפעול של protein C. נראה שתרומבין מסוגל לתווך בתגובות הווסקולריות לאירועים התומכים בקואגולציה, אך גם באנטי-קואגולציה, דלקת ופרוליפרציה. שני מנגנונים עיקריים תורמים למחלה פקקתית באדם: המסלול האנטי-קואגולנטי של protein C, ומנגנון האנטי-תרומבין של הפארין. שתי מערכות פיזיולוגיות אלו, פועלות ביחד לווסת תהליכי הקואגולציה. מסלול protein C מעכב את התפקוד של הפקטור המווסת Va, ושל פקטור VIIIa. מערכת ההפארין-אנטי תרומבין מעכבת את הפרוטאזות הקשורות לקואגולציה.
מסלולי השפעול של protein C והתרחשויות קליניות הכרוכות בפגמים במסלולים אלה
מסלול ה-protein C מתחיל באינטראקציה בין תרומבין ל-TM הגורם להתמרה של תרומבין באנזים המתחיל בתגובה אנטי-קואגולנטית. בגין הפולימורפיזם של protein C , ניתן לבחון את הקשר בין העמידות לצורתו המשופעלת של protein C לבין מחלות קרדיו-וסקולריות. השינוי בתפקוד של protein C, תורם להגברת הסיכון של התקף לב. השפעול של protein C הוא כמעט בוודאות כתוצאה מיצירת הקומפלקס תרומבין-TM. ניתן לשער שרמות נמוכות של TM מחלישות את התגובה האנטי-קואגולנטית כאשר הרמות הסיסטמיות של תרומבין עולות, ובכך מסייעות להיווצרות הפקקת באזורים של נזק וסקולרי. הודגם שהנוכחות של TM מפחיתה את יכולת תרומבין לשפעל תאים דרך הקולטן שלו. מחקרים אלה התבצעו על תאים המבטאים קולטנים לתרומבין, אך אינם מכילים קולטנים של TM. כאשר התאים האחרונים עברו transfection עם TM, והתגובה לתרומבין הוחלשה בגלל רמות TM שהוגברו. נראה ש-TM מעכב את שפעולם של תאים על ידי תרומבין, על ידי ש-TM פועל על קולטני תרומבין. כמו כן נראה, שאובדן הפעילות של TM יכולה לתרום באופן מקומי להתפתחות טרשת עורקים ולהתנתקות הרובד הטרשתי. רמות נמוכות של TM במטופלים עם מוטציות באזור ה-5' של הגן המקודד ל-TM, יכולות ליצר וריאנט של protein C המתנהג באופן פחות פעיל במהלך התקפים איסכמיים, ובכך להגביר את הפציעה הקרדיו-וסקולרית. TM מפגין גם פעילות הדומה לזו של גורם גדילה. רצפים חוזרים דמויי-EGF בצורה המולקולרית המסיסה של TM, התואמים את הפרגמנטים של TM שנבקעו פרוטאוליטית, הם בעלי השפעה למיטוזה של פיברובלסטים ושל תאי אנדותל.
מאפיינים פתו-פיזיולוגיים של TM
Protein C משחק תפקיד מהותי בפתו-פיזיולוגיה של תהליכי פציעת האנדותל, על ידי שהוא חוסם ראקציות דלקתיות באופן שניוני לשחרור פפטידים דלקתיים במהלך הקואגולציה, הפיברינוליזה ושפעול המשלים. באופן טבעי בתהליך זה, TM משתתף באופן פעיל בעצם יכולתו לשפעל את protein C. הביטוי של TM על פני שטח התאים, יכול להיות מושפע על ידי חומרים אחדים, כגון fibrinogen degradation products או FDP , bradykinine ,complement factor C3a, כאשר כל אלה מתפקדים כגריינים של תאי דלקת (כניטרופילים, מונוציטים ומקרופאגים) לייצר ציטוקינים. ידוע שציטוקינים כגון IL-1 ו-TNF מפחיתים את הביטוי של TM. גם אנדו-טוקסינים כמו LPS, אלסטאזה המופרשת על ידי ניטרופילים, רדיקלים חופשיים של חמצן, מי חמצן וכן anaphilotoxin, מסוגלים להפחית את פעילות TM על ידי שהם משפיעים על הביקוע וההסרה של החלק החוץ-ציטופלזמטי שלו. נתון נוסף הוא שניטרופילים משופעלים יכולים לשחרר TM מתאי אנדותל. החמצון של שיירי מתיונין ב-TM על ידי תוצרי שפעול של ניטרופילים, יכול לחסום את הפעילות דמוית הקו-פקטור של TM. הניטרופילים המשופעלים גורמים לדה-סנסיטיזציה של הפעילות האנטי-קואגולנטית של TM, על די תוצרים של הניטרופילים כגון אלסטאזה, catepsin G ומי חמצן.
רמות של TM בנסיוב ומינוניו
מצבים פיזיולוגיים שונים מגבירים בצירקולציה את רמות TM מסיס. תאי אנדותל החשופים יותר לערבול המודינאמי (כגון bifurcation של עורקים טרשתיים דוגמת העורקים התרדמניים), משחררים כמויות גדולות של TM. רמות תרומבומודולין בנסיוב נעות בתרחישים שונים בין 3-300 ננוגרם/מ"ל. הסברה היא שריכוז נורמלי של TM הוא 1.3±3.1 ננוגרם/מ"ל, והוא במעט גבוה יותר בגברים. נראה שבנשים רמות TM עולות בגיל חידלון הווסת. בנשים בהן מנופאוזה הושרתה על ידי פעולה כירורגית, רמת TM מסיס גבוהה בהרבה מרמתו הנורמלית. שישה שבועות לאחר התחלת טיפול הורמונלי משלים (HRT) בנשים בגיל המעבר, רמת TM פוחתת משמעותית (Lip וחב' ב-Am Heart J משנת 1997). בנבדקים שחורים רמות TM נמוכות יותר מאשר בלבנים (Salomaa וחב' ב-Lancet משנת 1999).
רמות TM נמדדות בדרך כלל בשיטת ELISA, ומחקר שבחן פרגמנטים מסיסים של TM בצירקולציה, מצא שהפרגמנטים הקטנים יותר (משקל מולקולרי 69,000 דלטון), היוו את המקטע החוץ-תאי של TM, בעוד שהפרגמנטים הגדולים יותר (משקל מולקולרי מעל 150,000 דלטון) הם חלקי TM בממברנת התאים או בציטופלזמה שלהם. מחקרים אחרים אף הם בשיטת ELISA, הראו שוני בהרכב בנסיוב של הפרגמנטים הקלים והכבדים במחלות שונות כמחלת כליות כרונית או חריפה, תסמונת מצוקה נשימתית במבוגרים, פקקת תסחיפית ריאתית, ו-DIC (או disseminated intravascular coaggulation) (על פי Shogo וחב' ב-Blood משנת 1990).
רמות TM מראות גם שוֹנוּת גדולה בלוגמי אלכוהול מתונים, כיוון שריכוז אלכוהול נמצא במתאם הופכי עם הצורה המסיסה של TM. לעומת זאת, נמצא מתאם חיובי משמעותי בין רמות TM לבין שנות עישון סיגריות (Markuliak וחב' ב-Nouv Rev Fr Hematol משנת 1995). תאי שריר חלק וסקולריים, וכן תאים של מספר סוגי סרטן, מייצרים אף הם TM בתנאי in vivo ו-in vitro. פרט לתאי אנדותל ולתאים וסקולריים לימפתיים, TM מיוצר גם על ידי טרופובלסטים, תאי mesangium ו-mesothelium וכן על ידי leptomeninges. יתרה מכך, הבדל משמעותי ברמות TM מסיס הודגמו על ידי תאים עם קבוצות-דם (ABO) שונות (Blann וחב' ב-Br J Hematol משנת 1996). הריכוז של TM נמוך יותר בנבדקים עם קבוצת דם O ו-A, וגבוהים יותר באלה עם קבוצת דם B. בנבדקים עם קבוצת דם AB, רמות TM שנמדדו נמצאו רמות ביניים בין אלה עם קבוצת דם A או עם קבוצת דם B.
רמות TM במצב של DIC: במהלך ספסיס עם DIC, רמות גבוהות של TM משתתפות לכאורה בהתפתחות כשל רב מערכתי (MOF) (על פי Endo וחב' ב- Molec Pathol Pharmacol Res Commun משת 1995). מטופלים עם רמות גבוהות יותר של TM במהלך DIC, הם בעלי שיעור תמותה גבוה יותר בהשוואה למטופלים ששורדים.
רמות TM במהלך ניתוחי לב ובעת התקף-לב: במטופלים שעוברים ניתוח לב חלה עלייה ברמת TM במתאם על דרגת הסיבוך של הניתוח, הגיל, והתמשכות המצוקה הלבבית (Boldt וחב' ב-Br J Anaesth משנת 1995). מוטציות בגן המקודד ל-TM מעודדות אוטם שריר לב. TM עם תפקוד פגום כתוצאה ממוטציות אלו, עם יכולת אנטי-קואגולנטית מופחתת (Neumann וחב' ב-Circulation משנת 1995). עם זאת, רמות TM מסיס פוחתות כתוצאה מעיכוב המנגנונים המושרים על ידי ציטוקינים, האחראיים ליצירת TM.
רמות TM בעת התפתחות טרשת עורקים: תהליכים טרשתיים כרוכים ברמות גבוהות של TM מסיס (Tohda וחב' ב-Arteriosclr Thromb Vasc Biol משנת 1998). רמות של TM מסיס מוגברות במטופלים עם מחלה טרשתית-עורקית מקומית, כמו זו בעורקים התרדמניים, או בעורקי הכסל והירך. רמות TM גבוהות עוד יותר באלה עם מחלה רב-וסקולרית, כמו טרשת תרדמנית, כלילית וזו בעורקי הירך והכסל. נראה אם כן שרמת TM מסיס נמצאת במתאם עם פתולוגיה וסקולרית (Blann וחב' ב-Eur J Clin Invest משנת 1997). כמו כן, הודגם ש-mRNA של TM במונוציטים נמצא במתאם חיובי עם רמות נמוכות של LDL (על פי Oida וחב' ב-Thromb Haemost משנת 1997).
רמות TM בתסמונת מצוקה נשימתית קשה (ARDS): עלייה בולטת ברמת TM (מעל 100 ננוגרם/מ"ל), יכולה לנבא התרחשות ARDS במטופלים עם סיכון לתרחיש זה (Bajaj וחב' ב-Intensive Care Med משנת 1999). זאת ועוד, רמות TM נמצאו גבוהות מאוד בנוזל של broncoalveolar lavage במטופלים עם ARDS (על פי Taniguchi וחב' ב-Zasshi משנת 1995).
רמות TM בשחמת הכבד: במטופלים עם שחמת אלכוהולית רמות TM הן הגבוהות ביותר, בהשוואה לרמותיו במטופלים עם הפטיטיס פעילה כרונית מסוג B או C (על פי Sido וחב' ב-Transplantation משנת 1995). בשחמת הכבד, הצורות של TM עם משקל מולקולרי גבוה מופחתות משמעותית, ולעומת זאת חלה עלייה ברמת הצורות הקלות של TM. במחלת כשל כבדי חריף, הצורות השונות של TM מוגברות באופן דומה.
רמות TM בסוכרת: רמות סוכר מוגברות בנסיוב עלולות להזיק לתאי אנדותל. רמת TM מוגברת בחולי סוכרת, גם בהיעדר נזק וסקולרי (McLaren וחב' ב-Clin Appl Thrombo Haemost משנת 1999). רמות TM נמצאות במתאם ישיר עם פרוטאינוריה. במטופלים עם NIDDM רמות TM גבוהות יותר באלה עם מקרואלבומינוריה, בהשוואה לאלה עם מיקרואלבומינוריה (Sumida וחב' ב-Blood Coaggul Fibrinolysis משנת 1997). רמות TM בנסיוב תואמות את משך המחלה במטופלים עם סוכרת type 1 כמו גם בסוכרת type 2. רמות TM בנסיוב מוגברות במטופלים עם סיבוכי סוכרת כגון נפרופתיה, רטינופתיה, מחלת חסימה עורקית ונירופתיה (Gabat וחב' ב-Vasa משנת 1996). בייחוד יש מתאם טוב בין העלייה ברמת TM ודרגת החומרה של רטינופתיה סוכרתית (Ikeda וחב' ב-Nippon Ganka Gakkai Zasshi משנת 1994). רמות מוגברות של TM בדם ובשתן, מנבאות התפתחות מוקדמת של נפרופתיה סוכרתית (Shimano וחב' ב-Clin Chim Acta משנת 1994).
רמות של TM במחלה וסקולרית צרברלית: הנוכחות של אוטם לקונארי "שקט", מייצגת גורם סיכון להתפתחות אוטם צרברלי איסכמי (Kario וחב' ב-Arteriosclr Thromb Vasc Biol משנת 1996). במטופלים עם אוטם לקונרי שקט או תסמיני, ביחד עם עלייה ברמות פיברינוגן, שפעול של פקטור VII ושל תרומבין גם כן מתבצע. עם מספר גדל של לקונות, מתגבר גם הסיכון לשפעול של קואגולציה, כאשר לרמת TM יש משמעות. רמות (Lp(a שהוא סמן אמין להתפתחות טרשת עורקים, מראה מתאם חיובי משמעותי עם רמת TM (0.05p<).
מדידת רמת TM במצבי בריאות ובתחלואה
את הדם יש ליטול במבחנת סודיום ציטראט (3.2%), ואת הפלזמה יש לקבל לאחר סרכוז של 30 דקות במהירות 1500g ולאחסן אותה בטמפרטורה של 80º-. C. Takano וחב' דיווחו ב-Blood משנת 1990 על מדידת רמת TM בפלזמה של 22 תורמי דם בריאים, וממקור של 19 חולים עם DIC, 9 חולים עם ARDS, 11 מטופלים עם פקקת תסחיפית ריאתית, 4 חולים עם דלקת ריאות אינטרסטיציאלית יציבה, 14 חולים עם סרטן ריאה, 10 חולים עם אי-ספיקת כליות כרונית, 11 חולים עם שחמת כבד, 8 חולים עם אי-ספיקת כבד, שני מאובחנים עם הפטיטיס פולמיננטית, ו-6 מקרים של שחמת כבד עם קרצינומה הפאטו-תאית. רמת TM בפלזמה נמדדה בשיטת ELISA והתוצאות היו כדלקמן: בפלזמה של נבדקים בריאים נקבעה רמה של 11.8±5.2 ננוגרם/מ"ל, ו-7.5±5.3 ננוגרם/מ"ל, תוך שימוש בשני נוגדנים חד שבטיים שונים, KA-2 ו-KA-3. רמות TM היו משמעותית גבוהות יותר בנבדקים עם אי-ספיקת כליות כרונית, עם ARDS, עם אי-ספיקת כבד חריפה, עם DIC ועם עם פקקת תסחיפית ריאתית. לעומת זאת, רמות TM בחולים עם הפטיטיס פולמיננטית, דלקת ריאות אינטרסטיציאלית, או קרצינומה הפאטו-תאית.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק