אפוליפופרוטאין - Apolipoprotein - A-I
| מדריך בדיקות מעבדה | |
| אפוליפופרוטאין A-I | |
|---|---|
| Apolipoprotein A-I | |
| שמות אחרים | apoA-I |
| מעבדה | כימיה בדם |
| תחום | בחינת מאזן של מרכיבי משק הליפידים |
| יחידות מדידה | מיליגרם לדציליטר |
| טווח ערכים תקין | בילדים מגיל 4 עד 11 שנה - 110-174; בילדות בגיל 4 עד 11 שנה - 107-164; בנערים מגיל 12 עד 19 שנה - 99-165; בנערות מגיל 12 עד 19 שנה - 105-180; בגברים מגיל 20 עד 29 שנה - 105-173; בנשים מגיל 20 עד 29 שנה - 111-209; בגברים מגיל 30 עד 39 שנה - 79-155; בנשים מגיל 30 עד 39 שנה -110 -189; בגברים מגיל 40 עד 49 שנה - 103-178; בנשים בגיל 40 עד 49 שנה - 115-195; בגברים מגיל 50 עד 59 שנה - 107-173; בנשים בגיל 50 עד 59 שנה - 117-211; בגברים בגיל 60 עד 65 שנה - 111-184; בנשים בגיל 60 עד 65 שנה - 120-205; בגברים מעל גיל 70 שנה - 119-180; בנשים מעל גיל 70 שנה - 118-190. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הבדיקה מתבצעת כדי להעריך את הסיבה למצבי דיסליפידמיה, כאשר יש חשד לערכים נמוכים של אפוליפרוטאין A-I במטופלים עם סיפור משפחתי של דיסליפידמיה, או באלה עם מפגעים קרדיווסקולאריים טרם-עת. בדרך כלל נדרש ביצוע בדיקה זו במקביל לבדיקת אפוליפופרוטאין B, כדי לקבוע את היחס apoB/apo A-I כגורם סיכון למחלות כלי-דם ולב, בהערכת היחס בין סוגי הכולסטרול השונים. בדיקת apoA-I תידרש במקביל לבדיקות נוספות לניטור תוצאות טיפול להפחתת כולסטרול (סטאטינים, פיבראטים ואחרים), או לבחון תוצאות שינוי באורח חיים (דיאטה, פעילות גופנית ואחרים), לבחינת יעילות שינויים אלה.
בסיס פיזיולוגי
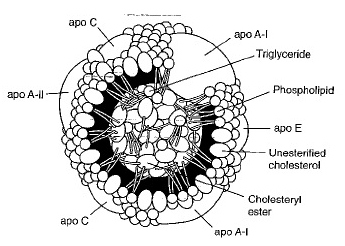
אפוליפופרוטאינים הם החלבונים קושרי הליפידים המהווים מרכיב של הליפופרוטאינים בפלזמה. כל קבוצה של ליפופרוטאינים מכילה מספר אפופרוטאינים ביחסים שונים, פרט ל-LDL המכיל בעיקר רק apoB-100. כך לדוגמה, HDL הוא העשיר ביותר באפוליפופרוטאינים המהווים 50% ממשקל החלקיק ומרכיביו העיקריים הם A-I ,A-II ,C-I ,C-II ו-C-III; לעומתו LDL מכיל כאמור בעיקר B-100 המהווה 21% ממשקלו הכולל, בעודVLDL מכיל בעיקר את האפוליפופרוטאינים B-100 ,C-I ,C-II ,C-III ו-E המהווים 8% ממשקלו של החלקיק, ואילו כילומיקרונים שמכילים את האפוליפרוטאינים A-I ,A-II ,B-48 ,C-I ,C-II ו-C-III בכמות קטנה (רק 2% ממשקל החלקיק).
התכונות האמפיפטיות (היכולת להתמוסס בממס פולארי כמו גם בממס אורגני) של אפופרוטאינים, יכולות להביא להמסת המרכיבים הליפידים ההידרופוביים של הליפופרוטאין. בנוסף לתפקידם בעיצוב מבנה הליפופרוטאין יש לאפופרוטאינים תפקיד כקו-פקטורים לפעילות אנזימטית וכן כקולטנים למרכיבים שונים של שומני הדם.
ApoA-I הוא המרכיב החלבוני העיקרי של החלקיק האנטי-אתרוגני HDL, המסייע ליציאת כולסטרול מהתאים, תהליך בעל חשיבות בשמירת ההומאוסטזיס התאי של כולסטרול.
ApoA-I הוא פוליפפטיד בודד המכיל 243 חומצות אמינו, משקלו המולקולארי 33,128 דלטון, מבנהו הֶליקָאלי ברובו, כאשר הקטע האמינו טרמינלי שלו הוא גלובולארי ומסתיים בשייר אלנין, בעוד שהקטע ה-C טרמינלי שלו המסתיים בחומצה אספרטית יכול לקשור פוספוליפידים. ApoA-I מופרש על ידי המעיים והכבד בעיקר בצורה חופשית מליפידים, והביוסיתזה של HDL מתקדמת עם היצירה בשלבים של יצירת pre-β HDL וחלקיקים דיסקואידאליים של HDL על ידי הוספה הדרגתית של כולסטרול ופוספוליפידים שמקורם בממברנות תאים. כל המרכיבים הללו מומרים לצורת HDL כדורית על ידי פעולה של LCAT המשופעל על ידי apoA-I, והחלקיק מקבל את צורתו הסופית על ידי פעולת אנזימים בפלזמה וחלבוני טרנספר או על ידי שחלוף של apoA-I. בנוסף, apoA-I הוא אחד החלבונים הנקשר ל-SR-BI אוscavenger receptor B type I, קולטן בררני המעביר ליפידים אך לא אפופרוטאינים לתוך התאים. apoA-I פועל בתור המשפעל של האנזים LCAT או lecithin-cholesterol acyltransferase.
ApoA-II, המרכיב החלבוני העיקרי השני של HDL, נוצר רק בכבד, ומשמש קו-פקטור לאנזים הכבדי ליפאזה. הוא דו-פפטיד עם שתי שרשראות זהות שכל אחת מכילה 77 חומצות אמינו ומשקלו המולקולארי הכולל הוא 17 אלף דלטון. למרות של-apoA-II יש תכונות מבניות דומות לאלה של apoA-I, הוא אינו מגן מפני תהליכי טרשת. נראה ש-apoA-II יכול לתפוס את מקומו של apoA-I על פני שטח הפנים של חלקיק HDL. החלבון apoA-IV נמצא בכילומיקרונים, אך תפקידו לא ידוע. החלבון apoA-V התגלה לאחרונה כחבר של הצֶבֶר הגֶני APOA1/C3/A4/A5 הממוקם על כרומוזום 11q23, אשר מפחית את רמת הטריגליצרידים בפלזמה, ומעודד את ההידרוליזה של VLDL המסתייעת על ידי LDL, ובכך מחיש את הקליטה של VLDL בכבד.
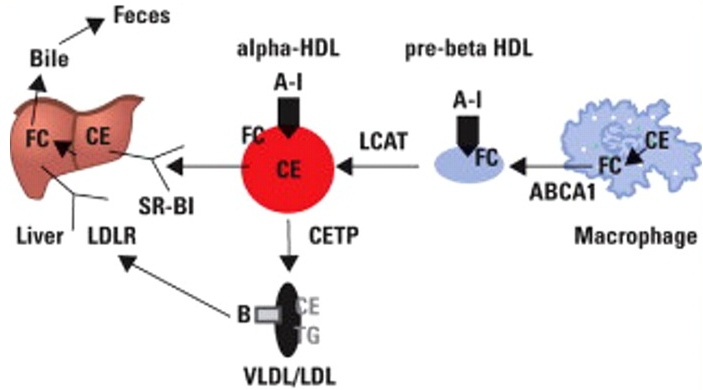
תהליך הטרנספורט של כולסטרול
במקרופאגים כולסטרול-אסטר (CE) הופך לכולסטרול חופשי (FC) וזה עובר בעזרת הטרנספורטר ABCA1 או ATP-binding cassette transporter 1 (הידוע גם CERP או cholesterol efflux regulatory protein), ליחידה הדיסקואידלית הידועה כ-pre-beta HDL (הידוע גם כ-alpha-4-HDL) המורכבת מכולסטרול חופשי הנצבר ממברנות תאים ו-apoA-I. בעזרת האנזים LCAT מוסב pre-beta HDL ל-alpha-HDL (הידוע גם כ-alpha-3-HDL) שצורתו עגולה בו מצטבר כולסטרול אסטר (CE), כתוצאה מפעולת האנזים LCAT המעביר חומצת שומן מ-phosphatidylcholine לכולסטרול חופשי. חלקיק אחרון זה יכול להגיע לכבד ולהיקלט שם על ידי הקולטן SR-BI או scavenger receptor B, ואפשרות אחרת היא שתכולת הכולסטרול-אסטר מועברת לחלקיקי VLDL/LDL המכילים אפוליפופרוטאין B בעזרת חלבון הטרנספר CETP או cholesteryl ester transport protein. חלקיק ה-LDL מועבר לכבד בו הוא נקלט על פני הקולטן LDLR. בכבד כולסטרול אסטר הופך לכולסטרול חופשי העובר לכיס המרה ומשם הוא מופרש בצואה.
בהיותו נעזר בפעולה של האנזים Lipoprein lipase על ליפופרוטאין עתיר טריגליצרידים, חלבון הטרנספר CETP מעביר אפוליפופרוטאינים מפני השטח של ליפופרוטאין זה ל-HDL, ובמקביל גם טריגליצרידים מועברים ל-HDL ליצירת alpha-2-HDL, הגדל והולך ליצירת alpha-1-HDL (הידוע גם כ-large HDL), הכרוך בהפחתה של מחלות קרדיווסקולאריות.
כילומיקרונים המופרשים מתאי האנטרוציט במעי מכילים אף הם apoA-I, אך זה מועבר במהירות ל-HDL בדם. מעבר לחשיבות של apoA-I בעידוד שחרור כולסטרול מהרקמות והעברתו לכבד, התגלה לאחרונה ש-apoA-I חיוני כגורם מייצב של prostacyclin או PGI2, ובתור שכזה ייתכן שיש לו השפעה כנוגד קרישה. אכן, פגמים בגן המקודד ל-apoA-I קשורים לחסרים ניכרים ב-HDL כפי שמוצאים במחלת Tangier וכן ב-Systemic non-neuropathic amyloidosis הידועה גם בשמותיה האחרים כגון Ostertag type amyloidosis ,Familial renal amyloidosis ,Apolipoprotein A1 derived amyloidosis ,Amyloidosis VIII ו-German type amyloidosis.
תרפיה על ידי טיפול ב-apoA-I
מאז שנת 1988 עם פרסום ממצאי National Cholesterol Education Panel (NCEP) Adult Treatment Panel I, הפך כידוע כולסטרול-LDL כמוקד עיקרי להתייחסות וטיפול. למרות שהיחס בין סך רמת כולסטרול לרמת כולסטרול-HDL, הוא מנבא קרדיו-וסקולארי מדויק יותר, הקונצנזוס ששלט בסוף שנות ה-80 היה שהראיות הרפואיות מעודדות רק הפחתה של LDL לשיפור הנתונים הקליניים. אכן מתחילת שנות ה-90 הטיפול בסטאטינים הניב תוצאות מרשימות, אך רמה נמוכה של HDL ממשיכה לנבא אירועים קרדיווסקולאריים גם בתרחישים של רמת LDL מופחתת.
חסר חמור של apoA-I (דוגמת Familial hypoalphalipoproteinemia) כרוך במחלת לב כלילית בגיל צעיר בדומה לתרחישים של Heterozygous familial hypercholesterolemia. יחד עם זאת, בניגוד למטבוליזם של LDL המובן מבחינת מנגנוני הבקרה התאית, התהליך בו HDL קשור ל- reverse cholesterol transport מורכב יותר ומהווה מטרה פחות ברורה בתחום פיתוח התרופות.
במודלים בחיות הגדלת רמת apoA-I או על ידי גישה של חיות טרנסגניות או על ידי עירוי של HDL רקומביננטי, הביא לשיפור הן על ידי רגרסיה מרשימה בטרשת העורקים, וכן עודדה reverse cholesterol transport התלוי במקרופאגים. על בסיס העקרונות הללו סונתז תכשיר פומי, RVX-208, המשרה באופן בררני גורמי טרנספורט המגבירים יצירה של apoA-I בכבד ובמעיים. היה זה התכשיר הראשון מסוג זה שהגיע לשלבים מתקדמים של ניסויים קליניים באדם. למרבה האכזבה, האופטימיות המתונה שהובעה מהעלאה מרשימה של רמות apoA-I בניסויים עם תכשיר זה בקופים, לא הוכיחה עצמה בניסויים האנושיים. בדיעבד הסתבר שטיפול זה הביר רק לעליות מתונות ב-HDL (בשעור של 8.3%) וב-apoA-I (בשעור של 5.6%) במינון הגבוה ביותר של RVX-208, ובנוסף נרשמו ב-10% מהמטופלים עליות של פי-2 ברמת טרנסאמינאזות. שינויים צנועים אלה ברמת HDL היו אף פחותים ממה שניתן היה להשיג על ידי טיפול בניאצין.
הנתונים העדכניים מניסוי DEFINE בהקשר לתכשיר anacetrapib המעכב של CETP נראים מעודדים במידה מסוימת, אך הם מייצגים גישה שונה להשפיע על מטבוליזם של HDL, שאינה מיועדת מלכתחילה להעלות את ייצור apoA-I. הפחתת קטבוליזם של HDL דרך הפעולה המעכבת של CETP, אינה משפיעה על ה-reverse cholesterol transport באותה עוצמה כפי שניתן היה להשיג עם תכשיר יעיל המעודד את יצירת apoA-I.
ApoA-I מסוג Milano
מדובר במוטנט נדיר ביותר שהתגלה בבני משפחה באזור כפרי מבודד ליד מילאנו, ביוצאי חלציהם של זוג הורים בודד במאה ה-18. המוטנט תואר לראשונה בשנת 1980, ובאופן פרדוקסאלי, נשאי מוטציה זו באפוליפופרוטאין A-I המתאפיינים ברמה מאוד נמוכה של HDL בדם, לא בהכרח סובלים מתחלואת לב מוגברת. באופן ביוכימי, במוטציה זו apoA-I יוצר גשר דיסולפידי נוסף בין שיירי ציסטאין, מה שגורם למולקולה ליצור הומודימר בין 2 מולקולות apoA-I או הטרודימר עם מולקולת apoA-II. המחשבה שמא סינתזה במעבדה של דימרים רקומביננטיים של apoA-I Milano שיוחדרו לליפוזומים אשר יוזרקו לבני אדם עשויה להפחית תהליכים טרשתיים, לא התממשה, זאת למרות שטיפול כזה בחיות הביא לירידה של 30% בבניית רבדים טרשתיים על דופן העורקים.
נמצא של-apoA-I ול-apo-E יש השפעה סינרגיסטית הגורמת למודולציה של טריגליצרידים המביאה להעלאת רמת ליפיד זה בדם. זאת למרות שאף לא אחד משני חומרים אלה בנפרד משפיע על רמת טריגליצרידים. במחלת Tangier מופיע apoA-I בלתי תקין העובר קטבוליזם במהירות יחד עם apoA-IIו-HDL. החסר ב-HDL כרוך בשקיעה של כולסטרול בכבד, בטחול, בקשרי לימפה כגון שקדים, וברקמות נוספות. גם רמת LDL נוטה לרדת במחלה זו, ולכן אין בה יצירה משמעותית של טרשת עורקים. לעומת זאת, במחלה המשפחתית של Hypoalphalipoproteinemia , החסר של apoA-I כן מגביר את מחלת העורקים הכליליים.
apoA-I ותחלואה
בדיקת apoA-I תימצא מוגברת במטופלים עם היפר-אלפא-ליפופרוטאינמיה משפחתית, וכן באלה עם חסר משפחתי של CETP (Cholesteryl ester transfer protein).
תוצאות מופחתות של apoA-I יימצאו במטופלים עם Abetalipoproteinemia (ידועה גם כתסמונת Bassen-Kornzweig), באלה עם חסר ב-lipoprotein lipase cofactor או apoC-II, מקרים של Familial hypo-α-lipoproteinemia, במקרים של apo A-I vatiants כגון apo AI Milano type, במקרים של Familial lecithin-cholesterol acyltranferase (LCAT) deficiency, במחלת Tangier, במקרים של Familial apo A-I deficiency (עם או ללא apo CIII/apo A-IV deficiency), במחלת לב כלילית, במפגעים הפאטוצלולריים, בעימדון הכבד (כולסטאזיס), בתסמונת נפרוטית, באי-ספיקת כליות כרונית, בסוכרת בלתי מאוזנת, במצבי טריגליצרידמיה ובממאיריות שונות.
השפעת תרופות ואורח חיים על רמת apoA-I
- תרופות ותכשירים המעלים את רמת apoA-I
פיבראטים כגון Clofibrate ,Gemfibrozil, סטאטינים (Lovastatin, Pravastatin, Simvastatin), ניאצין, פנוברביטל, Phenytoin, הריון אך גם גלולות למניעת הריון, אסטרוגנים, Carbamazepine, פרדניזולון, צריכה מתונה של אלכוהול. איבוד משקל באנשים עם השמנת יתר, פעילות גופנית או ספורטיבית סדירה.
- תרופות המפחיתות רמת apoA-I
אנדרוגנים, חוסמי β, תכשירים משתנים כתיאזידים ו-Chlorothalidone, פרוגסטין, Probucol ,Stanazolol ו-Calcitriol. דיאטה עתירה בפחמימות, סיבים או חומצות שומן רב בלתי רוויות, עישון סיגריות, בתקופת אשפוז בגלל אוטם שריר הלב, שבץ מוחי או צינתור.
הוראות לביצוע הבדיקה
יש להיות בצום של 12 שעות. ניתן לדגום את הדם במבחנה כימית רגילה (פקק אדום או צהוב) או במבחנת ספירת דם (פקק סגלגל). הדם יציב משך 4 ימים בקירור, או עד 6 חודשים בהקפאה במינוס 70 מעלות. כאשר מאחסנים עם חומר משמר (Thimerosal) ניתן להקפיא במינוס 20 מעלות ל-3 שנים, ולפרק זמן בלתי מוגבל במינוס 70 מעלות.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק