ריפוי פצע - Wound healing
עקרונות בכירורגיה
מאת ד"ר צבי קויפמן
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | ריפוי פצעים | |
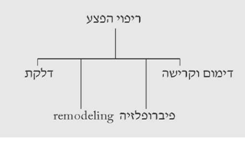
ריפוי הפצע הוא תהליך בסיסי עליו מבוסס הטיפול הכירורגי. פצע מוגדר כהפסקה ברציפות הרקמה. כאשר אנו מדברים על ריפוי פצע אנו מתכוונים למנגנון של סגירת הפצע.
למה חשוב לסגור פצעים? פצעים שאינם מכוסים על-ידי עור אינם מוגנים, נוטים להזדהם ולפתח דלקות חדות היכולות להיות מלוות באלח-דם אם לא יטופלו, ואף במוות. פצע מהווה מקור לאיבוד נוזלים, לאיבוד חום הגוף ולהיפותרמיה.
סגירת הפצע יכולה להיות:
- עצמונית, כאשר אין כל התערבות מבחוץ בתהליך הסגירה והיא נקראת Spontaneous closure או Secondary closure. במקרים אלה שולי הפצע נסגרים לבד על-ידי מספר תהליכים הגורמים להתקרבות השוליים ול׳׳הידבקותם"
- תהליך הסגירה נעזר על-ידי קירוב השוליים בעזרת תפרים, דבקים, מדבקות, סיכות או עזרים מכניים אחרים. הסגירה יכולה להיות מסוג:
- Primary closure: שולי הפצע מקורבים האחד לשני על-ידי אמצעים מכניים מיד או בסמוך לפציעה. רוב הפצעים הנקיים שבהם הסבירות לזיהום נמוכה נסגרים ראשונית
- Delayed primary closure: הפצע נשאר פתוח למשך מספר ימים ונסגר לאחר מכן. שיטה זו נהוגה במיוחד בפצעים לא נקיים או שקיימת בהם סבירות גבוהה לזיהום, ורק כאשר הפצע נראה נקי, השוליים מקורבים על-ידי תפרים או כל אמצעי מכני אחר. כאשר הפצע פתוח רצוי שיהיה חבוש בחבישה שבעיקרון היא לחה וסטרילית ויש להחליפה פעמיים ביום. יש להקפיד שלא להשתמש בתמיסות יוד או כאלה המבוססות על פראוקסידים, מכיוון שהן הורסות את רקמת הפצע יחד עם החיידקים. כאשר הפצע פתוח תהליכי הריפוי הנורמליים מתקיימים בו וכוללים התפתחות כלי דם לתוך הפצע, חדירה של לויקוציטים ומקרופגים לסילוק הרקמה שנהרסה והחיידקים
תהליכים הקשורים בריפוי הפצע
קיימים מספר תהליכים בסיסיים המתקיימים בריפוי הפצע:
- אפיתליזציה (Epithelialization)
- התכווצות הפצע (Contraction)
- Connective tissue matrix deposition
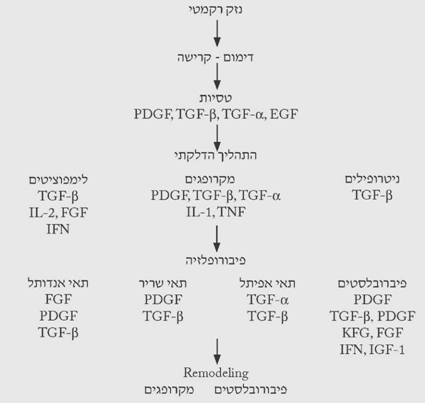
כל תהליך ריפוי הפצעים החדים מתחיל באותם התהליכים שמתוארים בנפרד, אבל חופפים האחד את השני מבחינת הזמנים כך שבו זמנית חלים מספר תהליכים (תרשים 1.18).
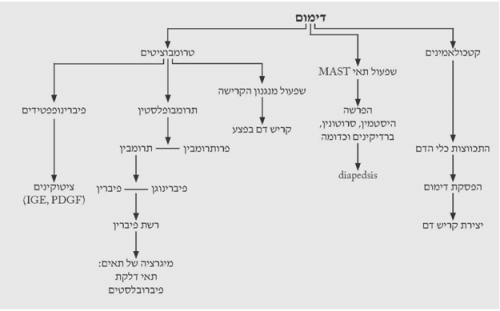
דימום וקרישה
בכל פצע ניתן לראות קריעה של כלי דם ודימום. יצירת קריש הדם בפצע חיונית ביותר לריפוי הפצע. הדימום פוסק עקב התכווצות של כלי הדם בעקבות הפרשה של קטכולאמינים וחומרים כמו ברדיקינין, סרוטונין, היסטמין ואחרים המופרשים על-ידי תאי מסט (Mast cell) הרקמתיים. חומרים אלה מגרים את תהליך ה-diapedesis של תאים מתוך כלי הדם לתוך הפצע. במקביל, שפעול מערכת הקרישה על-ידי הרקמות הקרועות ושפעול התרומבוציטים גורמים להיווצרות הקריש ולהפסקת הדימום. הפצע מתמלא על-ידי קריש הדם. התרומבוציטים, בנוסף על היותם משפעלים של מערכת הקרישה, גם משחררים חומרים אשר גורמים ליצירת רשת פיברין בפצע. רשת זו מאפשרת מעבר של תאי דלקת ופיברובלסטים לאזור החתך. הפיברין נוצר מפיברינוגן המשופעל על-ידי תרומבין שמקורו בפרותרומבין ההופך לתרומבין בנוכחות תרומבופלסטין המשתחרר מהרקמות הפגועות. אי-יצירת רשת הפיברין פוגעת קשות בחוזק האיחוי לאחר מכן. התרומבוציטים הם מקור עיקרי לציטוקינים שונים (תרשים 2.18). בשלב זה ניתן לראות מבחינה קלינית קריש דם על הפצע והפרשה סרוטית מהפצע.
דלקת
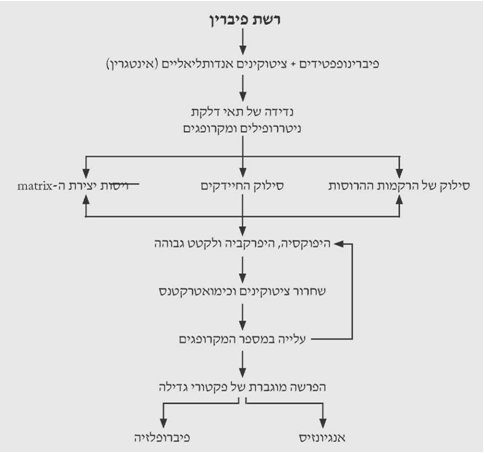
כל תהליך ריפוי מלווה בדלקת. הפיברינופפטידים ותרומבין מושכים את המקרופגים לפצע. תאי האנדותל הפגועים משחררים ציטוקינים, כמו האינטגרין, המושכים ליקוציטים לפצע ואלה מתחילים את התהליך הדלקתי. תוך 24 שעות כל אזור הפצע מתמלא על-ידי תאים פולימורפונוקלריים המלווים במקרופגים. המקרופגים והתאים הלבנים מסלקים את ה-debris והחיידקים מהפצע. הם גם אחראים לוויסות היצירה של ה-Tissue matrix ורקמת החיבור. הוויסות מתבצע על-ידי הפרשת פקטורי גדילה (Growth factors) שונים. תאי הדלקת החודרים לפצע הם צרכני אנרגיה, אך עקב הספקת הדם הלקויה יורד ה-PO2 ברקמה וריכוזי ה-CO2 והלקטט עולים. תהליכים אלה מתרחשים כל זמן הריפוי וגורמים לשחרור ציטוקינים מהמקרופגים ומהליקוציטים. אספקת החמצן הלקויה וריכוז הלקטט הגבוה מעודדים אנגיוגנזיס ושקיעה של קולאגן ברקמה. תופעה זו מעניינת מכיוון שהמקרופגים יוצרים מרכז גדילה של רקמה על-ידי השריה של סביבה היפוקסית היפרלקטטית.
אם הרקמה לא מזדהמת אוכלוסיית הליקוציטים פוחתת לאחר 24 שעות והמקרופגים מכסים את פני הפצע. תאים פיברובלסטיים בלתי בשלים יחד עם כלי דם חדשים מתחילים לחדור לפצע מתחת למקרופגים. בשולי הפצע, שבהם החמצון טוב יותר, נמצאים פיברובלסטים בשלים יותר המתחילים לייצר את ה-matrix ולהשקיעו בפצע. כך נוצר מפל ריפוי משולי הפצע למרכזו (תרשים 3.18).
בשלב זה הפצע נראה דלקתי עם סימני בצקת, נפיחות מקומית, אודם וחום מקומי.
פיברופלזיה - fibroplasia
תהליך זה מאופיין על-ידי יצירת קולאגן בפצע המקנה לפצע בסופו של דבר את חוזקו. יצירה מוגברת של קולאגן ניתן למצוא כ-10 שעות לאחר תחילת תהליך הריפוי והוא מגיע לשיאו 5–7 ימים לאחר תחילת תהליך הריפוי, ואז התהליך דועך בהדרגה. בשלב זה ניתן למצוא גם שקיעה של Ground substance בתוך המטריקס וכן צמיחה של כלי דם בפצע (תרשים 4.18). קלינית ניתן לראות בשלב זה יצירת צלקת גסה, עיבוי הרקמות בעור ומתחתיו (נפיחות מקומית) וקיימת תחושת גירוד באזור.
הפיברובלסטים מתחלקים תחילה בשולי הפצע, שבהם יש לחץ חלקי של חמצן גבוה יחסית (40 מ"מ כספית). הפיברובלסטים מתרבים על-ידי חלוקה בהשפעה של ציטוקינים. מקור הפיברובלסטים אינו ברור דיו; משערים שמקורם הוא בתאים מזנכימאליים שמוצאם הוא מאדונטיציה והמדיה של כלי הדם. הפיברובלסט החדש מייצר קולאגן ופרוטאוגליקן.
הסימנים הקליניים: יצירת צלקת, גרד מקומי, רגישות.
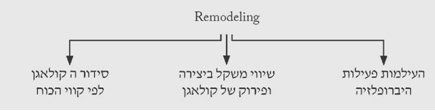
עיצוב מחדש - Remodeling
בתהליך זה הגוף מנסה להחזיר את הרקמות לצורתן המקורית. תהליכי הדלקת נעלמים, תהליכי יצירת כלי הדם פוסקים, וחוזר שיווי המשקל בין יצירת הקולאגן ופירוקו. בשלב הזה הגוף מנסה לסדר את סיבי הקולאגן בהתאם לקווי הכוחות הפועלים על הרקמה והצלקת מקבלת את צורתה הסופית, מתעדנת ובדרך כלל אינה רגישה (תרשים 5.18).
הסימנים הקליניים: הצלקת מתעדנת, לא מגרדת ולא כואבת.
ציטוקינים
הציטוקינים הם חומרים שבעזרתם מתקשרים תאים בתהליכים ביולוגיים שונים. בריפוי הפצע יש להם תפקיד חשוב ביותר. הם יכולים להשפיע כהורמונים אנדוקריניים, פאראקריניים, אוטוקריניים או אינטראקריינים. ההורמונים האנדוקריניים הם אלה המגיעים לפצע דרך הדם מרקמות מרוחקות, למשל 1-IGF. ההורמונים הפאראקריניים הם אלה הנוצרים בסביבת הפצע, מופרשים על-ידי תא אחד ומשפיעים על משנהו כמו ה-TGF ביתא. הורמונים אוטוקריניים מיוצרים על-ידי תא ומשפיעים על אותו התא דרך קולטנים בתא עצמו. הורמונים אינטראקריניים הם אלה הנוצרים בתא בצורה משופעלת ומשפיעים ישירות על התהליכים בתא. הציטוקינים בפצע מעודדים חלוקת תאים (ה-1-IGF), נדידה של תאים לפצע ויצירת ה-matrix.
PDGF (Platelet-Derived Growth Factor)- מעורב בפרוליפרציה של פיברובלסטים, כימוטקסיס, יצירת קולאגן ואנגיוגנזיס. הוא מהציטוקינים הראשונים המתחילים את תהליך הריפוי והוא גם מגרה להפרשת ציטוקינים אחרים המעורבים בריפוי הפצע.
TGF ביתא (Transforming Growth Factor) - מופרש על-ידי טסיות, פיברובלסטים ומקרופגים. מעורב בפרוליפרציה של פיברובלסטים, כימוטקסיס, יצירת קולאגן ואנגיוגנזיס. ציטוקין זה חשוב ביותר ביצירת הקולאגן. הוא משרה ביטוי של גן מיוחד, ומעכב פעילות ויצירה של קולאגנזות. כאשר הוא מופרש ביתר בפצע ניתן לראות צלקות היפרטרופיות ואף קלואידיות. בחיות נמצא שניתן לעכב את ה-TGF ביתא ו-1 על-ידי אנטיביוטיקה ובכך ליצור ריפוי ללא צלקת.
EFG (Epithelial Growth Factor) ו- TGF-אלפא - מגרים פרוליפרציה של תאי אפיתל ופיברובלסטים, וכמו-כן מעורבים ביצירת רקמה גרנולרית בפצע.
אינטרלוקין-1 - מעורב בפרוליפרציה של פיברובלסטים, יצירת קולאגנזות וכימוטקסיס של ניוטרופילים.
KGF (Keratinocyte Growth Factor) - מקורו בפיברובלסטים והוא גורם לפרוליפרציה של תאי אפיתל (אפקט פאראקריני).
הורמון הגדילה - מגרה להפרשת 1-IGF (אפקט אנדוקריני).
אינטרפרון - מעכב פיברובלסטים ויצירת קולאגן.
תרשים 6.18 מסכם את מעורבות הציטוקינים בשלבי הריפוי השונים של הפצע.
Extracellular matrix
הקולאגן הוא המרכיב העיקרי של המטריקס. קיימים לפחות שלושה עשר סוגים שונים של קולאגן. בנוסף לקולאגן ניתן למצוא במטריקס פרוטאוגליקנים, פיברונקטין, למינין, אלסטין ואחרים.
למרכיבי המטריקס תפקידים שונים: הקולאגן מקנה לרקמה את חוזקה וצורתה. האלסטין מקנה לרקמה את גמישותה ומאפשר תנועה. הפיברונקטין והלמינין מחברים בין תאים ובין תאים לקולאגן. פרוטאוגליקן משמש במקומות הדורשים לחות ובלימת זעזועים.
קולאגן
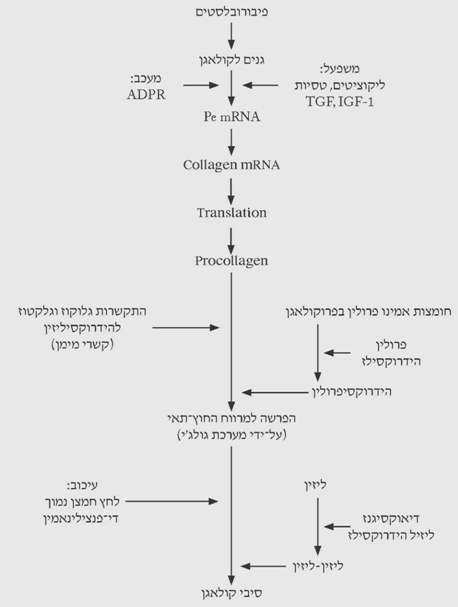
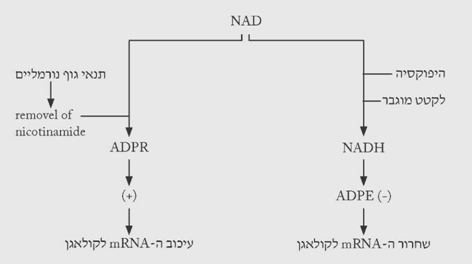
ייצור הקולאגן מווסת על-ידי מספר ציטוקינים (TGF-ביתא, IGF-1 ואחרים), המעודדים שעתוק של הגנים לקולאגן. באופן נורמלי מעוכב ייצור הקולאגן בתא על-ידי אדנוזין די-פוספוריבוז (ADPR). העיכוב הוא ברמה של יצירת ה-mRNA, ושחרור קולאגן מהתא. ה-ADPR נוצר כאשר הניקוטינאמיד שב-NAD (ניקוטין אדנין דינוקלאוטיד) מוצא וכתוצאה מכך נוצרת הגרסה היציבה יותר – ה-ADPR. בנוכחות לקטט הופך ה- NAD ל-NADH, ולכן כמות ה-ADPR פוחתת. הפחתה זו גורמת ליצירה של mRNA לקולאגן וכתוצאה מכך יצירה של פרוקולאגן. ברגע שנוצר הגירוי ליצירת הקולאגן, הגנים לקולאגן עוברים שעתוק ל-pre mRNA ולקולאגן mRNA המשרה יצירת מולקולות פרוקולאגן על-ידי הריבוזומים ברטיקולום האנדופלסמטי (תרשימים 7.18-8.18).
הקולאגן מורכב מ-3 שרשראות פוליפפטידיות הקשורות ביניהן בקשרי גליצין-פרולין מרובים. החומצה האמינית פרולין בפרוקולאגן עוברת הידרוקסילציה להידרוקסיפרולין על-ידי הדי-אוקסיגנז פרולין הידרוקסילז בנוכחות חומצה אסקורבית, ברזל ואלפא-קטוגלוטמט, ויוצרת את הליקס הקולאגן המורכב משלוש מולקולות של פרוקולאגן. גם תהליך זה מואץ בנוכחות לקטט ומעוכב בנוכחות ADPR (תרשים 7.18).
יצירת ההידרוקסיפרולין חשובה בייצוב הקולאגן. הפרעה בהידרוקסילציה זו הופכת את המולקולה לבלתי יציבה והיא נהרסת במהירות בתוך התא או במרווח החוץ-תאי. ההידרוקסילציה של הפרולין דורשת מספר קופקטורים וביניהם ויטמין C וחמצן. מחסור בשני אלה יגרום לריפוי לקוי המתבטא בצלקת חלשה הניתקת בקלות מהרקמה.
למולקולות הקולאגן מתווספות מולקולות של גלקטוז וגלוקוז לזנב של ההידרוקסיליזין. תוספת זו מייצבת את 3 המולקולות של הקולאגן, המתחברות זו לזו על-ידי קשרי מימן יציבים, ויוצרות מבנה של Helix complex. הקצה הקרבוקסילי של המולקולה מכיל תוספת הנקראת ה-Extension peptides, המובילה את המולקולה במיקרוטובולס הציטופלסמטיים אל הוקואולות של גולגיי ובעזרתם הם מופרשים למרווח החוץ-תאי. כאשר הקולאגן מופרש למרווח החוץ-תאי המולקולות מתחברות זו לזו ויוצרות סיבי קולאגן. הדיאוקסיגנז והליזיל הידרוקסילז גורמים ליצירת קשרי ליזין-ליזין בין מולקולות של קולאגן, תהליך היוצר את סיבי הקולאגן החזקים. תהליך זה דורש אף הוא אסקורבט וחמצן. מהירות היצירה של הקשרים הללו תלויה בלחץ החלקי של החמצן ומתחילה כאשר הלחץ הוא 20 מ"מ כספית ומגיעה למקסימום בלחץ חלקי של 200 מ"מ כספית (תרשים 7.18).
ניתן לעכב את האנזים lysyloxidase על-ידי חומרים כמו ביתא-אמינופרופיוניטריל (BAPN), או די-פנצילינאמין. חומרים אלה נמצאים בשימוש מוגבל במקרים שבהם מנסים למנוע יצירת קולאגן ביתר. ברקמה הנורמלית קיים איזון בין תהליך הבנייה של הקולאגן לבין תהליכי הפירוק שלו המתבצעים על-ידי קולאגנזות תחילה ועל- ידי פרוטאזות לאחר מכן.
המונומרים של הקולאגן המופרשים על-ידי הפיברובלסטים עוברים פולימריזציה בצורה אקראית וכתוצאה מכך נוצרת צלקת ראשונית שהיא חלשה יחסית. במשך הזמן הקולאגן הזה מתפרק על-ידי קולאגנזות המופרשות על-ידי הליקוציטים והפיברובלסטים ובמקומו שוקע קולאגן שבו הפולימריזציה מסודרת יותר והחפיפה בין ההליקסים היא של שלושת רבעי סיב, מה שיוצר סיבים חזקים יותר ואיחוי חזק יותר.
Ground substance
משמש כחומר הממלא את החללים בפצע בין סיבי הקולאגן. תפקידו המדויק לא ברור; ההשערה היא שהוא מאפשר ריכוך של זעזועים ברקמה וגם שומר על הלחות ברקמה הנוצרת. הוא מכיל ציטוקינים די רבים וכאשר הוא נהרס משתחררים ציטוקינים המעודדים את הריפוי. המרכיב העיקרי של ה-Ground substance הם פרוטאוגליקנים וגליקוזאמינוגליקן. החומצה hyaluronic, בגלל המבנה שלה, שומרת על סביבה מיימית המאפשרת תנועה מהירה של תאים והתמיינות שלהם.
אנגיוגנזיס
אנגיוגנזיס או צמיחת כלי דם לתוך הפצע היא חלק הכרחי בכל ריפוי פצע. אמנם ביצירת כלי הדם החדשים אפשר להבחין כעבור 4 ימים אולם תהליך הצמיחה מתחיל לאחר 24–48 שעות. קפילרות מתחילות לצמוח מהונולות של הרקמה בשולי הפצע בתגובה לגירוי של כימואטרקטן המשוחרר על-ידי הטסיות והמקרופגים. בפצעים סגורים היטב הקפילרות הנוצרות משולי הפצע נפגשות, מתחברות ויוצרות רשת של כלי דם קפילריים בפצע. כאשר הפצע לא נסגר כראוי או נשאר פתוח, כלי הדם מאותו הצד מתחברים רק עם עצמם ולא מתקשרים לאלה של הצד השני וביניהם נוצרת רקמה גרנולרית. גם כאן התהליך מעוכב על-ידי ADPR ומואץ על-ידי היפוקסיה ולקטט.
התכווצות הפצע (Wound contraction)
מונח זה מתאר מצב שבו שולי הפצע מתקרבים זה אל זה. התכווצות הפצע מאפשרת את סגירתו המהירה והחזקה יותר אולם במחיר של עיוות מסוים. לעיתים, תהליך ההתכווצות של הפצע, במיוחד בפציעות נרחבות ובכוויות, יוצר קונטרקטורות סביב פרקים ועיוותים. במערכת העיכול תהליך ההתכווצות יכול לגרום להיצרויות של אנסטומוזות בקו התפרים.
התכווצות הפצע מתרחשת רק בנוכחות פיברובלסטים מיוחדים שעברו התמיינות לתאים הנקראים מיופיברובלסטים. תאים אלה מכילים אלמנט שרירי בתוכם. עבודות הראו שהמיופיברובלסטים מגיבים בהתכווצות לחומרים מכווצי שריר או בהרפיה לחומרים מרפי שרירים. בתוך קונטרקטורות נמצאו מיופיברובלסטים בכמות רבה. בנוסף למיופיברובלסטים, למבנה המטריקס יש חשיבות רבה בהתכווצות הפצע והיווצרות קונטרקטורות, כך שקונטרקטורות נוצרות, כאשר יש ריבוי של תאים בעלי יכולת להתכווץ במטריקס, המאפשר התכווצות.
תהליך הרס הקולאגן החדש אינו דורש תנאים מיוחדים כמו חמצן, אנרגיה, חלבון וכו' ולכן הוא פחות תלוי בסביבה, בעוד שתהליך הבנייה כפי שכבר הוסבר תלוי מאוד בסביבה; ולכן כאשר קיימת איסכמיה יחסית או חסר במרכיבי תזונה וכו', תהליך ההרס נשאר כפי שהוא, תהליך הבנייה מתעכב והתוצאה היא חולשה של האיחוי, דבר העלול להתבטא קלינית בפתיחת פצעים ניתוחיים עם אויסצרציה, דלפים מאנסטומוזות במעי וכוי. לעיתים, כאשר תהליך היצירה מואץ ויש משקע רב של קולאגן, הוא גורם להתכווצות הצלקת ולקונטרקטורות. התכווצות זו יכולה לגרום לנזק עם הגבלה בתנועה, במיוחד באזורי המפרקים והפנים.
אין היום אמצעים למנוע את התכווצות הפצע. מתן חומרים מרפי שרירים לפצעים נמצא יעיל כל זמן שהחומר ניתן. ברגע שמופסק מתן החומר מתרחשת התכווצות מוחשת של הפצע. אמצעים מכניים למניעת התכווצות הפצע גם הם לא יעילים.
הטיפול בקונטרקטורות שנוצרו מתבסס על מספר עקרונות קליניים. לפני שמתחילים טיפול כירורגי חשוב לדעת האם הצלקת בשלה או לא. צלקת בשלה היא צלקת רכה וגמישה בעוד שצלקת לא בשלה היא נוקשה, מסוננת, היפרטרופית ורגישה. הצלקת הלא בשלה מכילה תאי דלקת בתוכה ותאים מיופיברובלסטיים; זו צלקת פעילה ולכן היא עלולה לגרום התכווצות לשתל עור המונח עליה. במקרים אלה התיקון צריך להתבצע על-ידי שתל עור מלא, הכולל גם רקמה תת-עורית, או שתל עור-שריר הכולל גם שריר, על מנת להבטיח אספקת דם לשתל. בקונטרקטורות בשלות שבהן אין פעילות של הרקמה אפשר להסתפק בשתל עור בלבד - חלקי או מלא. מתלה עור מלא מוצלח יותר.
אפיתליזציה
כיסוי הפצע על-ידי אפיתל הוא חלק חשוב בריפוי. העור שומר על הגוף מפני אובדן מים, חום, חדירת חיידקים, קרינה ועוד. חוסר עור חושף את אזור הריפוי לזיהומים חוזרים, גורם לאיבוד נוזלים ולמעשה תהליך הריפוי אינו מסתיים ללא אפיתליזציה. האפיתליזציה כוללת שני תהליכים - האחד נדידה והשני מיטוזה.
כאשר נוצר הפצע והוא מתמלא בקריש דם ותהליך הריפוי מתחיל, מתחילה גם הנדידה של תאי אפיתל מהשוליים - מהשכבה הבסיסית של הדרמיס (קראטוציטים - keratocyte), משורשי השערות ומבלוטות השומן הדרמליות - אל הפצע. הנדידה היא תהליך שאינו תלוי במיטוזה. אפשר לראות שכאשר מעכבים את תהליך המיטוזה הדבר אינו משפיע על הנדידה והאפיתליזציה. ככל שהפצע שטחי יותר כך תהליך האפיתליזציה מהיר יותר. בפציעות שבהן נפגעה הממברנה הבזלית של העור קיים גירוי לתחילת התהליך הדלקתי שמסתיים בצלקת ולכן האיחוי פחות יפה. בתחילת תהליך הנדידה התאים משתנים, הם נעשים שטוחים יותר ושולחים שלוחות לרקמה שמסביב ומאבדים את הקשר שלהם לממברנה הבזלית. התאים מתחילים לנוע לתוך הפצע כאשר התאים המובילים מבצעים פגוציטוזה של ה-debris ויוצרים את המעבר לקראטוציטים הבאים אחריהם. התאים האפיתליאליים לא נעים כבודדים אלא כמשטח של תאים. לאחר מספר ימים תאים אלה מתחילים להתחלק. נמצא שפיברונקטין וויטרונקטין המצויים בדם מסייעים בתהליך הנדידה של תאי האפיתל. פקטורי הגדילה מסוג ה-TGF בתא, TGF אלפא, PDGF ו-EGF כולם מגרים את תהליכי הנדידה והמיטוזה. ה-TGF בתא מעודד את תהליך הנדידה בלבד ומעכב פרוליפרציה. תנועתיות התאים מוכתבת על-ידי מנגנון המכיל אקטין ומיוזין. ברגע שהחסר מכוסה על-ידי תאי אפיתל התאים חוזרים ונדבקים לממברנה הבזלית, מתחלקים ויוצרים את מבנה העור הנורמלי. התהליך הזה מוחש כאשר שומרים על סביבת פצע לחה. חבישה לא הדוקה השומרת על לחות הפצע היא חשובה ביותר לעידוד האפיתליזציה.
תזונה
חוסר במרכיבים מסוימים במזון גורם לליקויים בריפוי הפצע. חוסר בוויטמין scurvy) C) גורם לפתיחה של פצעים שנסגרו מזה זמן רב. הסיבה היא הרס של הקולאגן ללא חידושו, מכיוון שהוויטמין C הוא קופקטור בהידרוקסלציה של הפרולין להידרוקסיפרולין, החיוני ליצירת ההליקס של הקולאגן. בבני אדם עם חסר של אסקורבט נוצר קולאגן שאינו יציב מבחינה תרמית ולכן נהרס מהר. חוסר ויטמין C שכיח בחולים לאחר חבלות גדולות וכן באוכלוסיות בעלות רקע חברתי-כלכלי נמוך. הסיבה לחסר הוויטמין בחולים עם חבלות נרחבות אינו ידוע. משערים שהסיבה קשורה בצריכה מוגברת של האסקורבט או באיבוד מוגבר שלו בכליות וספיגה נמוכה. חולים כאלה זקוקים לקבל עד 1 גרם של ויטמין C בתזונה. הברזל הלא מיונן נחוץ להידרוקסילציה של פרוליל. סידן ומגנזיום נדרשים לפעילות הקולאגנזות ולסינתזת החלבונים. כל חומצות האמינו ההכרחיות נדרשות לריפוי הפצע, במיוחד הארגינין שתוספת שלה למזון מאיצה את תהליך הריפוי.
היפוקסיה
היפוקסיה פוגעת בתהליך הריפוי. חמצן דרוש לתהליך הדלקת. תאי הדלקת הם צרכנים של חמצן. הרמה הקריטית של חמצן היא 20 מ"מ כספית, ואילו ברמה של 200 מ"מ כספית הפעילות היא מרבית. כלומר הפרפוזיה לרקמות חשובה ביותר. ה-PO2 של נוזלי הפצע הוא בסביבות 30–40 מ"מ כספית, כך שקיימת פעילות ריפוי, אבל ביעילות נמוכה. ככל שהפרפוזיה נמוכה יותר כך הרמה של החמצן בפצע נמוכה יותר ופעילות הריפוי איטית יותר. היפוולמיה, מתן קטכולאמינים בעירוי וקור גורמים לוזוקונסטריקציה הפוגעת בריפוי הפצע. פרפוזיה טובה מאפשרת חמצון רקמתי טוב של החולה וזה מעלה את ה-PO2 של הנוזל בפצע ל-100 מ"מ כספית. לעומת זאת, בחולים הלוקים במחלות קרדיופולמונליות ובחולים עם וזוקונסטריקציה עקב גירוי סימפטטי, ריפוי הפצע יהיה לקוי. תיקון נפח הדם, הקטנת כאב ומניעת היפותרמיה משפרים את חמצון הרקמות ומשפרים את ריפוי הפצע.
פגיעה בריפוי
פגיעה בריפוי יכולה להיגרם על-ידי הפחתה של התגובה הדלקתית או הגברתה. הפחתה של התגובה הדלקתית תיתכן כאשר חולה נוטל תרופות אנטי-דלקתיות כמו סטרואידים, NSAID's, חומרים מדכאי חיסון או תרופות כימותרפיות. כאשר התגובה הדלקתית דלה - הריפוי לוקה, הוא ממושך יותר והצלקת חלשה יותר. אם התחלת מתן התרופות נעשית לאחר שלב הדלקת - הפגיעה היא קטנה יותר. מתן של ויטמין A ופקטורי גדילה לחולים המטופלים בסטרואידים מפחית את השפעת התרופה על הריפוי.
דלקת בעוצמה יתרה אפשר למצוא במצבים של הפרשת יתר של אנדוטוקסינים זיהומיים של הפצע, פציעות נרחבות וכו׳. בפציעות אלה נגרם הרס רקמתי רב או קיימת הפרשה רבה של ציטוקינים ופרוטאינזות הגורמים לתגובת יתר דלקתית; כתוצאה מכך נוצרות רקמה גרנולרית רבה וצלקת היפרטרופית. זיהומים וגופים זרים בפצע גורמים תמיד להיווצרות צלקת ביתר.
סילוק הרקמה הפגועה משולי הפצע (debridement), וקיבוע שברים מקטינים את התגובה הדלקתית. חוסר יכולת לבצע קיבוע של שברים, כריתת רקמות נמקיות, וגירוי יתר של הרקמה הרטיקולואנדוטליאלית גורמים לתגובה דלקתית סיסטמית (SIRS) גם ללא עדות לזיהום.
ראו גם
- לנושא הבא: ריפוי איברים מיוחדים
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: הלם
- לפרק הבא: זיהומים בכירורגיה
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן - מומחה בכירורגיה, מנהל היחידה לבריאות השד מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק