תווכים של תאי פיטום - Mast cells mediators
| מדריך בדיקות מעבדה | |
| תווכים של תאי פיטום | |
|---|---|
| Mast cells mediators | |
| מעבדה | אונקולוגיה בשתן |
| תחום | מחלות אלרגיות ותאי פיטום. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכת מטופלים בסיכון לתסמיני שפעול של תאי פיטום הנובעים ממסטוציטוזיס סיסטמי.
כללי
תאי פיטום (mast cells) מפוזרים באופן נרחב ברחבי הגוף והם שכיחים במיוחד במשטחים ריריים. תאים אלה תלויים במיקרו-סביבה בה הם הופכים לבשלים הן מבחינה תפקודית ופנוטיפית (Galli וחב' ב-Ann Rev Immunol משנת 2005, ו-Hart ב-Immunol Cell Biol משנת 2001). אף על פי שתאי פיטום נראו באופן קלאסי כתאים אפקטוריים במקרים של מחלות אלרגיות המתווכות על ידי IgE, הם מוכרים גם כבעלי תפקיד חשוב בהגנה על המאחסן, בחסינות נרכשת ומולדת (innate), בתגובות הומאוסטטיות וברגולציה של מערכת החיסון. תאי פיטום יכולים להשרות שחרור של מתווכים כגון היסטמין מתוך גרנולות, כמו גם שחרור של מתווכים ליפידיים המסונתזים de novo, שחרור של ציטוקינים וכימוקינים, לא רק בריאקציות אלרגיות אלא גם בתגובות פיזיולוגיות ופתו-פיזיולוגיות. אכן, תאי פיטום משחררים את התווכים שלהם באופן כרונולוגי, בתלות בגירויים הכרוכים ובקסקדות האיתות שלהם (כגון תיווך של IgE או בתיווך של הקולטן דמוי-Toll).
תווכים תאיים: תאי פיטום הם מקור עיקרי לתווכים קדם-דלקתיים ואימונו-רגולטוריים. תווכים אלה כוללים היסטמין, פרוטזות נייטרליות, תווכים ליפידיים ומספר ציטוקינים וכימוקינים.
תאי פיטום מפרישים תווכים שונים לאחר שפעולם, האחראיים למערכות רבות של מחלה אלרגית ושל אנפילקסיס. תווכים אלה יכולים להתחלק לשלוש קטגוריות חופפות: תווכים מבוצעים, תווכים ליפידיים שסונתזו זה-עתה וציטוקינים וכימוקינים. גרנולות של תאי פיטום מכילות תווכים מבוצעים המשתחררים במהירות (תוך שניות או דקות) לסביבה החיצונית בעת גירוי התא. תווכים אלה כוללים היסטמין, פרוטאזות נויטרליות, פרוטאו-גליקנים ומספר ציטוקינים כגון alpha umor necrosis factor (TNF). תווכים אלה אחראיים לרבים מתוך הסימנים החריפים והתסמינים של ריאקציות אלרגיות המתווכות על ידי תאי הפיטום, הכוללים בצקת, כיווץ דרכי הנשימה והגברת החדירות הווסקולרית. יחסים בין רמות אקוטיות לרמות בסיס תוארו לגבי tryptase, היסטמין, פרוסטגלנדינים ולויקוטריאנים, שיכולים לשמש בשגרה הקלינית לקבוע את השפעול של תאי פיטום במטופלים עם תסמינים של שפעול תאי פיטום (Moon וחב' ב-Mucosal Immunol משנת 2010).
היסטמין מיוצר בעיקר על ידי תאי פיטום, אך גם על ידי בזופילים, נויטרופילים (Lancaster ב-Lipid Oxide משנת 1997) וטסיות. הוא מאוחסן הן בגרנולות דמויות שיטוט וכן בגרנולות מסבך (lattice) מפרישות בתאי פיטום של האדם (Lacy ו-Stow ב-Blood משנת 2011). תאי פיטום עוריים באדם מוערכים כמכילים 1.9 מיקרוגרם היסטמין לכל מיליון תאים (Mori וחב' ב-Arch Histol Cytol משנת 2000). אקסוציטוזה והפרשת היסטמין מגרנולות מתרחשת במהירות לאחר גירוי על ידי IgE או גירוי שאינו IgE (Schick ו-Austen ב-J Immunol משנת 1986). ההשפעות של היסטמין מתווכות על ידי קולטני H3 ,H2 ,H1 ו-H4 הממוקמים על פני תאי המטרה. פעולות המתווכות על ידי H1 כוללות הגברת החדירות של כלי הדם, התכווצות של שריר חלק ברונכיאלי ואינטסטינלי, על ידי הגברת היצירה של רירית אפית, הרחבת לחץ הדופק, הגדלת קצב הלב והפליטה הקרדיאלית, סומק, וכימוטקסיס של תאי T, נויטרופילים ואאוזינופילים (Alfonso וחב' ב-Br J Pharmacol משנת 2000, ו-Muller ו-Meineke ב-J Dermatol Sci משנת 2011). בעכברים, חסר של הקולטן ל-H1 גורם להפחתת הדלקת הריאתית כתוצאה מהפחתה של שטף תאי T.
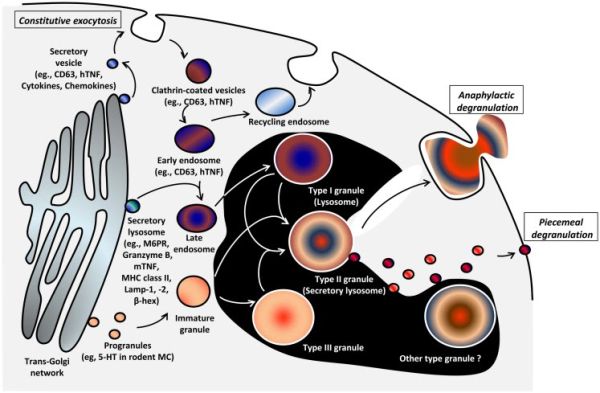
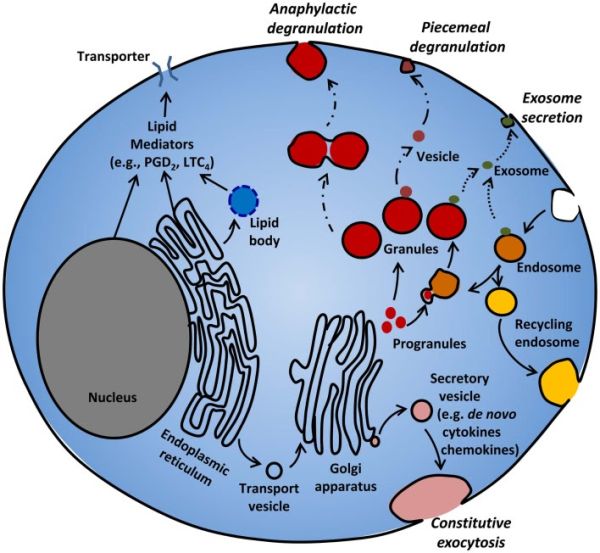
תווכי תאי פיטום: תאי פיטום באדם לרוב מאופיינים על ידי יכולתם להפריש מגוון של תווכים חשובים עם מספר פעילויות ביולוגיות. ההפרשה המבוקרת של פפטידים, אמינים, ליפידים ואפילו גזים אחדים, תלויה במספר מסלולים מולקולריים: באחד המסלולים גרנולות גדולות ודחוסות מפרישות הוא דרך אקסוציטוזה (דה-גרנולציה); דרך אחרת תלויי ביצירה de novo של תווכים בדרך של מסלול ים אקסוזומליים ואנדוזומליים כגון גז כחד תחמוצת החנקן (NO) על ידי דיפוזיה, ותווכים ליפידיים.
תאי פיטום מאופיינים מורפולוגית על ידי גרנולות ציטופלזמטיות דחוסות במיקרוסקופ אלקטרוני המכילות אמינים ביוגניים כגון היסטמין וסרוטונין (Schwartz וחב' ב-J Immunol משנת 1981), פרוטאזות serine כגון -α tryptase, טריפטאז βI, טריפטאז βII, טריפטאז βIII, טריפטאז γ, ו-טריפטאז δ וכן chymase-1, כמו גם cathepsin G ,granzyme B ו-carboxypeptidase A3 (Miller וחב' ב-J Clin Invest משנת 1989, Wong וחב' ב-J Biol Chem משנת 1999, Schwartz וחב' ב-Immunol משנת 1987, Fejler וחב' ב-Trends Immunol משנת 2009, Schechter וחב' ב-J Immunol משנת 1994 ו-Strik וחב' ב־Mol Immunol משנת 2007). תווכים נוספים המופרשים הם אנזימים ליזוזומליים דוגמת β-glucuronidase ,β-hexosaminidase, arylsulfatase (Schwartz וחב' ב-J Immunol משנת 1981), ציטוקינים אחדים כגון TNF (Olszewski וחב' ב-J Immunol משנת 2007), BFGF (Dvorak וחב' ב-J Histochem משנת 2001 ו-Wilson וחב' ב-Clin Exp Allergy משנת 2000), IL-4 (De Paulis וחב' ב-J Immunol משנת 1999), פרוטאו-גליקנים דוגמת הפארין ו-chondroitin (Stevens וחב' ב-Proc Natl Acad Sci U S A משנת 1988, ו-Metcalfe וחב' ב-J Clin Invest משנת 1979). תת-סוגים של תאי פיטום אנושיים נבדלים על ידי הנוכחות או ההיעדרות של serine proteases שונים בגרנולות שלהם (דהיינו tryptase+/chymase-, +tryptase+/chymase, ו-+tryptase−/chymase). השפעול של תאי פיטום נמדד על ידי ניטור השחרור של תווכים מהגרנולות, עם דגש מיוחד על היסטמין, טריפטאז או β-hexosaminidase (Hogan ו-Schwartz ב-Methods משנת 1997, ו-Hohman ו-Dreskin ב-Curr Protoc Immunol משנת 2001). שחרור התווכים יכול להיות מהיר ולהתרחש תוך 15–90 שניות. שחרור התווכים מאפשר לא רק ריאקציות אנאפילקטיות מהירות כמו גם תגובות אלרגיות, אלא מסוגל גם לאתחל גיוס של לויקוציטים לנקודת החדירה של הפתוגן, לשפעל תהליכים של חיסון טבעי, ותגובות דלקתיות. תגובות בתווך הרחוק כוללות ריפוי פציעות, ותהליכים של remodeling דרך קומוניקציות עם תאים אחרים כגון שגשוג פיברובלסטים, ויצירת משתית חוץ-תאית על ידי היסטמין ופרוטאזות המופרשים מתאי פיטום (Douaiher וחב' ב-Adv Immunol משנת 2014).
הביוגנזה של גרנולות בתאי פיטום כרוכה באיחוי מבוקר של גרנולות פיוזוגניות קטנות (Hammel וחב' ב-J Cell Biol משנת 1985). גרנולות אלו נובטות מאזור טרנס-golgi ומהרטיקולום האנדופלזמי הגס ומגרנולות בשלות בציטופלזמה. הפרו-גרנולות שהן לא-בשלות הופכות לבשלות דרך תהליך איחוי עם גרנולות לא בשלות או בשלות אחרות. תהליך המוגדר כדחיסה מפחית את נפח הגרנולה ומארגן את תוכנה, תוך יצירת גדלים שונים של גרנולות בשלות (Hammel וחב' ב-J Cell Mol Med משנת 2010). זוהו מספר חלבונים כרוכים בביוגנזה של גרנולות תאי הפיטום ובשלותן. החלבונים הללו מפורטים להלן: Histidine decarboxylase המסייע לבשלות הגרנולות (Nakazawa וחב' ב־Eur J Immunol משנת 2014, synaptotagmins המסייעים לתנועה בממברנה, secretogranin III המשתתף בדינמיקה הממברנלית של וסיקולות מפרישות דרך אינטראקציה עם chromogranin A (Prasad וחב' ב-J Immunol משנת 2008), כרומוגרנין A הנקשר ל-secretogranin ומסייע לביוגנזה של הגרנולה, clathrin כרוך באנדוציטוזה לאחר אקסו-ציטוזה (Cabeza וחב' ב-J Biol Chem משנת 2013), פוליאמינים המווסתים את מטען האגירה בגרנולה ואת המורפולוגיה של הגרנולה (Garcia-Faroldi וחב' ב-PLoS One משנת 2010), serglycin השומר על פרוטאזות בגרנולות (Henningsson וחב' ב-FEBS J משנת 2006), Vesicular monoamine transporter 2 (VMAT2) האחראי לטרנספורט של מונואמינים לתוך הגרנולות המפרישות (Anlauf וחב' ב-J Histochem Cytochem משנת 2006), ו-nuclear receptor 4a3 (Garcia-Faroldi וחב' ב-PLoS One משנת 2014). תת-סוגים של תאי-פיטום מפרישים: ב-type I נכללים cathepsin D (Puri ו-Roche ב-Proc Natl Acad Sci U S A משנת 2008), ו-β-Hexosaminidase. ב-type II נכללים היסטמין, סרוטונין ו-β-Hexosaminidase. ב-type III נכללים TNF, סרוטונין ו-β-Hexosaminidase.
הפרשה של היסטמין ושל פרוטאוגליקנים
גרנולות של תאי פיטום יכולות להפריש מגוון של אנזימים דוגמת β-hexosaminidase באופן שאינו תלוי בהיסטמין. מספר תווכים גרנולריים כגון היסטמין פרוטאוגליקנים של ליבת הגרנולה כגון serglycin הם מרכיבים חשובים בתהליך בשלות הגרנולה. לדוגמה, BMMC מעכבי knockout ל-cerglycin מכילים גרנולות מפרישות מתפקדות, אך הם פגומים ביצירה של ליבה דחוסה. יתרה מכך, תאי serglycin−/− BMMC עמידים לאפופטוזיס הכרוך בשחרור מופחת של פרוטאזות כמו גם בשפעול פגום של caspase-3. בנוסף, חסר בהיסטמין או באנזימים המפקחים על יצירתו, משנה משמעותית את המורפולוגיה ואת תכולת הגרנולות. תאי פיטום פריטונאליים מעכברי knockout עם חסר האנזים histidine carboxylase, מראים מורולוגיה לא נורמלית של הגרנולות המכילות פחות הפארין ופרוטאזות.
אנזימים ליזוזומליים
אנזימים ליזוזומליים רבים נמצאים בגרנולות של תאי פיטום, וההערכה היא שהם עוברים טרנספורט לתוך גרנולות type II כאשר הגרנולות עוברות איחוי עם אנדוזומים. אנזימים ליזוזומליים אלה יכולים להימצא בגרנולות type ii כמו גם בליזוזומים קלאסיים (גרנולות type I), והם מופרשים משני אברונים אלה. שימוש בתאי פיטום מעכברי knockout ל-serglycin מראה שהאגירה וההפרשה של בטא-הקסוזאמינידאז אינם תלויים ב־serglycin (Melo וחב' ב-J Biol Chem משנת 2011).
ציטוקינים
בין המספרים הגדולים של ציטוקינים וכימוקינים המופרשים לאחר שפעול של תאי-פיטום, TNF ,bFGF ,IL-4 ו-SCF ידועים להיות נאגרים בגרנולות של תאי פיטום, ויכולים להיות מופרשים בתהליך של אקסוציטוזה (Wernersson ו-Pejler ב-Nat Rev Immunol משנת 2014). תצפיות אלו מדגישות שמלבד TNF, המנגנונים לנשיאת bFGF, IL-4 ו-SCF, לא נלמדו בגרנולות של תאי פיטום באדם. בהתבסס על זיקת הקישור של bFGF להפארין (Moscatelli ב-J Cell Physiol משנת 1987), ההשהיה של bFGF בגרנולה, תלויה בהפארין, אם כי נתון זה חייב להיות מוכח. בדיקה אימונו-היסטוכימית הראתה ש-IL-4 אך לא IL-5 נאגרות בגרנולות הפרשה של תאי פיטום בפרנכימה של הריאות וברירית האף של מטופלים עם נזלת אלרגית.
הפרשה של תווכים ליפידיים
תאי פיטום משופעלים מפרישים מכוון של מטבוליטים של חומצה ארכידונית, ובעיקר leukotriene C4, prostaglandin D2 ו-platelet activating factor (להלן PAF) (Hogaboam וחב' ב-Br J Pharmacol משנת 1992, Mencia-Huerta וחב' ב-J Immunol משנת 1983, ו-Schleimer וחב' ב-J Immunol משנת 1986). תווכים ליפידיים אלה הם בעלי תכונות של כיווץ דרכי נשימה ופעילות ואזו-אקטיבית, אף גם משתתפים בהגנה על הפונדקאי, יצירת דלקת ומחלות אלרגיות (Boyce ב-Chem Immunol Allergy משנת 2005, Peters-Golden ב-J Immunol משנת 2005, ו-Joo ו-Sadikot ב-Mediators Inflamm משנת 2012).
Eicosanoids, הם תווכים ליפידיים שמקורם בחומצה ארכידונית, מסונתזים de novo, ומופרשים מיד מתאים משופעלים ולא נאגרים, ויוצרים תפקודים אוטוקריניים ופאראקריניים. אך היו תצפיות של מיקום תוך-תאי של הקולטן ל-PGD2, מה שמציע תפקודים אינטרקריניים של תווך זה (Moon וחב' ב-PLoS One משנת 2014).
הוראות לביצוע הבדיקה
במטופלים עם שפעול כרוני של תאי פיטום, יש רמה כרונית מוגברת של N-methylhistamine (NMH) ולעיתים יש להם רמות מוגברות לסירוגין של NMH. במקרים אלה איסוף שתן של 24 שעות מועדף. מטופלים הנוטלים מעכבי האנזים monoamine oxidase (להלן MAOI) או aminoguanidine עלולים לחוות רמות מוגברות של NMH. אם הדבר אינו פוגע קלינית, מטופלים אלה אינם אמורים ליטול MAOI או aminoguanidine למשך 3 שבועות לפני איסוף השתן. מטופלים הנוטלים אספירין או תכשירים לא-סטרואידליים נוגדי דלקת (NSAIDs) יכולים להיות בעלי ריכוזים נמוכים של prostaglandin F2 alpha, ואם הדבר אפשרי קלינית עליהם לא ליטול אספירין למשך שבועיים, או NSAIDs שלושה ימים לפני איסוף השתן לבדיקה. מטופלים הנוטלים zileuton (Zyflo) שהוא מעכב האנזים 5-lipoxygenase עלולים להיות בעלי ריכוז נמוך של leukotriene E4 (LTE4). אם הדבר אפשרי קלינית על הנבדקים להימנע מנטילת zileuton למשך 48 שעות לפני איסוף דגימת השתן. את דגימת השתן יש לשלוח למעבדה בבקבוק פלסטיק לאיסוף שתן. הדגימה צריכה להיות בת 20 מ"ל. את השתן יש לאסוף מספר שעות לאחר הופעת תסמינים. אין להכניס לשתן חומרים משמרים.
ניתן לבצע את הבדיקה בשני אופנים: או בבדיקה קולורימטרית, או בשיטת Liquid Chromatography Tandem Mass Spectrometry (LC-MS/MS). יציבות הדגימה הקפואה: 28 יום.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק