תסמונת הכאב האזורית המורכבת - Complex regional pain syndrome
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תסמונת הכאב האזורית המורכבת | ||
|---|---|---|
| Complex regional pain syndrome | ||
| יוצר הערך | ד"ר סילביו בריל, ד"ר איתי גור-אריה 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – כאב
- כאב עצבי
הכאב העצבי, נוראלגיה (נוירו-עצב; אלגיה-כאב) המאופיין באירועי כאב מתפרץ חזקים, שונה באופיו מכאבים בעלי אופי קבוע והוא מהווה את אחת מבעיות הכאב הקשות שאיתן מתמודדת הרפואה בכלל, ורפואת הכאב בפרט. הטיפול בכאב עצבי מהווה אתגר בכל הנוגע למינון התרופתי, שכן קשה לטפל בכאב מתפרץ מבלי לגרום לתופעות לוואי, כמו ישנוניות. הכאב העצבי ברובו אינו ניתן לריפוי, ולכן הטיפול בו הוא ארוך טווח ופוגע באיכות החיים של הסובלים ממנו.
בין הגורמים לכאב העצבי ניתן למנות מחלות סרטן שגורמות לפגיעה העצבית דרך מסת הגידול הלוחצת או חודרת לעצבים ולמוח, אך גם הטיפול במחלה ע"י הקרנות וכימותרפיה יכול לפגוע בעצב. מחלות זיהומיות, כגון שלבקת חוגרת הרפטית ועוד יכולות לפגוע בתאי העצב ולהורגם. מחלות מטבוליות, כגון סוכרת שגורמת לפגיעה בכלי הדם הקטנים המספקים דם לעצבים ומשנית לכך גורמים למוות של תאי עצב. חומרים רעילים, כגון עופרת, אך גם אלכוהול, גורמים לנזקים שונים ביניהם גם הרס של עצבי תחושה וכאב. קיים כאב עצבי לאחר ניתוחים (ובמיוחד ניתוחי דופן בית החזה), וכן פגיעה בשל חבלה או תאונות או לאחר ניתוחים אחרים.
תסמונת הכאב העצבי המרכזי כוללות בין היתר אוטם מוחי לאחר נזק לחוט השדרה מתאונות או מחלות ניווניות של מערכת העצבים, כגון טרשת נפוצה או כאב רפאים לאחר קטיעה. שכיחות הכאב העצבי עשויה להגיע לכדי 7%-5% מן האוכלוסייה המבוגרת. מבין כל תסמונות הכאב הנוירופתי, תסמונת כאב אזורי מורכב היא מהקשות לאבחנה ולטיפול. אנו נעסוק בהמשך באבחנה, במנגנונים ובטיפול.
תסמונת כאב אזורי מורכב
CRPS (Complex Regional Pain Syndrome)
Reflex Sympathetic Dystrophy
תסמונת CRPS מוכרת מאז מלחמת האזרחים האמריקאית, כאשר היא נקראה Causalgia, שם שנבחר כדי לתאר שריפה וכאבים לאחר פציעה. מאז, לשם התסמונת RSD היו כמה שינויים. Bonica טבע את המונח רפלקס סימפטי דיסטרופי ב-1953. פאנל מומחים של הסכמה קבע את שינוי השם לתסמונת כאב אזורי מורכב (CRPS). עם זאת רבים מהרופאים עדיין נוהגים להשתמש במונח RSD.
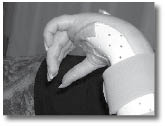
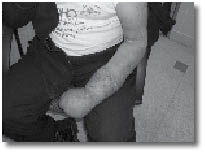
ה-CRPS מאופיינת בכאבים אזוריים המלווים בד"כ בשינויי צבע, חום ורגישות העור בגפה המעורבת.?הכאבים מתוארים בד"כ כ"שורפים" ולעתים גם מלווים בנפיחות מקומית או כללית של הגפה. אף שהתסמונת ידועה כבר כמאה וחמישים שנים, עדיין אין מנגנון ברור המסביר את התסמונת. CRPS היא תסמונת כאב שמופיעה בגפיים, ומאופיינת קודם כל בכאב חריג בעוצמתו וללא פרופורציה ביחס לפגיעה שגרמה לו.
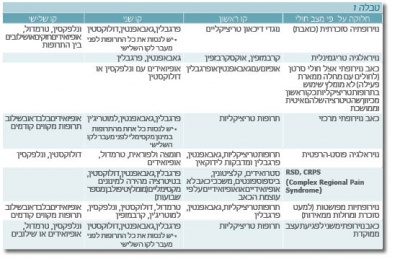
האגודה הבין-לאומית לחקר הכאב (IASP) קבעה את הקריטריונים לאבחון של תסמונת כאב אזורי מורכב:
- התסמין הראשון הוא היסטוריה של פגיעה באיבר שפיתח את התסמונת (כמו מכה, נקע או שבר). עוצמת הפגיעה יכולה להיות קלה ביותר ולא קשורה לחומרת התסמונת.
- התפתחות כאב באזור הפגיעה שמאפיין אותו העוצמה הגבוהה עם אלודיניה והיפר-אלגזיה .כאב בד"כ דמוי גרב או כפפה ואינו מתפזר לאורך מסלול עצבי ברור.
- עדות לנפיחות בגפה הפגועה ועדות לפגיעה בתפקוד כלי הדם, כמו חום או קור של הגפה.
- שלילה של מחלות אחרות.
- סימנים של שינויים ברקמות, כמו אובדן רקמות שריר,
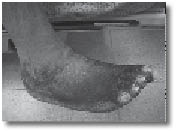
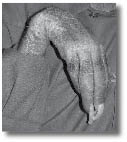
שינויים ניווניים בעור, גידול מהיר של שיער וציפורניים מחזקים את האבחנה. CRPS חולקה לשני סוגים:
- סוג 1, שבו הפגיעה היא כמתואר לעיל (90% ממקרים שייכים לסוג זה)
- סוג 2, שמלווה בפגיעה עצבית ברורה כמקור להתפתחות התסמונת.
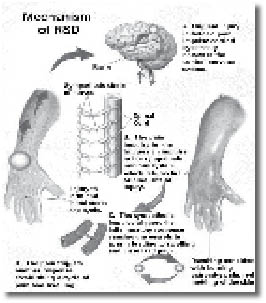
מנגנוני הפגיעה בעצב
מספר מנגנונים אחראים להתפתחות הכאב העצבי. כל כאב כרוני מתאפיין בהתעצמות של הכאב לאורך זמן. הסיבה לכך היא התפתחות של רגישות יתר לכאב. תופעה זו של רגישות יתרה מתפתחת לאורכה של מערכת העצבים. כל גירוי כאב מתמשך גורם לשינויים באזור קולטני הכאב ברקמה הפגועה, בגופי התא העצבי, בחוט השדרה ובמרכזי הכאב במוח. באופן נורמלי לגוף יש מנגנוני תיקון ודיכוי שמעלימים את השינויים הנ"ל (אחרת, היינו ממשיכים לסבול מכל כאב שחווינו בחיינו). בפגיעות עצביות המנגנונים הרבה יותר משמעותיים והשינויים נמשכים לאורך זמן. מאחר שמערכת העצבים האחראית על ההעצמה של הכאב והפסקתו בהמשך, היא הנפגעת, התיקון קשה יותר ולפעמים לא מתאפשר. מבחינה מכנית ניתן לדמות את מערכת העצבים למערכת של חוטי טלפון מבודדים הנעים יחדיו בצברים בתוך צינורות שמוליכים אותם מהמוח לרקמות ומהרקמות חזרה למוח. בזמן של פגיעה בעצב יכולים להיווצר מספר מצבים שבהם יש הרס מוחלט או חלקי של כל אחד מחלקי המערכת. רקמת עצב יכולה לגדול שוב רק אם השלוחות והרקמות סביבן נפגעו, ואילו גוף התא לא נפגע. קצב הגדילה של עצב הוא כ-2-1 מ"מ ליממה, והגידול מחדש יכול לכן לקחת זמן רב (פגיעה בעצב באזור הישבן יכולה להתרפא במשך שלוש שנים, ולאפשר לשלוחות העצב לגדול חזרה לכף הרגל). הגדילה מחדש של עצב היא חלק מההחלמה, אך לפעמים הם חלק מהבעיה! שלוחות העצב (אקסון) הגדלות מחדש, לא תמיד גדלות בצורה סדירה. לחלקן אין רקמות בידוד, כך שהן יוצרות מעין קצר עם שלוחות אחרות לא מבודדות. על ידי כך שלוחות אלה גורמות לתחושה שאינה כאב, לעבור למסלול של כאב או להפך. כאשר רקמות החיבור המובילות את שלוחות העצב נהרסות, השלוחות שגדלות מחדש ממשיכות לגדול ללא אבחנה, ויוצרות מבנה כדורי הנקרא נוירומה שרגיש לכל מגע ולעתים מופעל באופן עצמוני וגורם לכאב עז. השינויים במערכת העצבית אינם רק מבניים, לרוב מקורם בשינויים כימיים המתרחשים על מעטפות התאים ובגופי התא. השינויים הללו גורמים לתאים לפתח גריות יתר (היפראקסיטביליות) של העצב (משמעו כי גירוי שבדרך כלל לא היה מועבר דרך העצב, עתה יכול לעבור וביתר עוצמה). נראה כי לתעלות נתרן סידן ואחרות קיים חלק מרכזי בהתהוותה של גריות היתר ההיקפית (מנגנונים אלו חשובים להבנה של דרך פעילותן של תרופות הפועלות נגד כאב עצבי). נוסף על כך, מתפתחת גריות יתר של תאי עצב תחושתיים בחוט השדרה, וייתכן שגם באתרים גבוהים יותר במערכת העצבים המרכזית. שינויים אלו מושרים על ידי חומצה אמינית גלוטמאט וכנראה שגם על ידי חומרים אחרים.
מנגנון חשוב נוסף הנפגע בזמן פגיעה עצבית הן המערכות המדכאות הולכה במערכת העצבית. באופן נורמלי יש מסלולים עצביים במוח ומסלולים היורדים מהמוח לחוט השדרה, שתפקידם לדכא את ההולכה של גירויים מהרקמות לכיוון המוח (כדי לדכא גירויים בלתי פוסקים, כמו לדוגמה תחושת מגע הבגד על גופינו). בפגיעה עצבית יש ירידה בפעילותן של מערכות אלו שחלקן מדכא הולכת כאב. חלקן של התרופות מנסה לטפל דרך המנגנונים הללו, אם כי מנגנונים אלה טרם הובהרו די צורכם.
ייתכן שגם לגורמים גנטיים יש השפעה מסוימת על הופעת התסמונת שנמצאה שכיחה יותר אצל חולים בעלי HLA-A3 ,B7 ,DR2.
נוסף על כך, לפי מחקר אחד, חולים שהם בעלי HLA-DR2 היו עמידים יותר לטיפולים תרופתיים.
מנגנון נוסף של תסמונת הכאב האזורית המורכבת קשור לפגיעה במערכת האוטונומית, ובייחוד הסימפתטית, בתגובה לכאב או לפגיעה עצמה. המערכת הסימפתטית מגיבה ע"י פעילות יתר, מעין פעולה רפלקסיבית (תגובתית). תגובה זו היא הגורמת לעלייה בטמפרטורת הגפה בשלב הראשון עם גידול מהיר של השיער והציפורניים (השלב ההיפרטרופי) שמתחלף בהמשך לשלב שבו הטמפרטורה בגפה הפגועה יורדת, כלי הדם מתכווצים, העור, השיעור והציפורנים עוברים ניוון (השלב האטרופי). היום אנו יודעים, כי ברוב המקרים אין כנראה עלייה בפעילות מערכת העצבים האוטונומית, ולכן ההגדרות החדשות הן יותר תיאור של תסמינים מאשר שם שמוסר את המנגנון של הפגיעה.
חלק מהמקרים אכן מבוסס על פגיעה אוטונומית תפקודית. פגיעה זאת נקראת SMP (Sympathetically Maintained Pain), אך נראה שברוב המקרים יש חלק של מעורבות אוטונומית.
המחלה מתפרצת בעיקר במבוגרים צעירים, מעט יותר בנשים. הגירוי הגורם להתפתחות המחלה יכול להיות מדקירה של עירוי או זריקה ועד ניתוח. אין קשר בין עוצמת המחלה מהרגע שהתפתחה לבין הגירוי הראשוני. יש גירויים שהם מועדים יותר, כמו שבר במפרק כף יד ומרפק, אך גם אירועים כניתוחים סרטניים והתקפי לב יכולים להוביל להתפתחות המחלה.
האספקט הנפשי כנראה שותף להתפתחות המחלה. 80% מאלו שפיתחו את המחלה סבלו מלחץ נפשי בחודשיים שקדמו למחלה ובחודש לאחר שהתפתחה. אבל, צריך לציין שלא נמצא מבנה נפשי משותף קשור למחלה.
מאפיינים קליניים נוספים של המחלה הם: כאב עז עד כדי חוסר תנועה של הגבה הפגועה, הופעת אלודיניה והיפר-אלגזיה, שינויים בטמפרטורת הגפה והפרעה בהזעה. הפרעות תנועתיות שאינן קשורות לכאב יכולות גם כן להופיע ולהתבטא כהתכווצות רעד וחוסר יכולת לתנועה קואורדינטיבית.
השלבים הסופיים של המחלה יכולים להגיע עד שברים בעצמות עקב ניוון שלהן, התפתחות כיבים מחוסר תנועה ולחץ לא אחיד והתקצרות של השרירים המוביל לשיתוק פונקציונאלי.
המחלה יכולה להתפשט. ההתפשטות היא לרוב לאורך הגפה הפגועה, אם כי יש מקרים שבהם הכאב קופץ לגפה השנייה המקבילה (ימין-שמאל) או לגפה השנייה באותו הצד (עליונה-תחתונה).
לאחר התפתחות המחלה יש תסמינים פסיכולוגיים משיניים לכאב: פחד, חרדה, כעס ודיכאון.
בדיקות עזר
מעבר לנטילת היסטוריה של המחלה והבדיקה הגופנית, קיימים מבחנים נוספים העוזרים להגיע לאבחנה. חסמים עצביים של המערכת הסימפתטית או של העצב החשוד כפגוע (ב-CRPS מסוג 2) ע"י הזרקות או עירויי פנטולאמין. בדיקות כמו EMG ובדיקות של הולכה תחושתית יכולות גם הן לעזור באבחנה וברמת הפגיעה העצבית. תרמוגרפיה ואולטרה-סאונד דופלר יכולים גם הם לעזור באבחון של החלק המשפיע על כלי הדם. צילומי רנטגן ומיפוי עצמות מראים לעתים סימני ניוון אופייניים בעצמות, אך הם לא חד-משמעיים בביסוס האבחנה. צריך להדגיש שנכון להיום אין בדיקת עזר שיכולה לאשר או לשלול באופן ברור את קיום תסמונת כאב אזורי מורכב.
טיפול
הטיפול בתסמונת זו כולל מספר שיטות וגישות: תרופות, הזרקות וחסמים עצביים, פיזיותרפיה משמעותית ותמיכה פסיכולוגית. פעמים רבות יש לערב את מחלקות השיקום המתמחות בנושא.
הטיפול התרופתי מבוסס על שימוש בתרופות לכאב עצבי, כמו ליריקה, נוירונטין, סימבלטה, טגרטול, אלטרול ועוד.
יש גם תרופות ממשפחות אחרות. השימוש בתרופות החוסמות רצפטורים אדרנרגיים, כגון: קלונידין, תרופות הפועלות על מניעת ספיגת עצם ממשפחת הביספוספונטים. תרופות במתן תוך-ורידי דווחו בעבר כיעילות, אך חלק גדול מהן לא קיים בישראל. התרופות התוך-ורידיות יכולות לשפר את אספקת הדם לרקמות ע"י הורדה בפעילות של המערכת הסימפתטית, ולהוריד את הכאב העצבי. עירויים של לידוקאין, מגנזיום, פנטולאמין, קטמין וברטיליום הם המקובלים.
חסמים עצביים וורידיים סימפתטיים עם פנוקסיבנזמין, פרזוסין, דוקסזוסין וטרזוסין יעילים לחסום באופן מכוון את הקולטנים על כלי הדם, לחומרים המופרשים ע"י המערכת הסימפתטית. ע"י כך הם מרחיבים את כלי הדם בגפה הפגועה ומשפרים זרימת דם ואת שיכוך הכאב. חסמים של המערכת העצבית הסימפתטית בגובה הצוואר (חסם של גנגליון הסטליט) שחוסמים את העצבוב לכיוון הגפה העליונה, וחסם של השרשרת העצבית הסימפתטית בגב התחתון שמספקת את הרגל, יכולים לעזור באבחנה, אך גם בטיפול ע"י סדרה של חסמים.
במקרים של CRPS מסוג 2 יש בהחלט מקום לחסמים עצביים באזור של העצב הפגוע ואף לניסיון להזריק סטרואידים למקום. השימוש בפעולות פולשניות, כגון: השתלת אלקטרודות אפידורליות ואף משאבות הוא יעיל, אך נשמר לשלבים מאוחרים בטיפול עם הרס מכוון של שרשרות העצבים האוטונומיות.
טיפול בכאב עצבי מתבצע במספר שלבים שנכונים עבור כל טיפול: מתחילים בטיפול שמידת הסיכון בו נמוכה, ועולים במידת הפולשניות במידת הצורך. הטיפול מתחיל בטיפול תרופתי, עובר להזרקות ובסוף עובר לניתוק עצבים ולהשתלת אלקטרודות.
טיפול תרופתי
בחירת הטיפול התרופתי שממנו אנו מתחילים, הוא שילוב של מספר גורמים: יעילות מוצעת ממחקרים וניסיון קודם לעומת מידת תופעות הלוואי הצפויות. פן נוסף הוא מידת החריפות של הבעיה. נטפל ביתר אגרסיביות בחולה עם כאב עצבי חדש. נעדיף שימוש בתרופה אחת לטפל בכאב, אך נשקול שילוב תרופתי במקרים של כאב קשה לטיפול. לרוב נעדיף תרופות הניתנות דרך הפה, לעומת מתן תוך-ורידי.
שלוש קבוצות תרופות מהוות את אבני היסוד בטיפול בכאב העצבי בכלל ובתסמונת כאב אזורי מורכב בפרט והן התרופות נוגדות הדיכאון, נוגדות הפרכוס והאופיואידים.
קבוצת התרופות נוגדות הדיכאון
מנגנון פעולתן המשוער של קבוצת התרופות נוגדות הדיכאון הוא הפעלת מערכות שיכוך כאב מוחיות וחיזוק פעולתם של המסלולים היורדים מהמוח לכיוון חוט השדרה ומדכאות הולכה במסלולי כאב לכיוון המוח. הדבר נעשה באמצעות מניעת ספיגה חוזרת של סרוטונין ונוראדרנלין בסינאפסות (נקודת הקשר בין עצבים) מוחיות. ייתכן כי לתרופה מנגנוני שיכוך כאב נוסף באמצעות ייצוב מעטפות תא עצביות. השפעתן של התרופות נגד דיכאון על הכאב היא ישירה, ואינה תלויה בהשפעתן על דיכאון. לרוב השפעתן על הכאב היא במינונים נמוכים מהמינונים הנדרשים לטיפול בדיכאון, ומהירה יותר. חשוב לומר למטופל כי התרופה שבה הוא מטופל משמשת גם לטיפול בדיכאון. הסיבה היא שאם המטופל לא מודע לעובדה זו, כשהוא שומע על כך ממקורות אחרים (רוקח, משפחה), עוברת בראשו המחשבה שהרופאים אינם מאמינים לכאביו וחושבים שהם נפשיים, ובהמשך לכך יסרב ליטול את התרופה או להמשיך בטיפול.
פן הדיכאון עצמו הוא פן חשוב בכאב. כאב כרוני מוביל לדיכאון בחלק גדול מהמקרים ובמיוחד בסובלים מכאב עצבי, לכן יש תועלת כפולה בשימוש בתרופות נוגדות דיכאון לכאב.
- קבוצת התרופות נוגדות הדיכאון כוללת מספר תת-קבוצות
- הקבוצה הוותיקה של תרופות בעלות המבנה התלת טבעתי (טרי-ציקלי) נחקרה רבות ונמצאה יעילה בהפחתת סוגי כאב עצבי רבים ללא קשר להשפעתה על דיכאון. התרופות מתת-קבוצה זאת אינן בררניות ומשפיעות על חומרים מוחיים נוספים, ולכן גם תופעות הלוואי שלהן נרחבות יותר.
- אלטרול (Amitriptyline) היא "נציגה" של הקבוצה. תרופה זאת ניתנת במינון התחלתי בן 25-10 מ"ג. העלאת המינון חייבת להיות הדרגתית כדי להפחית תופעות לוואי. חלק מן המטופלים מדווחים על הקלת כאב במינוני ביניים (75-50 מ"ג), אם כי לעתים יש צורך להגיע ל-150-100 מ"ג ליממה ואף יותר במנה אחת בערב. הסיבה לכך היא שהתרופה גורמת לישנוניות, וכך אנו יכולים להשתמש בתופעת הלוואי כדי לעזור למטופל להירדם. תופעות הלוואי רבות וכוללות אפקטים של יובש בפה, עצירות, ישנוניות יתר, סחרחורת ועוד. יש להימנע משימוש בתרופה אצל חולים הסובלים מגלאוקומה מסוג זווית חדה, הגדלת הערמונית, הפרעות במערכת ההולכה בלב ולאחר אוטם חד בשריר הלב. תרופות נוספות מקבוצה זאת הן דפרקסן (Desipramine), אנפרניל (Chlomipramine) ואחרות.
- SNRI(Serotonin and Norepinephrin Reuptake Inhibitor) היא הקבוצה השנייה המודרנית של תרופות נוגדות דיכאון שנמצאה יעילה לטיפול בכאב עצבי. תרופות ממשפחה זו חוסמות את ספיגת נוראדרנלין וסרוטונין באופן סלקטיבי. מאחר שהחסימה בררנית יותר מאשר התרופות התלת-טבעתיות, פרופיל תופעות הלוואי שלה נמוך יותר.
- סימבלטה (Duloxetine) נרשמה בארץ ואף הוכנסה בימים אלה לסל התרופות לאחר שנמצאה לה יעילות גבוהה בהפחתת כאב עצבי סוכרתי: ירידה ב-50% ברמת הכאב ב-50% מהמטופלים. ניתן להתחיל במינון של 30 מ"ג לשבוע, ואז להעלות את המינון ל-60 מ"ג ליום במנה אחת בערב. תופעות הלוואי העיקריות שנצפו היו בחילה, נמנום וסחרחורת, שחלפו לרוב עם הזמן. רוב תופעות הלוואי היו בדרגת חומרה קלה עד בינונית, נצפו בדרך כלל בתחילת הטיפול, וחלפו עם המשך הטיפול. נציגה נוספת ממשפחה זו היא האפקסור (Venlafaxine), אם כי לגביה ההוכחות ליעילות נמוכות יותר, ותרופה זאת אינה רשום לאבחנה של טיפול בכאב עצבי בישראל.
- (Selective Serotonin Reuptake Inhibitor) SSRI תת-הקבוצה השלישית פועלת באופן סלקטיבי להעלאת מינון הסרוטונין במוח. תרופות אלה בטוחות יותר בשימוש בהשוואה לטרי-ציקליות, אולם יעילותן כמשככי כאב עצבי ירודה בהתאם. מבין תרופות אלה ניתנת לציין את הסרוקסאט/פאקסט (Paroxetine) הניתנת במנה אחת בת 40-20 מ"ג מאחר שנמצאה יעילה בהפחתת נוירופתיה סוכרתית כואבת במחקר בודד. כנראה כי ההשפעה שלה על הכאב נובעת בעיקר מהשפעתה על הדיכאון הנלווה.
- תרופות נוגדות כפיון.
- השימוש בתרופות נוגדות כפיון לטיפול בכאב עצבי נראה מעט מוזר בתחילה, אך כשאנו בוחנים את מנגנוני הפעולה של התרופות נוגדות הכפיון מחד, ומאידך את השינויים ומנגנוני הנזק בכאב עצבי, אנו מוצאים התאמה. התרופות פועלות על מנגנונים המונעים את ההתפרצויות העצמוניות של הכאב, ומעלות את סף ההפעלה של העצבים הפגועים. התרופות נוגדות הכפיון אינן יוצרות התרגלות או התמכרות, הן יחסית בטוחות לשימוש, ופרופיל תופעות הלוואי שלהן לרוב סביל. התרופות ברובן בשימוש שנים רבות לטיפול באפילפסיה.
- שוב, כמו שהוזכר לעיל, יש לידע את החולה כי אנו נותנים לו תרופות נוגדות כפיון, וכי אין סכנה שיפתח אפילפסיה בשל כך.
בתוך נוגדי הכפיון יש מספר תת-משפחות הנבדלות במנגנונים אשר עליהן הן פועלות
- • ליריקה (Pregabalin) היא תרופה חדשה אשר
נבדקה ונמצאה יעילה ובטוחה במספר גדול של חולים עם נוירופתיה סוכרתית או בתר-הרפטית. המינון הוא של 600-300 מ"ג ליממה בשתי מנות מחולקות. יתרונה בהתאמת המינון המהיר המתבצעת תוך פרק זמן קצר (6-3 יממות). התרופה פועלת על חסימה של תעלות סידן מיוחדות המופיעות על גופי תאי העצב הפגועים. התרופה נקשרת ביעילות גבוהה פי 6 מאשר הגבהפנטין לתעלות הסידן, ולכן יותר סלקטיבית ואולי עם פרופיל תופעות לוואי קטן יותר. התרופה מופיעה במינונים של 25, 50, 75, 150 ו-300 מ"ג. עיקר תופעות הלוואי הן סחרחורת, עייפות, טשטוש ובצקות היקפיות. התרופה היחידה הרשומה בישראל לכל סוגי הכאב העצבי פריפרי ולאחרונה גם לכאב עצבי מרכזי. לאחרונה נכנסה לסל הבריאות.
- • נוירונטין (Gabapentine) העובד במנגנון זהה לליריקה, נמצא יעיל בשיכוך כאב עצבי מסוגים שונים במספר רב של מחקרים. בישראל רשום רק לטיפול בנוירופתיה בתר-הרפטית ונוירופטיה סוכרתית. מינון הנוירונטין הוא בין 900 ל-3,600 מ"ג ליממה בשלוש מנות מחולקות. הקינטיקה של התרופה אינה ליניארית כך שלפעמים תחילת האפקט האנאלגטי נראית רק במינוני תרופה גבוהים. העלאת המינון מתבצעת תוך ימים עד שבועות. תופעות הלוואי דומות לאלה של הליריקה.
- • טגרטול (Carbamazepine) יעיל במיוחד להפחתת התקפי נויראלגיה טריגמינלית, וייתכן שגם בכאבים עצביים נוספים. המינון התחלתי הנו 100 מ"ג פעמיים ביום, ויש לעלות במינון בהדרגה בשל ריבוי תופעות הלוואי. המינון המומלץ הוא זה שמביא להקלת כאב ללא תופעות לוואי בלתי נסבלות וללא קשר לרמת התרופה בפלזמה. תופעות הלוואי רבות וכוללות הפרעות בשווי המשקל, ישנוניות, תפרחת על פני העור, הפרעות בתפקודי הכבד, היפונתרפמיה, דיכוי מוח העצם ועוד. יש לפיכך צורך לערוך בדיקת אלקטרוליטים, תפקודי כבד וספירת דם לפני תחילת הטיפול ולאחת למספר חודשים בהמשך.
- • למיקטל (Lamotrigine) היא תרופה נוגדת פרכוס נוספת אשר נמצאה יעילה במספר סוגי כאב עצבי דוגמת נויראלגיה טריגמינלית, נוירופתיה סוכרתית, כאב סכיאטי ועוד. המינון האפקטיבי הוא 400-200 מ"ג בשתי מנות מחולקות, אולם יש להעלות את מינון התרופה בהדרגה, פעם בשבוע, החל מ-25 מ"ג ליום כדי למנוע תופעות לוואי ובמיוחד תפרחת העלולה להתפתח לתגובת סטיסנס-ג'ונסון.
- • אופיואידים הן מהתרופות הטובות והיעילות לשכוך כאב בכלל וגם את הכאב העצבי. בעבר נחשבו כלא יעילים לכאב העצבי, אך יעילותם בהפחתת כאב עצבי הוכחה במספר מחקרים קליניים. בשנים האחרונות גובר השימוש באופיואידים להקלת כאב כרוני שאינו ממקור ממאיר וזאת על סמך ניסיון מצטבר המראה כי הסיכון להתמכרות נמוך ביותר. התרופות משמשות בעיקר להתקפים קשים ולתרופות קו שני כאשר תרופות אחרות נכשלו.
- סטארוידים
- במחקר של קולטין נמצא שיפור ניכר ב-83% מהחולים שטופלו ב-40 מ"ג פרדניזולון ליממה למשך חודש, לעומת 17% שיפור בחולים שטופלו בפירוקסיקם. הטיפול בסטארוידים הוא טיפול מקובל בשלבים הראשונים של המחלה.
- קלציטונין
- יעילות הטיפול בסלמון קלציטונין מוטל בספק עם יתרון על אינבו עם תופעות לוואי משמעותיות. רוב הטיפולים האחרים נמצאו יעילים יותר.
• ביספוספונטים במחקר של ורנה נמצא קלודרונט יעיל לעומת אינבו במתן דרך הווריד למשך 10 ימים במינון של 300 מ"ג ליממה. פמידרונט ואלדרונט נמצאו גם הם יעילים עם השפעה משמעותית על רמת הכאב והתפקוד בחולים עם CRPS. כסיכום, ביספוספונטים נמצאו יעילים כקבוצה בחולים הסובלים מ-CRPS.
- תרופות במתן תוך-ורידי
- לידוקאין במתן תוך-ורידי במינון של עד 5 מ"ג לק"ג משקל גוף במהלך כשעה (בד"כ במסגרת מרפאות כאב). הטיפול עשוי להפחית כאב עצבי למשך ימים ואף שבועות. הטיפול מחייב ניטור קפדני עקב הסכנה לתופעות לבביות וכפיוניות. יש לבצע בד"כ אק"ג לפני העירוי הראשון.
- קטאמין או אמנטדין במתן תוך-ורידי המשמשים כחסמים לקולטני גלוטמאט (חומרים המעלים את רגישות קולטני הכאב) נמצאו כטיפול יעיל לכאב עצבי. מתן עירויים מסוג זה מתבצע במרפאות כאב בניטור ולעתים תוך כדי אשפוז. מתן פומי או באמצעות משחות של תכשירים אלה לתקופות ממושכות מביא להפחתת כאב, אך מתונה הרבה יותר.
- מגנזיום במתן תוך-ורידי הוא טיפול מקובל במרפאות הכאב בישראל. יש מעט מאוד פרסומים בספרות הרפואית לגבי יעילות הטיפול, אך הניסיון הקליני בארץ תומך בשימוש בו. המגנזיום מוריד תחושת כאב, מרפה שרירים, מעלה סף הפעלה של עצבים, חוסם קולטני NMDA שמגרים כאב ומרחיב כלי דם. יש לחזור על הטיפולים פעם במספר שבועות. ניתן להוסיף כדורי מגנזים כתוסף מזון, אך יש לעקוב אחרי רמות המגנזיום בדם.
- טיפולים דרך העור
- משחת הזוסטריקס (קפסיצין) פועלת במנגנון ייחודי להפחתת הכאב. המשחה מכילה את החומר הפעיל בפלפל האדום. כאשר אנו אוכלים פלפל חריף לראשונה, אנו מרגישים צריבה חזקה. לאחר מכן, אם אנו ממשיכים לאכול פלפל חריף, הצריבה הולכת ופוחתת ותחושה של עמימות מופיעה במקומה. הקפסיצין שנספג דרך העור או הריריות ומגיע לקצות העצבים גורם לריקון שלהם מחומר שנקרא Substance C שגורם לצריבה בלשון. לאורך זמן הקפסיצין מרוקן את החומר מקצות העצבים, ולכן נמנעת תחושת הצריבה והשריפה המאפיינת את הכאב העצבי. הבעיה בשימוש במשחה היא שכדי לקבל את ההקלה בכאב יש לעבור תחילה דרך התקופה של הצריבה. החולה נאלץ למרוח את המשחה 4-2 פעמים ביום ולהתמיד בכך.
- מדבקות לידוקאין ((Lidoderm 5% היא מדבקה אשר מצופה בלידוקאין שהוא חומר הרדמה מקומי. הלידוקאין נספג חלקית דרך העור לסיבי העצב. המדבקה מוצמדת לעור פעם עד פעמיים ביממה למשך 12 שעות ועשויה להפחית כאב ורגישות יתר אצל חולים עם כאב עצבי ממוקם היטב. למרבה הצער, המדבקה אינה משווקת בארץ, אם כי ניתן להשיגה בבתי מרקחת מסוימים המייבאים אותה מחו"ל.
- פיזיותרפיה היא אבן פינה של הטיפול. הנחיות הטיפול צריכות לכלול שיפור תפקודי בעזרת רפואה פיזיקלית.
- טיפולים פולשניים
- ישנו מגוון רחב של טיפולים פולשניים לכאב עצבי. הטווח נע בין הזרקות של חומרי הרדמה מקומיים לצורך אבחון של מקור הבעיה ומתן תשובה אם תעזור הפעולה הפולשנית. הזרקה של סטרואידים לעצב הפגוע בייחוד בתקופה של התפתחות הפגיעה העצבית, ולבסוף פעולות לניתוק או הקטנת ההולכה בעצב ע"י הזרקה של חומרים הורסי עצבים (פנול, אלכוהול וגליצרול). כיום מתבצעות חסימות עצב גם באמצעות גלי רדיו אשר יתרונם בכך שהם פוגעים באופן סלקטיבי בסיבי העצב מוליכי הכאב תוך צמצום הפגיעה בפונקציות עצביות אחרות. במקרים מסוימים מבוצעים ניתוחים לשחרור הידבקויות, התקת עצב, ניתוקו או הרחקת נוירומה שגם הם עשויים להקל או אף להבריא כאב.
- גירוי חוט השדרה (Spinal Cord Stimulation): הטיפול מבוסס על החדרת אלקטרודות לתעלת עמוד השדרה שדרכן מועבר גירוי חשמלי אל חוט השדרה במגמה לחסום את הולכת הכאב אל המוח. החדרת האלקטרודות דרך העור ללא צורך בניתוח פתוח הופכת את הפעולה לפשוטה ומדויקת במחיר של תחלואה נמוכה יחסית. הטיפול ניתן לחולים שבהם לא ניתן להשיג הקלת כאב בדרכים פשוטות יותר. יעילות השיטה נבדקה במספר עבודות רב, הוא מצוי מספר שנים בסל הבריאות בארץ. פירוט בנושא ניתן למצוא בפרק על השתלות אלקטרודות.
- השתלת משאבות מורפין היא אמצעי נוסף לשיכוך כאב מכל סוג, וכאב עצבי בפרט, אשר יוצע רק לחולים שבהם כל האמצעים שנמנו עד כה לא הועילו. הטיפול מבוסס על החדרת מינונים נמוכים ביותר של אופיואידים, חומרי אלחוש מקומי ותרופות נוספות ישירות אל החלל
התת-עכבישי. השתלת המשאבה היא פעולה כירורגית לכל דבר. מילוי המשאבה מתבצע אחת למספר שבועות תוך התאמת סוג התרופות ומינונן. יצוין שגם טיפול זה כלול בסל הטיפולים בארץ.
סיכום
תסמונת הכאב האזורית המורכבת גורמת סבל ניכר ופגיעה קשה באיכות חייהם של חולים רבים. ההסתמנות הקלינית של כאב עצבי רחבה ושונה לעתים מחולה לחולה. בשל העובדה שהוא מגיב לטיפולים ספציפיים בלבד, וכי חוסר אבחון, מעבר לסבל הנורא, יכול לגרום גם לתחלואה קשה, יש חשיבות מרובה לאבחון. אין מענה אחיד ויעיל לכל צורות הכאב, ולכן חשוב להכיר את אפשרויות הטיפול השונות. הטיפול הראשוני כולל תרופות נוגדות דיכאון או ונוגדות פרכוס, עם או ללא שילובם של תכשירים עוריים. שילובן של תרופות אופיואידיות נחשבות לקו טיפול שני. מתן תרופות תוך-ורידיות וביצוע חסימות עצב הן עיקרי השלב הבא בטיפול. במקרים סלקטיביים יותר יבוצעו השתלות אלקטרודות, התערבות כירורגית או מתן אופיואידים תוך-שדרתי. אין לשכוח לשלב טיפולים פיזיקליים ופסיכולוגיים שהם בעלי חשיבות עליונה להמשך תפקוד החולה.
דגלים אדומים
ביבליוגרפיה
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר סילביו בריל - מנהל יחידת לטיפול בכאב, המרכז הרפואי ת"א ע"ש סוראסקי, תל אביב; מזכיר האגודה הישראלית לכאב, ד"ר איתי גור-אריה- מנהל יחידת הכאב המרכז הרפואי ע"ש ח' שיבא, תל השומר; יו”ר האגודה הישראלית לכאב,


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק