מחלת אנדרסון-פברי - Anderson-Fabry disease
| מחלת אנדרסון-פברי | ||
|---|---|---|
| Anderson-Fabry disease | ||
| 250px | ||
Alpha galactosidase - the protein that is deficient in Fabry disease
| ||
| שמות נוספים | Alpha-galactosidase A deficiency, Angiokeratoma corporis diffusum, Ceramide trihexosidosis, Ruiter-Pompen-Wyers syndrome, Sweeley-Klionsky disease | |
| ICD-10 | Chapter E 75.2 | |
| ICD-9 | 272.7 | |
| MeSH | D000795 | |
| יוצר הערך | ד"ר אניק רז-רוטשילד | |
מחלת אנדרסון-פברי היא מחלת אגירה ליזוזומלית המורשת בתאחיזה לכרומוזום ה-X (X- linked). תפוצתה באוכלוסיה הנה פאן-אתנית. המאפיין הביוכימי של מחלת פברי הנו ירידה או חסר בפעילות של האנזים אלפא גלקטוזידאז A (Alpha-galactosidase-A) הגורם לאגירה של סובסטרט ממשפחת הגליקוספינגוליפידים ופגיעה במערכות שונות של הגוף.
הפגיעה העיקרית כוללת את מערכת העצבים הפריפרית והמרכזית, מערכת הלב וכלי הדם (קרדיווסקולרית) והכליות. משמעותה של הורשה אחוזה ל-X הינה כי הגברים הנם המיזיגוטים (Hemizygotes) (בעלי כרומוזום X בלבד הנושא את המוטציה) ומפתחים מחלה רב מערכתית, ואילו הנשים הן הטרוזיגוטיות (בעלות כרומוזום X הנושא את המוטציה, וכרומוזום X שאינו נושא את המוטציה) אך על פי רוב תפתחנה גם הן תסמינים עם השנים. זוהי מחלה פרוגרסיבית וסימניה הראשונים מופעים כבר בגיל הילדות (1,2). חומרת המחלה וצורת הופעתה מגוונות בין המשפחות השונות וגם בין חולים של אותה משפחה. משנת 2001 זמין הטיפול באנזים חליפי ועל כן, אבחון מוקדם ומתן טיפול בטרם נוצר נזק בלתי הפיך לרקמה ולאברים עשויים לשפר את איכות חיי החולים ואולי אף להאריכם (3,4).
אפידמיולוגיה
מחלת אנדרסון-פברי אינה שכיחה יותר בעדות או עמים מסוימים ופוגעת בכל האוכלוסייה. בעבר תוארה המחלה כמחלה נדירה המופיעה בזכרים בשכיחות של 1:40,000-60,000 (1). אולם, במחקר סקר ילודים שנערך באיטליה נמצאה פעילות ירודה של האנזים אלפא גלקטוזידאז A (מתחת ל-20% מהנורמה) בשכיחות של 1:3100 בתינוקות ממין זכר (13) ובסקר שנערך בטאיוואן נמצאה שכיחות של 1:1250, כאשר 86% מהחולים נשאו אותה מוטציה אופיינית אשר קשורה להופעה מאוחרת של המחלה (14). בישראל מאובחנים כיום כ-25-30 חולים (גברים, נשים וילדים).
אטיולוגיה
פתופיזיולוגיה
בעקבות חסר או ירידה בפעילות האנזים אלפא גלקטוזידאז A נמנע פירוק תקין של גליקוספינגוליפידים (Glycosphingolipids) ובעיקר של Globotriaosylceramide (GL3,Gb3, ceramide trihexoside) בתאים שונים ובמיוחד בתאי האנדותל הוסקולרי. הסובסטרט נאגר בליזוזומים וגורם לפגיעה בתפקוד תאים כגון תאי עצב, תאי האפיתל הגלומרולרי (Glomerular epithelia) והטובולרי (Tubular epithelia) של הכליות ותאי שריר הלב (קרדיומיוציטים) (1). הפגיעה התאית גוררת פגיעה ברקמה עם הופעה של איסכמיה (Ischemia) ופיברוזיס (Fibrosis). כיום עדיין לא ברור באיזה שלב הנזק לתאים הוא בלתי הפיך ומתי הטיפול אינו יכול להביא לשיפור במצבם של החולים. לאחרונה מצטברות עדויות כי מתן טיפול מוקדם ככל האפשר הנו יעיל יותר ואף עשוי למנוע סיבוכים של המחלה כגון כשל כלייתי, שבץ מוחי או התקף לב בגיל צעיר (3,4,5).
תורשה
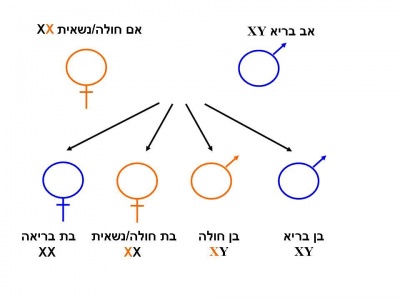
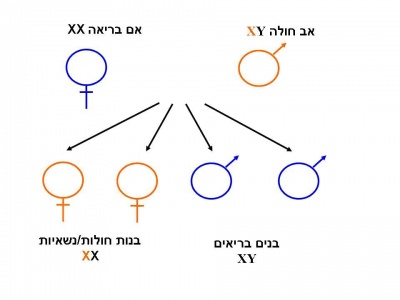
הגן המקודד לאנזים alpha-galactosidase-A ממופה על גבי הזרוע הארוכה של כרומוזומום X (Xq22) ומכיל 7 אקסונים שהם האיזורים המקודדים לאנזים (6). לכל משפחה מוטציה משלה (private mutation). עד היום תוארו יותר מ-384 מוטציות (7). מחלת פברי מורשת בתאחיזה לכרומוזום ה-X. חשוב לציין כי נשים הנושאות מוטציות בגן ל-Alpha-A galactosidase יהפכו להיות עם הזמן סימפטומטיות בדרגות חומרה שונות (8,9). הסיבה להופעת המחלה בנשים לא ברורה אך דפוס של הופעת סימפטומים בנשים במחלה שאינה דומיננטית ומופיעה בתאחיזה לכרומוזום ה-X אינו יחודי למחלת פברי (10,11, 12). לאישה נשאית יש סיכון של 50% לילד זכר חולה, ו-50% לילדה נשאית אשר יכולה לפתח תסמנים בהמשך.
בנותיו של גבר חולה פברי בהכרח נשאיות ואילו כל בניו יהיו בריאים.
קליניקה
חולה פברי יופיע במרפאה עם אחד או יותר מהממצאים הבאים: נוכחות נגעים עוריים מסוג angiokeratoma, כאבים "שורפים" בגפיים (acroparesthesia), כאבי בטן, שלשולים במיוחד אחרי אכילה, חוסר הזעה, עייפות, אי סבילות לחום, אי סבילות למאמץ וכן סיפור משפחתי של אי-ספיקת כליות, שבץ מוחי (stroke), או מחלה קרדיאלית (1,2). אחד הכלים היעלים ביותר לאבחון המחלה הינו עריכת בירור אם קיימים עוד קרובי משפחה עם תסמינים אשר יכולים להיות קשורים למחלת פברי. כלומר, בנית עץ משפחה המתאים לתורשה בתאחיזה ל-X. לאחר אבחון של אדם במשפחה חדשה יש צורך לבדוק את כל בני המשפחה המצויים בסיכון על בסיס נתוני המשפחה תוך התייחסות לאופן ההורשה.
סימני המחלה מתחלים להופיע בגיל הילדות ומחמירים עם הזמן גם בגברים וגם בנשים (15). סימנים ראשונים מופיעים בבנים כבר בגילאים 3-10 ובבנות סביב גיל 13-19. האבחנה הסופית הינה בממוצע סביב גיל 26 בגברים וסביב גיל 30-32 בנשים (8, 9, 16). בתקופה זו ולמעשה עוד בשלבים העובריים מצטבר GL3 ברקמות ונוצר נזק שעשויי להיות בלתי הפיך בגיל מבוגר יותר. חולים עם פעילות אנזימתית ירודה או לא קיימת, מציגים תמונה קלאסית של המחלה ואילו חולים עם פעילות אנזימתית שאריתית מציגים מחלה קלה יותר או Variant disease (17,19).
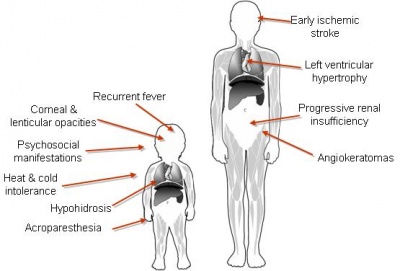
חולים עם הופעה קלאסית מציגים את הסימנים הבאים המערבים מספר מערכות ואילו חולים קלים יותר יציגו רק חלק מהסימנים:
ממצאים נוירולוגים
כאבים כרוניים (Acroparesthesia) או התקיפי כאבים "משברי פברי" במיוחד בזמן מאמץ, בזמן מחלת חום או במזג אוויר חם, שינויים בחומר הלבן של המוח, אשר ניתנים לאבחון רק ב-MRI. חולים יכולים להופיע עם תמונה קלינית של שבץ מוחי או TIA (Transient Ischemic attack) בגיל צעיר יחסית. נמצא כי 5% מהגברים הסובלים מ-acute cryptogenic stroke הם חולי פברי שלא אובחנו (13).
ממצאים כליתיים
סימנים ראשונים הינם פרוטאינוריה (proteinuria) ואיזוטנוריה (isothenuria). עם הזמן הפגיעה מתקדמת עם עליה בקראטינין וירידה בקצב הסינון הגלומרולרי (glomerular filtration rate - GFR). במחקרים אשר בהן נסרקו אוכלוסיות המטופלים בהמודיאליזה לנשאות מחלת פברי, נמצא כי 0.25%-1% מהגברים המטופלים בהמודיאליזה חולים ב- Fabry (13,19).
ממצאים גסטרואיטסטינאלים
כאבים אחרי האוכל, שלשולים, תחושה של שובע מהיר.
ממצאים עוריים
נגעים מסוג Angiokeratomas מופעים במיוחד באזור החלציים ומתרבים עם הזמן, חוסר הזעה (Hypo-anhydrosis) (1,2,17,19).
ממצאים קרדיואסקולארים
הפגיעה הלבבית עשויה להתבטא בצורות רבות בניהן: הפרעות קצב (קיצור PR ללא גל δ, QRS מאורך, AV block ועוד) כאשר, 10%-20% מהחולים נזקקים להשתלת קוצב קבוע, פגיעה בכלי הדם הכליליים עשויה להוביל להופעה של אנגינה פקטוריס (angina pectoris) ולאוטם שריר הלב. חולים יכולים להופיע עם תמונה של אי-ספיקת לב משנית כגורם הבירור, פגיעה במסתמים או קרדיומיופטיה (cardiomyopathy). סימנים אלה יופיעו על פי רוב בגיל צעיר מן הממוצע באוכלוסיה. נמצא כי 3%-4% מהגברים הסובלים מקרדיומיופטיה הם חולי פברי שלא אובחנו (13,17). מחלת הלב בפברי מאופיינת בהיפרטרופיה של החדר השמאלי הדומה לזו המתקבלת בחולים עם הפרטרופיה סרקומרית או לחץ דם גבוה (18).
ממצאים המופיעים בעיניים
ל- 70%-90% מהחולים (ללא הבדל מין) מופיעה cornea verticillata ב-corneal epithelium. אבחון ממצא זה מצריך שימוש במנורת סדק. זהו אינו ממצא סימפטומטי אך נוכחותו פטוגנומית לפברי.
ממצאים נוספים: התקיפי vertigo, ירידה בשמיעה מחלת ריאות רסטרטיבית וחסימתית (1,2,17,18).
נשאיות יכולות להיות סימפטומטיות
תוחלת החיים של נשים נשאיות למחלת פברי קצרה ב- 15 שנים יחסית לממוצע באוכלוסיה, ועל פי רוב הן מפתחות סימפטומים של המחלה עם הזמן (8). הופעת הסימפטומים בנשים מופיעה בין 5 ל-10 שנים מאוחר יותר לעומת גברים, והדיאגנוזה מתאחרת בהתאם (8,9,16). נמצא כי ב-20%-30% מהנשים מופיעים סימפטומים קשים כגון: כאבים נויירופתיים, מחלת כליות, אירועים מוחיים ומחלת לב (9). חשוב אם כן לזכור כי יש לעקוב גם אחר נשים אסימפטומטיות שכן לא ניתן לחזות מתי יתפתחו הסימפטומים.
אבחנה
אישור האבחנה במעבדה
אשור האבחנה בגברים מבוסס על בדיקת פעילות האנזים alpha galactosidase בלויקוציטים, בסרום או בפלזמה. בנשים רמת הפעילות האנזימטית יכולה להיות נמוכה או תקינה בהתאם לכמות הלוייקוציטים בהם חלה אינאקטיבציה של כרומוזום ה-X (10). לפיכך מבוצע אישור האבחנה הקלינית בנשים על ידי בדיקת רצף הגן המקודד ל-alpha galactosidase. במידה ואין ידע מוקדם על המוטציה הקיימת במשפחה מבוצע ריצוף של כל הגן. חשוב לבדוק גם נוכחות של חסר בגן על ידי בדיקת MLPA.
אבחון טרום לידתי
מומלץ להפנות את החולים והמשפחות לייעוץ גנטי כדי שיקבלו מידע על אפשרויות אבחון טרום לידתיים. אבחון זה יתבצע על ידי בדיקת הפעילות האנזימתית בעוברים זכרים או בדיקת המוטציה המשפחתית.
את הבדיקה ניתן לבצע בסיסי השיליה בשבוע ה-11 או בתאי מי שפיר בשבוע ה-17. במידה והמוטציה ידועה ניתן גם להציע למשפחות אבחון טרם השרשה (preimplantation genetic diagnosis) על ידי בדיקת תא של עוברים מהפריה חוץ גופית (In Vitro Fertilization).
טיפול
בטרם פותח הטיפול באנזים חליפי, היה הטיפול בחולי פברי טיפול תומך וטיפול סימפטומטי בלבד ותוחלת החיים הממוצעת בגברים היתה 41 שנים (2). משנת 2001 זמינים, שני תכשירים שפותחו בשיטות של הנדסה גנטית: Agalsidase alpha (Replagal) המיוצר בתאים פיברובלסטים ממקור אנושי ו-Agalsidase beta (Fabrazyme) המיוצר בתאי שחלה של אוגר סיני (CHO cells - Chinese Hamster Ovary cells).
בשנת 2001 אושר שימוש בשני התכשירים לשיווק באירופה ואילו בארה"ב אישרה רשות המזון והתרופות (FDA) ב-2003 את Agalsidase beta בלבד וב- 2009 הוגש התיק בשנית לאישור מזורז תכשיר Agalsidase alpha של על רקע מחסור זמני בתכשיר Agalsidase beta.
בישראל מאושרות שתי התרופות ושתיהן כלולות בסל הבריאות לטיפול בחולי פברי. Agalsidase alpha מומלץ לשימוש במינון של 0.2mg/kg ואילו Agalsidase beta מומלץ לשימוש במינון של 1mg/kg שניהם ניתנים בעירויי לווריד בתדירות של פעם בשבועיים (3,5). מחירם דומה בשלב ראשון החולים מטופלים במסגרת בי"ח ובהמשך ובהעדר תגובות רגישות ניתן לעבור לטיפול במסגרת טיפולי בית, לאחר קבלת אישור הרופא המטפל.
בבדיקות ביוכימיות שבוצעו נראה כי רצף חומצות האמינו זהה בשני התכשירים וכך גם הפעילות האנזימתית. קיים וויכוח בספרות לגבי היתרונות של תרופה אחת על פני השנייה (20,21,22).
מאחר ומדובר בהזרקה של חלבון אשר בחולים מסוימים הנו זר לגוף, תתכן יצירת נוגדנים כנגד האנזים המוזרק (23,24). דווח כי ב-30% מבין החולים המתפתחים נוגדנים מסוג IgG נגד האנזים נשארים הנוגדנים לאורך זמן אולם, השפעתם על יעילות הטיפול עדין לא ברורה (20,21). נשים הטרוזיגוטיות אינן מפתחות נוגדנים ותופעות לוואי בדרך כלל.
במי לטפל ומתי להתחיל טיפול
המלצה לטיפול בחולים זכרים הנה להתחיל בטיפול מוקדם ככול האפשר על מנת למנוע את נזק האגירה בתאים וברקמות. מן הראיות שהצטברו עד כה נראה כי חשוב לעקוב אחר התפתחות המחלה בנשים "נשאיות של המוטציה" ולשקול טיפול בשלבים מוקדמים יחסית עם הופעת הסימפטומים כדי למנוע נזק בלתי הפיך (1,4). בילדים יש וויכוח אם להתחיל טיפול לפני הופעת התסמינים או להמתין להופעת הסימנים הקלינים (15).
הטפול כולל מעקב על ידי צוות רב תחומי, הכולל רופא המשפחה, נפרולוג, קרדיולוג, נוירולוג, מומחה לכאבים, ומומחים נוספים בהתאם לצורך. יש לשים דגש מיוחד על מעקב התפקוד הכיליתי, התפקוד הלבבי ומערכת העצבים. מומלץ טיפול סימפטומטי תומך כמו טיפול במעקבי ACE (ACE - Angiotensin Converting Enzyme inhibitors) ובחוסמי הרצפטור לאנגיוטנסין - (ARBs - Angiotensin Receptor Blockers) בחולים עם פרוטאינוריה, יתר לחץ דם ו–dyslipidemia. ניתן לטפל ב - Aspirin למניעת קרישיות יתר.
בגלל אופייה הפרוגרסיבי של המחלה, חשוב לזכור, כי המפתח לטיפול יעיל והטבת איכות חיי החולים נעוץ באבחון המוקדם של המחלה ובתחילת מתן האנזים החליפי בטרם נוצר נזק בלתי הפיך לרקמה.
ביבליוגרפיה
- Desnick RJ, Brady R, Barranger J, Collins AJ, Germain DP, Goldman M, Grabowski G, Packman S, Wilcox WR. Fabry disease, an under-recognized multisystemic disorder: expert recommendations for diagnosis, management, and enzyme replacement therapy. Ann Intern Med. 2003;138(4):338-46.
- Breunig F, Wanner C. J Nephrol. Update on Fabry disease: kidney involvement, renal progression and enzyme replacement therapy. 2008; 21(1):32-7.
- Lidove O, Joly D, Barbey F, Bekri S, Alexandra JF, Peigne V, Jaussaud R, Papo T. Clinical results of enzyme replacement therapy in Fabry disease: a comprehensive review of literature. Int J Clin Pract. 2007; 61(2):293-302.
- Ortiz A, Oliveira JP, Wanner C, Brenner BM, Waldek S, Warnock DG. Recommendations and guidelines for the diagnosis and treatment of Fabry nephropathy in adults. Nat Clin Pract Nephrol. 2008; 4(6):327-36. Epub 2008 Apr 22.
- Desnick RJ. Enzyme replacement therapy for Fabry disease: lessons from two alpha-galactosidase-A A orphan products and one FDA approval .Expert Opin Biol Ther. 2004; 4(7):1167-76.
- Stratta P, Quaglia M, Messina M, Cavagnino A, Ragazzoni E, Bergamo D, Mazzucco G. The challenges of diagnosing Fabry disease. Am J Kidney Dis. 2008; 51(5):860-4.
- https://research.cchmc.org/LOVD/home.php?select_db=GLA
- Wang RY, Lelis A, Mirocha J, Wilcox WR. Heterozygous Fabry women are not just carriers, but have a significant burden of disease and impaired quality of life. Genet Med. 2007; 9(1):34-45.
- Hughes DA. Early therapeutic intervention in females with Fabry disease. Acta Paediatr Suppl. 2008; 97(457):41-7.
- Dobyns WB. The pattern of inheritance of X-linked traits is not dominant or recessive, just X-linked. Acta Paediatr Suppl. 2006; 95(451):11-5.
- Maier EM, Osterrieder S, Whybra C, Ries M, Gal A, Beck M, Roscher AA, Muntau AC. Disease manifestations and X inactivation in heterozygous females with Fabry disease. Acta Paediatr Suppl. 2006; 95 (451):30-8.
- Ropers HH, Wienker TF, Grimm T, Schroetter K, Bender K. Evidence for preferential X-chromosome inactivation in a family with Fabry disease. Am J Hum Genet. 1977; 29 (4):361-70.
- Marco Spada, Severo Pagliardini, Makiko Yasuda, Turgut Tukel, Geetha Thiagarajan, Hitoshi Sakuraba, Alberto Ponzone, and Robert J. Desnick. High Incidence of Later-Onset Fabry Disease Revealed by Newborn Screening. Am. J. Hum. Genet. 2006; 79:31–40.
- Hwu WL, Chien YH, Lee NC, Chiang SC, Dobrovolny R, Huang AC, Yeh HY, Chao MC, Lin SJ, Kitagawa T, Desnick RJ, Hsu LW. Newborn screening for Fabry disease in Taiwan reveals a high incidence of the later-onset GLA mutation c.936+919G>A (IVS4+919G>A). Hum Mutat. 2009;30(10):1397-405.
- Hopkin RJ, Bissler J, Banikazemi M, Clarke L, Eng CM, Germain DP, Lemay R, Tylki-Szymanska A, Wilcox WR. Characterization of Fabry Disease in 352 Pediatric Patients in the Fabry Registry. Pediatr Res. 2008.
- Wilcox WR, Oliveira JP, Hopkin RJ, Ortiz A, Banikazemi M, Feldt-Rasmussen U, Sims K, Waldek S, Pastores GM, Lee P, Eng CM, Marodi L, Stanford KE, Breunig F, Wanner C, Warnock DG, Lemay RM, Germain DP. Females with Fabry disease frequently have major organ involvement: lessons from the Fabry Registry. Mol Genet Metab. 2008; 93 (2):112-28.
- Sachdev B, Takenaka T, Teraguchi H, Tei C, Lee P, McKenna WJ, Elliott PM. Prevalence of Anderson- Fabry disease in male patients with late onset hypertrophic cardiomyopathy. Circulation 2002; 105:1407–11.
- Gambarin FI, Disabella E, Narula J, Diegoli M, Grasso M, Serio A, Favalli BM, Agozzino M, Tavazzi L, Fraser AG, Arbustini E. When should cardiologists suspect Anderson-Fabry disease?. Am J Cardiol. 2010 15;106(10):1492-9.
- Nakao S, Kodama C, Takenaka T, Tanaka A, Yasumoto Y, Yoshida A, Kanzaki T, Enriquez AL, Eng CM, Tanaka H, Tei C, Desnick RJ. Fabry disease: detection of undiagnosed hemodialysis patients and identification of a "renal variant" phenotype. Kidney Int. 2003; 64:801–7.
- Vedder AC, Breunig F, Donker-Koopman WE, Mills K, Young E, Winchester B, Ten Berge IJ, Groener JE, Aerts JM, Wanner C, Hollak CE.; Treatment of Fabry disease with different dosing regimens of agalsidase: effects on antibody formation and GL-3. Mol Genet Metab. 2008 Jul; 94(3):319-25.
- Vedder AC, Linthorst GE, Houge G, Groener JE, Ormel EE, Bouma BJ, Aerts JM, Hirth A, Hollak CE. Treatment of Fabry disease: outcome of a comparative trial with agalsidase alfa or beta at a dose of 0.2 mg/kg. PLoS ONE. 2007; 2(7): 598.
- Mehta A, Beck M, Kampmann C, Frustaci A, Germain DP, Pastores GM, Sunder-Plassmann G. Enzyme replacement therapy in Fabry disease: Comparison of agalsidase alfa and agalsidase beta. Mol Genet Metab. 2008
- Bodensteiner D, Scott CR, Sims KB, Shepherd GM, Cintron RD, Germain DP. uccessful reinstitution of agalsidase beta therapy in Fabry disease patients with previous IgE-antibody or skin-test reactivity to the recombinant enzyme.Genet Med. 2008;10(5):353-8.
- Ohashi T, Iizuka S, Ida H, Eto Y. Reduced alpha-Gal A enzyme activity in Fabry fibroblast cells and Fabry mice tissues induced by serum from antibody positive patients with Fabry disease. Mol Genet Metab. 2008; 94(3):313-8.
המידע שבדף זה נכתב על ידי ד"ר אניק רז-רוטשילד המחלקה לגנטיקה ולמחלות מטבוליות, ביה"ח הדסה עין-כרם, האוניברסיטה העברית ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק