CD59 glycoprotein
| מדריך בדיקות מעבדה | |
| CD59 | |
|---|---|
| שמות אחרים | CD59 glycoprotein; MAC-inhibitory protein (MAC-IP); membrane inhibitor of reactive lysis (MIRL); protectin, FLAER. |
| מעבדה | כימיה בדם |
| יוצר הערך | פרופ' בן-עמי סלע |
היבטים היסטוריים של PNH
PNH או paroxysmal nocturnsl hemoglobinuria היא מפגע המטולוגי נרכש המאופיין על ידי המוגלובינוריה לילית, אנמיה המוליטית כרונית, פקקות, pancytopenia, ובמספר חולים ממאירות חריפה או כרונית של השורה המייאלואידית. מחלת דם נדירה זו מאופיינת גם על ידי המוליזה תוך-וסקולארית המתרחשת בהתקפים ליליים ופקקת מסכנת-חיים. ושכיחותה מוערכת ב-2-4 מקרים באוכלוסייה של מיליון בני-אדם. PNH תוארה לראשונה על ידי Paul Stübing בשנת 1882 במטופל בו אובחנה הפרשת המוגלובין חופשי בדגימות שתן. Stürbing ידע להבדיל בין PNH לבין paroxysmal cold hemoglobinuria וכן להבדיל את PNH מ-march hemoglobinuria הנגרמת על ידי טראומה לחלקי גוף שונים כמו במאמצי צעדה (march) ממושכת, בריצות מרתון או בקרבות קראטה. Stürbing הסיק שהמוליזה זו היא תוך-וסקולארית, ואינה מתרחשת במערכת הולכת השתן או בכליות, והוא יצא בהשערה ש-PNH נגרמת על ידי רגישות יוצאת דופן של אריתרוציטים להגברת החומציות בדם (acidosis) בעת השינה.
המונח PNH נטבע על ידי הרופא ההולנדי Ennekin בשנת 1928, אך עוד קודם לכן הראה הולנדי אחר, van den Bergh, שבתרחיש של PNH, אריתרוציטים עוברים ליזיס בחשיפה ל-CO2 בנסיוב, מה שמעיד על פגם של תאים אלה, מה גם שהמוליזה זו הייתה תלויה בגורם רגיש לחום (heat labile) המופיע בנסיוב. במאמר בשנת 1937 ב-N Eng J Med היה זה Thomas Ham שבחן את השערתו המקורית של Stürbing, והוא אף הדגים הגברה של המוגלובינוריה במטופלים שעברו עירוי של אמוניום כלוריד מה שהגביר את חומציות הדם (Ham ו-Dingle ב-J Clin Invest משנת 1939), באותה מידה שביקרבונאט שהפחית את חומציות הדם הביא גם להפחתת ההמוליזה של כדוריות אלה. Ham הסיק שב-PNH מדובר באריתרוציטים לא-תקינים, ואין כאן מעורבות של תגובת אנטיגן-נוגדן, והוא אף היה הראשון שהציע במאמר משנת 1939 שהמשלים הוא בעל תפקיד חשוב בתהליך ההימוליטי ב-PNH. בשנת 1944 כרך Dacie את PNH עם תופעת ה-aplasia במח העצם של חולים עם אנמיה ע"ש Fanconi, ובשנת 1953 הבחין Crosby שיש קשר בין PNH לבין הופעת פקקת.
צעד משמעותי נוסף לקראת פיענוח מנגנון PNH נעשה על ידי Pillemer שפענח בשנת 1954 את המסלול החלופי של המשלים (complement), והעלה את ההשערה ש-properdin אחראי להמוליזה של אריתרוציטים ב-PNH. פרופרדין מייצג קבוצת חומרים בפלזמת הדם, המסוגלים לקטול חיידקים ונגיפים מסוימים, בשילוב עם משלים ויוני מגנזיום. בשנות ה-60 היו אלה Dacie ו-Rosse שהשתמשו במבחן complement lysis sensitivity, וזיהו תופעה של הטרוגניות פנוטיפית (mosaicism) באריתרוציטים של חולים עם PNH, ומאוחר יותר זיהה Rosse שלושה פנוטיפים של אריתרוציטים ב-PNH, שהוא סימן כ-II, I ו-III עם רגישות נורמאלית, מתונה וחמורה לפעולת המשלים, בהתאמה.
בשנת 1969 הראו Aster ו-Enright במאמר ב-J Clin Invest שגם טסיות דם (Platelets) וניטרופילים של חולי PNH, רגישים באופן בלתי נורמאלי לליזיס כתוצאה מפעילות המשלים. בכך תגליתם זו של Aster ו-Enright ביססה את מקורה של תופעת PNH בשלב תאי הגזע (stem cells). ניסויים בשנות ה-70 וה-80 הראו שקישורו של מרכיב המשלים C3 היה מוגבר בתאי PNH כתוצאה מחוסר של מה שמוגדר כ-decay activating factor או DAF שזוהה לאחר מכן כ-CD55, שמשמש כמעכב של האנזים C3 convertase. על ידי כך גדֵל הקישור של C3 לאריתרוציטים של חולי PNH (על פי Nicholson-Weller וחב' ב-Proc Natl Acad Sci USA משנת 1983).
צעד חשוב נוסף בדרך להבנת הפגם בתופעת PNH, נעשה בשנת 1989 על ידי Holguin וחב' במאמר שפרסמו ב-J Clin Invest, בו הראו שאריתרוציטים מחולי PNH חסרים גורם חלבוני נוסף הקשור לתופעת הליזיס הממברנאלי, גורם המעכב את הנזק שגורם קומפלקס המשלים לתאים אלה על ידי וויסות קישורם לתאים. גורם חסר זה שכונה בתחילה MIRL או membrane inhibitor of reactive lysis, זוהה בהמשך כ-CD59. אך אולי הממצא החשוב ביותר להסבר החסרים של CD55 ו-CD59 בהקשר של PNH, היה זה ש-Takeda וחב' דיווחו עליו ב-Cell בשנת 1993. חוקרים אלה מצאו כבר בשנת ה-70 המאוחרות חסר באנזים LAP או leukocyte alkaline phosphatase בחולים עם PNH, ובהמשך התברר שגם פעילותם של אנזימים נוספים דוגמת acetylcholinesterase הייתה מופחתת באריתרוציטים של חולי PNH, וכן נמצאה פעילות ירודה של האנזים nucleotidase-'5 בלימפוציטים של חולים אלה. אנזימים אלה היו קשורים לממברנת התאים האמורים דרך תאחיזתם ב-glycosylphosphatidylinositol (להלן GPI), ואכן Takeda וחב' יצאו מהנחה שכל אותם חלבונים כמו CD55 ו-CD59 שהיו חסרים באריתרוציטים של חולי PNH, הם חלבונים הקשורים לממברנה על ידי תאחיזתם ב-GPI, האמור לעגן אותם לממברנה. בנוסף ל-C55 ול-C59 יש חלבונים ממברנאליים נוספים המעוגנים על ידיGPI , ובין אלה נכללים גם CD14, CD16, CD24, CD48, CD58, CD66b ו-CD67 (על פי Oelschaegel וחב' ב-Clin Lab Haematol משנת 2001, ו-Piedras ו-Lopez-Karpovitch ב-Cytometry משנת 2000). החסר בחלבון CD59 נובע ממוטציה בגן CD59 הממוקם על כרומוזום 11 בעמדה 11p13 (על פי Heckl-Ostreicher וחב' ב- Cytogenet. Cell Genet משנת 1993).
מוטציות ברקע של PNH
תרומתם של Takeda ,Kinoshita וחב' בהמשך, התבטאה בזיהוי של הגן המקודד ל-GPI, המכונה PIG-A או phosphatidylinositol glycan class A, הממוקם על הזרוע הקצרה של כרומוזום X בעמדה Xp22.1. האנזיםphosphatidylinositol N-acetylglucosaminyltransferase subunit A מקודד בבני-אדם על ידי הגן PIG-A. גן זה מקודד לחלבון הדרוש לסינתזה של N-acetylglucosaminyl phosphatidylinositol, שהוא שלב הביניים הראשון בביו-סינתזה של PGI, שהוא הגליקוליפיד המופיע בממברנות של תאי דם רבים, ומשמש עוגן לקישורם של חלבונים שונים על פני הממברנה. CD59 נקשר לתאים דרך העוגן הממברנלי GPI. כאשר שפעול המשלים מביא לרׅבּוץ של C5b678 על פני התאים, CD59 יכול למנוע את הפילמור של C9 ואת יצירת הקומפלקס של המשלים התוקף את הממברנה (Huang וחב' ב-J Biol Chem משנת 2006). המוטציות הגורמות להפחתת ביטויו של CD59 גורמות ל-PNH (על פי Parker וחב' ב-Blood משנת 2004). Mevorach דיווח ב-Mol Immunol משנת 2015 שגם מוטציה נקודתית (Cys89Tyr) ברצף של CD59 היא בעלת משמעות בהשפעה עת תפקודו של חלבון זה בהקשר של PNH.
המוטציות הפוגעות בגן זה בתאי הגזע ההמאטופויאטים של חולים ב-PNH הן סומטיות (דהיינו מוטציות המתרחשות בתאי-גוף, ואינן מורשות לצאצאים). בתרחיש של PNH נקבות וזכרים מושפעים ונפגעים באותה מידה, שכן רק כרומוזום X יחיד פעיל סומטית כתוצאה ממה שמוגדר כ-lyonization או X-inactivation (על פי Bessler וחב' ב-EMBO J משנת 1994, ו-Karadimitris וחב' ב-Br J Hematol משנת 2000). זהו תהליך בו אחד משני העותקים של כרומוזום X בנקבות של יונקים עובר אינאקטיבציה. העותק של כרומוזום X מושתק על ידי היותו "ארוז" באופן שהוא מכיל מבנה בלתי פעיל מבחינת שעתוק (transcription) הידוע כהטרוכרומטין.
מדובר אם כן על כך ש-PNH הוא מפגע נרכש של תאי גזע שאינו מועבר בתורשה (Nafa וחב' ב-Blood Cells Mol Dis משנת 1998). יצוין שדרגת ההמוליזה והפגיעה בצורות היותר מתונות או היותר חמורות של PNH, תלויה באם המוטציה בגן PIG-A היא מסוג nonsense או missense (על פי Rosse ו-Ware ב-Blood משנת 1995). על פי Horikawa וחב' ב-Blood משנת 2002, מוטציות סומטיות הגורמות ל-PNH יכולות להתרחש באופן ספונטאני או שהן מופיעות במצבים פיזיולוגיים מסוימים. תאים נושאי מוטציות ב-PNH הם בעלי יתרון הישרדותי, שעשוי לנבוע מסלקציה שלילית כנגד תאים שאינם נושאים מוטציה, מאשר סלקציה חיובית המסייעת לתאים נושאי מוטציה בגן PIG-A (על פי Araten וחב' ב-Leukemia משנת 2002, ו-Chen וחב' ב-Exp Hematol משנת 2002).
מאפיינים של PNH
החוסר לדרגותיו של CD55 ו-CD59 על פני האריתרוציטים בחולי PNH, מקטין את התנגודת של תאים אלה להמוליזה תוך-וסקולארית וחוץ-וסקולארית המתווכת על ידי המשלים. הגברת ההמוליזה התוך-וסקולארית מייצרת המוגלובין חופשי הפועל כ-scavenger יעיל של חד-תחמוצת החנקן (NO) (על פי Rother וחב' ב-JAMA משנת 2005). הנטרול והחסר של NO נכרך בהגברת הסיכון לפקקת שהיא הסיבה העיקרית לתמותה ב-PNH. אירועים פקקתיים אלה יכולים להופיע באתרים אנטומיים בלתי-מקובלים כמו ורידי השער של הכבד (portal veins), או גם במערכת כלי-הדם המזנטרית. תאי גזע המאטופויאטים הנושאים את המוטציה בגן PIG-A, הם בעלי יתרון בהישרדות, ויש להם נטייה לשגשג עם הזמן ולעתים קרובות להוביל להתפתחות של תסמונות של כשל במח העצם, כולל אנמיה אפלסטית, כמו גם תסמונת מיֶאלודיספלסטית (Wang וחב' ב-Blood משנת 2002, ו-Pu ו-Brodsky ב-Clin Transl Sci משנת 2011). כמו כן יש סיכון מוגבר שמוטציות אלו ב-PIG-A מגבירות את הסיכון להופעת AML (על פי Hillmen וחב' ב-N Eng J Med משנת 1995), וכן acute non-lymphoblastic leukemias, כמו גם non-Hodgkin's lymphomas ו-Hodkin's disease, אם כי הקשר המנגנוני של תחלואות המאטולוגיות אלו, אינם מוחוור לחלוטין. יצוין שבאלה עם PNH קיימת גם נטייה מוגברת להופעת זיהומים שונים (Meletis ו-Terpos ב-Med Sci Monit משנת 2003).
למרות ש-PNH היא מחלה נדירה עם שכיחות של 1.3 מקרים מדי שנה למיליון נפש (Borowitz וחב' ב-Cytometry B Clin Cytom משנת 2010), יש לה השפעה עמוקה על איכות החיים של הנגועים בה, ועל הישרדותם. אכן, פיתוחם של טיפולים חדשים הכוללים את eculizumab (שם מותג Soliris) שהוא נוגדן חד-שבטי המכוון כנגד המרכיב הטרמינאלי C5 של המשלים, שיפר באופן משמעותי את איכות החיים של החולים עם PNH (על פי Hillmen וחב' ב-N Eng J Med משנת 2006).
- מנגנון הפעולה של eculizumab הוא כדלקמן
מרכיב המשלים C5 עובר ביקוע ל-2 תת מרכיבים, C5a ו-C5b: בעוד שתפקידו של C5a הוא בעיקר בתופעת ה-chemotaxix, הרי ש-C5b יוצר את החלק הראשון של תופעת ה-complement membrane attack complex. נמצא ש-C5b יכול ליצור קומפלקס עם מרכיב המשלים C6, ושהי אלה מאתחלים את "ההתקפה" הממברנאלית של המשלים. מנגנון פעולת eculizumab הוא במניעה של הביקוע של C5 לשני התוצרים C5a ו-C5b (על פי Brodsky וחב' ב-Blood משנת 2008).
תסמיני המחלה
בשלביה השונים PNH עלולה להתבטא ברדמת (לתרגיה), המוגלובינוריה, אנמיה, תסחיפי פקקת, קשיי בליעה (דיספגיה), כאבי בטן, ובעיות זקפה. התקפים המוליטיים מופיעים באופן בלתי סדיר ועשויים להתעורר עקב זיהומים, ניתוחים, או לאחר פעילות גופנית בעצימות גבוהה. בערך שליש ממקרי PNH קשורים לאנמיה אפלסטית (Hillmen וחב' ב-N Eng J Med משנת 1995). הטיפול מגוון ומשתנה עם התסמינים וחומרת המפגע, ועשוי להיות מורכב מתכשירים מדכאי חיסון, אנדרוגנים, עירויי דם, הפארין, טיפול תרומבוליטי, השתלת מח עצם והזרקת eculizumab, הנוגדן החד שבטי המונע את ליזיס התאים הנגרם על ידי מרכיב המשלים C5 (על פי Hillmen וחב' ב-N Eng J Med משנת 2004).
Yamashina וחב' דיווחו ב-N Eng J Med משנת 1990 על כך שכדוריות אדומות של מטופל מאובחן עם PNH לא הכילו את חלבון HRF20 הידוע כ-CD59, וכן ששני הוריו שהיו בני דודים מדרגה ראשונה הראו חוסר חלקי של חלבון זה שהתאים להטרוזיגוטיות לפגם. במטופל זה בן 22 שנה החלו אירועי המטוריה 9 שנים קודם לכן, כאשר התגלה בגיל 13 כאשר סבל מאירוע חמור של אנמיה המוליטית והמוגלובינוריה. ב-9 שנות המעקב בדיקות Ham ו-sucrose hemolysis test היו חיוביים באופן עקבי, כאשר בפרק זמן זה סבל מ-9 אפיזודות המוליטיות ו-2 אירועים של אוטם מוחי.
מבחני מעבדה לאבחון PNH
הוריות קליניות לבירור אפשרות של PNH: המוגלובינוריה, המוליזה, פקקת, LDH מוגבר, אנמיה המוליטית שהיא Coombs שלילית, ציטופניות בלתי מוסברות, אנמיה אפלסטית, תסמונות מיאלודיספסטיות (RA-MDS) אחדות.
באנשים עם PNH יכול להופיע מגוון של תסמינים קליניים שאחדים מהם אינם ספציפיים ומשותפים למפגעים אחרים. הבדיקות שנועדות לאבחן באופן ספציפיPNH , ויש לבצען בנבדקים עם מאפיינים קליניים הכוללים המוליזה וסקולארית בלתי-מוסברת שהיא שלילית במבחן Coombs, המוגלובינריה לילית, פקקת בלתי אופיינית, אנמיה אפלסטית, תסמונת מיאלודיסלסטית וכשל נרכש של מח העצם. בדיקה זו מתאימה לצורך ניטור של אנשים המטופלים בגין PNH מאובחנת. מספר בדיקות נכללו בעבר ועדיין משמשות כיום לאבחון תרחיש של PNH, אם כי כפי שייראה בהמשך, חלק מבדיקות אלה נחשבות למיושנות, ואינן מתבצעות יותר. רשימת הבדיקות כוללת: ספירת דם כללית (CBC), עם ספירה מבדלת של התאים; ספירת רטיקולוציטים (שמספרם היחסי עשוי להיות גבוה במצבי אנמיה); בדיקת שתן למדידת רמת hemosiderin (על ידי צביעה ב-Prussian blue על פי Kjeldsberg וחב' ב-Pract Diagn Hematol Disorders משנת 2000) ; בדיקת LAP או מדידת רמת האנזים leukocyte alkaline phosphatase; ביופסיה של מח עצם; מדידת רמת ברזל בנסיוב; sucrose hemolysis test; מבדק Ham להמוליזה בהחמצת הנסיוב; אנליזה מולקולארית לאיתור מוטציות בגן PIG-A, אלא שבדיקה זו מוגבלת למעבדות מחקר ולמרות הספציפיות הרבה שלה היא עדיין לא אבחונית ל-PNH ; בדיקת Flow cytometry מלאה (CD59, CD55, FLAER של גרנולוציטים, מונוציטים ואריתרוציטים).
שנים רבות מבחן Ham נחשב לבדיקה הסטנדרטית לאבחוןPNH על בסיס הפגיעוּת של אריתרוציטים, כאשר רק מחלה אחת נוספת הגיבה גם כן באופן חיובי במבחן Ham, ומדובר ב-CDA או congenital dyserythropoietic anemia typw II הידועה גם כ-HEMPAS או hereditary erythroid multi-nuclearity with positive acidified serum. עם זאת התסמונת האחרונה יכולה להיות מובדלת בקלות מ-PNH על ידי ההיסטוריה הרפואית, המורפולוגיה של תאים הנשאבים ממח העצם וכן בעובדה שב- HEMPAS מתקבלת תשובה שלילית במבחן ההמוליזה בסוכרוזה (Crookston וחב' ב-Br J Hematol משנת 1969, וב-Br J Hematol משנת 1972).
מבחן Ham מבוסס על העיקרון שמשלים הנצמד לאריתרוציטים של חולי PNH ב-pH מעט חומצי, יגרום להם ליזיס, כיוון שתאים אלה רגישים ל-complement fixation. הבדיקה מתבצעת עם דם מלא שנלקח במבחנת הפרין בדרך כלל, והבדיקה ההשוואתית בין דם של מטופל עם PNH לבין דם של אדם בריא מתבצעת בנסיוב לא מטופל, בנסיוב מוחמץ ל-pH 6.2-6.8, בנסיוב שחומם משך 3 דקות בטמפרטורה של °C56 בתנאים שהורסים את המשלים, ובנסיוב שעבר אינאקטיבציה בחימום והוסף לו משלים של חזיר-ים, באופן שאינו גורם לליזיס אריתרוציטים שלPNH , שכן המשלים של חזירי-ים אינו פעיל על תאי אדם. ניתן לשנות את תנאי מבחן Ham באופן שניתן יהיה להבדיל בין רגישות לליזיס של PNH type II ל-PNH type III (על פי Hillmen וחב' ב-Br J Hematol משנת 2000). מידת הליזיס של הכדוריות האדומות מכומתת על ידי מדידה ספקטרופוטומטרית של המוגלובין חופשי. בשנות ה-60 פיתחו Hartmann ו-Jenkins את בדיקת ה-Sucrose hemolysis test לאבחון PNH, שפורסמה ב-N Eng J Med משנת 1966.
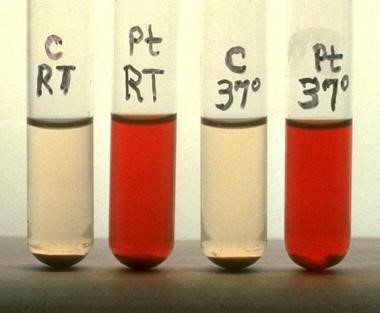
בדיקת Ham להופעת ליזיס בנסיוב מוחמץ
אם הבדיקה מתבצעת בהקפדה בדיקת Ham היא שיטה אמינה לאבחון PNH . בשיטה זו ניתן למצוא הרס אריתרוציטים של נבדקים עם PNH על ידי משלים כאשר נסיוב נורמאלי הוחמץ.
כפי שנראה בתמונה, אריתרוציטים של נבדק עם PNH (מסומנים כ-Pt) עוברים ליזיס על ידי נסיוב נורמאלי מוחמץ בטמפרטורת החדר (RT) וכן בטמפרטורה של C°37, בהשוואה לאריתרוציטים הלקוחים מביקורת בריאה המסומן כ-C. חימום של הנסיוב לטמפרטורה של °C56 גורם לאינאקטיבציה של המשלים ומונע את הליזיס של תאי PNH. החמצת הנסיוב על ידי הפחתת ה-pH ל-6.2 וריכוז המגנזיום המוסף לנסיוב המוקפד על 0.005 מול'/ליטר, נקבעו כתנאים האופטימאליים להשגת רגישות מלאה של תאיPNH לפעילות המשלים. התאים שעוברים המוליזה הם תאים רגישים, בעוד שאריתרוציטים שאינם עוברים המוליזה הם תאים נורמאליים, מה שמצביע על 2-3 תת-אוכלוסיות של אריתרוציטים בצירקולציה כפי תיאר Rosse והוזכר למעלה.
תוצאות חיוביות-כזובות (false-positive) יכולות להתקבל עם אריתרוציטים שמקורם בחולים עם congenital dyserythropoietic anemia, type II הידועה גם כ- hereditary erythroblastic multinuclearity with positive acidified serum [HEMPAS]. למטופלים האחרונים מתקבלת תוצאה שלילית במבדק sucrose hemolysis או "sugar water test". לעתים ניתן לקבל תוצאה false-negative עם נסיוב נורמאלי במבחן Ham, וניתן לבצע את ה-sucrose-water test, שהוא יותר רגיש אך פחות ספציפי ל-PNH.
מבחן רגישות לליזיס על ידי המשלים
מבחן זה שהוכנס על ידי Rosse ו-Dacie באמצע שנות ה-60 במאמריהם ב-Bibl Hematol משנת 1965 וב-J Clin Invest משנת 1966, מדויק יותר לאבחון PNH. כדוריות דם אדומות מרוגשות על ידי נוגדן נוגד אנטיגן I ליטי, ועוברות המוליזה עם כמויות מוגבלות של נסיוב כמקור של משלים. מבחן זה מדגים נוכחות של 3 קבוצות של כדוריות דם אדומות באלה עם PNH:
- תאי PNH I שהם נורמאליים ברגישותם למשלים;
- תאי PNH II שהם מעט יותר רגישים למשלים מאשר תאים נורמאליים;
- תאי PNH III שהם רגישים בהרבה למשלים, ודורשים 5-20% מכמות המשלים לגרום לאותה דרגת ליזיס; קבוצת תאים זו גדולה יותר בחולי PNH בצורתה החמורה יותר, כאשר משך החיים הממוצע של כדוריות אדומות אלו הוא 10-15 יום בלבד.
מבחן Sugar water או Sugar lysis
מבחן זה מבוסס על ההשערה שהדגרת דם מלא של חולים עם PNH בתמיסת סוכרוזה היפוטונית, תזרז שפעול של משלים ותגרום להמוליזה in vitro של תאים הרגישים למשלים. מבחן זה אמנם יותר רגיש אך פחות ספציפי ל-PNH בהשוואה למבחן Ham, כיוון שחלק מהדוריות האדומות עוברות המוליזה כתוצאה מאנמיה המוליטית אוטו-אימונית, מלויקמיה, מאנמיה מגלובלסטית, מ-HEMPAS, מספרוציטוזיס ומאנמיה אפלסטית בדרגה נמוכה יותר של המוליזה. למרות שמבחנים אלו זולים ופשוטים לביצוע, הם דורשים יותר זמן עבודה ופחות רגישים כתוצאה מתקופת מחצית החיים הקצרה יותר של כדוריות אדומות מחולי PNH. בהתאם, מבחנים אלה בעלי יכולת מוגבלת לגלות מספר קטן של תאי PNH, עם דרגת המוליזה של לפחות 10% הנדרשת להגדיר בדיקה זו כחיובית. מבחני Ham וה-Sugar lysis למעשה אינם משמשים כיום בשגרת המעבדות לאבחון PNH, בגין אי-הספציפיות והרגישות הנמוכה שלהם. רק במקרה הנדיר של חשד לאנמיה מולדת דיס-אריתרופויאטית יש להעדיף את מבחן Ham כבדיקה ראשונית.
שיטות אחרות להדגמה של המוליזה תוך-וסקולארית כוללים את המבחנים הבאים: רמה מוגברת של האנזים LDH; ספירה מוגברת של רטיקולוציטים; רמה נמוכה עד כדי חסר של haptoglobin בנסיוב, המוגלובינוריה והמוסידרינוריה.
מבחני הדמיה
פקקות של ורידים ראשיים ניתנות להערכה על ידיח אמצעים רדיוגרפיים: ניתן לבחון פקקת של ווריד הכבד בשיטת סריקה קולואידית עם technetium-99m (99m Tc) של הכבד והטחול. שיטה זו לרוב מגלה תפקוד פחות של הכבד פרט לאונת ה-caudate, כיוון שזו קשורה לווריד הנבוב התחתון ולא לווריד הכבד. על ידי ultrasonogram ניתן להדגים את הפסקת הזרימה בווריד הכבד או על ידי הזרקה של תמיסת צבע שתדגים פקקת בווריד זה. בשיטה של MRI עם חומר ניגוד, ניתן להדגים פקקת בווריד הסגיטלי.
Flow cytometry ובדיקת FLAER
הפיתוח של נוגדנים חד-שבטיים מסומנים פלואורסצנטית, לאפיון של חלבון שטח הפנים על ידי flow cytometry, שיפר באופן משמעותי את הרגישות והספציפיות של גילוי דרגות שונות של PNH, מה שהפך שיטה זו ל"מדד הזהב" של גילוי PNH. שיטות שונות זמינות לבחינה ראשונית לצורך גילוי PNH, החל ברגישות של 1% בערך, או שיטות רגישות עוד יותר של תאי PNH בשכיחות של 0.01% (על פי Borowitz וחב' ב-Cytometry B Clin Cytom משנת 2010).
העדר הביטוי של חלבונים כמו CD55 ו-CD59 המעוגנים ל-GPI בממברנות של תאים אדומים, שימש בתחילה למבחן דיאגנוסטי של PNH. אך יש לקחת החשבון שאנליזה של תאים אדומים אינה אופטימאלית כיוון שהמוליזה של הכדוריות כמו גם עירויי דם עלולים להשפיע על מידת הדיוק של קביעת דרגת PNH (על פי Sutherland וחב' ב-Am J Clin Pathol משנת 2009). כיום קיימת הסכמה נרחבת שהאנליזה של לויקוציטים ב-PNH היא בעלת יתרונות, לכן גרנולוציטים ומונוציטים של דם היקפי הם השימושיים ביותר לאנליזה זו ומועדפים על פני לימפוציטים להם יש דרגות שונות של חלבוני ממברנה המעוגנים ל-GPI. תוך התבססות על מבדקים שפותחו עבור כדוריות דם אדומות, נעשה בתחילה שימוש ב-CD55 ו-CD59 לזיהוי לויקוציטים שמקורם בחולי PNH. אך הסתבר שממנים אלה הם בעלי דרגות ביטוי משתנות על סוגי לויקוציטים שונים, מה שגרם לבעייתיות בפירוש התוצאות. לדוגמה, נויטרופניה חמורה בנבדק עם כשל חמור של מח עצם הקשור ל-PNH, עלולה להשפיע על היכולת לזהות גרנולוציטים שמקורם ב-PNH.
הבדיקה הרגישה ביותר באבחון PNH היא בדיקת FLAER או fluorescent labeled inactive toxin aerolysin. בשנת 1999 פרסמו Brodsky וחב' ב-Blood, על זיהוי של טוקסין בקטריאלי בשם aerolysin הנקשר ל-GPI וניתן להשתמש בו להבדלה בין תאי PNH. על ידי סימון פלואורסצנטי של aerolysin והפיכתו לצורת FLAER הופכים את הטוקסין לוואריאנט הנקשר ל-GPI באופן יותר ספציפי ורגיש מאשר הנוגדן ל-CD59 (על פי Brodsky וחב' ב-Am J Clin Pathol משנת 2000). כמו כן FLAER מזהה שבטי גרנולוציטים של PNH שמספרם אינו עולה על 0.5% מכלל הגרנולומיטים, ובנוסף הספציפיות של FLAER ל-GPI שוללת את הצורך להשתמש בשני סמנים (CD55 ו-CD59), והופכת את גילוי תאים של PNH לפחות מורכבת.
החלבון aerolysin מקורו בחלבון proaerolysin שמשקלו המולקולארי 52,000 דלטון, והוא מופרש על ידי החיידק Aeromonas bydrophila. לאחר ביקוע פרוטאוליטי בקצה ה-C טרמינאלי מתקבלת הצורה הפעילה של aerolysin, שאינו גורם לליזיס של תאי PNH, שכן הוא נקשר למבנים של GPI החסרים או פגומים ב-PNH (על פי Diep וחב' ב-J Biol Chem משנת 1998). התכשיר המקובל כיום לבדיקה זו מוכר כ-Alexa Flour 488. מגבלה אחת של בדיקת FLAER היא שלא ניתן להשתמש בה לזיהוי שבטים של PNH ממקור של כדוריות דם אדומות, שכן אלו אינן מכילות על פניהן את האנזימים הפרוטאוליטים הנחוצים לצורך הביקוע של proaerolysin. מגבלה נוספת השוללת את היכולת של aerolysin לגלות חלבונים הקשורים ל-GPI על פני תאים אדומים, היא העובדה שתאים אלה המכילים על פניהם את הגליקופרוטאין glycophorin, וזה נקשר במידה מעטה ל-proaerolysin, וזאת למרות שglycophorin אינו קשור בממברנה ל-GPI (Mackenzie וחב' ב-J Biol Chem משנת 1999).
- וריות קליניות לבירור אפשרות של PNH
המוגלובינוריה, המוליזה, פקקת, LDH מוגבר, אנמיה המוליטית שהיא Coombs שלילית, ציטופניות בלתי מוסברות, אנמיה אפלסטית, תסמונות מיאלודיספסטיות (RA-MDS) אחדות.
מודלים בחיות
כדי לבחון את התפקיד של CD59 בשמירה מפני המוליזה יצרו Holt וחב' (Blood משנת 2001) עכברי knock-out הומוזיגוטים (Cd59-/-), החסרים את אנטיגן CD59 כתוצאה מפגיעה בתאי גזע עובריים. למרות החסר המוחלט של CD59, העכברים היו בריאים ופוריים. אריתרוציטים in vitro הפגינו רגישות מוגברת למשלים ועברו המוליזה במבחן החמצת הנסיוב. למרות זאת, עכברי Cd59-/- לא היו אנמיים, אך ניכרה אצלם ספירה מוגברת של רטיקולוציטים, מה שמצביע על turnover מוגבר של אריתרוציטים. פלזמה ושתן טריים של עכברים אלה הכילו כמויות מוגברות של המוגלובין בהשוואה לעכברי ביקורת מאותו שֶגֶר בהם לא בוצעה הפגיעה בגן ל-CD59, מה שמעיד על המוליזה תוך-וסקולארית ספונטאנית. כמו כן נמצא בעכברים המטופלים המוליזה תוך-וסקולארית מוגברת כאשר החדירו להם גורם מארס נחש Cobra, להחיש את השפעול של המשלים.
הוראות לביצוע הבדיקה
יש לדגום דם למבחנת ספירת-דם (EDTE, פקק סגלגל) או מבחנת ליתיום הפארין (פקק ירוק( ויש לערבב את המבחנה היטב לאחר איסוף הדם לתוכה. אין לסרכז את הדם, ויש לאחסנו במקרר. יש לשלוח את דגימת הדם המלא למעבדה בטמפרטורת החדר או בקירור תוך 24 שעות. יש לפסול דגימות שתגענה יותר מ-48 שעות מנטילת הדם, דגימות קפואות, דגימת דם קרוש, דם שנלקח במבחנה לא מתאימה, או דגימת דם עם ספירה נמוכה של ליקוציטים ושל גרנוליציטים. הדגימה יציבה 72 שעות בטמפרטורת החדר. ניתן לקבל דגימת דם עם המוליזה קלה אך יש לפסול דגימה עם המוליזה ניכרת. יש לציין אם בוצע לנבדק עירוי דם לאחרונה, שכן זה עלול להוריד את דיוק הבדיקה ורגישותה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק