הבדלים בין גרסאות בדף "אבץ פרוטופורפירין - Zinc Protoporphyrin"
| שורה 100: | שורה 100: | ||
==סטאטוס ברזל בתורמי דם== | ==סטאטוס ברזל בתורמי דם== | ||
| − | תורמי דם פוטנציאליים נבדקים באופן שגרתי לאפשרות של חסר ברזל, בעיקר בבדיקה הפשוטה של השקעת המוגלובין על ידי copper sulfate. אף על פי שטסט זה מזהה אנמיה על רקע חסר ברזל, הוא אינו משקף במדויק את סטאטוס הברזל שכן חלק מתורמי הדם יהיו בעלי מאגרי ברזל נמוכים (פריטין) ועדיין רקמות היקפיות שלהם עשויות לקבל אספקת ברזל תקינה כפי שהדבר בא לביטוי ביחס ZPP/heme תקין. השימושיות של בדיקת היחס ZPP/heme תוארה במספר מחקרים (Schifman וחב' ב-JAMA משנת 1982, Jensen וחב' ב-Clin Chem משנת 1990, ו-Harthoorn-Lasthuizen וחב' ב-Clin Chem משנת 1998). בדיקת ZPP/heme תפחית את מספר תורמי הדם שייפסלו לכאורה בגלל הערכה מוטעית של סטאטוס ברזל ירוד. Finch בסקירתו ב-Blood משנת 1994, קבע שתרומת דם יוצרת חוסר איזון בין הצורך בברזל של מח העצם, וכמות הברזל המסופקת למח העצם, מה שמביא לרמת ZPP מוגברת. במטופלים עם polycythemia vera שמקיזים מדמם באופן תקופתי, נוצר מצב הדומה במקצת לזה של תרומת-דם, בו רמת ZPP נמצאת מוגברת בהתאמה לירידה ברמת פריטין (Birgegard וחב' ב-Scand J Clin Lab Invest משנת 1987), מה שמדגים שוב את הקשר בין סטאטוס ברזל לבין ZPP. | + | תורמי דם פוטנציאליים נבדקים באופן שגרתי לאפשרות של חסר ברזל, בעיקר בבדיקה הפשוטה של השקעת המוגלובין על ידי copper sulfate. אף על פי שטסט זה מזהה אנמיה על רקע חסר ברזל, הוא אינו משקף במדויק את סטאטוס הברזל שכן חלק מתורמי הדם יהיו בעלי מאגרי ברזל נמוכים (פריטין) ועדיין רקמות היקפיות שלהם עשויות לקבל אספקת ברזל תקינה כפי שהדבר בא לביטוי ביחס ZPP/heme תקין. השימושיות של בדיקת היחס ZPP/heme תוארה במספר מחקרים (Schifman וחב' ב-JAMA משנת 1982, Jensen וחב' ב-Clin Chem משנת 1990, ו-Harthoorn-Lasthuizen וחב' ב-Clin Chem משנת 1998). בדיקת ZPP/heme תפחית את מספר תורמי הדם שייפסלו לכאורה בגלל הערכה מוטעית של סטאטוס ברזל ירוד. Finch בסקירתו ב-Blood משנת 1994, קבע שתרומת דם יוצרת חוסר איזון בין הצורך בברזל של מח העצם, וכמות הברזל המסופקת למח העצם, מה שמביא לרמת ZPP מוגברת. במטופלים עם [[polycythemia vera]] שמקיזים מדמם באופן תקופתי, נוצר מצב הדומה במקצת לזה של תרומת-דם, בו רמת ZPP נמצאת מוגברת בהתאמה לירידה ברמת פריטין (Birgegard וחב' ב-Scand J Clin Lab Invest משנת 1987), מה שמדגים שוב את הקשר בין סטאטוס ברזל לבין ZPP. |
==אבחון של מפגעים נוספים במטבוליזם של ברזל== | ==אבחון של מפגעים נוספים במטבוליזם של ברזל== | ||
גרסה אחרונה מ־20:59, 28 בינואר 2023
| מדריך בדיקות מעבדה | |
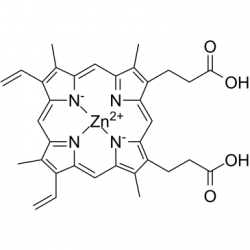
| אבץ פרוטופורפירין | |
|---|---|
| Zinc Protoporphyrin | |
| שמות אחרים | ZPP |
| |
משקל מולקולרי: 626g/mol נוסחה אמפירית: C34H32N4O4Zn
| |
| מעבדה | כימיה בכדוריות דם |
| תחום | הערכות חסר ברזל והרעלת עופרת |
| טווח ערכים תקין | פחות מ-70 מיקרומול'/מול' של ZPP/מול' heme. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכת חסר ברזל; ניטור הטיפול והמעורבות הסביבתית של הרעלת עופרת כרונית.
היסטוריה
תרכובות עם מבנה פורפיריני היו מוכרות כבר משנות ה-30 של המאה ה-20 (על פי Labbe וחב' ב-Clin Chem משנת 1999), אך העניין בהם התחזק בשנת 1974 כאשר נקבע ש-Zinc protoporphyrin (להלן ZPP) הוא הפורפירין ה-non-heme העיקרי הנוצר בכדוריות אדומות כתוצאה מהרעלת עופרת או במצבי חסר ברזל (Lamola ו-Yamane ב-Science משנת 1974). הספרות המוקדמת מעם מבלבלת, באופן שתוצאות מעבדות שונות היו שונות בגין שיטות מדידה מגוונות, כאשר חלק מהדיווחים ביטאו תוצאות כיחס המולרי בין ZPP לבין heme, חלקם ביטאו תוצאות כמיקרוגרם אריתרופויאטין/ דציליטר של כדוריות דם דחוסות, או כמיקרוגרם אריתרופויאטין/גרם המוגלובין (כאשר חלקן אף העריכו המטוקריט תקין כ-35%. נכון למועד כתיבת מאמר זה נהוג לדווח על היחס המולרי של ZPP/heme (מיקרומול/מול) (Crowell וחב' ב-Pediatrics משנת 2006). כבר בשנת 1929 הצליח Fischer להשלים סינתזה מלאה של פרוטופורפירין ושל heme, מה שזיכה אותו בפרס נובל. בשנת 1932 זיהה van den Bergh לראשונה פרוטופורפירין נטול-מתכת כמרכיב בדם, ובשנת 1930 Darien ו-Cristol היו הראשונים שזיהו מה שהם כינו Zincoporphyrinurie שכינויו הוסב מיד ל-zinc porphyrin.
ההתייחסות הקלינית הראשונה של פורפירינים קודמה על ידי Grinstein ו-Watson בשנת 1943, שפיתחו שיטות אנליטיות פוטואלקטריות ופלואורומטריות לקביעה כמותית של פרוטופורפירינים בדם ופורסמו ב-J Biol Chem. רק בשנת 1966 פרסמו Dagg וחב' ב-Br J Hematol על שימוש ברמת פרוטופורפירינים באריתרוציטים לזיהוי שלבים מוקדמים של חסר ברזל. ZPP עורר לראשונה עניין, כאשר נוכחותו באריתרוציטים זוהתה כתגובה טוקסית לעופרת (Lamola ו-Yamane ב-Science משנת 1974). בהמשך, התפרסם מחקר שהעלה את ההשערה ש-ZPP נכנס למאגר החופשי של heme בעוברים וביילודים, על מנת לווסת את הקטבוליזם של heme עד לשלב הפיכת biliverdin לבילירובין (Labbe ו-Carlson ב-Netherland J Med משנת 1993). השערה אחרת הייתה ש-ZPP יכול לשנות מטבוליזם במוח דרך מודולציה של יצירת CO (על פי Marks וחב' ב-Can J Physiol Pharmacol משנת 1993).
בשנות ה-50 וה-60 של המאה ה-20 הביוסינתזה של פורפירינים ושל heme זכתה לקידום בהבנת התהליכים הביוכימיים, כולל ההיבט של מפגעים במטבוליזם של פורפירינים (Bottomley ו-Muller-Eberhard ב-Semin Hematol משנת 1988). דרך רצף של ריאקציות, שתי מולקולות של delta aminolevulinic acid (להלן ALA), נדחסות ליצירת monopyrrole porphobilinogen. ארבע מולקולות של קודמן פורפירין זה, עוברות ציקליזציה עם מספר מודיפיקציות של שרשרת צדדית ליצירת tetrapyrrole protoporphyrin. בשלב זה האנזים ferrochelatase מקטלז chelation של יון Fe+2 על ידי פרוטופורפירין כאשר הריאקציה הסופית היא יצירת heme (תמונה A):
משך תקופה ארוכה שלטה הדעה שעודף של פרוטופורפירין-נטול מתכת מצטבר במצבי חסר ברזל, ו-ZPP נוצר על ידי chlation לא-אנזימטי של יוני אבץ, אך מחקרי המשך על ferrochelatase מצאו שאנזים זה יכול לקטלז chelation של אבץ כמו גם של ברזל על ידי פרוטופורפירין (Taketani ו-Tokunaga ב-Eur J Biochem משנת 1982, ו-Bloomer וחב' ב-Gastroenterology משנת 1983). הריאקציה עם אבץ מתרחשת כאשר סינתזה של heme במצבים של זמינות נמוכה של ברזל (Labbe וחב' ב-Ann NY Acad Sci משנת 1987). ריאקציה זו מתרחשת במידה קטנה מאוד במח העצם, בשלבי ביוסינתזה של heme ובשלות תאים, בעוד שכמות מוגברת של הצטברות ZPP מופיעה באריתרוציטים בצירקולציה במצבי חסר של ברזל במח העצם (Langer וחב' ב-Blood משנת 1972, ו-McLaren וחב' ב-Clin Chem משנת 1975). בעוד ש-ZPP נותר קשור בתוך אריתרוציטים בצירקולציה לאורך חיי תאים אלה, פרוטופורפירין נטול-מתכת נוטה לדלוף מתאים אלה (Piomelli וחב' ב-J Clin Invest משנת 1975).
כתוצר מטבולי הנוצר במהלך הסינתזה של המוגלובין באריתרוציטים מתפתחים, מוצאים ZPP בדם של אנשים בריאים ביחס של בערך 50 מולקולות ZPP לכל 1,000,000 מולקולות heme. הפרקציה המינורית של פורפירינים ללא-heme באריתרוציטים בריאים מורכבת מ-95% ZPP ומ-5% של erythrocyte protoporphyrin (להלן EP). יוצא דופן חשוב ליחס האחרון, מופיע בפרוטופורפיריות, בהן חסר תורשתי של ferrochelatase גורם ליצירה מסיבית והצטברות של EP.
מטבוליזם של ZPP
הנוכחות של ZPP באריתרוציטים כתוצאה מסינתזה שגויה של heme, גורמת לשקיעתו בטחול וכנראה גם בכבד, כאשר אריתרוציטים זקנים משלימים את מכסת חייהם ו-heme ו-ZPP מופרשים ונקשרים ל-heme oxygenase (להלן HO) באיברים אלה, מה שגורם בהמשך לפירוק איטי יותר של heme. כיוון ש-ZPP אינו נקשר ל-O2, הוא אינו עובר פירוק חמצוני בתיווך HO האופייני ל-heme (על פי Maines ב-Biochim Biophys Acta משנת 1981). הפרשה מועטה של ZPP במרה, אך לא בשתן, דווחה בקופי rhesus בהיוולדם.
החדרת ZPP לחולדות הביאה לשקיעתו במגוון של איברים (כבד, טחול, כליות, ריאות ומוח), מה שגורם לירידה בפעילות heme oxygenase ויצירת CO. פעילות אנזים זה בכבד בוולדות של חולדות ביקורת הגיעה לשיאה בימים 1–4 לאחר הלידה. החדרה תוך-פריטונאלית של ZPP במינון של 40 ננומול'/גרם, הביאה לריכוז רקמתי של 27–38 ננומול'/גרם של ZPP, כאשר פעילות HO בכבד עוכבה ב-27-51% בין הימים 1–4. עיכוב זה גרם לירידה של 23-28% ברמת בילירובין בנסיוב. העיכוב של HO במוח, יכול לפגוע בתפקיד המשוער של CO כ-messenger עצבי (Maines וחב' ב-Mol Cell Neurosci משנת 1993, ו-Zhuo וחב' ב-Science משנת 1993). עם זאת, ZPP אינו מסוגל לעבור דרך מחסום דם-מוח (BBB) ברוב המחקרים (Mark ו-Maines ב-Pediatr Res משנת 1992).
כמו שתואר בשנת 1981 על ידי Maines, כאשר ZPP מוחדר תת-עורית פעמיים ביום יומיים ברציפות, במינון של 40 ננומול'/גרם, הוא נמצא מעכב 40-60% מעילות HPO בכבד, בטחול ובכליות בוולדות חולדה בגיל 5 ימים. מחקרים מאוחרים יותר עם וולדות קופי rhesus, הראו שמעט ZPP הופרש בשתן ובמרה, אך לעומת זאת רמת ZPP באריתרוציטים גדלה דרמטית 4 ימים לאחר הזרקתו, באופן שביום 11, בערך 46% מה-ZPP המוזרק הצטברו באריתרוציטים. דרך מדידה של בילירובין בנסיוב ושל פעילות HO בכבד ובטחול, משך הפעולה של ZPP המוחדר לתוך הפריטונאום של וולדות חולדה, נמצא כפחות משבוע אחד. רוב ה-ZPP נקלט על ידי הכבד, ורק כמויות מועטות שלו נמצאו בכליות ובטחול.
ZPP וקטבוליזם של heme
ZPP ואנלוגים של מטלו-פורפירינים (MP) נוספים של heme יכולים לשחק תפקיד חשוב בקטבוליזם של heme על ידי HO קשור לממברנה, בשילוב עם האנזים reductase בציטוכרום P450, עם NADPH, ועם O2 (על פי Tenhunen וחב' ב-J Bioi Chem משנת 1969). ריאקציה זו מוליכה ליצירה של מולקולה אחת של biliverdin, של CO ושל Fe+2. בהמשך, biliverdin מחוזר על ידי biliverdin reductase ליצירת בילירובין, שהוא טטרה-פירול ליניארי (Kutty ו-Maines ב-J Biol Chem משנת 1981). גישות תרפיה עכשוויות, במצבים של היפר-בילירובינמיה, כגון פוטו-תרפיה או exchange transfusion, מוכנסות לטיפול לאחר אבחון המפגע (Ennever ב-Hepatology משנת 1988, ו-Ostrow באותו כתב עת מאותה שנה). אסטרטגיה יותר רצויה הייתה במניעת היפר-בילירובינמיה. כיוון ש-HO הוא האנזים הקובע את קצב הפעולות המובילות ליצירת בילירובין, עיכוב HO עשוי להיות בעל יתרון חשוב לבקרה של יצירת האחרון (Stevenson וחב' ב-Am J Dis Child משנת 1989).
אנלוגים מטלו-פורפיריניים של heme כגון ZPP אנדוגני, או נגזרים סינתטיים של ZPP, בהם הותמרו יון המתכת המרכזי, ו/או גם קבוצות בעמדות 2 ו-4 בטבעת, הם מעכבים פוטנטיים של HO בניסויים in vivo ו-in vitro (על פי Frydman וחב' ב-Biochemistry משנת 1981). בניגוד לפרוטופורפירינים המכילים קובלט או ברזל, ZPP לא נמצא משפיע על אנזימים הקשורים לביוסינתזה של heme. ממצא זה הביא למסקנה ש-ZPP עשוי להיות שימושי ככלי ניסויי לדיכוי בררני של פירוק heme (על פי Maines ב-FASEB J משנת 1988). אך למרות ההבטחה הגלומה ב-ZPP בהיבט הטיפולי לא בוצעו ניסויים בבני אדם עם מולקולה זו (Berglund וחב' ב-Gut משנת 1990, Galbraith וחב' ב-Pediatrics משנת 1992, Kappas וחב' באותו כתב עת משנת 1988, וכן משנת 1995).
תכונות כימיות ופיזיקליות
יציבות ומסיסות: המסיסות של פורפירינים קשורה במספר הקבוצות הקרבוקסיליות החופשיות. פרוטופורפירין המכיל רק 2 קבוצות כאלה הוא ליפופילי, ממש כמו ZPP. לדוגמה, ZPP מסיס ויציב בתמיסות מימיות בסיסיות חזקות. מטלו-פורפירינים (להלן MPs) גם כן מסיסים מאוד בתמיסות אורגניות בסיסיות, דוגמת פירידין ואתנולאמין, כמו גם במספר חומרים פעילי-שטח (surfactants). בניגוד לכך, תכונה חשובה במיוחד של ZPP היא שהוא מאבד במהירות את האבץ בחשיפה לחומצה חזקה. שימור של ZPP בעת מיצויו מחומרים ביולוגיים תלוי בשימוש במדיום אורגני נייטרלי או חומצי חלש (Schwartz וחב' ב-Int J Biochem משנת 1980, ו-Bailey ו-Needham ב-Clin Chem משנת 1986). בדם, ZPP קשור ל-heme בגלובין (Leonard וחב' ב-Biochemistry משנת 1974). בחינה של האינטראקציה של ZPP עם oxyhemoglobin תוך שימוש בשיטות של מיקרו-קלורימטריה, פלואורומטריה, absorption spectroscopy, oxygen equilibrium,ו-isoelectric focusing, הביאה את Hirsch וחב' ב-Biochemistry משנת 1989 למסקנה ש-ZPP נקשר להמוגלובין טטרמרי באזורי "כיס" שאינם חלק מ-heme, באופן לא-ספציפי, רופף ושאינו קו-ולנטי.
ספקטרום ופלואורסצנציה
בין התכונות הפיזיקליות המבדילות את ZPP מרוב ה-MPs האחרים, היא הפלואורסצנציה שלו. Heme שהוא פרוטופורפירין נושא ברזל, וויטמין B12 שהוא בעל מבנה pyrrole המכיל קובלט, אינם פלואורסצנטיים. הספיגתיות (absorptivity) של ZPP לא נקבעה באופן ישיר, אלא לאחר התמרתו לפרוטופורפירין נטול-מתכת, על ידי המסתו ב-HCl. תוך שימוש בחומר טהור במיוחד, נקבע שה-absorptivity של פרוטופורפירין היא 297 מיקרומול' למילימול לס"מ. המאפיינים הפלואורסצנטיים הכוללים את שיאי ה-excitation וה-emission של פרוטופורפירין בצורותיו השונות מסוכמים בטבלה למטה. תכונות ספקטרליות אלו שימשו לאבחון של מפגעי מטבוליזם של פורפירין (Poh-Pitzpatrick ו-Lamola ב-J Lab Clin Med משנת 1976):
- מקסימום excitation ו-emission פלואורסצנטית למצבים וצורות שונות של פרוטופורפירין (על פי Gambino ב-Lab Rep Physicians משנת 1986)
| פרוטופורפירין | Emission(nm) | Excitation(nm) |
|---|---|---|
| אריתרוציטים בחסר ברזל | 594 | 424 |
| אריתרוציטים בהרעלת עופרת כרונית | 594 | 424 |
| zinc protoporphyrin-globin | 594 | 423 |
| magnesium protoporphyrin-globin | 594 | 420 |
| protoporphyrin-globin | 625 | 403 |
| אריתרוציטים בפרוטופורפיריה אריתרופויאטית | 625 | 397 |
| פרוטופורפירין נושא ברזל (heme) | אין פלואורסצנציה | |
שיטות אנליטיות
שלוש שיטות אנליטיות שונות משמשות באופן שגרתי לקביעת רמת ZPP בחומרים ביולוגיים דמיים למטרות קליניות:
- מיצוי של ZP ושל EP עם ממס כגון אתיל אצטט/חומצה אצטית, מיצוי חוזר לתוך HCl מהול, ומדידת סך פרוטופורפירין נטול-מתכת על ידי פלואורומטריה או absorptivity
- מיצוי של ZPP עם ממס אורגני נויטרלי או חומצי חלש, הפרדה באמצעות HPLC, מלווה על ידי מדידת ZPP בעזרת פלואורומטריה (Rodgers וחב' ב-Pediatr Res משנת 1996, ו-Chisolm ו-Brown ב-Biochem Med משנת 1979)
- מדידה ישירה של ZPP בדם מלא או באריתרוציטים רחוצים על ידי המטו-פלואורומטריה
וריאציות רבות של שיטות מדידה אלו פורסמו ונמצאות בשימוש, כאשר שתיים מהמומלצות יותר למעבדה הקלינית הן אלה של Gunther וחב' ב-Clin Chem משנת 1989, וזו המומלצת על ידי ה-NCCLS ב-Erythrocyte Protoporphyrin Tesing משנת 1996).
המטו-פלואורומטריה היא הדרך המהירה והקלה יותר למדידת ZPP בדגימות דם. המטו-פלואורומטר הוא מכשיר ייעודי, המודד באופן ישיר בדם מלא או באריתרוציטים רחוצים את היחס בין הפלואורסצנציה של ZPP לבין ה-absorption של המוגלובין, ומציג את התוצאה כיחס בין שני גורמים אלה (Lamola וחב' ב-Clin Chem משנת 1980). אף על פי ששיטה זו פשוטה ומהירה, היא אינה חפה ממגבלות, כאשר רמות גבוהות של בילירובין בפלזמה, עלולות לתת תוצאות מוגברות שגויות של ZPP (על פי Schifman ו-Finley ב-Clin Chem משנת 1981). חומרים נוספים שעלולים לפגוע בדיוק המדידה הן מספר תרופות, כמו גם ריכוזי ריבופלבין בפלזמה. פתרון מקובל להימנע מההפרעות השונות למדידת ZPP, הוא ברחיצת האריתרוציטים על מנת להרחיק את הפלזמה (Louro ו-Tutor ב-Clin Chem משנת 1994), ואף הוצעו חלופות נוספות לשטיפת הכדוריות האדומות (Labbe וחב' ב-Clin Chem משנת 1999). בעיה פוטנציאלית שנייה היא בצורך לחמצון מוחלט של המוגלובין, שבהיעדרו מתקבלים ערכים נמוכים שגויים של ZPP בגלל הסטייה ב-absorption של המוגלובין. פתרון אחד לבעיה זו הוא שימוש בריאגנט הממיר המוגלובין ל-cyanmethemoglobin (על פי Rettmer וחב' ב-Ann NY Acad Sci משנת 1987). גם המוליזה עלולה לגרום להטיית התוצאות, לכן מקובל לבצע את המדידה בדגימות לא המוליטיות. מומלץ שהתוצאות תבוטאנה ביחידות של מיקרומול' ZPP/מול' heme.
טכניקות למחקרים in vivo של ZPP
אף על פי שמדידת בילירובין בפלזמה והכנת רקמות שימשו כאינדיקטור מרכזי של תפקוד ZPP (על פי Tenhunen וחב' ב-Proc Natl Acad Sci USA משנת 1968), מדידות אלו באורגניזם שלם הם בהחלט קשות יותר לאינטרפרטציה כיוון שבילירובין מצוי גם בחללי גוף שהגישה אליהם קשה (Yao ו-Stevenson ב-Clin Perinatol משנת 1995). בילירובין הוא ליפופילי ומצטבר בעיקר ברקמות עתירות ליפידים, והכימות של בילירובין, פרט למדידות ספקטרופוטומטרית המוגדרות כ-trans-cutaneous צריך להתבצע באופן חודרני (Maisels ו-Kring ב-Pediatrics משנת 1997, ו-Yamauchi ו-Yamanouchi ב-Biol Neonate משנת 1989).
טכניקות למחקרים in vitro של ZPP
מחקרי in vitro רבים בוצעו להערכת התפקיד של ZPP בפירוק של heme המתבצע בתיווך האנזים heme oxygenase (על פי Maines ב-Heme oxygenase, CRC Press משנת 1992, ו-Kappas ו-Drummond ב-J Clin Invest משנת 1986). באופן דומה, במחקרים in vivo, בילירובין ו-CO הם התוצרים הנמדדים באופן השכיח ביותר. כללית, מדידת בילירובין היא השיטה הנפוצה ביותר, כיוון שהיא יכולה להתבצע באופן ספקטרופוטומטרי זמין ביותר (Maines ב-Methods Enzymol משנת 1996, ו-Drummond ו-Kappas ב-Proc Natl Acad Sci USA משנת 1981), או בשיטת HPLC (על פי Vreman וחב' ב-J Chromatogr משנת 1988). עם זאת, שיטות אלה דורשות דגימות של ממברנות (של מיקרוזומים) נקיות ביותר, ללא כל חומרים ספוחים המפריעים לביצוע המדידה, כגון חומרים הגורמים לפיזור אור וכן המוגלובין. לכן, הכנת הדגימות למדידה עלולה להיות מסורבלת וגוזלת זמן. לעומת זאת, מדידת CO דורשת טכניקות לאצירת גז ומכשור המיועד לכרומטוגרפיה של גז (Vreman ו-Stevenson ב-Anal Biochem משנת 1988). יתרה מכך, ההוספה של תרכובות פורפירין בעלות צבע כגון ZPP, אינן מפריעות בשיטת המדידה של CO (על פי Vreman וחב' ב-Pediatr Res משנת 1989).
שימושים קליניים
הערכה של הסטאטוס התזונתי של ברזל: מספר בדיקות המודדות מדדי ברזל שונים (אגירה, טרנספורט, תוצרי קצה וקולטנים לברזל) זמינים להערכת הסטאטוס התזונתי של ברזל. כל אחת מבדיקות אלו מודדת היבט אחר של מטבוליזם של ברזל, ולכן לא צפויה להיות קורלציה ביניהן. בדיקות אלה שונות באופן נרחב בדרגות הרגישות והספציפיות שלהן, ואף לא אחת מהן מאבחנת באופן ראוי חסר ברזל (Hastka וחב' ב-Clin Chem משנת 1996). "מדד הזהב" המקובל כבדיקה לאבחון חסר ברזל, היא הקביעה של ברזל במאגרי מח העצם, אך בדיקה זו יקרה מדי ואף חודרנית ואינה מתאימה לסריקה שגרתית של חסר ברזל או לניטור הטיפול בחסר זה. מגבלות אלה מדגישות את התועלת של בדיקת ZPP, שלמעשה נמצאה משקפת את סטאטוס הברזל במח העצם. מאגרי ברזל המשתקפים בבדיקת רמת ferritin בנסיוב, נחשבת לרוב כבדיקה המדד התואמת ביותר לסטאטוס הברזל. אך כיוון ש-ferritin הוא גם חלבון acute phase, הריכוז שלו אמור להימדד בשילוב עם היחס ZPP/heme, להערכת מפגעים רבים של ברזל.
אינטרפרטציה של היחס ZPP/heme באבחון של מפגעי ברזל
- כאשר היחס ZPP/heme נמוך (פחות מ-60 מיקרומול'/מול'), יש לספק ברזל באופן סיסטמי, ואין צורך בבדיקות נוספות לקביעת חסר ברזל. ההמלצה במקרה זה היא שמאגרי הברזל יכולים להיקבע במדידת פריטין בנסיוב. אם היחס ZPP/heme נמוך מ-40 מיקרומול'/מול', יש לשקול בדיקתת העמסת-יתר של ברזל, או אפשרות של hemochromatosis, על ידי מדידת רמת פריטין בנסיוב, ובדיקת אחוז הריוויון של טרנספרין
- יחס ביניים של ZPP/heme (בתחום שבין 60–80 מיקרומול'/מול'), מצביע על אפשרות של סטאטוס ברזל בלתי-גָּדוּשׁ. במקרה זה יש לבדוק דיאטה דלה, איבוד ברזל, אנמיה של מחלה כרונית או סיבות אחרות. במקרה זה רמת המוגלובין או המטוקריט בספירת דם כללית יכולות לאשש חסר ברזל. אם מומלץ קלינית, יש לקבוע רמת פריטין בנסיוב, כדי להבדיל בין מאגרי ברזל נמוכים או חסימה דלקתית של שחרור ברזל ממאגריו. האפשרות האחרונה יכולה להיבחן במדידת C-reactive protein
- מצב של יחס גבוה של ZPP/heme (למעלה מ-80 ננומול'/מול'), ורמת פריטין נמוכה (פחות מ-20 מיקרומול'/מול'), מצביע על אריתרופויאזה בחסר ברזל, המיוחסת לאספקה נמוכה של ברזל למח העצם, כנראה כתוצאה מדלדול מאגרי הברזל. במקרה זה יש לטפל על ידי אספקת ברזל. יש נטר את יעילות התרפיה במצבים של יחס נמוך של ZPP/heme, ו/או כאשר ספירת רטיקולוציטים גבוהה. יש לבחון את האטיולוגיה למצב זה הכוללת דיאטה דלה, איבוד מסיבי של דם, אנמיה של מחלות כרוניות או חשיפה כרונית לעופרת
- יחס מוגבר של ZPP/heme (מעל 80 מיקרומול'/מול') ורמת פריטין גבוהה (מעל 200 מיקרומול'/מול') יכולים להצביע על חסימה דלקתית חמורה, על אנמיה של מחלה כרונית או על מפגעים אחרים עם ניצול פגום של ברזל. יש לשקול הרעלת עופרת חמורה כרונית, כאשר אספקת ברזל אינה יעילה, ויש לתקן את המצב של חוסר מופחת בצריכת ברזל. גישה עם עלות-יעילות גבוהה להערכת סטאטוס הברזל היא לקבוע תחילה את היחס בין ZPP/heme: אם התוצאה היא בתחום הנורמלי, יש לשער שמח העצם והרקמות ההיקפיות מקבלים אספקה נאותה של ברזל, ללא כל קשר לריכוז פריטין, שיכול להצביע על מאגרי ברזל נמוכים גם במצב של אספקת ברזל נאותה לרקמות. לעומת זאת, אם היחס ZPP/heme מוגבר, יש להמשיך לעקוב כיוון שגורמים רבים עלולים להשפיע על צריכת ברזל במח העצם. Hastka וחב' ב-Clin Chem משנת 1994, מציעים לשלב את הנתונים של ZPP עם אלה של פריטין והמוגלובין לצורך הערכת חסר ברזל
סטאטוס הברזל בילדים
קביעת המטוקריט והמוגלובין, יכולה בהגדרה לאבחן חסר ברזל רק בשלב של אנמיה. השגרה בה משתמשים בשתי הבדיקות האחרונות לסריקת סטאטוס של ברזל בילדים, עלולה להחמיץ רבים מתוכם במצב קדם-אנמיה, שהם בחסר ברזל וההמלצה היא לטפל על ידי מתן תוסף ברזל (Siegel ו-LaGrone ב-Clin Pediatr משנת 1994, ו-Kazal ב-J Fam Practice משנת 1996). אף על פי שבדיקות המוגלובין והמטוקריט הן בדיקות פשוטות לביצוע, הן אינן רגישות או ספציפיות באופן הדומה לבדיקת ZPP/heme, שניתן להשתמש בה ביעילות בשגרת הבירורים בילדים (Rettmer וחב' ב-Pediatrics משנת 1999, ו-Graham וחב' ב-West J Med משנת 1997). הימנעות מאנמיה על רקע חסר ברזל חשובה במיוחד בילדים קטנים בשלבי גדילתם המואצים, שכן חסר ברזל עלול להוביל לפגיעה בהתפתחות המוטורית והקוגניטיבית (Walter ב-Baillieres Clin Hematol משנת 1994), כמו גם להחמיר חשיפה לעופרת (Yip ב-Dietary Iron ב-Raven Press משנת 1989).
סטאטוס הברזל בהיריון
כיוון שאנמיה על רקע חסר-ברזל עלולה להתפתח במהלך היריון, בדרך כלל הסטאטוס שלו בנשים הרות מנוטר באופן שכיח על ידי מדידת המוגלובין, המטוקריט ו/או פריטין (Romsio וחב' ב-Br J Obstet Gynecol משנת 1983). במהלך היריון, קביעת הסטאטוס של ברזל בשיטות אלו מבוססת על ריכוז הברזל, ועלולה להיות בלתי מדויקת לעיתים על ידי מיהולו כתוצאה מהתפשטות נפח הפלזמה.
Schifman וחב' ב-Am J Obstet Gynecol משנת 1987 מסיקים שמדידת ריכוז ZPP היא בעלת ערך רגישות וספציפיות המספיק על מנת לנבא את סטאטוס הברזל בהיריון, ערך בדיקה זו מוגבר אף יותר על ידי קביעת היחס ZPP/heme, בה נמנעת ההשפעה של התפשטות נפח הפלזמה, שכן ZPP והמוגלובין (או heme) נמהלים באופן שווה, ובכך נמנע פירוש תוצאות לא נכון העלול להתרחש עם השינוי בנפח הפלזמה (Stein בתיזה שהוגשה בשנת 1999 לאוניברסיטת Gonzaga ב-Spokane, וושינגטון).
סטאטוס ברזל בתורמי דם
תורמי דם פוטנציאליים נבדקים באופן שגרתי לאפשרות של חסר ברזל, בעיקר בבדיקה הפשוטה של השקעת המוגלובין על ידי copper sulfate. אף על פי שטסט זה מזהה אנמיה על רקע חסר ברזל, הוא אינו משקף במדויק את סטאטוס הברזל שכן חלק מתורמי הדם יהיו בעלי מאגרי ברזל נמוכים (פריטין) ועדיין רקמות היקפיות שלהם עשויות לקבל אספקת ברזל תקינה כפי שהדבר בא לביטוי ביחס ZPP/heme תקין. השימושיות של בדיקת היחס ZPP/heme תוארה במספר מחקרים (Schifman וחב' ב-JAMA משנת 1982, Jensen וחב' ב-Clin Chem משנת 1990, ו-Harthoorn-Lasthuizen וחב' ב-Clin Chem משנת 1998). בדיקת ZPP/heme תפחית את מספר תורמי הדם שייפסלו לכאורה בגלל הערכה מוטעית של סטאטוס ברזל ירוד. Finch בסקירתו ב-Blood משנת 1994, קבע שתרומת דם יוצרת חוסר איזון בין הצורך בברזל של מח העצם, וכמות הברזל המסופקת למח העצם, מה שמביא לרמת ZPP מוגברת. במטופלים עם polycythemia vera שמקיזים מדמם באופן תקופתי, נוצר מצב הדומה במקצת לזה של תרומת-דם, בו רמת ZPP נמצאת מוגברת בהתאמה לירידה ברמת פריטין (Birgegard וחב' ב-Scand J Clin Lab Invest משנת 1987), מה שמדגים שוב את הקשר בין סטאטוס ברזל לבין ZPP.
אבחון של מפגעים נוספים במטבוליזם של ברזל
חסר יחסי של ברזל הוא מצב בו ברזל מועבר למח העצם בקצב שאינו מספיק לספק את הצרכים של אריתרופויאזה מוגברת. דוגמאות להתרחשות זו כוללות אריתרופויאזה בלתי-יעילה או אנמיה המוליטית, מצבים בהם הדרישה לברזל ליצירת אריתרוציטים מוגברת. אנמיה סידרובלסטית היא מפגע מטבולי בניצול של ברזל היוצרת תגובה דמוית חסר-ברזל עם יחס מוגבר של ZPP/heme. ניצול פגום של ברזל מוצאים בעיקר באנמיה של מחלות כרוניות, ומתבטא בהגברת היחס ZPP/heme, שניתן להשתמש בו לזיהוי האנמיה האמורה (Hastka וחב' ב-Blood משנת 1993). כעיקרון, יחס גדול יותר של מאושפזים בבתי חולים צפוי להראות יחס מוגבר של ZPP/heme, כתוצאה מאטיולוגיות אחדות הפוגעות בניצול ברזל במח העצם. למרות ספציפיות נמוכה, ZPP מאוד ספציפי כאשר הוא מוגדר במושגים של דרישת מח העצם לברזל, ולא במושגים של מאגרי ברזל (או רמת פריטין בנסיוב), או במושגים של תוצרי ניצול הברזל, (המוגלובין או המטוקריט). יש ראיות לכך שהיחס ZPP/heme הוא מכשיר בדיקה טוב לחסר ברזל אפילו במאושפזים (Wong וחב' ב-Clin Chim Acta משנת 1996).
תלסמיה מאופיינת על ידי פגיעה ביצירת שרשרת גלובין, אך תלסמיה באה גם לביטוי בחסר ברזל בגלל נפח הכדוריות הנמוך. המאפיין האחרון מוסבר על ידי היפרפלזיה אריתרואידית חריפה בתלסמיה היוצרת מצב של חסר יחסי בברזל (Pootrakul וחב' ב-Am J Clin Pathol משנת 1984). ניתן להשתמש במדידת ZPP כדי להבדיל בין חסר ברזל על רקע כדוריות מיקרוציטיות לבין מצב של פגיעה בסינתזה של גלובין או של המוגלובין בתלסמיה (Stockman וחב' ב-J Lab Clin Med משנת 1975, Graham וחב' ב-J Pediatr משנת 1996, ו-Harthoorn-Lasthuizen וחב' ב-Eur J Hematol משנת 1998). מחלת כליות היא מצב בו ניתן להזריק אריתרופויאטין (EPO) על מנת לעודד המטופויאזיס, אך סטימולציה זו של יצירת אריתרוציטים עלולה להביא למצב של חסר יחסי של ברזל. בהשוואה של אינדיקטורים לסטאטוס ברזל במטופלים בהֶמוֹ-דיאליזה, הגיעו Fishbane ו-Lynn ב-Am J Kidney Dis משנת 1995 למסקנה ש-ZPP מאפשר את יכולת הניבוי הטובה ביותר לצורך במתן תוספי ברזל. Braun וחב' ב-Nephrol Dial Transplant משנת 1996, לא מצאו אמנם תגובה ברמת ZPP לתרפיה של ברזל במטופלי דיאליזה, אם כי הם הבחינו בהגברה ברמת ZPP שהייתה במתאם עם רמת עופרת בדם. באופן דומה, Baldus וחב' ב-Nephrol Dial Transplant משנת 1996, לא מצאו כל מתאם בין רמת ZPP לבין אינדיקטורים אחרים של סטאטוס ברזל.
אבחון טוקסיות מעופרת
ההשפעות של עופרת על מסלולי הביוסינתזה של פורפירין ושל heme נלמדו באופן נמרץ. ממצאי מחקרים אלה הדגימו שהרעלת עופרת וניצול ברזל קשורים זה בזה באופן בלתי נפרד, לפחות במח העצם. כחומר טוקסי, עופרת פוגעת באופן עמוק בביוסינתזה של heme, אף על פי שיש הגברה ברמת ZPP. לפני יצירת פורפירין, עופרת מעכבת את האנזים porphobilinogen synthase, מה שגורם להפרשה מוגברת של ALA בשתן. ההנחה הרווחת שעופרת מעכבת גם את ferrochelatase אינה לגמרי מדויקת, שכן עופרת אמנם נקשרת in vitro לקבוצות sulfhydryl של ferrochelatase, אך in vivo העיכוב מתרחש רק במצבים של הרעלת עופרת חריפה ביותר. תופעה זו עשויה להסביר את העיכוב על ידי עופרת של ferrochelatase הנצפה בהפטוציטים בתרבית (Jacobs וחב' ב-Toxicology משנת 1998). אם ההשפעה של עופרת במח העצם בשלב הטוקסיות הכרונית הייתה דרך עיכוב של ferrochelatase, העיכוב של אנזים זה היה צפוי להגביר את הפרוטופורפירין נטול-המתכת, כמו שמוצאים בפרוטופורפיריה, מפגע עם חסר תורשתי של ferrochelatase. יתרה מכל, הכלציה של ברזל ואבץ מסתמנת כמקוטלזת על ידי אותו ferrochelatase (על פי Nunn וחב' ב-Anal Biochem משנת 1988), מה שלא היה צפוי לגרום ליצירה מוגברת של ZPP על ידי עופרת. לכן, עופרת מצטיירת כמפריעה להעברת ברזל לצורך צריכתו על ידי אריתרוציטים בלתי בשלים, ובכך היא משרה תגובה דמוית חסר ברזל עם רמה מוגברת של ZPP המופיע באריתרוציטים בשלים.
בשנת 1991 ה-CDC הודיע שאף לא אחת משתי הבדיקות, של פרטופורפירין נטול-מתכת ובדיקת היחס ZPP/heme מתאימים כבדיקת סקר להרעלה כרונית של עופרת בתינוקות ובילדים צעירים, מסקנה שהקהילייה הרפואית אימצה בהמשך לכל הגילים. אף-על-פי-כן, היחס ZPP/heme עשוי לספק מידע חיוני כאשר הוא נמדד בשילוב עם רמת עופרת בדם לניטור טוקסיות רקמתית בנבדקים בכל הגילים עם רמת עופרת גבוהה בגופם (Parsons וחב' ב-Clin Chem משנת 1991). היחס ZPP/heme הוא בעל תועלת מוספת לזיהוי חסר ברזל, הנגרם על ידי הרעלת עופרת בילדים צעירים. כמו כן, יחס זה נוח לקביעה ובעל עלות-יעילות גבוהה כבדיקת סקר לקבוע חשיפה לעופרת במבוגרים הנחשפים למתכת כבדה זו במקום העבודה בעיקר כיוון שמבוגרים אינם סובלים מהנזק הנוירולוגי הקבוע האופייני לילדים (Zwennis וחב' ב-Clin Chem משנת 1990). ההשפעות של חשיפה כרונית לעופרת במבוגרים הן הפיכות לאחר טיפול.
ZPP כחומר תרפויטי
אף כי ל-ZPP יש שימושים אבחוניים, יש לו גם פוטנציאל טיפולי. כיוון שצהבת יילודים היא תסמונת זמנית וברת-חלוף, חומר בעל פוטנציאל כימי-מניעתי עם משך פעולה קצר יחסית, הוא בבחינת חומר מבוקש. מחקרים על יעילות קלינית באדם, בוצעו רק עם פרוטופורפירין ומזופורפירין שהם בעל פוטנציאל גדול יותר מזה של ZPP. כיוון ש-ZPP משדרג את פעילות HO-1 באופן חלש יחסית (למעשה פי-2 בלבד על פי Zhang וחב' ב-J Investig Med משנת 1999), וכיוון שאין ל-ZPP תכונות של ריגוש על ידי אור, חומר זה עשוי להיות מתאים להתנהלות בתרחיש של היפר-בילירובינמיה. בנוסף, ZPP הוא חומר טבעי וכך הגוף עשוי להיות בעל מנגנון להרחקת ZPP מוזרק.
ZPP לטיפול בסרטן
מחקר בתחום של ננו-טכנולוגיה מוצא ש-ZPP היא תרכובת העשויה לסייע בסוגי סרטן רבים בניסויי מעבדה (Kongpetch וחב' ב-PLos One משנת 2012, ו-Rouhani וחב' ב-Pharm Res משנת 2014). הקבוצה הכימית לה שייך ZPP דומה ל-heme חופשי שהוא מצע טבעי של heme oxygenase (Wang וחב' ב-PLos One משנת 2015). ידוע ש-ZPP הוא מעכב תחרותי של heme oxygenase שהוא אנזים בעלת יכולת הגנה על תאים, המתמודד עם עקה חמצונית בתא ומראה ביטוי גבוה יותר ברקמות סרטניות (Kang וחב' ב- Tumor Biol משנת 2012). דיכוי של heme oxygenase על ידי ZPP, מפחית את חיותם של תאים סרטניים על ידי הגברת הטוקסיות בתאים אלה. ZPP פועל בשילוב עם תכשירים אנטי-סרטניים להגברה ניכרת של הציטו-טוקסיות במקרים מסוימים. מחקר אחד הראה הגדלה פי-5 ביעילות הטיפול (Yin וחב' ב-BMC Cancer משנת 2014). בדומה, ZPP נמצא כמשחק תפקיד נכבד בעיכוב שגשוג תאי סרטן סולידיים בעיקר. גידולי מוח, מעי גס, ערמונית, כליה, גידול קשקשתי של הפה והלוע, וכן תאי לויקמיה, מראים רגישות ל-ZPP כתוצאה מביטוי מוגבר שלheme oxygenase. עיכוב אנזים זה מגביר את פעילותן של מולקולות פעילות באופן חמצוני בתא, מה שמרגש תאים סרטניים לטיפול בתכשירים כימותרפיים.
חומרים מחמצנים אלה יכולים לגרום לאפופטוזיס בתאים הסרטניים, וכך להפחית את עמידות תאים אלה לטיפולים תרופתיים בעיקר בהיותם חשופים ל-ZPP, כתוצאה מאובדן של מנגנון ההתמודדות עם heme oxygenase. השילוב של שתי תרפיות אלו בניסויים של טיפול בסרטן נמצא יעיל. הטיפולים המשולבים עם ZPP אף מגבירים את הרגישות להקרנות (Zhang וחב' ב-Radiopharm משנת 2011). תאים המטופלים בשילוב של ZPP והקרנות, בהשוואה לטיפול יחידני עם אחד משני אלה, נמצאים בסבירות גבוהה יותר להישאר בפאזה G1 מאשר לעבור לפאזה G2. הטיפול המשולב של ZPP והקרנות, מראה רמת אפופטוזיס גבוהה יותר בתאים הסרטניים. במספר ניסויים הוזרק ZPP ישירות לתוך הגידול הסולידי, והשפעתו גדולה יותר בתאי הסרטן מאשר בתאים בריאים. כאשר ZPP עובר ציפוי בננו-חלקיקים פעילותו המעכבת heme oxygenase נשמרה. בדומה, ZPP המוחדר לננו-חלקיקים היה בעל פעילות ציטו-טוקסית גדולה יותר מאשר הזרקת ZPP חופשי.
הוראות לביצוע הבדיקה
הכנת הנבדק לבדיקה: בנבדק שעבר בסמוך לבדיקה זו פרוצדורת הדמיה עם חומר הניגוד gadolinium או חומרי ניגוד המכילים יוד, עלולה להיות הפרעה במדידה של רוב החומרים המכילים מתכת. במקרים של הזרקת גדוליניום או חומרי ניגוד המכילים יוד אין להתחיל בבדיקת ZPP אלא כאשר עברו 96 שעות מהטיפול האמור האחרון. לצורך הבדיקה יש להשתמש במבחנות בדרגת ניקיון גבוהה ונטולות מתכת כגון אלה של חברת Becto-Dickinson כגון Metal Tube B-D EDTA מספר קטלוגי T183, או Metal free (Lead only) מספר קטלוגי T615, או BD microtainer מספר קטלוגי T174, המכילים EDTA. יש לפסול דגימות מאוד המוליטיות או ליפמיות. יש לאחסן את הדם בקירור ויציבותו עד 28 יום. יציבות דם הנשמר בטמפרטורת החדר עד 30 שעות. אין לקבל דם קפוא או קרוש. הבדיקה מתבצעת בשיטה של המטו-פלואומטריה.
תיאור שיטת הבדיקה: ZPP נמדד כמומלץ בהמטו-פלואומטר הידוע כ-Helena ProtoFluor Z, תוך שימוש בפוטו-פלואורומטר רב-ערוצי. כאשר הדגימה נחשפת לאור, ZPP עובר אקסיטציה ומשחרר אור. מערכת שנייה של עדשה עם פילטר קולטת את האור המשתחרר, ומרכזת אותו לתוך שפופרת ה-photomultiplier או ה-PMT. האחרון מייצר רמת זרם בתגובה לאור המגיע אליו, הנמצאת במתאם עם היחס ZPP/heme. במהלך הפעולה, למעלה מ-1,000 קריאות אור נלקחות, ועוברת מיצוע לתוך מיקרו-מחשב והערך מבוטא במיקרומול' ZPP למול' heme.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 