אלפא-1 מיקרוגלובולין - Alpha-1-microglobulin
| מדריך בדיקות מעבדה | |
| אלפא-1-מיקרוגלובולין | |
|---|---|
| α-1 microglobulin | |
| שמות אחרים | α1M |
| מעבדה | כימיה בשתן ובדם |
| טווח ערכים תקין | באופן תקין ערכי α1M בפלזמה אינם עולים על 60 מיליגרם לליטר. בשתן תחום הערכים התקין הוא כדלקמן: 0.1-1.5 מיליגרם /ד"ל, או פחות 1.5 גרם/מול קראטינין. לפי גרסה אחרת תחום הנורמה של α1M עד גיל 50 שנה הוא פחות מ-13 מיליגרם לגרם קראטינין, ומעל גיל 50 שנה פחות מ-20 מיליגרם לגרם קראטינין. |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
החלבון α-1-microglobulin (להלן α1M) התגלה בשתן על ידי הקבוצה השוודית של Berggard בשנת 1975 במאמר שהתפרסם ב-Biochem Biophys Res Commun. השם נקבע על פי נדידתו באלקטרופורזה כ-α-גלובולין, ו"מיקרוגלובולין" נועד להדגיש את היותו יחסית חלבון קטן מימדים. החלבון α1M מקודד על ידי גן ייחודי, המקודד בנוסף ל-α1M גם לחלבון נוסף, bikunin (הידוע גם כ-Kuntz-type proteinase inhibitor), שאין לו כל קשר ל-α1M מעבר להיותם מקודדים על ידי גן משותף. נציין רק בקצרה ש-bikunin בפעילותו הוא למעשה גליקופרוטאין מעכב פרוטאזות, הקשורות לתהליך הגרורתי של תאים סרטניים, וכן הוא החוסם קליטת סידן על ידי תאים ומווסת על ידי כך את קצב גידולם.
הגן AMBP המשותף ל-α1M ול-bikunin, מופה לאזור 9q32-33, והוא מתורגם לקודמן (precursor) של α1M ושל bikunin המבוקע בהמשך ליצירת 2 החלבונים הבשלים. α1M הוא חלבון בגודל 26-27,000 דלטון, המיוצר בעיקר בכבד אך גם בכליות. למרות היציבות האופיינית של רמתו בפלזמה, הביטוי של הגן AMBP משתנה כלפי מעלה או כלפי מטה בעת תהליכי דלקת, כפי שהדבר הודגם לראשונה בחולדות על ידי Falkenberg וחב' ב-1997 ב-Scand J Immunol.
מבנה החלבון
α1M אנושי הוא גליקופרוטאין גלובולארי המכיל 183 חומצות אמינו, מהם מסתעפות 3 שרשרות קרבוהידרטיות. שלושת השרשרות האוליגו-סכרידיות הן כדלקמן: שתיים מהן עם חומצה סיאלית בקצותיהן קשורות בקשר N-גליקוזידי לחלבון דרך שיירי אספרגין בעמדות 17 ו-96, ואילו השרשרת השלישית קשורה בקשר O-גליקוזידי לחלבון דרך threonine בעמדה 5. בשתן מוצאים עותקים של α1M המכילים 2 גרסאות של שרשרת סוכרית בעמדה של אספרגין-96: אחת עם מבנה di-antennary והאחרת עם מבנה tri-antennary. החלק הסוכרי מהווה 22% מכלל מולקולת α1M. המולקולה החופשית של α1M מאוד הטרוגנית במטענה החשמלי, מה שמקל על התקשרותה לכרומופור.
α1M חופשי הוא פפטיד מונומרי המכיל 3 שיירים של ציסטאין, כאשר שניים מהם בעמדות 75 ו-173, יוצרים ביניהם קשר די-סולפידי ליצירת לולאה. כאשר התגלה לראשונה, כונה החלבון בשם protein HC או Human Complex forming glycoprotein, וכן Heterogenous in Charge protein. החלבון שייך למשפחת העל של ה-lipocalins, הקושרת ליגנדים הידרופוביים. כל חברי משפחת lipocalin בנויים כסל המורכב מ-8 גדילי בתא, כאשר שייר ציסטאין הממוקם באחת מלולאות החלבון בקצהו הפתוח, משמעותי במיוחד לגבי תפקודו. החלבון α1M השתמר היטב במהלך האבולוציה, ומוצאים אותו ביונקים, בעופות, בדו-חיים ובדגים. במבנהו, יש ל-α1M את הקרבה הרבה ביותר ל-complement factor C8-gamma, ויש לו אף קשר ל-epididymal retinoic acid-binding protein. שייר הציסטאין החופשי הפעיל בעמדה 34 של 1Mα , מאפשרת לו ליצור קומפלקסים עם חלבונים שונים בפלזמה, ובין השאר להיקשר לכרומופור צהוב-חום, מה שמקנה ל-α1M את צבעו האופייני. מספר חומרים הידרופוביים כגון retinol, נקשרים גם כן על ידי α1M.
קומפלקסים של α1M בפלזמה
בפלזמת האדם, כ-50% מה-α1M יוצר קשר (1:1) עם IgA מונומרי, על ידי קשר די-סולפידי עמיד לחיזור בין שייר ציסטאין בעמדה פנאולטימטיבית בשרשרת α של האימונוגלובולין, לבין ציסטאין בעמדה 34 של α1M. כ-7% מ-α1M קשור לאלבומין, ו-1% קשור בקשר די-סולפידי עם פרותרומבין. לא ידוע היכן נוצר כל אחד מהקומפלקסים הללו. הקומפלקס של α1M-IgA הוא בעל משקל מולקולארי של 200,000 דלטון, וריכוזו בפלזמה הוא 0.3 מיליגרם /מ"ל. α1M נקשר גם לרטינול.
צורות אופייניות של α1M גבה-מולקולארי מופיעות בפלזמה במצבים פתולוגיים: אז יש ל-α1M נטייה להיקשר לצורות מוטנטיות של גורמי-קרישה בהם יש שייר חופשי של ציסטאין. כך נמצא לדוגמה קומפלקסים בין α1M לבין פקטור IX Zutphen, לבין פקטור XII Tenri וכן עם צורות מוטנטיות של protein C.
פיזיולוגיה
לאחר הפרשתו לדם, α1M מופיע הן באופן חופשי, או במגוון של קומפלקסים במשקל מולקולארי גבוה. בצורתו החופשית המונומרית, עובר α1M דרך פקעיות הכליה לתמיסת השתן הראשונית, ממנה הוא נספג מחדש על ידי אבוביות הכליה הקריבניות (proximal) ושם מתרחשים תהליכים קטבוליים של חלבון זה. הספיגה מחדש של α1M בתאי אבוביות הכליה הקריבניות נעשית על ידי הקולטן megalin המסייע לאנדוציטוזה של α1M.
שתן תקין מכיל כמויות קטנות מאוד של α1M, בגין פעילות הספיגה מחדש האינטנסיבית באבוביות, אך במצבים של פגיעה בפעילות האבוביות, פוחתת הספיגה מחדש של החלבון, ומופיעות כמויות מוגברות שלו בשתן. הריכוז של α1M חופשי בפלזמה נקבע בעיקר על ידי קצב הפינוי הפקעתי (GFR), זאת בניגוד לריכוז בפלזמה של הקומפלקס α1M-IgA.
החלבון α1M מופיע ברוב רקמות הגוף, פרט למערכת העצבים המרכזית. מוצאים אותו בכבד, בפלזמה ובכליות בעיקר, החלבון מופיע ברקמות החיבור הפּרי-וסקולאריות גם בריאות, במעי ואף בשליה. בהתאם, חלבון זה מופיע כבר בעוּבּר.
אין כל דיווחים על חסר של α1M בבעלי חוליות, מה שמעיד על כך שחסר של החלבון עלול להיות קטלני, ומצביע על חשיבותו הפיזיולוגית. ריכוזו של α1M בפלזמה נותר קבוע באופן בולט במצבי דלקת, אפשרות אחת היא ש-α1M מדכא באופן קבוע של מערכת החיסון על מנת למנוע פעילות אוטו-אימונית, אם כי יש סבורים שתגובה חיסונית מקומית יכולה להתגבר על פעילות ה-immune-suppression של α1M על ידי הפרשת ציטוקינים. פעילות נוספת המיוחסת ל-α1M היא של היותו נוגד חמצון שיכול להעלים מבני heme הנחשבים כמעודדי חמצון.
יכולת הקישור של α1M ל-heme ונטרולו של האחרון, ראויה לתשומת לב: כאשר α1M חופשי או α1M-IgA נחשפים לצד הציטוזולי של ממברנת תאי-דם אדומים, משתחרר t-α1M או truncated α1M, שהיא צורת α1M עם קבוצת SH- חופשית של שייר ציסטאין בעמדה 34. צורת t-α1M זו נקשרת ל-heme ומסייעת לפירוקו. Allhorn וחב' הדגימו במאמר משנת 2003 ב-J Invest Dermatol, ש-α1M הוא גם בעל יכולת הגנתית כנגד heme גם מחוץ לתאים, בעיקר במצבים בהם יש פגיעה וביקוע של אריתרוציטים ושחרור של heme מחוצה להם. נמצא גם ש-α1M מגיב עם חלבונים קושרי-heme, כגון ציטוכרום C.
בין שאר פעילויותיו, α1M נקשר ומפרק את גרעין ה-heme שכן חלבון זה הוא גם בעל פעילות אנזימטית של reductase וגם בולען (scavenger) של רדיקאלים חומציים. יש המתארים את α1M כ"מיכל אשפה" המרחיק ללא הרף רדיקאלים חופשיים וחומרים בעלי פוטנציאל חמצוני גבוה כגון heme מהרקמות, מעביר אותם לכליות שם הם עוברים פירוק נוסף ומופרשים בשתן.
בדומה ל-bikunin, נמצא ש-α1M הוא מעכב חזק של תהליכי התגבשות של קלציום-אוקסלאט, ליצירת אבנים בדרכי השתן. אכן, באנשים עם נטייה ליצירת אבנים מסוג קלציום-אוקסלאט נמצא שרמת α1M בשתן הייתה נמוכה באופן משמעותי בהשוואה לאנשים בריאים., כפי שהראו Tardivel וחב' ב-Urol Res בשנת 1999.
ערכי ייחוס של α1M בנוזלי גוף
קביעה של רמת α1M בפלזמה או בנסיוב מסובכת בשל הנוכחות של צורות שונות של החלבון. כתוצאה מכך, דיווחים של ריכוזים נורמאליים של α1M בדם נתנו מגוון של תוצאות בתחומי ריכוז השונים משמעותית, שכן לא קיים למעשה תקן בינלאומי לערכי נורמה של חלבון זה. כך פרסמו DeMars וחב' ב-1989 ב-Clinical Chemistry תוצאות של מדידות של α1M בשיטה משולבת אימונו-אנזימטית/אימונו-רדיומטרית. לפי מקור זה, סף הנורמה העליון בפלזמה של α1M חופשי הוא 11.7 מיליגרם לליטר, אך רק 0.094 מיליגרם לליטר בנסיוב. בשתן קבעו Jung וחב' בשנת 1992 ב-Clin Chim Acta רמת סף עליון של α1M של 1.27 גרם/מול' קראטינין בנבדקים בני 18-40 שנה, ו-2.2 גרם/מול' קראטינין בנבדקים מעל גיל 40 שנה.
כיוון ש-α1M נוטה להיקשר ל-IgA, נמדדו ערכים של הקומפלקס α1M-IgA ונקבע תחום רחב של ריכוזים החל מ"בלתי ניתן לגילוי" בשתן, בחלב אם, בנוזל שדרה של חולים בטרשת נפוצה וברירית פי הרחם, ועד ערכים של 59.2 מיליגרם/ליטר בפלזמת הדם. ריכוזים מוגברים של α1M נמצאו בנוזל הברונכו-אלבאולארי של מאובחנים עם pulmonary alveolar proteinosis, בנסיוב של חולים עם תסמונת Bechet, ובנוזל סינוביאלי של חולים עם gout, עם דלקת מפרקים שגרונית (RA), ובאלה עם chondrocalcinosis.
לעומת זאת ריכוזי α1M-IgA נמצאו מוגברים רק בנבדקים עם דלקת מפרקים שגרונית או באלה עם pulmonary alveolar proteinosis. במחקר שהתפרסם ב-J Clin Pathol מצאו Takagi וחב' את הערכים הממוצעים הבאים של α1M בנוזלי הגוף הבאים: 28.7 מיליגרם/ליטר בנוזל סינוביאלי, 28.7 מיליגרם לליטר במיימת ,21.5 מיליגרם לליטר בתפליט פלאוראלי, 2.7 מיליגרם לליטר במי שפיר, ו-42.3 מיקרוגרם לליטר בנוזל עמוד שדרה.
רמות α1M במצבים פתולוגיים
לא נרשמים כל שינויים ברמת α1M בנסיוב של חולים במחלות ממאירות, במפגעים של מערכת העצבים המרכזית, בהדבקות חיידקים ונגיפים, בדלקת מפרקים שגרונית, בתגובות הפאזה החריפה או במפגעים אחרים. בדרך כלל שינוים ברמת α1M בפלזמה או בנסיוב קשורים תמיד לליקויים בתפקוד הכבד או הכליות. יוצא דופן מובהק להכללות אלה, הוא רמת α1M נמוכה בהדבקה מוקדמת, עדיין א-תסמינית של HIV, כפי שהראו Porstmann וחב' ב-1990 ב-J Clin Chem Clin Biochem.
רמת α1M חופשי בפלזמה, בניגוד לזו של α1M-IgA נקבעת בעיקר על ידי ה-GFR כפי שהראה Grubb ב-1992 ב-Clin Nephrol, באופן שרמת החלבון הזה בפלזמה מוגברת עם ירידת ה-GFR. בהתאם, במקרים של multiple myeloma עליה ברמת α1M בפלזמה עולים במקביל לעלייה ברמות קראטינין בדם עם הירידה בפינוי הכלייתי (Corso וחב' במאמר משנת 2003 ב-Ann Hematol). כמו מיקרו-חלבונים אחרים בנסיוב (ציסטטין C, בתא-2-מיקרוגלובולין), גם רמת 1Mα בפלזמה יכולה לשמש לקביעת ה-GFR אפילו בתחום ה"חלון העיוור" של קראטינין: נמצא מתאם חיובי משמעותי בין רמת α1M בנסיוב לבין רמות קראטינין (r=0.75; p<0.001). במטופלים עם נזקים כלייתיים על רקע של מיאלומה נפוצה, רמת α1M בנסיוב נמצא בתיאום טוב עם רמות קראטינין בנסיוב (r=0.816), וכן בתיאום טוב עם בתא-2-מיקרוגלובולין (r=0.791).
α1M ומערכת החיסון
אך מעבר ליכולתו לשמש כסמן לפגיעה כלייתית, הולך ומתברר הספקטרום הרחב של סגולותיו במודולציה של התגובה החיסונית של הגוף, באופן שהוא משמש בעיקר כמדכא של המערכת החיסונית. ל-α1M מייחסים תפקיד אימונו-רגולטורי בעיקר בהיבט של יכולת לחלבון זה לדכא חלקית את התגובה של לימפוציטים ונויטרופילים. Sanin ו-Cannas במאמר משנת 1999 ב-Scand J Immunol העלו את ההשערה על תפקידו נוגד הדלקת וההגנתי מבחינה חיסונית של α1M. ההשפעה המעכבת של קומפלקסים של α1M וקולאגן על השפעת רדיקאלים חופשיים במונוציטים, תוארה לצד השפעה זו על יצירת IL-1β. באותו כתב עת התפרסם דיווח ב-1986 על ההשפעה המיטוגנית של α1M על לימפוציטים של חזירי-ים, שסייעה לתאים אלה לשגשג. אך לעומת זאת, היו דיווחים מנוגדים, שהצביעו דווקא על השפעה מעכבת של α1M יכולתם של תאי T helper לייצר IL-2 בהשראת אנטיגן (Wester וחב' ב1998 ב-Scand I Immunol), השפעה מעכבת על כושר הנדידה של לויקוציטים (Logdberg ו-Akerstrom באותו כתב עת ב-1981), וכן השפעה מעכבת של α1M על כימוטקסיס של נויטרופילים (Mendez וחב' ב-Proc Natl Acad Sci משנת 1986). אפשרות אחרת היא שברקמות בהן רמת α1M גבוהה במיוחד בולטת פעילותו האנטי-אימונית. בשליה לדוגמה, ריכוז α1M גבוה יחסית, ושם חלבון זה אמור להגן על העובר מפעולת נוגדנים של האם.
מפגעים נפרולוגיים ו-α1M
פרוטאינוריה טובולארית מתרחשת כאשר התפקוד הגלומרולארי תקין, אך לאבוביות הקריבניות יש יכולת מוגבלת לספוג מחדש חלבונים ולפרקם, מה שגורם להפרשה מוגברת בשתן של חלבונים קטן-מולקולאריים כמו retinol-binding protein, בתא-2-מיקרוגלובולין, Clara cell protein ו-α1M. הפרשה בשתן של חלבונים אלה בתרחיש של פרוטאינוריה טובולארית הוא בדרך כלל נמוך מ-1.5 גרם ליום.
ישנן סיבות רבות לפרוטאינוריה טובולארית, החל מחומרים נפרו-טוקסיים הגורמים נזק לאבוביות כגון מתכות כבדות דוגמת קדמיום ועופרת, תרופות אחדות (ציקלוספורין, אמינו-גליקוזידים, תכשירים ציטו-סטאטיים ואף תרופות משככות כאבים). פרוטאינוריה טובולארית כרוכה גם עם pyelonephritis, עם מחלות וסקולאריות של הכליה, דחייה של כליה מושתלת, תסמונת Fanconi ו-Balkan nephropathy. במטופלים עם דלקות בדרכי השתן (UTI), רמות מוגברות של α1M בשתן יכולות להעיד על מעורבות כלייתית (pyelonephritis).
מחקר של Jung וחב' משנת 1993 ב-Clin Chem, מצא שבעובדים בתעשייה הנחשפים באופן קבוע לקדמיום, ערכי α1M בשתן מוגברים משמעותית, במובהקות גבוהה יותר מזו שהושגה עם חלבונים סמנים אחרים המופרשים בשתן. גם בחשיפה תעסוקתית לכספית ולעופרת, נמצא יתרון למדידת α1M בשתן כמדד מוקדם לנפרופתיה כפי שהראו Lim ןחב' ב-2001 ב-Ann Acad Med Singap. כמו כן α1M היה בשימוש על ידי Bruning וחב' כסמן להדגמה של נזק טובולארי הנגרם על ידי קרצינוגנים כמו dinitro-toluene, במחקרם משנת 2002 ב-Environ Health.
בתרחיש של idiopathic membranous nephropathy, הפרשת α1M בשתן נמצאה בהתאמה טובה עם נזק טובולו-אינטרסטיציאלי (p=0.0024). כן נמצא על ידי Bazzi וחב' במאמרם משנת 2001 ב-Am J Kid Dis, שרק הפרשה מוגברת של α1M, הייתה כרוכה בתרחישים כמו globular glomerular nephrosis (p=0.0032) או של arteriolar hyalinosis עם מובהקות של p=0.0004. הפרשה מוגברת של α1M מתרחשת בשלבי נפרופתיה מוקדמים בסוכרת type 2, כפי שהדגימו Hong וחב' ב-Diabetes care ב-2003.
במחקר משנת 2010 של Shore וחב', נבחנה היעילות של מדידת נזק טובולארי מוקדם במקרים של diabetic nephropathy, בעזרת מדידת רמות α1M בשתן. המדגם כלל גברים ונשים בני 41-50 שנה מאובחנים עם סוכרת type 2, אך ללא פגיעה ידועה בכליות, וכן קבוצת ביקורת של בריאים משני המינים באותה קבוצת גיל. רמת α1M באיסוף שתן של 24 שעות, נמצאה גבוהה פי-46.7 בדגימות מחולי הסוכרת לעומת אלה מאנשים בריאים, זאת למרות שלא היו עדיין כל ממצאים קליניים של פגיעה כלייתית.
α1M יכול לשמש כמדד של פרוטאינוריה. המבדק יכול להיחשב חיובי כאשר היחס α1M/creatinine בשתן הוא מעל 0.7 מיליגרם/מילימול. יש הסבורים ש-α1M עשוי גם לשמש מדד אבחוני של preeclampsia, בהתבסס על העובדה שהעקה החימצונית בשליה מגרה סינתזה אנדוגנית של α1M, ורמתו עשויה לעלות בפלזמה של האם. מבדק של α1M אידיאלי להערכת פרוטאינוריה טובולארית בתסמונת Fanconi, אן במפגעים טובולו-אינטרסטיציאליים.גם בתסמונת נפרוטית, אם כי עלייה ברמת החלבון הזה בשתן אינה ממצא קבוע בתסמונת נפרוטית. רמות α1M בשתן עולות עם הגיל, ומוגברות משמעותית בקרב מעשנים.
מפגעים אורולוגיים ו-α1M
מדידת α1M בשתן שימשה בהצלחה לאבחון מגוון של מפגעים אורולוגיים הכרוכים בנזק כלייתי. מדידת הפרשת α1M בשתן שימושית במקרים של רפלוקס וסיקו-אורטרלי (VUR), והיא מוגברת במצבים של לחץ תוך-וסיקולרי מוגבר. VUR הוא פגם מבני בכניסת השופכן לכיס השתן, שגורם לרפלוקס של השתן בחזרה לשופכן. הפרשת α1M קשורה לדרגת VUR עם רגישות של 90%, סגוליות של 70% וערך ניבוי של 97% כפי שנובע ממחקרם של Everaert וחב' משנת 2001 ב-Eur Urol. במקרים של חסימה חלקית של השופכן, הפרשת α1M היא אבחונית לנזק טובולארי אם כי לא למפגע הזה כשלעצמו.
בילדים עם מחלת שלפוחית נירוגנית, חיוני אבחון מוקדם של pyelonephritis בעיקר במקרים של היעדר תסמינים ספציפיים של המפגע, אבחון שיכול להיות מאתגר במקרים רבים. מחקריו של Everaert וחב' בשנת 1998 ב-Eur Urol וב-Spinal Cord, הדגימו שהיחס α1M/creatinine הוא בעל רגישות וסגוליות גבוהים במיוחד (98-100% ו-87-100%, בהתאמה), לאבחון מוקדם של פיאלו-נפריטיס במחלת השלפוחית הנירוגנית, והוא גם במתאם טוב מאוד עם ממצאי סינטיגרפיה עם DMSA. היום מקובל ש-DMSA scan, העושה שימוש ברדיו-נוקליד דוגמת dimercaptosuccinic acid, להערכת המורפולוגיה הכלייתית לאבחון acute pyelonephritis.
הירידה בקליטת DMSA תואמת היטב עם רמת ההפרשה של α1M בשתן (r=0.758 , p<0.001), ואמנם רמת ההפרשה הזו הייתה משמעותית גבוהה יותר במצבים של pyelonephritis דו-צדדי מאשר חד-צדדי (p<0.02). בחינה של 483 מטופלים אורולוגיים על ידי Everaert וחב', העלתה שיש הפרשה מוגברת בשתן של α1M ב-polynephritis חריפה אך לא ב-cystitis, כפי שדיווחו ב-1998 ב-Clin Chem Lab Med. השימושיות של היחס α1M/creatinine הודגמה על ידי Mantur וחב' ב-2003 ב-Clin Nephrol, כסמן של נזק טובולארי בילדים עם הדבקות ב-E.Coli או ב-Proteus.
יציבות α1M בדגימות השתן
ההערכה של תפקוד אבוביות הכליה (tubules) היא בעלת משמעות ראשונה במעלה בבירור הנפרולוגי. מטבע הדברים, הסתננות של מיקרו-חלבונים והפרשתם בשתן, עשויה לתת מידע חיוני על מפגעים טובולאריים כבר בשלביהם המוקדמים, ויכולה לסייע לאבחנה מבדלת של פתולוגיה כלייתית באמצעים לא חודרניים. שנים רבות שימש למטרה זו החלבון β-2-microglobulin, אלא שחלבון קטן זה (מ.מ. 11,800 דלטון), אינו יציב בתנאי pH חומציים השוררים בדרך כלל בשתן, ולעומתו α1M יציב ביותר בתנאים אלה.
ברוב הדיווחים, בניגוד ל-β-2-microglobulin, נמצא ש-α1M יציב בשתן ב-pH-ים שונים, ולכן הוא מועדף כסמן לנזק טובולארי, כפי שסיכמו DeMarsוחב' ב-1989 ב-Clin Chem. אמנם Donaldson וחב' במאמר ב-Clin Chim Acta משנת 1989, המליצו על אלקילציה של השתן בעזרת ביקרבונאט כדי לייצב את β-2-glycoprotein כמו גם את retinol-binding protein ו-α1M, אך מסתבר ש-α1M שומר על יציבותו גם ללא הבססה של השתן. Payn וחב' פרסמו ב-2002 ב-Clin Chem סקירה נרחבת על תנאי היציבות של α1M בשתן. על פי נתוני סקירה זו, חלבון זה יציב בשתן בטמפרטורת החדר משך 7 ימים, או עד 21 יום בקירור. יחד עם זאת הקפאת השתן במינוס 20 מעלות למשך שנה הביאה לירידה ניכרת בכמות α1M שנמדדה. Tencer וחב' פרסמו ב-1997 ב-Scand J Urol Nephrol המלצה להשתמש בהוספת חומרים משמרים בשתן כגון benzamidium chloride, סודיום אזיד, או ethylene-diamene-tetraacetate, אך בפועל אין כיום נטייה לשימוש בחומרי שימור אלה.
השפעה diurnal על הפרשת α1M בשתן
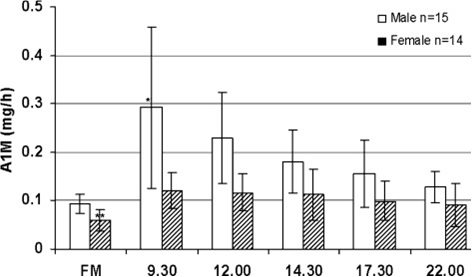
היבט חיוני להערכת רמת α1M בשתן, הוא תלות מועד נטילת הדגימה והשינויים בהפרשת חלבון זה לאורך שעות היממה. בשנת 2012 התפרסם ב-Nephrol Dial Transplant מחקרו של Berrgard וחב', לבחון את המועד האופטימאלי לדגימת השתן בשעות היום, וכן לברר את יציבות החלבון בתנאי אחסון שונים של השתן. במדגם נכללו 29 מתנדבים בריאים שנתנו דגימות שתן בשעות קבועות לאורך שעות היממה, משך יומיים ברציפות. נמצא שאכן יש תלות של הפרשת α1M בשתן בשעות היום: ההפרשה גדולה יותר בשעות היום מאשר בלילה, וזאת כנראה בתלות ברמה מוגברת של זרימת השתן בשעות היום. רמת α1M הייתה נמוכה ביותר בשתן הבוקר הראשון, וגבוהה ביותר בשעה 0930. רמת α1M הייתה גבוהה בשתן של גברים ב-80% מעל זו בשתן של נשים (ראה תרשים).
גישות מעבדתיות למדידת α1M
בעיקרון, רוב השיטות מבוססות על immunoassays, כאשר בשנת 1983 נוסתה גישה של electro-immunoassay ולאחריה שיטה של radial immunodiffusion באגר. בהמשך נכנסה שיטה של solid phase radioimmunoassay ולאחריה נוסו שיטות של immunoassay בעזרת גרגירים של polystyrene מצופים בנוגדנים כנגד α1M. כיום מקובלות יותר ערכות של ELISA, שרגישותן טובה אף לריכוזי α1M בשתן של 0.8 מיליגרם לליטר.
הוראות לביצוע הבדיקה
מדידת רמת α1M בשתן יכולה להתבצע על דגימה אקראית נקודתית, או על איסוף 24 שעות, כאשר האפשרות השנייה נחשבת באופן מסורתי כמייצגת יותר. אם מסיבות לוגיסטיות מבצעים את הבדיקה בשתן נקודתי, יש לבטא את התוצאה ביחס לריכוז הקראטינין, מה שמתקן את הערך של α1M מפני ריכוזים שונים של השתן בשעות היום. יש להקפיד באיסוף שתן של 24 שעות על אחסון השתן בקירור,ואין להוסיף חומר משמר או חומצה לשתן בעת האיסוף או אחריו. אין להקפיא השתן בשום שלב. השתן יציב משך 8 שעות בטמפרטורת החדר, או משך 8 ימים בקירור.
כיוון שמדידת α1M בשתן היא למעשה שיטה נפלומטרית, עכירות וחלקיקים (תאים, חיידקים או גבישים ומשקעים שונים) בשתן עלולים להפריע לדיוק המדידה. לכן, לפני הבדיקה יש לסרכז את דגימת השתן כדי להשקיע חלקיקים אלה.
בשיטות נפלומטריות מודגש שבדגימות שתן בהן ריכוז הסידן גבוה מ-7.5 מילימול'/ליטר, דיוק המדידה של α1M נמוך, כנראה בגלל דנטורציה של חלבונים על ידי סידן הידרוקסידי בדגימות שתן עם pH גבוה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק