אנמיה ממארת - Pernicious anemia cascade
הופניתם מהדף אנמיה ממארת לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| אנמיה ממארת | |
|---|---|
| Pernicious anemia cascade | |
| שמות אחרים | PA |
| מעבדה | המטולוגיה בדם. |
| תחום | אנמיה ממאירה |
| טווח ערכים תקין | טווח ערכים תקין של B12: 180-914 ננוגרם/ליטר. |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אנמיה
מטרת הבדיקה: אבחון של אנמיה ממאירה; אבחון של נוירופתיה הנובעת מחסר ויטמין B12.
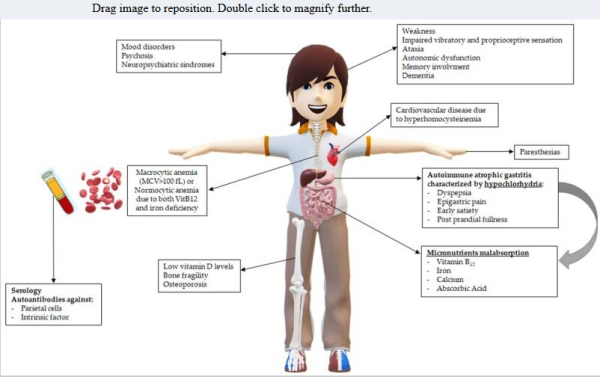
תסמיני אנמיה ממאירה
תסמיני PA כוללים שלשולים או עצירות, סחרחורת כאשר נעמדים, איבוד תיאבון, עור חיוור (צהבת והצהבה של העיניים, קוצר נשימה, לב צורב, לשון נפוחה אדומה וחניכיים מדממות, בעיות של מערכת העיכול כגון בחילה, נפיחנות ואיבוד משקל, נזק למערכת העצבים הגורמת חולשת שרירים, שיטיון, איבוד זיכרון, חֹסֶר תְּחוּשָׁה ונמלול בידיים וברגליים, בעיות לבביות הגורמות לדפיקות לב מואצות ועייפות. תסמיני מערכת העצבים של PA הנגרמים על ידי רמות נמוכות לטווח ארוך של ויטמין B12 כוללים בלבול, איבוד זיכרון לטווח קצר, דיכאון, איבוד שיווי משקל, בעיות ריכוז, רגזנות, הזיות, וניוון עצב הראייה. חסר ויטמין B12 עלול להתפתח אם התבצע ניתוח להרחקת כל או חלק מהקיבה, המפחית או מסלק תאים האמורים לאפשר ספיגה של הוויטמין. כמחצית מאלה שעברו ניתוח מעקף קיבה למניעת השמנת-יתר סובלים מחסר הוויטמין. אם מורחק בניתוח חלק או כל המעי הדק, נמנעת הספיגה של הוויטמין. אם האדם סובל מצמיחת יתר של חיידקים במעי הדק, חיידקים אלה עושים שימוש בוויטמין לפני שהמעי הדק יכול לספוג אותו. צריכת אנטיביוטיקה, או תכשירים למניעת סוכרת או פרכוסים, עלולה לפגוע ברמת הוויטמין. מחלת קרוהן, הדבקה עם שרשור או אכילת דגים לא מבושלים תביא לחסר הוויטמין שתולעים אלה ניזונות ממנו. צמחונים עלולים להיות בחסר הוויטמין. חולים בצליאק או במחלת קרוהן, או במחלות אוטו-אימוניות אנדוקריניות כגון היפו-פאראתירואידיזם או מחלת Grave עלולים לסבול מחסר הוויטמין.
| Vitamin B12 >400 ng/L | Results are normal. There is no need for more tests. |
| Vitamin B12 150 to 400 ng/L | Borderline vitamin B12 level-methylmalonic acid (MMA) is performed. If MMA is >0.40 nmol/mL, then intrinsic factor blocking antibody (IFBA) is performed. |
| Vitamin B12 <150 ng/L | Vitamin B12 deficiency-IFBA is performed. If IFBA is negative or indeterminate, then gastrin is performed. |
| MMA < or =0.40 nmol/mL | This value implies that there is no vitamin B12 deficiency at the cellular level. |
| IFBA positive | Consistent with pernicious anemia, Graves disease, or Hashimoto thyroiditis. |
| Gastrin >200 pg/mL | Result consistent with pernicious anemia. |
| Gastrin <200 pg/mL | Result does not suggest pernicious anemia. |
מצבים רבים אחרים עלולים להשפיע על ריכוז הוויטמין כולל מצבים אלה:
| רמות נמוכות של הוויטמין | רמות מוגברות של הוויטמין |
|---|---|
| היריון | צריכת ויטמין C |
| נטילת אספירין | צריכת ויטמין A |
| Anticonvulsants | פגיעה הפטו-צלולורית |
| קולכיצין | Uremia |
| שתיית אתנול | מפגע מיאלו-פרוליפרטיבי |
| הורמונים למניעת היריון | |
| עישון | |
| המודיאליזה | |
| Multiple myeloma |
אנמיה ממאירה (pernicious anemia, להלן PA), היא עדיין מפגע מוזנח בהקשרים רפואיים רבים והיא לא מאובחנת במטופלים רבים. PA קשורה אך שונה מגסטריטיס אוטו-אימונית. PA מתרחשת בשלב מאוחר של גסטיריטיס אוטו-אימוני אטרופי, כאשר חסר intrinsic factor בקיבה, מה שגורם לחסר B12. אכן, PA עלול להוביל לסיבוכים רציניים ארוכי-טווח הקשורים לחסרים של מיקרו-נוטריינטים, ולתוצאים הנגרמים כגון התפתחות סרטן הקיבה ולגידולים נוירואנדוקריניים קיבתיים type 1. כאשר אין אבחון של PA או כאשר מפגע זה מאובחן באיחור, סיבוכים אלה עלולים להיות מסכני-חיים, ולעיתים בלתי הפיכים. האופי המגוון של PA קשור לתפקיד החשוב של cobalamin, ובהיעדר האחרון עלולים להיגרם מספר תפקודים לקויים החל בהמטו-פויאזה, עבור דרך אנומליות נוירולוגיות, פסיכיאטריות וגינקולוגיות. התפקיד המקדים של הדבקה על ידי Helicobacter pylori כגורם מאתחל אם כי לא מוכח של אוטואימוניות כנגד הקיבה אינו יכול להישלל.
אפידמיולוגיה של PA
PA היא אנמיה מאקרוציטית בגין אי-ספיגה של ויטמין B12 כתוצאה מחסר של IF (Annibale וחב' ב־Curr Gastroenterol Rep משנת 2011). באופן כללי, לוקח בערך 10–12 שנה עד להופעת PA תסמיני, כך ש-PA עלול להופיע במקרי חסר תת-קליני של חסר B12 (Carabotti וחב' ב-Nutrients משנת 2021). במקרים של PA, המנגנון הפתוגני הוא AAG, מפגע המתווך על ידי מערכת החיסון הספציפית לאיברים, בה יש נזק לתאים הפריאטליים בקיבה הכרוכים בהפרשת IF וחומצה הידרוכלורית, ועל ידי משאבת הפרוטונים הקיבתית (Lenti וחב' ב-Nat Rev Dis Primers משנת 2020). מציאותם של נוגדנים anti-parietal המכוונים כנגד משאבת הפרוטונים הקיבתית (gastric H+/K+ ATPase), כמו גם נוגדנים המכוונים כנגד IF (אם כי באחוז קטן יותר), גורמים לרוב לאטרופיה של הקיבה, ולחסר של IF. הגסטריטיס האטרופית היא מחלה כרונית המוגדרת כירידה או חסר של בלוטות הקיבה המקוריות, המוחלפת על ידי מטפלזיה של המעיים או פיברוזיס (Lenti וחב' ב-Aliment Pharmacol Ther משנת 2019). אטרופיה של גוף הקיבה הוא מצב הכרחי אם כל לא מספיק להתחלת התסמינים של PA, כיוון שאטרופיה זו יכולה להתקיים גם ללא PA. לרוב קיים בלבול בין PA לבין חסר של B12, אך למעשה PA נחשב לשלב מאוחר של AAG.
מחקרים אפידמיולוגיים הראו ש-PA משפיע על 0.1% מהאוכלוסייה הכללית ועל 2 עד 3% מבני למעלה מגיל 65 שנה, כאשר היחס בין נשים לגברים הוא בערך 2:1. בארצות הברית השכיחות של PA היא 151 מקרים ל-100,000. PA יכול להשפיע על בני כל הגילים, אך שכיחותו עולה עם הגיל. בשני מחקרים מאיטליה ומטורקיה, הגיל הממוצע של גברים המושפעים על ידי PA היה בערך 49-55 שנה, בהשוואה לגיל 40–61 בנשים (Kocak ו-Paydas ב-Int J Hematol משנת 1992). בדומה, מחקר פרוספקטיבי על סטאטוס קובלמין בקשישים, שכלל 729 איש בני למעלה מ-60 שנה, השכיחות הכללית של אלה בהם לא אובחן PA הייתה בערך 2%, והייתה גבוהה יותר בקרב שחורים (4.3%) לעומת 4.0% בנשים לבנות (Carmel ב-Arch Intern Med משנת 1996). בדומה, גם אם PA משפיע על נשים קשישות עם מוצא אתני צפון אירופי, מחקרים עדכניים הראו שכיחות דומה של PA באלה ממוצאים אתניים אחרים (אפריקנים ואמריקנים), עם הופעת תסמינים פתולוגיים מוקדמים יותר (Carmel ו-Johnson ב-N Engl J Med משנת 1978).
יתרה מכך, PA הכרוך עם מערכת חיסון לקויה, עם רמה נמוכה של אימונוגלובולין בנסיוב, עם חסר סלקטיבי של IgA, או עם PA בילדות, צריכה להיות מובדלת מ-PA קלאסית, הן בגין הופעה מוקדמת של תסמינים כמו גם בגין חסר של אטרופיה בקיבה האופיינית לקודמים. במיוחד, PA בילדות מאופיין על ידי אי-יכולת גנטית להפריש IF או להפריש IF פגום (Toh וחב' ב-N Engl J Med משנת 1997). מנקודת המבט קלינית, העובדה ש-PA לרוב מתפתח ללא תסמינים, מובילה להערכת-חסר של השכיחות האמיתית של אבחון PA וסיבוכיה. מחקר עדכני על תסמיני מערכת העיכול העליונה ב-AAG שכלל 379 מטופלים תסמיניים עם AAG, גילה את הנוכחות של PA ב-53.6% המקרים (Carabotti וחב' ב-Medicine משנת 2017). סקירה סיסטמטית של סיבוכי PA, מצאה שכיחות של 2.4% של מקרי סרטן, ו-0.3 מקרי סרטן קיבה ל-100 שנות-אדם (Vannella וחב' ב-Aliment Pharmacol Ther משנת 2013).
באשר לוויטמין B12 תוך הסתמכות על נתוני המרכז הלאומי של בריאות ותזונה, ובהתחשב בערכי הסף של B12 הנמוכים מ-148, 200 ו-256 פיקומול/ליטר, השכיחות של רמות נמוכות של B12 הוערכה כ-2.9%, 10.6% ו-25.7%, בהתאמה. אלא שסקירה זו לא הייתה מוגבלת ל-PA, אלא לכל הסיבות לחסר של ויטמין B12 (Green וחב' ב-Nat Rev Dis Primers משנת 2012). מחקרים אחרים הראו שגורמים פרוטוטיפיים סוציו-דמוגרפיים תורמים לרמות של B12 בדם של האוכלוסייה. השכיחות של PA נמצאה נמוכה יותר בקרב אפריקנים (אף על פי שיש בהם אחוז גבוה יותר של חסר B12 בגלל צריכת מזון פחותה), וגבוהה יותר בקרב צפון אירופיים (בגלל שכיחות גבוהה יותר של מחלות אוטו-אימוניות (Ankar ו-Kumar ב-StatPearls משנת 2022). באשר ל-atrophic gastritis כרונית, השכיחות העולמית באוכלוסייה הכללית נמצאה כ-29.9% בעקבות בדיקות סרולוגיות, ו-33.4% בעקבות ביופסיות (Lahner וחב' ב-Dig Liver Dis משנת 2019). בדומה, בעוד שבדיקות סרולוגיות מזהות שכיחות של AAG של 8-20%, מחקרים היסטולוגיים מעריכים שכיחות של 0.5-4.5% (Massironi וחב' ב-Autoimmun Rev משנת 2019).
פתוגנזה של PA
ב-PA הרירית האוקסינטית של הקיבה (שהיא שכבת הרקמה הדקה המכסה את פני השטח הפנימיים של גוף (פונדוס) הקיבה) נהרסת עם אובדן התאים הפרייאטליים, מה שגורם לחסר של IF ו-HCl ובכך פוגעים בספיגת ויטמין B12, כמו גם ספיגת ספיגת מיקרו-נוטריאנטים. אופיינית, PA כרוך בנוכחות של אוטו-נוגדנים כנגד IF, וכנגד תאים פרייטאליים, כך שנתמכת הדעה של המקור האוטו-אימוני של המפגע (Lahner ו-Annibale ב־World J Gastroenterol משנת 2009). PA נחשב השלב הסופי של AAG ומאופיין על ידי מחלת נוגדנים עצמיים כנגד התירואיד, סוכרת type 1 ובהקת (vitiligo). תכונה אחרת של AAG היא היעדר Helicobacter pylori בבדיקה היסטולוגית. הנוגדנים העצמיים הם מסוג IgG המכוונים כנגד אתרי הקישור של cobalamin בקיבה או כנגד אתרי הקישור של IF ברירית האפיתל של ה-ileum (Cohn ב-Med Lab Sci משנת 1986). הנוגדנים כנגד תאים פריאטליים הם אימונוגלובולינים מסוג IgG המכוונים כנגד תת-היחידות α ו-β של משאבת הפרוטונים הקיבתית (H⁺/K⁺ ATP-ase) (Toh וחב' ב-Immunol Today משנת 2000, ו-Bunn וחב' N Engl J Med משנת 2014). נוגדנים אלה משתחררים מתאי פלזמה המשופעלים על ידי לימפוציטים T מסוג +CD4 (Toh וחב' ב-Clin Rev Allergy Immunol משנת 2012).
AAG (אטרופיה של גוף הקיבה) ואטרופיה גסטריטית רב-מוקדית של H. pylori (הכרוך באנטרום הקיבתי), נחשבים כשתי ישויות נפרדות, על פי מערכת Sidney (Dixon ב-Histopathol Gastritis משנת 1994). אובחן שהדבקה ארוכת טווח עם H. pylori יכולה להיות מעורבת בפתוגנזה של AAG וההשרייה של אוטו-אימוניות קיבתית (D’Elios וחב' ב-Trends Mol Med משנת 2004, Appelmelk וחב' ב-Immunity Today משנת 1998, ו-Field וחב' ב-Int Rev Immunol משנת 2005). החפיפה בין גסטריטיס אוטואימוני ואטרופי כתוצאה מהדבקה עם H. pylori, מודגשת על ידי הראיות להדבקה זו בשיטות היסטולוגיות, על ידי ELISA וסרולוגיה על ידי immunoblotting, במטופלים עם AAG (Fong וחב' ב-Gastroenterology משנת 1991, Presotto וחב' ב-Helicobacter משנת 2003, ו-Annibale וחב' ב-Helicobacter משנת 2007). בסדרה של מטופלים עם PA, נמצאו 60.5% מתוכם חיוביים ל-H. pyloi, לעומת 50.6% שהיו חיוביים רק לסרולוגיה של IgG אנטי-H. pylori, אך 9.9% נמצאו עם היסטולוגיה חיובית. ב-PA רגישות גנטית לאוטו-אימוניות יכולה אף היא לשחק תפקיד, כמו שנמצא למחלות אוטו-אימוניות אחרות (Ungar וחב' ב-Br Med J משנת 1981). במיוחד, HLA-DRB1*03 ו-HLA-DRB1*04, הידועים למעורבות שלהם בתירואידיטיס אוטו-אימונית ובסוכרת type 1, נמצאו להיות כרוכים משמעותית עם PA, מה שתומך במקור האוטו-אימוני של PA.
כמו כן נמצאו מעורבויות של אללים של HLA, ו-HLA-DRB1*0404 ,HLA-DQA1*0301 ,DQB1*0302 ו-DRB1*0201, שנכרכו עם הנוכחות של נוגדנים עצמיים כנגד תת-יחידה A של משאבת הפרוטונים, ביחד עם מספר וריאנטים של PTPN22 ו-CTLA4, כאשר שני האחרונים כרוכים בתגובה החיסונית (Fernando וחב' ב-PLoS Genet משנת 2008). מחקר genome wide זיהה ארבעה אתרי סכנה ל-PA בתוך או בקרבת גנים המועמדים ליצור מחלות אוטו-אימוניות (AIRE ,HLA ,PTPN2 ו-IL2RA), והציע ש-PNPT1 (Laisk וחב' ב-Nat Commun משנת 2021), שהוא polyribonucleotides nucelotidyltransferase המשתתף ב-RNA transfer המיטוכונדריאלי ואשר באי-תפקוד שלו יש שפעול של מערכת החיסון (Dhir וחב' ב-Nature משנת 2018).
המיצג הקליני של PA
התוצאים ההמטולוגיים והנוירולוגיים של חסר ויטמין B12 דורשים מספר שנים כדי להתפתח. חסר הוויטמין פוגע בהמופויאזה בגלל תפקידו המרכזי בסינתזת DNA. אנמיה מאקרוציטית עם MCV של מעל 100 פמטוליטר, היא הסממן החשוב ביותר של PA, אך סממן זה אינו תמיד חלק מהאבחון, שהרי 30% מהמטופלים עם PA אינם מיוצגים על ידי מאקרוציטוזה ובהם כדוריות הדם האדומות נורמוציטיות. תופעה זו מתרחשת במקרים של חסר ברזל בעת ובעונה אחת, או במקרי מחלות אחרות בהן נגרמת מיקרוציטוזה. בעוד שמטופלים אנמיים מאופיינים על ידי חולשה, ירידה בריכוז מנטלי, כאבי ראש, דפיקות לב, או לעיתים נדירות כאבים בחזה, מטופלים שסובלים ממאקרוציטוזה לא-אנמית יכולים לחוות תסמינים נוירולוגיים (Htut וחב' ב-J Evid Based Med משנת 2021). ממצאים המטולוגיים חשובים אחרים של PA ושל חסר ב-B12 הם פקקת כתוצאה מרמה מוגברת של הומוציסטאין (Ammouri וחב' ב-J Med Case Rep משנת 2017), וכן כשל של מח העצם עם פנציטופניה (Belen וחב' ב-BMJ Case Rep משנת 2014).
נזקים נוירולוגיים נגרמים על ידי דה-מיאלינציה המושרית בגלל חסר של ויטמין B12 (Hemmer וחב' ב-J Neurol Neurosurg Psychiatry משנת 1998, המאופיינת על ידי נגעים בעמודות הפוסטריאליות והלטראליות של עמוד השדרה, מה שמוביל לספסטיות, ול-asthenia (חולשה, תשישות, חוסר אנרגיה), ומה שמוביל לפגיעה בתחושה הויברטורית והפרופריוצבטיבית (חישה עצמית שבניגוד לחושים האחרים שחשים את העולם סביבנו מספקת לנו מידע העוסק בגופנו, וליתר דיוק רצף מידע על התנועה ועל המנח של חלקי הגוף שלנו) ולשיגשון (אטקסיה) (Gwathmey וחב' ב-Muscle Nere משנת 2020). המופע ההתחלתי השכיח ביותר של חסר ויטמין B12 הוא פרסתזיה (נמלול), המופיעה ב-70% מאלה עם תסמינים נוירולוגיים (Healton וחב' ב-Medicine משנת 1991). הנמלול מתחיל באופן אופייני בידיים ובקצות הגפיים הדיסטליות. התבטאויות נוירולוגיות אחרות עלולות לכלול אי-תפקוד אוטונומי של הזיקפה ושלפוחית השתן (Kumar ב-Neurol Clin משנת 2007), נוירופתיה אופטית עד כדי איבוד ראייה (Briani וחב' ב-Nutrients משנת 2013), ומעורבות של מצבי רוח ואיבוד זיכרון עד כדי שיטיון. תסמונות נוירופסיכיאטריות עלולות גם כן להופיע ללא סימנים המטולוגיים, שעלולות להיגרם על ידי יצירת נוירוטרנסמיטור של monoamine והגברה שניונית של הומוציסטאין וחומצה מתיל-מלונית (Obeid וחב' ב-Clin Chem Lab Med משנת 2007). התבטאויות משמעותיות הן הפרעות במצבי רוח כגון דיכאון ומניה, תסמונת עייפות כרונית, ופסיכוזה (Dommisse ב-Med Hypotheses משנת 1991).פסיכוזה יכולה להופיע כחשדות, מחשבות בלתי מאורגנות, והזיות בשמיעה ובראייה (Hutto ב-Psychatry משנת 1997).
פגיעה קוגניטיבית נכרכת אינטנסיבית עם חסר B12, כמו גם פגיעה בזיכרון, מחשבה איטית, חסר תשומת לב, עד שיטיון (van Goor ב-Age Ageing משנת 1995, ו-Stabler ב-Blood משנת 1990). רמות נמוכות של B12 נכרכו עם מחלת אלצהיימר, עם שיטיון וסקולרי, ועם מחלת פרקינסון על פי מחקרים רבים. קשר זה דווח גם ברמות נמוכות או נורמליות של B12 (פחות מ-250 פיקוגרם/ליטר, ותת-קבוצה קטנה של שיטיונות המגיבה לתוספת של B12. תסמינים נוירולוגיים עשויים להיות הפיכים עם טיפול על ידי מתן B12, אם טיפול זה ניתן בהקדם.
לחסר נחושת יש דמיון למיצג קליני/המטולוגי של חסר B12, וצריך לשלול אותו, בעיקר באלה שאינם מגיבים לטיפול על ידי מתן קובלמין (Green ב-Hematol. Am Soc Hematol Educ Program משנת2012, ו-Tan וחב' ב-Can J Neurol Sci משנת 2009). התסמינים השכיחים ביותר נכללים בספקטרום הרחב של דיספפסיה (פֶּרַע עִכּוּל) שהיא המונח הרפואי לקשיי עיכול בחלק העליון של הבטן. התסמינים יכולים לכלול כאב או חוסר נוחות בבטן ב-35% מהמקרים, תחושת שובע ב-10% מהמקרים, בחילה, הקאה, גזים, גיהוקים, ותחושת שריפה ב-7% מהמקרים (Miceli וחב' ב-Clin Gastroenterol Hepatol משנת 2012). תסמינים אלה יכולים להיות כרוכים ישירות עם hypochlorhydria שיכולה בעצמה להשרות פגיעה בהתרוקנות הקיבה (Tosetti וחב' ב-Dig Dis Sci משנת 2000). תסמינים קליניים של PA יכולים לכלול מחלת תירואיד אוטואימונית ב-40% ממטופלים עם AAG (סוכרת type 1, וכן ויטיליגו (Lahner וחב' ב-Am J Med משנת 2008). דווח הקשר עם מחלות אוטו-אימוניות אחרות כגון צליאק (Nenna וחב' ב-J Pediatr Gastroenterol Nutr משנת 2012), היפר-פארא-תירואידיזם (Massironi וחב' ב-Eur J Endocrinol משנת 2013), ראומטואיד ארטריטיס (Chang וחב' ב-J Formos Med Assoc משנת 2006), מיאסטניה גרביס, מחלת מעיים דלקתית (Jevremovic וחב' ב-Am J Surg Pathol משנת 2006), לופוס סיסטמי ומחלת כבד אוטואימונית (Vanderlocht וחב' ב-J Immunol Meth משנת 2017).
היפו-כלורידריה ותפקידו המרכזי בספיגה לקויה של מיקרו-נוטריינטים וב-PA
הבסיס הפתוגנטי של PA כולל את הפגיעה בחלק הפרוקסימלי של הקיבה (פונדוס וקורפוס), בבלוטות האוקסינטיות הכוללות את התאים הפריאטליים המפרישים HCl ויוצרים את ה-IF (Saenz ו-Mills ב-Nat Rev Gastroenterol Hepatol משנת 2018). משאבת הפרטונים (H+, K+ ATPase) מייצרת HCl באופן המבוקר ומושרה על ידי היסטמין, גסטרין, ואצטילכולין (Kopic ו-Geibel ב-Physiol Rev משנת 2013, Engevik וחב' באותו כתב עת משנת 2020, ו-Festen וחב' ב-Scand J Gastroenterol Suppl משנת 1991). ויטמין B12 מגיע בעיקר ממוצרי מזון מחי, כגון בשר, דגים, ביצים, ומוצרי חלב. הכמות היומית הנדרשת של הוויטמין היא 2–3 מיקרוגרם, וחלק גדול ממנה נאגר בכבד, באופן שנדרשים שנים לפני הופעת חסר של קובלמין (Stabler ו-Allen ב-Annu Rev Nutr משנת 2004). חומציות הקיבה ויצירת פפסין, משרים את הפרוטאוליזה של קובלמין מהחלבונים במזון, ובהמשך קובלמין נקשר ל-haptocorrin המיוצר על ידי בלוטות הרוק (Fedosov וחב' ב-Biochemstry משנת 2007). בתריסריון, שינויים ב-pH משרים את השתחררות קובלמין מהפטוקורין, ומהחיבור שלו ל-IF המאפשר ל-B12 להגיע ל-ileum הדיסטלי, מקום בו הקומפלקס B12-IF נספג על ידי אנדוציטוזיס (Nielsen וחב' ב-Nat Rev Gastroenterol Hepatol משנת 2012). בשלב זה, יוצא קובלמין דרך הממברנה הבזו-לטרלית של אנטרוציטים ונקשר לטרנס-קובלמין, שנושא אותו בדם ומעביר אותו לתאים. רוב B12 נאגר בכבד, וכמות קטנה יותר מופרשת במרה, תוך השתתפות בצירקולציה האנטרו-הפטית (Stabler ב-N Engl J Med משנת 2013).
ברזל, גורם שחסר שלו נשכח כגורם ל-PA
ברזל במזון זמין כחלק מ-heme או כברזל שאינו חלק מ-heme (Annibale וחב' ב-Dig Liver Dis משנת 2003). ברזל של heme נמצא בבשר, ומהווה 5-10% מהברזל הדיאטתי בדיאטה המערבית, והוא נספג על ידי תאי הרירית של המעי הדק בהיקשרו לקולטן. ברזל שאינו חלק מ-heme, נמצא בירקות, דגני בוקר, קטניות, ופירות, ומהווה 80% מהברזל הדיאטתי (Conrad וחב ב-Am J Med Sci משנת 1999). צורת ברזל אחרונה זו עוברת טרנספורט דרך הממברנה האפיקלית של אנטרוציטים על ידי divalent metal-ion transporter 1 (להלן DMT1), ועוברת לצירקולציה דרך ferroportin 1 (להלן FPN1) (Anderson ו-Frazer ב-Am J Clin Nutr משנת 2017). ברזל שאינו ממקור heme אינו מסיס ושוקע ב-pH 3, ולצורך ספיגתו יש דרך לחזר אותו לצורת ה-ferrous. במצבים בריאים, יש ל-HCl ולוויטמין C תפקיד חשוב בספיגת הברזל. מחקר הראה שאטרופיה של הקורפוס הקיבתי מופיעה ב-20% מהמטופלים עם אנמיה על רקע חסר ברזל המאובחנת על ידי היסטולוגיה של הקיבה (Dickey וחב' ב-Scand J Gastroenterol משנת 1997). חוקרים אחרים הראו אטרופיה אימונית או לא-אימונית של הקורפוס הקיבתי ב-19.5-26.0 של חסר ברזל המטופלים עם אנמיה על רקע חסר ברזל ללא תסמינים גסטרו-אינטסטינליים (Marignani וחב' ב-Am J Gastroenterol משנת 1999, ו-Annibale ב-AM J Med משנת 2001). נמצא שחסר ברזל ואנמיה על רקע חסר ברזל ב-34% וב-13.1% של אלה עם AAG, בהתאמה (Zilli וחב' ב-Dig Liver Dis משנת 2019). חסר ברזל יכול להקדים את ההתפתחות של PA (Hershko וחב' ב-Blood משנת 2008).
סידן, ויטמין D וחומצה אסקורבית - גורמים נסתרים של PA
ספיגה של סידן מתחילה כתוצאה מ-pH חומצי קיבתי שמביאה להתפרקות מלחי סידן ליצירה של סידן כלורידי מסיס, ולספיגה של סידן במעי הדק הפרוקסימלי (Boyce ב-Nat Med משנת 2009). בהקשר של ספיגת סידן, יש לשקול את תפקיד ויטמין D (Kitai ו-Geibel ב-Adv Exp Med Biol משנת 2017). נמצא שרמות נמוכות של ויטמין D עלולות להיות גורם סיכון להתפתחות מצבים אוטואימוניים (Antico וחב' ב-Clin Rev Allergy Immunol משנת 2012). יתרה מכך, במטופלים עם AAG נמצאה שכיחות גבוהה של hyperparathyroidism שניונית לחסר ויטמין D (Massironi וחב' ב-Clin Sci משנת 1989). מיקרו-נוטריאנט נשכח נוסף ב-PA היא חומצה אסקורבית, שאנו מקבלים במזון, שכן האדם אינו מסוגל לסנתז אותה בגלל חסר של gluconolactone oxidase, הנחוץ לשלב הסופי של סינתזת חומצה זו. ויטמין C הוא מסייע חיוני לספיגה של ברזל, בכך שהוא ממיר ברזל ferric לצורת ה-ferrous המסיס בסביבה הבסיסית של התריסריון (Bothwell וחב' ב-J Intern Med משנת 1989). הדבקה עם H. pylori קשורה לרמות מופחתות של ויטמין C בנול הקיבה ובפלזמה (Annibale וחב' ב-Gut משנת 2003, ו-Ruiz וחב' ב-Am J Gastroenterol משנת 2011).
בדיקות ביוכימיות: הגישה הלא-חודרנית
הממצא העיקרי של PA היא אנמיה מאקרוציטית עם נפח ממוצע של כדוריות אדומות הגבוה מ-100 פמטוליטר, והמוגלובין נמוך מ-12 גרם/ליטר בנשים לא-הרות, ונמוך מ-11 גרם/ליטר בנשים הרות, או נמוך מ-13 גרם/ליטר בגברים (Moore ו-Adil ב-StatPearls משנת 2022). ככל שה-MCV גדול יותר ההפרעה לסינתזת DNA גדולה יותר. חסר של cobalamin מוביל לפגיעה בסינתזה של H4-folate, מה שמגביל את הזמינות של הצורה הנדרשת של folate, לסינתזת DNA (Green ב-Blood משנת 2019). במטופלים עם רמה גבולית של B12 (200-300 פיקוגרם/מ"ל, יש לבצע בדיקות אנזימטיות נוספות. התוצאה השכיחה של חסר קובלמין גורמת למפגעים במטבוליזם של B12, בעיקר בחסר תאי של אחד או שני הצורות של B12, שהן adenosyl-B12 ו-methyl-B12. חסר ב־Methyl-B12, גורם להצטברות של הומוציסטאין ולירידה בסינתזה של מתיונין ושל אדנוזיל-מתיונין. חסר של אדנוזיל-B12 גורם להצטברות של חומצה מתיל-מלונית (להלן MMA). הצטברות של הומוציסטאין ושל MMA גורמים לחסר B12, אך הומוציסטאין יכול להיות מושפע גם על ידי חסר של folate ושל ויטמין B6, על ידי תפקוד התירואיד והכליות, על ידי המגדר והגיל. המדד הספציפי והרגיש ביותר לחסר של ויטמין B12 הוא MMA הנחשב לרוב כ"סטנדרט הזהב" להגדרת הסטאטוסשל B12 (Rasmussen וחב' ב-Clin Chem משנת 1996, ו-Vogiatzoglou ו-Refsum ב-Clin Chem משנת 2009).
ההערכה הביוכימית של מטופלים עם אבחון של PA צריכה לכלול בדיקת מעבדה של נוגדנים עצמיים כנגד הקיבה. נוכחות נוגדנים אלה יכולה להתבצע על ידי אימונו-פלואורסצנציה. הזיהוי של H+/K+ ATPase כאנטיגן יעד מתבצע על ידי ELISA לזיהוי נוגדנים אלה (Chuang וחב' ב-Autoimmunity משנת 1992). מחקר שהתבצע על 516 מבוגרים עם AAG מוכח היסטולוגית, מצא ש-20% מתוכם נמצאו שליליים סרולוגית בעת האבחון ההיסטולוגי של AAG, בעיקר בקשישים יותר (Conti וחב' ב-Dig Liver Dis משנת 2020). יתרה מכך, מחקר אחר הראה שפפסינוגן I, פפסינוגן II, היחס בין פפסינוגן I ל-פפסינוגן II כמו גם גסטרין-17יכולים לאבחן כל סוג של גסטריטיס אטרופי (Korstanjeet וחב' ב-Scand J Gastroenterol משנת 2002). מטה-אנליזה שכללה 4,241 מטופלים עם atrophic gastritis במטרה לאשש את המשמעות האבחונית של בדיקות אלו, הראתה רגישות של 74.7%, וספציפיות של 95.6% (Yoshida וחב' ב-Int J Cancer משנת 2020). נוגדנים עצמיים כנגד IF נחשבים סמנים סרולוגיים של PA, עם ספציפיות גבוהה אך עם רגישות נמוכה, וקיבלו חשיבות מוגברת מאז שמבחן Schilling איבד את הרלוונטיות שלו.
בדיקות מעבדה
רמת ויטמין B12, ספירת דם מלאה (CBC), ספירת רטיקולוציטים לקביעה האם מח העצם מייצר מספיק אריתרוציטים. רמת LDH: רמות גבוהות מאוד של אנזים זה עלולות להצביע על PA. רמת בילירובין בנסיוב. רמות MMA שכן רמות גבוהות שלו מאמתות חסר B12. רמת הומוציסטאין המסמלת אף היא חסר בוויטמין. ביצוע אנדוסקופיה של החלק העליון של מערכת העיכול, לבחינה של סימני דגנרציה או אטרופיה של שכבת הקיבה הפנימית.
הוראות לביצוע הבדיקה
הנבדק אמור לצום 8 שעות לפני נטילת הדם. בפרק הזמן של 12 שעות לפני נטילת הדם, הנבדק אמור להימנע מצריכת מולטי-ויטמינים, או תוספי מזון המכילים ביוטין (ויטמין B7). בפרק הזמן של שבוע לפני נטילת הדם על הנבדק להימנע אם הדבר מתאפשר קלינית מנטילת מעכבי משאבת הפרוטונים (כגון omeprazole ,lansoprazole ,esomeprazole ,dexlansoprazole ,pantoprazole ו-rabeprazole). לפחות שבועיים לפני נטילת הדם הנבדק אינו אמור להיות מטופל על ידי תרופות כגון אופיואידים הפוגעים בתנועת המעיים. את הדם יש לדגום למבחנת ג'ל (פקק אדום), ולאחר הסרכוז יש להעביר את הנסיוב למבחנת פלסטיק, ולשלוח לאחר הקפאה למעבדה. יציבות הדגימה: כדגימה קפואה (מועדפת) - 30 יום, וכדגימה מקוררת - 24 שעות. יש לפסול את הדגימה אם היא מאוד המוליטית, או מאוד איקטרית. אין לפסול דגימה מאוד ליפמית. שיטת הבדיקה: Immunoenzymatic Assay.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק