הבדלים בין גרסאות בדף "אסטמה אאוזינופילית חריפה, טיפולים ביולוגים חדשים - Acute eosinophilic asthma, new biological therapy - 2017"
| שורה 44: | שורה 44: | ||
*'''Benralizumab''' - נוגדן חד שבטי (IgG1k) הניתן בהזרקה תת-עורית כל 8 שבועות והוא צפוי לאישור FDA במהלך 2017. פעילותו עוברת דרך קשירה לשני סוגי קולטנים: הראשון, בתת-יחידה α בקולטן ל־IL-5 המתבטא ע״ג אאוזינופילים ובאזופילים אנושיים. היקשרות גורמת לבלימת ייצור האאוזינופילים ומנטרלת פעילותם. השני מצוי באזור ה- Fc. הוא נקשר באפיניות גבוהה לקולטנים המצויים בעיקר ע״ג תאי הרג טבעי NK {{כ}}(Natural Killer ). היקשרות מביאה להיצמדות האאוזינופילים לתאי NK, ואפופטוזיס של האאוזינופילים בתהליך ־Antibody dependent cell cytotoxicity {{כ}} ADCC {{כ}}{{הערה|שם=הערה17|Kolbeck R, et al. J Allergy Clin Immunol. 2010;125(1):1344-53}}. | *'''Benralizumab''' - נוגדן חד שבטי (IgG1k) הניתן בהזרקה תת-עורית כל 8 שבועות והוא צפוי לאישור FDA במהלך 2017. פעילותו עוברת דרך קשירה לשני סוגי קולטנים: הראשון, בתת-יחידה α בקולטן ל־IL-5 המתבטא ע״ג אאוזינופילים ובאזופילים אנושיים. היקשרות גורמת לבלימת ייצור האאוזינופילים ומנטרלת פעילותם. השני מצוי באזור ה- Fc. הוא נקשר באפיניות גבוהה לקולטנים המצויים בעיקר ע״ג תאי הרג טבעי NK {{כ}}(Natural Killer ). היקשרות מביאה להיצמדות האאוזינופילים לתאי NK, ואפופטוזיס של האאוזינופילים בתהליך ־Antibody dependent cell cytotoxicity {{כ}} ADCC {{כ}}{{הערה|שם=הערה17|Kolbeck R, et al. J Allergy Clin Immunol. 2010;125(1):1344-53}}. | ||
| − | :Benralizumab ניתן במינון של 30 מ״ג במתן תת-עורי והוא נבחן בתדירות בשני מחקרי רישום דומים (SIROCCO ו-CALIMA){{הערה|שם=הערה18|Bleeker ER et al. Lancet. 2016 Oct 29;388(10056):2115-2127}}, {{הערה|שם=הערה19|FitzGerald JM et al. Lancet. 2016; 388:2128-2141}}: תדירות של פעם ב־4 שבועות למשך 48־56 שבועות ותדירות של פעם ב־8 שבועות (עם שלוש ההזרקות הראשונות בכל 4 שבועות) למשך 48־56 שבועות, בתוספת הטיפול הסטנדרטי. | + | :Benralizumab ניתן במינון של 30 מ״ג במתן תת-עורי והוא נבחן בתדירות שונה בשני מחקרי רישום דומים (SIROCCO ו-CALIMA){{הערה|שם=הערה18|Bleeker ER et al. Lancet. 2016 Oct 29;388(10056):2115-2127}}, {{הערה|שם=הערה19|FitzGerald JM et al. Lancet. 2016; 388:2128-2141}}: תדירות של פעם ב־4 שבועות למשך 48־56 שבועות ותדירות של פעם ב־8 שבועות (עם שלוש ההזרקות הראשונות בכל 4 שבועות) למשך 48־56 שבועות, בתוספת הטיפול הסטנדרטי. |
| + | :במחקר SIROCCO{{כ}}{{הערה|שם=הערה18}} נבדקו 1,205 חולים. המחקר הראה ירידת משמעותית בשיעור ההחרפות השנתי (45% בקבוצת ה־ Benralizumab בתדירות של 4 שבועות ו־51% בקבוצת מתן Benralizumab בתדירות של 8 שבועות). התוצאות הטובות ביותר היו אצל מטופלים עם רמת אאוזינופילים גבוהה מ-μl/{{כ}}300. כמו כן, זמן להחמרה הראשונה היה ארוך יותר בשתי תדירויות בהשוואה לפלצבו והסיכוי להחמרה ירד ב־37% בקבוצת טיפול כל 4 שבועות וב־40% בקבוצת טיפול כל 8 שבועות. המחקר גם הראה שיפור ב-FEV1 של 159 מ״ל בקבוצת המטופלים שקיבלו Benralizumab כל 8 שבועות (0.0006=p) וב־106 מ״ל בקבוצת המטופלים שקיבלו Benralizumab כל 4 שבועות. תסמיני האסתמה השתפרו רק בקבוצת מתן ה-Benralizumab כל 8 שבועות. | ||
| + | :סיכום הממצאים משני המחקרים מראה שמתן Benralizumab בתדירות של 8 שבועות יעיל יותר מתדירות של 4 שבועות. לא נרשם שיעור תופעות לוואי שונה בקבוצת Benralizumab בהשוואה לפלצבו. | ||
| + | :מחקר ZONDA{{כ}}{{הערה|שם=הערה20|Nair et al. NEJM. 2017 ;376(25):2448-2458}} בחן אפשרות צמצום ocs אצל מטופלים עם SEA ושימוש כרוני ב-ocs. התוצאות הראו הורדה של 75% במינון ה-ocs בהשוואה לפלצבו שבו התאפשרה ירידה של 25% בלבד (0.001>P). הסיכוי לצמצום מינון ocsvi היה גדול פי 4.1. בקבוצות ה-Benralizumab בהשוואה לפלצבו. על אף הירידה במינוני ה-ocs, היה צמצום בשיעור החרפות השנתי ב־70% בהשוואה לפלצבו בתדירות של 8 שבועות (0.54 ,marginal rate 0.001>vs 1.83, P). שיעור הביקורים במיון ירד ב־93% בהשוואה לפלצבו במתן התרופה בתדירות כל 8 שבועות. תדירות תופעות הלוואי היו דומות בקבוצות Benralizumab והפלצבו. | ||
| − | '''טבלה 1. טיפולים ביולוניים הבולמים את | + | '''טבלה 1. טיפולים ביולוניים הבולמים את הציטוקין 5-IL הקשור בשנשונ ובשפעול האאוזינופילים (Mepolizumab ו- Reslizumab) וטיפול המכוון ישירות ננד אאוזינופילים (Benralizumab)''' |
| − | Benralizumab | + | {| class="wikitable" |
| − | + | |- | |
| − | anti IL- | + | ! {{רווח קשיח}} !!Mepolizumab!!Reslizumab!!Benralizumab |
| − | + | |- | |
| − | 8 שבועות (4 שבועות ב־3 ההזרקות הראשונות) | + | | שם מסחרי ויצרן || Nucala GSK || Cinqair Teva || Asrtazeneca |
| − | 18 ומעלה 18 ומעלה | + | |- |
| + | | מנגנון פעילות || anti IL-5 || anti IL-5 || anti IL-5Rα | ||
| + | |- | ||
| + | | מינונים ואופן הזרקה || 100 מ״ג תת-עורי (SC)|| 3 מ״ג לק״ג IV בעירוי למשך 20–50 דקות ||30 מ״ג תת-עורי (SC) | ||
| + | |- | ||
| + | |תדירות הזרקה||4 שבועות||4 שבועות||8 שבועות (4 שבועות ב־3 ההזרקות הראשונות) | ||
| + | |- | ||
| + | |גיל ||12 ומעלה||18 ומעלה||18 ומעלה | ||
| + | |} | ||
| − | + | לסיכום, הטיפולים באסתמה חמורה ממשיכים להשתפר. זיהוי מנגנונים ייחודיים לאסתמה ופיתוח תרופות ביולוגיות המותאמות לאטיולוגיה הדלקתית מגבירים את היכולת לתת מענה לחולים עם אסתמה חמורה שהיו נעדרי טיפול הולם. הטיפול ב-SEA כולל עתה טיפולים ביולוגיים הבולמים את הציטוקין 5־IL הקשור בשגשוג ובשפעול האאוזינופילים (Mepolizumab ו- Reslizumab) וטיפול המכוון ישירות נגד אאוזינופילים (Benralizumab). חולים הסובלים מאסתמה אאוזינופילית קשה שאינה בשליטה צפויים לשיפור באיכות החיים ולהפחתה בביקורים התכופים במיון ובמרפאות קהילה, שהיו מנת חלקם. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | לסיכום, הטיפולים באסתמה חמורה ממשיכים להשתפר. זיהוי מנגנונים ייחודיים לאסתמה ופיתוח תרופות ביולוגיות המותאמות לאטיולוגיה הדלקתית מגבירים את היכולת לתת מענה לחולים עם אסתמה חמורה שהיו נעדרי טיפול הולם. הטיפול | ||
| − | ( | ||
| − | |||
| − | |||
| − | |||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
גרסה מ־08:42, 7 במרץ 2018
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| אסטמה אאוזינופילית חריפה, טיפולים ביולוגים חדשים (2017) | ||
|---|---|---|
| Acute eosinophilic asthma, new biological therapy (2017) | ||

| ||
משאף טיפוסי
| ||
| שמות נוספים | נלחמים באאוזינופילים - טיפולים ביולוגיים חדשים באסתמה אאוזינופילית חמורה | |
| ICD-10 | Chapter J 45. | |
| ICD-9 | 493 | |
| MeSH | D001249 | |
| יוצר הערך | ד״ר דניאל בן דיין | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אסטמה
אסתמה היא מחלה דלקתית כרונית של דרכי האוויר אשר מתפתחת עקב גורמים גנטיים וסביבתיים. היא מאופיינת באפיזודות חוזרות של תסמיני נשימה (כגון צפצופים, שיעול, קוצר נשימה ולחץ בחזה) אשר משתנות בתדירות ובעוצמה לאורך זמן וכן היא מאופיינת במגבלה משתנה בזרימת אוויר בנשיפה.
לאסתמה מספר סיווגים על סמך שליטה בסימפטומים ונוכחות או היעדר של דלקת אאוזינופילית בדרכי אוויר. לאסתמה חמורה, אין מענה טיפולי מיטבי ולכן יש לה השלכות אישיות, חברתיות וכלכליות קשות[1]. בסקירה זו מוצג הידע החדש בנושא אסתמה אאוזינופילית חמורה (Severe Eosiniphilic Asthma ־ SEA) ואפשרויות טיפוליות על ידי בולמי 5-IL (5־interleukin): Benralizumab ,Reslizumab ,Mepolizumab.
הגדרת אסתמה אאוזינופילית חמורה - SEA
אסתמה מוגדרת כמחלה חמורה כאשר נדרש טיפול הן של סטרואידים בשאיפה (inhaled corticosteroids ־ ICS) או סיסטמיים (oral Corticosteroids ־ OCS) והן של מרחבי סמפונות בטווח פעולה ארוך על מנת להשיג שליטה במחלה, או כאשר טיפול זה ניתן ועדיין אין שליטה על המחלה[2]. חלק קטן מן החולים עם אסתמה חמורה לא מגיעים לשליטה במחלה למרות אמצעים סטנדרטיים. לפני אבחנה סופית של אסתמה חמורה, ראוי לבדוק האם יש גורמים אשר ניתן לשנות ולשפר כגון: אי התמדה בטיפול, טכניקת לא נכונה בשימוש המשאפים, חשיפה לאלרגנים או מיצוי לא מקסימלי של הטיפול הסטנדרטי[2][3],
על פי ההערכות, 5%־10% מתוך חולי האסתמה סובלים מאסתמה חמורה[1]. מתוכם, שיעור החולים שמחלתם איננה בשליטה הוא: 9%־36% בארה״ב, 33% בצרפת ו־55% בספרד. בישראל נספרו, על פי מרשמים שמבוטחים קיבלו, שיעור של 5.68% חולים עם אסתמה, 4.65% מתוכם סובלים מאסתמה חמורה, 2/3 עם מחלה נשלטת ו־1/3 עם מחלה לא נשלטת[4]. אסתמה חמורה איננה מחלה אחידה. זיהוי של כל פנוטיפ על ידי סמנים ביולוגיים שונים (כגון אאוזינופילים) יתרום רבות בהתאמת הטיפול היעיל ביותר לכל מטופל[3].
פתוגנזה של אסתמה אאוזינופילית חמורה
מנגנון פעילות האאוזינופילים בתהליך פתוגני של אסתמה חמורה זכה להתעניינות רבה. אאוזינופילים הם תאים גרנולוציטים הנוצרים במח העצם, אשר עוברים לאיברים שונים דרך מחזור הדם. הם משחררים מתווכי דלקת לדרכי האוויר וגורמים לנזק של תאי האפיתל, לרגישות יתר בדרכי האוויר ולשינוי מבני (remodeling) בדרכי האוויר[5]. שחרור אאוזינופילים ממח עצם תלוי בעיקר בהפעלת הציטוקין 5־IL אשר קושר אותם בקולטן שלו (5 receptor־5R :IL־IL) וגורם לשגשוגם ולשפעולם. קולטן זה הוא נפוץ והחשוב ביותר לאאוזינופילים ובהיעדר 5־IL, האאוזינופילים יעברו אפופטוזיס מהיר[6], [7]. 5־IL הוא ציטוקין אשר מופרש על ידי תאי T helper 2) Th2) או 2־Type 2 Innate Lymphoid Cells) ILC) ומוביל להתפתחות של אאוזינופילים בתוך מח עצם, לפעולתם ולשגשוגם בדם וברקמות[7], [8].
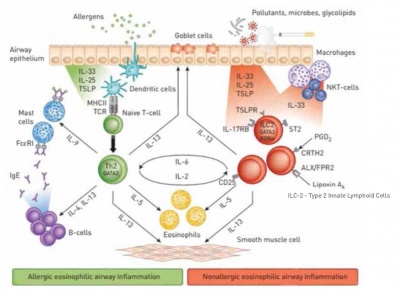
דלקת אאוזינופילית של דרכי האוויר יכולה להיות קשורה הן לאסתמה אלרגית והן לאסתמה שאינה אלרגית. באסתמה אלרגית עם דלקת אאוזינופילית, האלרגנים הם שמובילים לשיעתוק ציטוקינים ולביטוי מוגבר של קולטנים כימוקינים בתאי Th2. לעומת זאת, באסתמה אאוזינופילית שאינה אלרגית, מזהמים, חיידקים או גליקוליפידים מובילים אמנם לביטויים דומים לאלה של אסתמה אלרגית, אך ביטויים אלה מופיעים בתאי 2־ILC (תמונה 1).
אסתמה עם אאוזינופילים מוגדרת כאשר יש עליה בכמות תאי אאוזינופילים בכיח (1%־3%), אבל ספירת התאים בכיח היא בדיקה לא שגרתית הדורשת מיומנות וציוד מיוחד. לכן, הבדיקה החלופית היא ספירת תאי האאוזינופילים בדם הפריפרי. זו בדיקה קלה ושגרתית, זמינה אך לא ספציפית לאסתמה אאוזינופילית. SEA מוגדרת כאשר יש 300־400 תאים אאוזינופילים למיקרוליטר בדם הפריפרי אצל מטופל עם עדות קלינית ותפקודית של אסתמה חמורה[9].
התרופות הביולוגיות החדשות לטיפול ב-SEA
- Mepolizumab - הנוגדן האנושי החד שבטי (k־Ig1) הראשון שאושר על ידי ה- FDA לטיפול ב-SEA בתוספת טיפול סטנדרטי. Mepolizumab הוא בולם 5־IL הניתן בהזרקה תת-עורית (sc) במינון של 100 מ״ג או במינון 75 מ״ג במתן IV כל 4 שבועות. הוא נקשר בספציפיות גבוהה ל־5־IL אנושי. ההיקשרות מונעת איתות ומביאה לירידה בייצור האאוזינופילים ומנטרלת את פעילותם ואת הישרדותם[10].
- 3 מחקרים מרכזיים, כפולים אקראיים מבוקרים פלצבו (DREAM, MENSA, SIRIUS) בחנו את יעילות Mepolizimab אצל חולי SEA[11], [12], [13].
- במחקר I MENSA־DREAM, מינון של 100 מ״ג sc כל 4 שבועות במשך כ־8 חודשים הביא לירידה משמעותית בתדירות החרפות בהשוואה לקבוצת פלצבו (הפחתה של 53%, 0.001>P), לשיפור בתפקודי הריאות (FEV1 עלה ב־98 מ״ל, 0.03 =P) ובאיכות החיים (0.001>P). נכללו מטופלים עם רמת אאוזינופילים בדם מעל μl/150, אבל ניתוח הנתונים הראה שתוצאות הטובות ביותר מופיעות אצל מטופלים עם אאוזינופילים מעל μl/300 בדם פריפרי [11], [12].
- מחקר אחר (SIRIUS) בחן את יעילות Mepolizumab בצמצום צריכת OCS אצל מטופלים שנזקקו לטיפול כרוני ב-ocs. תוצאות המחקר הראה סיכוי גדול פי 2.39 לצמצום צריכת ocs בקבוצת ה-Mepolizumab בהשוואה לקבוצת הפלצבו (4.56־1.25 95%: CI 0.008 P ;), וירידה החציונית במינון OCS של-50% בקבוצת ה-Mepolizumab לעומת קבוצת הפלצבו (0.007=P). חרף צמצום מינוני הסטרואידים, הושגה גם ירידה של 32% בשיעור החרפות השנתי בקבוצת ה-Mepolizumab בהשוואה לפלצבו (0.04 = P vs. 2.12 1.44 )[13].
- Reslizumab - נוגדן אנושי חד שבטי בולם 5־IL, שהיה השני שאושר על ידי ה-FDA לטיפול ב-Reslizumab .SEA נקשר לאזור המקביל לחומצות אמינו 92־89 ע״ג 5־IL ובולם את השפעתו. הוא אושר במינון של 3 מ״ג לק״ג IV בעירוי למשך 50־20 דקות בכל 4 שבועות.
- שני מחקרי רישום דומים ומקבילים בחנו את יעילות Reslizumab בחולים עם SEA שאינה בשליטה [14], [15]. למשתתפים במחקר הייתה לפחות ספירת דם אחת עם מספר אאוזינופילים מעל μl400 והם השתמשו ב-ICS במינון בינוני/גבוה עם או בלי אמצעי שליטה נוסף. בשני המחקרים, הסיכוי להחרפות הצטמצם בצורה משמעותית בקבוצה ה-Reslizumab לעומת הפלצבו: 50% במחקר הראשון (0-37-0-67 RR:0-50 95% CI) ו־59% במחקר השני (0-28-0-59, 0-41). בשניהם ירידה משמעותית ־ 0.0001>P. בקרב חולים בקבוצת ה-Reslizumab נצפתה ירידה מובהקת בשיעור החרפות השנתי בהשוואה לפלצבו (0.84 מול 1.81 0.001>P), שיפור בתפקודי ריאות (עלייה של 160 מ״ל ב-FEV1) ובמדדי איכות החיים (I ACQ־AQOL). כיוון ש־0.3% מהחולים פיתחו תגובה אנאפילקטית, הוציא ה-FDA אזהרה והנחיה לפקח על החולים במסגרת רפואית אחרי עירוי Reslizumab[16]. לא היו תופעות לוואי אחרות.
- Benralizumab - נוגדן חד שבטי (IgG1k) הניתן בהזרקה תת-עורית כל 8 שבועות והוא צפוי לאישור FDA במהלך 2017. פעילותו עוברת דרך קשירה לשני סוגי קולטנים: הראשון, בתת-יחידה α בקולטן ל־IL-5 המתבטא ע״ג אאוזינופילים ובאזופילים אנושיים. היקשרות גורמת לבלימת ייצור האאוזינופילים ומנטרלת פעילותם. השני מצוי באזור ה- Fc. הוא נקשר באפיניות גבוהה לקולטנים המצויים בעיקר ע״ג תאי הרג טבעי NK (Natural Killer ). היקשרות מביאה להיצמדות האאוזינופילים לתאי NK, ואפופטוזיס של האאוזינופילים בתהליך ־Antibody dependent cell cytotoxicity ADCC [17].
- Benralizumab ניתן במינון של 30 מ״ג במתן תת-עורי והוא נבחן בתדירות שונה בשני מחקרי רישום דומים (SIROCCO ו-CALIMA)[18], [19]: תדירות של פעם ב־4 שבועות למשך 48־56 שבועות ותדירות של פעם ב־8 שבועות (עם שלוש ההזרקות הראשונות בכל 4 שבועות) למשך 48־56 שבועות, בתוספת הטיפול הסטנדרטי.
- במחקר SIROCCO[18] נבדקו 1,205 חולים. המחקר הראה ירידת משמעותית בשיעור ההחרפות השנתי (45% בקבוצת ה־ Benralizumab בתדירות של 4 שבועות ו־51% בקבוצת מתן Benralizumab בתדירות של 8 שבועות). התוצאות הטובות ביותר היו אצל מטופלים עם רמת אאוזינופילים גבוהה מ-μl/300. כמו כן, זמן להחמרה הראשונה היה ארוך יותר בשתי תדירויות בהשוואה לפלצבו והסיכוי להחמרה ירד ב־37% בקבוצת טיפול כל 4 שבועות וב־40% בקבוצת טיפול כל 8 שבועות. המחקר גם הראה שיפור ב-FEV1 של 159 מ״ל בקבוצת המטופלים שקיבלו Benralizumab כל 8 שבועות (0.0006=p) וב־106 מ״ל בקבוצת המטופלים שקיבלו Benralizumab כל 4 שבועות. תסמיני האסתמה השתפרו רק בקבוצת מתן ה-Benralizumab כל 8 שבועות.
- סיכום הממצאים משני המחקרים מראה שמתן Benralizumab בתדירות של 8 שבועות יעיל יותר מתדירות של 4 שבועות. לא נרשם שיעור תופעות לוואי שונה בקבוצת Benralizumab בהשוואה לפלצבו.
- מחקר ZONDA[20] בחן אפשרות צמצום ocs אצל מטופלים עם SEA ושימוש כרוני ב-ocs. התוצאות הראו הורדה של 75% במינון ה-ocs בהשוואה לפלצבו שבו התאפשרה ירידה של 25% בלבד (0.001>P). הסיכוי לצמצום מינון ocsvi היה גדול פי 4.1. בקבוצות ה-Benralizumab בהשוואה לפלצבו. על אף הירידה במינוני ה-ocs, היה צמצום בשיעור החרפות השנתי ב־70% בהשוואה לפלצבו בתדירות של 8 שבועות (0.54 ,marginal rate 0.001>vs 1.83, P). שיעור הביקורים במיון ירד ב־93% בהשוואה לפלצבו במתן התרופה בתדירות כל 8 שבועות. תדירות תופעות הלוואי היו דומות בקבוצות Benralizumab והפלצבו.
טבלה 1. טיפולים ביולוניים הבולמים את הציטוקין 5-IL הקשור בשנשונ ובשפעול האאוזינופילים (Mepolizumab ו- Reslizumab) וטיפול המכוון ישירות ננד אאוזינופילים (Benralizumab)
| Mepolizumab | Reslizumab | Benralizumab | |
|---|---|---|---|
| שם מסחרי ויצרן | Nucala GSK | Cinqair Teva | Asrtazeneca |
| מנגנון פעילות | anti IL-5 | anti IL-5 | anti IL-5Rα |
| מינונים ואופן הזרקה | 100 מ״ג תת-עורי (SC) | 3 מ״ג לק״ג IV בעירוי למשך 20–50 דקות | 30 מ״ג תת-עורי (SC) |
| תדירות הזרקה | 4 שבועות | 4 שבועות | 8 שבועות (4 שבועות ב־3 ההזרקות הראשונות) |
| גיל | 12 ומעלה | 18 ומעלה | 18 ומעלה |
לסיכום, הטיפולים באסתמה חמורה ממשיכים להשתפר. זיהוי מנגנונים ייחודיים לאסתמה ופיתוח תרופות ביולוגיות המותאמות לאטיולוגיה הדלקתית מגבירים את היכולת לתת מענה לחולים עם אסתמה חמורה שהיו נעדרי טיפול הולם. הטיפול ב-SEA כולל עתה טיפולים ביולוגיים הבולמים את הציטוקין 5־IL הקשור בשגשוג ובשפעול האאוזינופילים (Mepolizumab ו- Reslizumab) וטיפול המכוון ישירות נגד אאוזינופילים (Benralizumab). חולים הסובלים מאסתמה אאוזינופילית קשה שאינה בשליטה צפויים לשיפור באיכות החיים ולהפחתה בביקורים התכופים במיון ובמרפאות קהילה, שהיו מנת חלקם.
ביבליוגרפיה
- ↑ 1.0 1.1 Chung, K. F et. al. "International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma." Eur. Respir. J 2014 ;43(2): 343-373.
- ↑ 2.0 2.1 GINA. (2016). "Global Strategy for Asthma Management and Prevention 2016." www.ginasthma.org ;
- ↑ 3.0 3.1 Gauthier, M, et al Am J Respir Crit Care Med 2015;192 (6): 660-668.
- ↑ Versano S et al. Respir Med 2017:131-139
- ↑ Patterson, M. et al .J Asthma Allergy 2015; 8: 125-134 :
- ↑ Chung KF. Expert Rev Respir Med. 2017;11(5):395^02
- ↑ 7.0 7.1 Kouro T, Takatsu K.Intern Immunolgy 2009 :1303-9
- ↑ Lambrecht BN, Hammad H. Nat Immunol. 2015;16(1):45- 56.
- ↑ Fowler S et al J All Clin Immunol 2015 822-824
- ↑ Hannah H et al: a US perspective Journal of Asthma and Allergy 2014:7 53-65
- ↑ 11.0 11.1 Pavord ID et al Lancet 2012 ;380, 9842:651-9
- ↑ 12.0 12.1 Ortega HG et al. NEJM 2014 371:1198-1207
- ↑ 13.0 13.1 Bel E, et al. NEJM 2014; 371: 1189-97.
- ↑ Bjermer L et al. Chest 2016;150:789-798,
- ↑ Castro M et al. Lancet Respir Med. 2014 (11):879-890.
- ↑ Masselli DJ et al. Journal of Asthma and Allergy 2016:9 155-162
- ↑ Kolbeck R, et al. J Allergy Clin Immunol. 2010;125(1):1344-53
- ↑ 18.0 18.1 Bleeker ER et al. Lancet. 2016 Oct 29;388(10056):2115-2127
- ↑ FitzGerald JM et al. Lancet. 2016; 388:2128-2141
- ↑ Nair et al. NEJM. 2017 ;376(25):2448-2458
המידע שבדף זה נכתב על ידי ד״ר דניאל בן דיין, מנהלת מחלקת ריאות, מנהלת המרכז הארצי לשחפת, מומחית לרפואה פנימית וריאות מבוגרים, בית החולים שמואל הרופא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק