תת-פריון הגבר - Male subfertility
הופניתם מהדף בדיקת זרע לדף הנוכחי.
| אי פריון גברי | ||
|---|---|---|
| Male Infertility | ||
| ICD-10 | Chapter N 46. | |
| ICD-9 | 606 | |
| MeSH | D007248 | |
| יוצר הערך | ד"ר שי שפי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – תת-פריון הגבר
שיעור משמעותי של כ-15% מהזוגות המנסים להרות לא יצליחו בהשגת היריון ספונטני.[1] מתוכם, כ-50% לא יצליחו בכך עקב גורם גברי (Male factor infertility) כסיבה יחידה או כסיבה משותפת עם גורם נשי (Female factor infertility).
אפידמיולוגיה
שיעור משמעותי של כ-15% מהזוגות המנסים להרות לא יצליחו בהשגת היריון ספונטני.[1] מתוכם, כ-50% לא יצליחו בכך עקב גורם גברי (Male factor infertility) כסיבה יחידה או כסיבה משותפת עם גורם נשי (Female factor infertility).
במעקב אחרי האוכלוסיה הכללית, נמצא כי שיעור ההצלחה בהשגת היריון הוא כ-25% בחודש, 75% בחצי שנה וכ-90% בשנה.[2] מסיבות אלו, ההמלצה של הגורמים העוסקים ברפואת פריון היא להתחיל בבירור מקביל של שני בני הזוג, לאחר שנה של חוסר הצלחה בהשגת היריון. אולם, בעשורים האחרונים אנו עדים להשפעות שונות של אורח החיים המערבי על הפריון, כגון הרצון למימוש עצמי ולביסוס הקריירה לפני הקמתו והרחבתו של התא המשפחתי, וכתוצאה עליה בגיל הנישואים ובגיל האישה בלידת הצאצא הראשון.[3] בעוד שעובדה זו בעלת משמעות שולית בדרך כלל לגבי פריון הגבר, הרי שהיא עלולה להיות משמעותית מבחינת פריון האשה. בנוסף, לעתים מגיע הגבר לרופא עם ממצא ידוע בעל פוטנציאל לפגיעה בפוריותו. כתוצאה מכך, לא אחת מתחיל הבירור האנדרולוגי לפני חלוף שנה.
אטיולוגיה
קיימות שתי שיטות עיקריות לתיאור האבחנה המבדלת בתת-פריון הגבר -
- השיטה הראשונה מבוססת על המדורים האנטומיים השונים הגורמים לתת-פריון הגבר, ובדומה, למשל, לחלוקה המוכרת של כשל כלייתי, מחלקת את האבחנות לפי מיקום הפתולוגיה:
- טרום אשכי (Pre-testicular) – מצבים המשפיעים בעקיפין על ייצור הזרע (Spermatogenesis) או על תפקודו ללא פגיעה ראשונית באשך: הפרעות גנטיות, הורמונליות ומטבוליות, מערכת העצבים המרכזית, תרופות, גונדוטוקסינים. לדוגמא: תסמונת קלמן, הפרעות בסינתזת אנדרוגנים, הפרעות במבנה הציליה כ-Primary ciliary dyskinesia) PCD), סוכרת, תת-פעילות בלוטת התריס (היפותירואידיזם), אנמיה חרמשית, המוכרומטוזיס, אדנומה של בלוטת יותרת-המוח, סטרואידים (כטיפול רפואי או לבניית גוף), סמים
- אשכי (Testicular) – מצבים המשפיעים ישירות על ייצור הזרע ו/או על הזרע באשך: כישלון ראשוני אידיופטי, תסמונת קליינפלטר, מוטציות בקולטן לאנדרוגן, גידולי אשך, כימותרפיה, קרינה, דלקות וזיהומים, אשך טמיר, תסביב אשכים (Testicular torsion), חבלה, נוגדנים לזרע
- בתר אשכי (Post-testicular) – מצבים חסימתיים או אחרים, בהם הפגיעה ממוקמת אנטומית דיסטלית לאשך ו/או על ציר הזמן לאחר השלמת תהליך ייצור הזרע באופן תקין (לעתים תיוצר פגיעה משנית בתהליך זה): העדר צינור זרע (Vas deferens) בגלל מוטציה בגן Cystic fibrosis transmembrane conductance regulator) CFTR) או כמלפורמציה אורוגניטלית, חסימות דלקתיות או מולדות ביותרת האשך (אפידידימיס), מצב לאחר ניתוח כריתת צינור הזרע (Vasectomy), חסימת צינוריות הזרע באזור הוורום (EDO), שפיכה אחורית (טרשת נפוצה, סוכרת, פגיעה סימפתטית יאטרוגנית, ניתוחי צוואר השלפוחית כדוגמת ((Transurethral resection of the prostate (TURP), פגיעות עמוד שדרה), הפרעות בתפקוד המיני.
- השנייה מבוססת על קבוצות של אבחנות בעלות מכנה משותף מבחינת ההסתמנות הקלינית (לרוב על פי ההפרעה העיקרית בבדיקת הזרע), ובדרך כלל גם מבחינת הגישה הטיפולית (Therapy Directed Diagnostic Groups). מכיוון שסקירה זו עוסקת גם בטיפול בתת-פריון הגבר , ייעשה שימוש בשיטה זו בתיאור הטיפול.
קיימת קבוצה לא קטנה, המהווה לפחות 25% מסך המקרים, שגם בתום בירור עם הכלים המתקדמים ביותר העומדים לרשותנו, יישארו ללא אבחנה ברורה ויסווגו כתת-פריון הגבר אידיופטי/ שאינו מוסבר (Idiopathic / Unexplained male infertility). חלק ממקרים אלה יכללו בירור תקין לחלוטין (כולל בדיקת הזרע), דבר המלמד על חלקיות הבנתנו המדעית בנושא. אטיולוגיות שונות של תת-פריון הגבר מובאות בטבלה 1.
טבלה 1: תת-פריון הגבר לפי אבחנות
| שפיכה 1.7% | וריקוצלה 42% |
|---|---|
| כשל אשכים 1.3% | בלתי מוסבר 23% |
| תרופה/קרינה 1.3% | חסימה 14% |
| זיהום 1% | תקין 8% |
| ED 0.3% | אשכים טמירים 3% |
| מחלה מערכתית 0.3% | אימונולוגי 3% |
| אנדוקריני 1.7% |
מקור:
קליניקה
אבחנה
בסקירה זו יובאו עקרונות הגישה הסדורה לבירור תת-פריון הגבר, כפי שבאה לידי ביטוי בספרות האנדרולוגית, בבחינת רפואה מבוססת ראיות (Evidence-Based Medicine). בדומה לשטחים אחרים ברפואה, לא נדיר להגיע לאבחנה כבר לאחר קבלת אנמנזה מסודרת וביצוע בדיקה גופנית מכוונת, ולהשתמש בבדיקות מודרניות ומורכבות הקיימות גם באנדרולוגיה באופן מושכל.
היסטוריה רפואית
לאחר קבלת גילאי בני הזוג, חשוב לברר את פרק הזמן בו מקיימים בני הזוג מגע מיני לא מוגן במטרה להרות. ככל שזמן זה ארוך יותר, גובר הסיכוי להמצאות בעיה משמעותית. היריון ולידה קודמים מעידים באופן ישיר על פוטנציאל פריון (באותה נקודת זמן), ומהווים, בהקשר זה, מדד טוב יותר מבדיקת זרע. חשוב להבין כי ייצור הזרע הנו תהליך ארוך ומורכב ביותר, וכל מצב או מחלה הפוגעים במצב הבריאות הכללי עלולים לפגוע בו גם כן. יש לשלול גם הפרעות בתפקוד המיני כגון בעיות בזקפה או הפרעות שפיכה. תדירות המשגל המומלצת היא פעם ביומיים מסביב ליום הביוץ, שניתן לקביעה באמצעות ערכות ביתיות המודדות את הורמון הצהבה (Luteinizing hormone, LH) או אסטרדיול בשתן, או ע"י מעקב זקיקים שחלתיים (על-קול גינקולוגי).
מעבר למחלות עם קשר ישיר לפריון הגבר (כגון גידולי אשך, תסמונת קליינפלטר, לייפת כיסתית (Cystic fibrosis) ועוד), כל מחלה סיסטמית או מחלת חום כשפעת, עלולות לפגוע בתהליך יצירת תאי הזרע (ספרמטוגנזה) המורכב, באופן קבוע או הפיך. זיהומים בדרכי השתן ובייחוד ביותרת האשך עלולים לגרום להצטלקות ולחסימה, הן ביותרת האשך והן ב-Ejaculatory Ducts הנפתחים לשופכה הפרוסטטית. זיהומים חוזרים בסינוסים ובדרכי הנשימה יכולים להיות קשורים לתפקוד לקוי של הציליה (cilia) הגורם להפרעה חמורה בתנועתיות תאי הזרע, כחלק מסינדרום רב-מערכתי (Primary Cilia Dyskinesia), או בגלל קושי בסילוק הפרשות סמיכות כמו בתסמונת יאונג (Young Syndrome). סוכרת עלולה לגרום פגיעה בעצבים פריפריים, וכתוצאה מזאת תיתכן פגיעה בסוגר שלפוחית השתן וקבלת שפיכה אחורית (Retrograde Ejaculation), וכך גם בטרשת נפוצה. באופן דומה יש לבדוק את רשימת התרופות של הגבר, כול שימוש בסטרואידים אנאבוליים, ולברר הרגלים כעישון וצריכת אלכוהול.[4][5]
היסטורית ניתוחים
פרטים שונים בהיסטוריה הכירורגית עלולים להמצא כבעלי חשיבות לענייננו, אם מכיוון שבוצעו לטיפול בבעיה הגורמת במישרין או בעקיפין להפרעה בספרמטוגנזה (לדוגמא, קיבוע אשך טמיר) או כאמצעי מניעה כמו במקרה של כריתת צינור הזרע(Vasectomy), או מכיוון שהם עלולים לגרום לסיבוך רלוונטי. מבין הקבוצה האחרונה, ניתוח בקע מפשעתי מבוצע כיום בעזרת רשת סינטטית, העלולה לגרום לתגובה דלקתית קשה ולחסום את צינורית הזרע (Vas Deferens), ולגרום לאזואוספרמיה בניתוח דו-צדדי.[6] בנוסף, ניתוחי ערמונית ושלפוחית יכולים לפגוע בסוגר השלפוחית ולגרום לשפיכה אחורית. ניתוחי אגן כגון בתירה של בלוטות לימפה אחורי-צפקיות (Retroperitoneal Lymph Node Dissection) המבוצע בגידולי אשכים או חיתוך קדמי נמוך של החלחולת (Low Anterior Resection of Rectum), עלולים לפגוע בעצבים סימפטטיים ובהעברת הזרע מצינורית הזרע לשופכה. ניתוחים לכריתת פוליפים באף יכולים לרמז על לייפת כיסתית.
טבלה 2: מרכיבים באנמזה של פריון הגבר
- היסטוריה רפואית
- מחלות חום
- מחלות סיסטמיות: סוכרת, סרטן, דלקות ( דלקת אשכים על רקע חזרת (Mumps orchitis), שחפת)
- פגיעה נוירולוגית (סוכרת, טרשת נפוצה, פגיעה בחוט השדרה)
- מחלות גנטיות: לייפת כיסתית, תסמונת קליינפלטר - היסטוריה כירורגית
- קיבוע אשך טמיר
- תיקון בקע מפשעתי
- טראומה לאשך
- שיזור אשך
- ניתוחי אגן, שלפוחית, ערמונית, רטרופריטוניאום - היסטורית פריון
- הריונות קודמים (כולל עם בני זוג קודמים)
- משך תת-פריון
- טיפולי פריון קודמים
- הערכת בת הזוג - היסטוריה מינית
- תפקוד מיני
- תזמון יחסי מין ביחס לביוץ
- שימוש בחומרי סיכה - היסטוריה משפחתית
- אשך טמיר
- היפוספדיאס
- תסמונות נדירות - תרופות
- אנטי פסיכוטיות, אלופורינול, חוסמי תעלות סידן, סימטידין, כולכיצין, ליתיום, מעכבי מונואמין אוקסידז, ניטרופורנטואין, פניטואין, ספירונולקטון, סולפאסלזין, טסטוסטרון, תרופות נוגדות דיכאון טריציקליות, חומצה ולפרואית
- כימותרפיה
- חסמי אלפא - הרגלים
- אלכוהול
- סמים (מריחואנה, קוקאין)
- סטרואידים אנאבוליים
- עישון (?)
- קפה (?) - גורמים תעסוקתיים וסביבתיים
- חשיפה לחום (טבחים, כבאים, אמבט חם / ג'קוזי)
- עופרת
- צבעי אנילין (אמינים ארומטיים)
- קוטלי חרקים
- קרינה
בדיקה גופנית
בבדיקה כללית יש לשים לב להשמנת יתר, גינקומסטיה, סימני מין משניים כפיזור שיער ושלב התפתחותי על פי טנר. בבדיקת הפין ניתן למצוא היפוספדיאס, רבדים (פלאקים) תת-עוריים שיכולים לרמז על מחלת פירוני (Peyronie) העלולה לגרום לעקמת הפין ולהפרעות זקפה, או לזיות אופייניות למחלות מין. את האשכים יש להעריך מבחינת הנפח, המרקם וממצאים החשודים לגושים. מכיוון שכ-80% מנפח האשך מורכב מאבוביות ומתאים גרמינליים, פגיעה בספרמטוגנזה מתבטאת בד"כ באטרופיה של האשך. תפיחות או אינדורציה ביותרת האשך עלולות להצביע על דלקת או חסימה. חבל הזרע נבדק לוריקוצלה (Varicocele) ולהמצאות צינורית זרע. בדיקת חלחולת עשויה לגלות ממצאים הקשורים בחסימה, כגון שלפוחיות זרע נמושות או ציסטה בערמונית.
מעבדה
בדיקת הזרע - ספרמוגרם
בדיקת הזרע הנה למעשה אבן הפינה בבירור הגבר הלוקה בתת-פריון, אם כי, כאמור, איננה מדד ישיר להערכת פריון. מצד אחד, גם גברים עם פרמטרים נמוכים בבדיקה יוכלו לעתים להשיג היריון ספונטני (למעט אלה הלוקים באזואוספרמיה או העדר תנועתיות מוחלט של תאי הזרע). מצד שני, ככל שההפרעה בה חמורה יותר, סיכוייו של הגבר בהשגת היריון ספונטני פוחתים באופן משמעותי יותר.
בכל הנוגע לטכניקה המעבדתית לביצוע בדיקת הזרע, מרבית המעבדות האנדרולוגיות פועלות בהתאם לפרוטוקולים מקובלים של ארגון הבריאות העולמי.[7] בדיקת זרע "תקנית" תכלול את הפרמטרים נפח, PH, ריכוז, תנועתיות ומורפולוגיה. יתכן שוני משמעותי באותם הפרמטרים בבדיקות עוקבות אצל אותו הנבדק, היכול להגיע לערכים שבין 50-100%.[8] לפיכך, מקובל כיום להתייחס לפחות לשתי בדיקות זרע שניתנו לאחר תקופה של 2-7 (עדיפות ל-3) ימי המנעות מקיום יחסי מין או אוננות, ובהפרש של 3 שבועות.[7] בנוסף נראה, כי בגברים צעירים ובריאים, ריכוז תאי זרע מתקרב ל-50x106/ml, ולא רק 20x106/ml כפי שנקבע כגבול התחתון ע"י ארגון הבריאות העולמי.[9] חשוב להדגיש כי גם בבדיקת זרע אצל גבר בריא יכולים למצוא ערכים נמוכים מהנורמה ב-5-10% מהדגימות מחד, ובדיקת זרע תקינה לחלוטין איננה שוללת קיום גורם גברי לתת-פריון, מאידך.[7]
טבלה 3: ערכים הנורמה בבדיקת זרע (WHO 2010)
- נפח:≥1.5ml
- PH: ≥7.2
- ריכוז: ≥15x106/ml
- תנועתיות: ≥40%
- מורפולוגיה תקינה (לפי קרוגר - Kruger): ≥4%
- תאי דם לבנים (WBC): <1x106/ml
לעתים יש לבצע בדיקות נוספות מעבר לבדיקת הזרע. פרמטרים נוספים הניתנים לבירור מעבר לבדיקת הזרע המסורתית יפורטו להלן.
Post Ejaculatory Urinalysis (PEU)
בבירור של נפח שפיכה הקטן מ-1ml תבוצע מיד לאחר השפיכה בדיקת שתן בחשד לשפיכה אחורית (Retrograde Ejaculation). במסגרת הבדיקה השתן עובר סרכוז, המשקע מועבר לנפח קטן יותר, הריכוז נקבע בבדיקה תחת עדשת המיקרוסקופ, ומספר תאי הזרע מחושב.
זיהוי כדוריות דם לבנות בזרע
שחרור ציטוקינים במצבי דלקת עלול לפגוע בתנועתיות ובתפקוד תאי הזרע. לא ניתן לזהות את ההבדל בין כדוריות לבנות לתאי זרע צעירים (ספרמטוציטים) ע"י שימוש במיקרוסקופ אור בלבד, שם יראו שניהם כ"תאים עגולים" (Round Cells). על מנת להבדיל בין השניים יש לבצע צביעה ספציפית.
נוגדנים לזרע (Anti-sperm Antibodies, ASA)
במקרים של הפרעה בפריון בנוכחות ספרמוגרם תקין או עם הפרעה בתנועה (Asthenospermia) בלבד, או כאשר נצפים צברים (אגרגאטים) של תאי זרע, מומלץ ביצוע בדיקת ASA. גורמי סיכון ליצירת נוגדנים עצמיים כנגד תאי זרע הם אלה הקשורים עם "פריצת" מחסום דם-אשך (Blood-Testis Barrier) כגון ניתוחי אשך, כריתת צינור הזרע, או טראומה לאשך.
תרבית זרע
זיהומים גניטאליים בגברים הנם סיבה נדירה להפרעה בפריון. בנוסף, שיעור משמעותי של התרביות יראה צמיחת חיידק מהפלורה של העור עקב קולוניזאציה של המיאטוס (פתח השופכה) והחלק הדיסטאלי שלה. שלל פתוגנים נחשדו במשך השנים כמזהמים, אך עבודות שונות הראו שרוב הבידודים בתרביות זרע אכן קשורים לקולוניזאציה ולא לזיהום. לפיכך, נטילת תרבית זרע איננה מומלצת בהעדר תסמינים דלקתיים של זיהום כגון אלה של דלקת בשופכה או דלקת בשלפוחית השתן (Urethritis/Cystitis), דלקת באשכים (Orchitis) או דלקת בערמונית (Prostatitis).
בדיקת מבנה כרומטין הזרע
הצורה הדחוסה בה "ארוז" הדנ"א בתאי הזרע, העדר או המצאות "שברים", או עמידותו בפני דה-נטורציה ע"י גורמים חיצוניים, נמצאו כפרמטר בעל ערך עצמאי ונפרד משאר הפרמטרים הקונבנציונליים בבדיקת זרע בהערכת תקינותו. כמו כן, ניתן להשתמש בבדיקות אלה כאמצעי נוסף למעקב אחרי השינוי בבדיקת הזרע בהסרת גורמים פוגעים.[10][11] בין גורמים אלה ניתן למנות מחלות חום וגידולים ממאירים, וריקוצלה, עישון, חשיפה לזיהום אויר ומזהמים תעשייתיים. קיימים מספר תבחינים מעבדתיים לבדיקת שלמות הדנ"א בזרע. הנפוץ ביניהם הוא ה-SCSA, המבוצע רק במרכזים מיוחדים עקב הצורך בציוד ופרוטוקולים מורכבים, ומחירו גבוה יחסית. הבדיקה עדיין איננה זמינה בארץ.
קביעת פרופיל הורמונלי
התוויות מקובלות לבירור הורמונלי (פרולקטין, טסטוסטרון, הורמון מגרה זקיק (Follicle-stimulating hormone, FSH), והורמון הצהבה (LH)) הן:
- ריכוז תאי זרע ≤ 10*106/ml בספרמוגרם
- ממצאים קליניים המחשידים לבעיה אנדוקרינית, כגון נפח אשכים קטן, הפרעה בתפקוד המיני, גינקומסטיה, הפרעות ראיה מסוימות, ועוד.
בירור גנטי
ההערכה הגנטית של הגבר הלוקה בתת-פריון כוללת כיום מספר מצומצם של בדיקות. הדבר דומה במידה מסוימת לחיפוש מטבע מתחת למנורה. בעוד שקיים מספר מצומצם ביותר של "בדיקות גנטיות" בהערכת תת-פריון הגבר, הרי שלפי הערכות שונות כ- 1/4-1/3 מהגורמים לבעיה בפריון הגבר נותר "אידיופאטי" בסוף הבירור. הדעה המקובלת היום כי חלק ניכר מ"שק" זה הנו על רקע הפרעות גנטיות שאיננו מכירים, קל וחומר שאיננו יכולים לזהותן ע"י בדיקה מעבדתית.
- הסיכוי למציאת אברציה כרומוזומלית או חסר זעיר (Microdelition) בכרומוזום Y נמצא ביחס הפוך לריכוז תאי זרע בשפכה. מומלץ לבצע בדיקת קריוטיפ וכרומוזום Y בגברים הלוקים באזואוספרמיה או באוליגוספרמיה חמורה (ריכוז תאי זרע ≤ 5*106/ml). שיעורים מרביים של אברציות כרומוזומליות באוכלוסיות אלו הם 15-20%, ושל חסר בכרומוזום Y הם 13-15%.[12] חשיבותן של בדיקות אלה במספר מישורים: ראשית, אברציות כרומוזומליות מסוימות עלולות להיות משמעותיות גם בתחומים שמעבר לפריון. לאחר ביצוע הפריה חוץ גופית, מניעת החזרת עובר נגוע אפשרית על ידי ביופסיה עוברית בשלבי ההתפתחות הראשוניים במעבדה (Preimplantation Genetic Diagnosis, PGD). עוברים הנושאים את הפגם לא מוחזרים לרחם. שנית, חסרים בכרומוזום Y מועברים מאב לבן. חלקם יגרמו לאזואוספרמיה בבן, וחלקם יגרמו להידרדרות הדרגתית בייצור הזרע אצל הבן. להמצאות חסר קיים ערך פרוגנוסטי בכל שלבי האבחנה והטיפול - מציאת זרע בשפיכה, מציאת זרע באמצעים כירורגיים, הצלחה בהפריה חוץ גופית ובלידת צאצא.[13] שלישית, כאשר מדובר בשילוב של בעיה גנטית עם וריקוצלה המלווה באזואוספרמיה/אוליגוספרמיה חמורה, לא נראה שיש תועלת בניתוח לתיקון וריקוצלה.[14]
- בדיקה לנשאות לייפת כיסתית מומלצת במצבים הבאים:
- לא נמושה צינורית זרע באחד או בשני הצדדים.
- צינורית הזרע נמושה מנוונת (אטרטית) או מקוטעת
- בדיקת על-קול חלחולתית הדגימה פתולוגיה בצינורית הזרע, בשלפוחיות הזרע (Seminal Vesicles) או ב-Ejaculatory Duct.
הקשר בין אנומליות במערכת המין הגברית ללייפת כיסתית מקורו במוטציה של הגן CFTR, הגורמת ברוב המכריע של המקרים, בנוסף לשאר מאפייני הלייפת הכיסתית, גם לאזואוספרמיה חסימתית כתוצאה מפגמים הקשורים בהתפתחות העוברית של ה-Mesonephric Duct: חסר או אטרופיה של צינורית הזרע, שלפוחיות הזרע או ה-Ejaculatory Duct ולעתים גם אגנזיס של הכליה. רובם המכריע של הגברים עם הפרעה חסימתית כזו הנם נשאים בלבד של מוטציה בגן CFTR וללא התבטאות קלינית של CFTR, ולכן לפני ביצוע הפריה חוץ גופית חשוב לבדוק נשאות אצל בנות זוגם.
- בדיקה למוטציה בגנים KAL 1-3 מומלצת במקרים של Hypogonadotrphic Hypogonadism (במעבדות ספציפיות בלבד).
הדמיה
על-קול חלחולתי (TRUS)
מקומה של בדיקה זו במקרים בהם נפח השפיכה נמוך (< 1.5ml) ויש חשד לחסימה רחיקנית (דיסטאלית) של דרכי הזרע, וכאמצעי עזר באבחנה המבדלת בין אזואוספרמיה לא-חסימתית לאזואוספרמיה חסימתית.[15] מיקומו של מתמר על-קול בחלחולת מאפשר הדגמה טובה של החלקים הרחיקניים של דרכי הזרע, הנמצאים באספקט האחורי (פוסטריורי) של בסיס שלפוחית השתן ובלוטת הערמונית: צינורית הזרע, שלפוחיות הזרע וה-Ejaculatory Duct. ממצאים פתולוגיים שכיחים הנם הרחבה, ציסטות ואבנים.
על-קול אשכים
בדרך כלל תזהה בדיקה גופנית טובה את רוב הממצאים בעלי הפוטנציאל לפגיעה בפריון. השימוש בעל-קול מוגבל לפיכך למקרים בהם בדיקת האשכים קשה, או שמעלה ממצאים לא חד-משמעיים, וכמובן להערכת ממצא של גוש באשך. למרות שקיים קשר בין הפרעה בפריון הגבר לגידולי אשך, שיקולי עלות-תועלת אינם בעד ביצוע בדיקת על-קול לכל גבר הלוקה בפוריותו, מה גם שהרוב המוחלט של גידולי האשך ניתן לגילוי בבדיקה הגופנית. וריקוצלה, למשל הנו ממצא שהגדרתו קלינית, ושלביו השונים (III- נראה, II – נמוש, I – נמוש רק בולסלבה) מוגדרים לפי הבדיקה הגופנית. אין כל הוכחה בספרות האנדרולוגית במחקר מבוקר, כי תיקונו הכירורגי של וריקוצלה תת-קליני (שנמצא בהדמיה בלבד) הביא לשיפור בפרמטרים השונים בבדיקת הזרע, או להשגת היריון. במקרים בהם בכל זאת נעשית הערכת וריקוצלה ע"י על-קול, מקובל להתייחס לווריד בעל משמעות קלינית מקוטר ≥ 3-3.5mm.
ביופסיה אבחנתית
חלה ירידה משמעותית בצורך בביצוע ביופסית אשך אבחנתית במהלך הבירור של אזואוספרמיה. בעזרת מדדים קליניים (מרקם ונפח האשך, מישוש צינורית זרע) ורמות הורמונים (הורמון מגרה זקיק (FSH)), ניתן להימנע מפעולה חודרנית, להגיע לאבחנה ברמת סבירות גבוהה, ולהציע פתרון הולם. רק במקרים של אזואוספרמיה מלווה בנפח אשכים תקין, צינורית זרע תקינה והורמון מגרה זקיק (FSH) תקין, מומלץ לבצע ביופסיה.
הערכת בת הזוג
כאמור, גיל בת הזוג הוא בעל חשיבות מכרעת בבחירת הטיפול המוצע לזוג. מכיוון שלא ניתן להעריך פוריות של אישה באופן ישיר, ההערכה המקובלת הנה על סמך השגת היריון בטיפולי הפריה. באופן פיזיולוגי, בסביבות גיל 35 מתחילה ירידה בפוטנציאל הפריון של האישה, שמקורה בשילוב של ירידה בכמות הביציות הזמינות מחד, ועליה באברציות הכרומוסומליות בהן, מאידך. ירידה זו מתחזקת בגיל 37 לערך.
הערכה של פוטנציאל זה ניתן לקבל משילוב של פרטים בהיסטוריה הרפואית, בדיקות מעבדה והדמיה, שעיקרם יפורט להלן:
- הערכה מניחה את הדעת של תפקוד שחלתי תקין וביוץ מתקבלת במקרים של מחזור סדיר באורך של 7±28 ימים.
- רזרבה שחלתית תקינה מוערכת לפי רמת FSH<10 IU (יום 3 של המחזור), ולפי ספירת זקיקים (Antral Follicle Count, AFC) בעל-קול נרתיקי בתחילת המחזור, כאשר AFC>10. תוצאות לא תקינות בפרמטרים אלה משמשות כמדד פרוגנוסטי רע בניבוי היריון בהפריה חוץ-גופית.
- הערכה אנטומית על ידי צילום רחם עם חומר ניגוד (Hysterosalpinogram, HSG) משמש להערכת מעבר תקין בין חלל החצוצרה לחלל הרחם.
טיפול
אחת הדרישות המוקדמות הן לבירור והן לטיפול בתת-פריון הגבר היא ההבנה כי לתהליך שותפים שני בני זוג בעלי שוני מהותי בפיזיולוגית הפריון שלהם. קביעה זו עלולה להיתפס כנאיבית או כברורה מאליה, אך לא נדירים המקרים בהם איננה מיושמת הלכה למעשה. אחת משתי גישות מתחרות קיימות תכתיב את עומק הבירור והטיפול בתת-פריון הגבר: הראשונה, שהיא הבסיס לסקירה זו ומקובלת בעיקר על האורולוג-אנדרולוג דוגלת בניסיון לשיפור פוטנציאל הפריון של הגבר על ידי השקעת מאמץ באיתור גורמים הפיכים הפוגעים בו, ושימוש באמצעים היכולים לשפר את יכולת ההפריה ו/או איכות הזרע שלו, באופן קבוע או זמני. השנייה, המקובלת בעיקר על הגינקולוג, דוגלת בהשגה מהירה של היריון ולידה, תוך כדי העזרות בשיטות מעבדתיות מתקדמות לצורך "מעקף" של נתוני בסיס אנדרולוגיים שאינם אופטימליים.
למרות שבמקרים מסוימים אין ברירה אלא להשתמש בגישה השנייה, הרי שלעתים ניתן לכאורה להשתמש בראשונה או בשנייה, והבחירה נמצאת בידי הזוג ורופאיו. לדוגמא, בדרך כלל לא יהיה זה מוצדק לתכנן טיפול ארוך ומסובך לגבר שבת זוגו סובלת מבעיה המחייבת ממילא הפריה חוץ גופית (In Vitro Fertilization; IVF), או שגילה מתקדם מבחינת פוטנציאל הפריון. מצד שני, לעתים לא מוצדק השימוש המוקדם בהפריה חוץ גופית, כגון בבעיה הניתנת לתיקון מהיר יחסית אצל גבר עם בת זוג צעירה ובריאה. כיום עומדים לרשותנו אמצעים רבי עוצמה, הנחשבים ל"היי-טק" בתחום טיפולי הפריון, כגון השימוש בהפריה חוץ גופית משולבת במיקרומניפולציה של הזרקת זרע בודד לביצית (IVF+ICSI), אך השימוש בהם חייב להיות מושכל, הן מבחינת הערכת סיכוי-סיכון והן מבחינת עלות-תועלת.[16] לדוגמא, יש להביא בחשבון את שכיחות הסיבוכים הייחודיים לגירוי יתר הורמונלי שמקבלת בת הזוג כהכנה להפריה חוץ גופית, הסיכוי להיריון רב-עוברים, והאפשרות להחמרת הליקוי בפריון הגבר, במידה שאיננו מטופל, בניסיונות היריון עתידיים. בנוסף, במקרים של גורם גברי לתת-פריון בהם יעברו בני הזוג טיפולי הפריה חוץ גופית ללא בירור הגבר, קיים הסיכון של עד 1-10% להחמיץ בעיה רפואית משמעותית, כגון גידול באשך, גידול בבלוטת יותרת המוח (היפופיזה), סוכרת, מחלה נוירולוגית, ועוד.[17]
בדומה לשטחים אחרים ברפואה, תוצאה מיטבית נגזרת מתהליך רב-שלבי הכולל איסוף מידע קליני, עיבודו לפי גישה הגיונית ועדכנית, גיבוש אבחנה מבדלת, בחירת האבחנה הנכונה או הסבירה ביותר, ושאיפה למתן טיפול שיעילותו הוכחה בספרות. סקירה זו תתרכז בשלבים הכוללים את בחירת הטיפול המיטבי. מכיוון שחלק לא מבוטל באבחנה המבדלת של תת-פריון הגבר הנו אידיופטי, יסקר גם הטיפול הלא-ספציפי, על הבעייתיות הכרוכה בו.
שלושה עקרונות בסיסיים מכתיבים את הטיפול בתת-פריון הגבר:[18]
- הדרגתיות - בתחילה יש לשלול גורמים ניתנים לשינוי בהרגלי ותזמון המשגל, באורח החיים והימנעות מגונדוטוקסינים. בשלב הבא נבדוק אפשרויות לטיפול תרופתי, ובסוף נבדוק אפשרות לתיקון מצב קיים על ידי ניתוח. יש לוודא עם הגינקולוג המטפל בבת הזוג כי פוטנציאל הפריון שלה מאפשר לחכות 6-12 חודשים הדרושים להשגת היריון ברוב הטיפולים בגבר.[19]
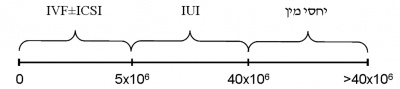
- טיפול מקביל - למתח הנפשי בו נמצאים לא אחת זוגות המתקשים להשיג היריון עלולות להיות השלכות לא רצויות. לכן, מן הראוי לידע את הזוג במקרים המתאימים, כי ניתן להשיג היריון על ידי ART (Assisted Reproduction Techniques) תוך כדי הבירור או הטיפול בגבר. יחד עם זאת, יש להבהיר כי מטרות הבירור האנדרולוגי כוללות ניסיון לשיפור נתוני היסוד האנדרולוגיים של הגבר ומניעת הידרדרותם עבור ניסיונות עתידיים, וכן איתור סיבות מערכתיות משמעותיות הגורמות לתת-פריון הגבר ומחייבות טיפול. רמות שונות של ART, בהתאם לבדיקת הזרע, מומחשות בתמונה 1 -
- הזרעה תוך רחמית ((Intrauterine insemination (IUI) – פרוצדורה מרפאתית בה התוצר השפיכה עובר שטיפה והשבחה בשיטות שונות לקבלת דגימה בנפח זעום (בדרך כלל 0.3-0.5 מ"ל) עם אחוז גבוה של תאי זרע בתנועה, המוחדרת לרחם מעבר לצוואר-הרחם. דרישה מוקדמת הנה ספירת תנועתיות כוללת (Total Motile Count (TMC) = Volume x Concentration x %motility) של לפחות 5 מיליון. התוויות לטיפול מסוג זה: פתולוגיה של צוואר-הרחם, תנועתיות זרע ירודה, נוגדנים לזרע, היפוספדיאס משמעותי.
- הפריה חוץ גופית ((In Vitro Fertilization (IVF) – בת-הזוג עוברת מניפולציה הורמונלית לצורך גירוי-יתר מבוקר של השחלות. הפרוצדורה הדורשת הרדמה לצורך שאיבת ביציות והחזרת עוברים. דרוש TMC בין 0.5-5 מיליון.
- הזרקת זרע בודד לביצית ((Intracytoplasmic Sperm Injection (ICSI) – פרוצדורה המשולבת עם IVF. קיימת כ-15 שנה בלבד, וכוללת מיקרומניפולציה של זרע בודד המוחדר לביצית. גרמה למהפך ב-ART, בגלל היכולת להסתפק אפילו בתא זרע אחד, ונתנה דחיפה להתפתחות המיקרוכירורגיה של הפקת זרע ניתוחית (Surgical Sperm Retrieval) (SSR).
- חלופות - לעתים אין ברירה אלא לייעץ לזוג בדבר אפשרות השימוש בתרומת זרע או בחירה באימוץ.
בחירת הטיפול בהתאם לאטיולוגיה
גורמים התנהגותיים
- שימוש בחמרי סיכה מלאכותיים מסחריים או ברוק, עלול לפגום בתנועתיות תאי הזרע ובכושר ההפריה שלהם. לזוגות הנזקקים לחומרים אלה, מומלץ השימוש בחומרים טבעיים כשמן ירקות, שמן זית או בפרפין רך.[20]
- שימוש בסטרואידים אנבוליים עלול לפעול בדומה לטסטוסטרון חיצוני ולהשיג אפקט של תכשיר למניעת היריון על ידי דיכוי הפרשת FSH ופגיעה בייצור הזרע באשך. ההפרעה בדרך כלל הפיכה, אך יכולה להשפיע מספר חודשים ואף יותר.[21]
- המלצות לזמן קיום יחסי מין להשגת היריון נשענות על מחזור ביוץ קלאסי של האישה (28 יום), נפחי פליטה של הגבר, אורך חיי תא זרע (כיומיים), ואורך חיי הביצית (עד יום). בתנאים אלה, ובהנחה שהביוץ מתרחש בערך ביום ה-14 של המחזור, מומלץ לקיים יחסים לא מוגנים בימים ה-11, 13, 15, 17 של המחזור. לאיתור מדויק יותר של מועד הביוץ ניתן להשתמש במדידת חום הגוף של האישה, או ביתר דיוק ע"י ערכות מסחריות לשימוש ביתי, המודדות LH או אסטרדיול בשתן, או ע"י מעקב זקיקים שחלתיים (על-קול גינקולוגי).
- בעוד שמספר עשורים ידוע כי מחלות חום יכולות לגרום לפגיעה הפיכה בייצור הזרע, מקורות חום חיצוניים הקשורים לתעסוקה (טבחים, כבאים וכו') או להרגלים כטבילה באמבט חם או בג'קוזי, נמצאו קשורים להפרעה בייצור הזרע רק במחקרים קטנים ולא מבוקרים.[22] עם זאת, רוב המומחים בענף ממליצים על הימנעות מהרגלים אלה בעת ניסיון להשיג היריון.
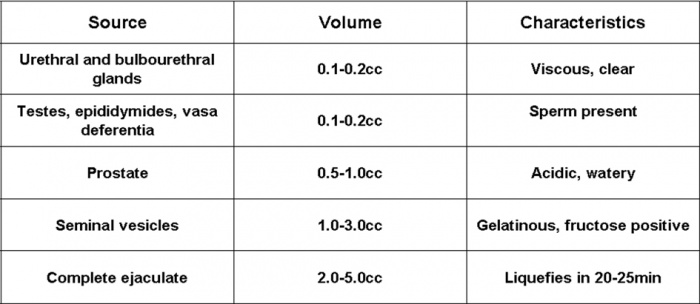
נפח שפיכה נמוך
נפח תקין מוגדר כגדול או שווה ל-1.5-2.0 מ"ל. באופן נורמלי, השפיכה הנה תערובת שמקורה במספר איברים של מערכת הרבייה הזכרית. כל אחד מהם מוסיף מרכיב ייחודי מבחינה פיסיקלית, כימית או ביולוגית, כפי שניתן לראות בטבלה 4. באופן גס, שלפוחיות הזרע תורמות כ-65% מנפח הזרע, הערמונית כ-30-35%, וכל השאר (אשכים, יותרת האשך, צינור הזרע, בלוטות) כ-3-5%. בהעדר התרומה של שלפוחיות הזרע, נפח השפיכה יהיה נמוך משמעותית ובעל pH חומצי.
טבלה 4: מאפיינים של נוזל הזרע לפי מקור
האבחנה המבדלת מבוססת על 2 בדיקות זרע לפחות, וכוללת 5 מצבים:
- בעיה בנתינת הדגימה (דגימה חלקית או תקופת הימנעות קצרה מ-48 שעות) מהווה את הגורם השכיח ביותר בקבוצה זו (1). קל לגלותו בעזרת תשאול פשוט של הגבר.
- טסטוסטרון נמוך - שלפוחיות הזרע ובלוטת הערמונית הינן איברים התלויים באנדרוגנים להתפתחותם ולתפקודם. מצבי חסר טסטוסטרון ו/או חסר המטבוליט הפעיל שלו DHT, יגרמו לנפח שפיכה נמוך, ויתכן גם לפגיעה בייצור הזרע. במקרה של פגיעה מרכזית כגון היפוגונדיזם היפוגונדוטרופי (Hypogonadotropic Hypogonadism), הביטוי יכול להיות גם אזואוספרמיה. בירור אנדוקריני יגלה את מיקום הפגיעה (מרכזי או פריפרי) ומהותה. חשוב לזכור כי הטיפול לא יכלול, בכל מקרה, טסטוסטרון חיצוני, שבמשוב שלילי גורם לדיכוי הפרשת FSH ולפגיעה קשה בייצור הזרע, אפקט המנוצל בניסיונות להפוך את הטסטוסטרון, לבדו או בשילוב עם פרוגסטרון, ל"גלולה הגברית".[23] לפיכך, המניפולציות האנדוקריניות העומדות לרשותנו מבוססות על העלאת רמת הטסטוסטרון האנדוגני בצורה עקיפה, וניתנות לשימוש גם בהתוויות נוספות בתת-פריון הגבר. מעבר לרמת הטסטוסטרון, נראה גם כי לסביבה ההורמונלית בכללותה, ובייחוד ליחס שבין הטסטוסטרון לאסטרוגן, יש השפעה על ייצור הזרע.[24]
- חסר של צינור הזרע - הפנוטיפ בעל ספקטרום רחב הכולל מצבים מהעדר מוחלט בשני הצדדים או בצד אחד, חסר של מקטע/ים, חלק/ים חסום/ים (Atresia), הרחבה ציסטית של שלפוחיות הזרע או אטרזיה שלהן, ושילוב של פגמים מרובים מגוף יותרת האשך ועד ל-Ejaculatory Ducts. חלק מהמצבים יתגלו בבדיקה הגופנית, וחלקם רק בעל קול חולחלתי. כמעט כל חולי לייפת כיסתית (95-98%) יהיו בעלי פנוטיפ של חסר דו צדדי מולד של צינור הזרע (CBAVD ,Congenital Bilateral Absence of the Vas Deferens), ככל הנראה בגלל אטרופיה וניוון של צינורות חסומים בהפרשות סמיכות, בעוד שמקרב בעלי הפנוטיפ של CBAVD, כ-80% יהיו נשאי מוטציה מוכרת של CFTR (מקורות 8-10). בכל המקרים יש לבצע בדיקה גנטית לאיתור מוטציות או פולימורפיזם של CFTR. תוצאה חיובית מחייבת ייעוץ גנטי על פי חוק, ובדיקה של בת-הזוג לשלילת נשאות שלה גם כן. במידה שלא נמצאת מוטציה ב-CFTR, מומלץ בצוע בדיקת על-קול של דרכי השתן, לשלילת חסר יצירת הכליה (Renal agenesis), המלווה CBAVD בכ-10% מהמקרים ו-CUAVD (חסר מולד חד-צדדי של צינור הזרע) עד כ-25% מהמקרים.[25] הטיפול המועדף הוא שאיבת זרע מיותרת האשך באופן מיקרוכירורגי (Microsurgical epididymal sperm aspiration (MESA)). בשיטה זו ניתן להשיג מיליונים רבים של תאי זרע בתנועה, לשימוש מיידי ב-IVF+ICSI ו/או להקפאה לשימוש מאוחר יותר. אלטרנטיבה לשיטה זו יכולה להוות שאיבת זרע מן האשך (Testicular sperm aspiration (TESA)), שאיננה מחייבת מיומנות מיקרוכירורגית, קצרה יותר, אך מספקת מספר מצומצם של תאי זרע.
- חסימה בדרכי הזרע - בדרך כלל מדובר בחסימה בחלק הדיסטלי, למשל חסימת ה-Ejaculatory duct. זהו מצב נרכש בדרך כלל, עקב דלקות והצטלקויות באזור הוורום. ציסטה בבלוטת הערמונית יכולה לתת תמונה דומה. האבחנה נעשית לפי שילוב של בדיקת זרע עם נפח נמוך, אזואוספרמיה או אוליגוספרמיה עם תנועתיות ירודה, וממצאים אופייניים לחסימה בעל קול חולחלתי. לעתים קרובות יתלונן הגבר על דם בשפיכה (המוספרמיה) ו/או כאבים בשפיכה. האבחנה יכולה להיות בעייתית בחסימות חלקיות/פונקציונליות או חד צדדיות. מכיוון שמדובר באבחנה נדירה יחסית, גם המרכזים המובילים בעולם לא הציגו סדרות גדולות של גברים שעברו טיפול ניתוחי. הניתוח מכונה TUR-ED (Transureatral resection of ejaculatory ducts)וכולל שימוש בעל קול חולחלתי לצורך זיהוי שלפוחיות הזרע החסומות והזרקת חומר צבע (Chromatubation) לתוכן. לאחר מכן מתבצעת כריתה זהירה של פתח ה-Ejaculatory Duct הממוקם בצד הוורום בשופכה הפרוסטטית, עד לזיהוי חומר הצבע.[26] קיימת אי-אחידות דעות בקשר להצלחה ארוכת הטווח של ההליך, גם בגלל התופעה של הצטלקות וחסימה חוזרת, בשיעורים שונים, וגם בגלל וויכוח של עלות תועלת לעומת ביצוע SSR+IVF. אטיולוגיה חסימתית חדשה יחסית הנה חסימה יאטרוגנית של צינור הזרע בעקבות תיקון בקע מפשעתי תוך כדי שימוש ברשת פרולן.[27] במידה והניתוח דו-צדדי, חסימת צינור הזרע המפשעתי בתוך תגובה פיברופלסטית קשה עלולה להביא לאזואוספרמיה. הטיפול המוצע הנו חקירה (אקספלורציה) מפשעתית ובצוע Vasovasostomy או Vasoepididymostomy. לחלופין, או במקרים בהם שחזור אינו אפשרי, ניתן לבצע TESA או MESA. מסיבות תרבותיות ודתיות, עיקור הגבר על ידי כריתת צינור הזרע (Vasectomy) מבוצע בישראל לעתים נדירות ביותר. לפיכך, לא ידונו בסקירה זו אפשרויות טיפוליות על ידי שחזור (Vasectomy Reversal Procedures), עקב חוסר רלוונטיות מקומי.
- הפרעות שפיכה (Ejaculatory dysfunction) - הסיבה השכיחה ביותר לשפיכה אחורית (Retrograde ejaculation) הנה פגיעות עמוד שדרה. סיבות שכיחות נוספות הגורמות לפגיעה בעצבוב צוואר שלפוחית השתן הן סוכרת וטרשת נפוצה. גם ניתוחים כ-TURP (Transurethral resection of the prostate), ניתוחי מעי ואגן, ושימוש בתרופות (חסמי אלפא) עלולים לגרום לתופעה. ניתן לטפל לפני שפיכה מתוכננת. לחילופין, ניתן להבסיס את השתן, ולאסוף זרע מהשלפוחית בצנתור. ניתוחים כגון RPLND (Retroperitoneal lymph node dissection) לגידולי האשכים עלולים לפגוע בעצבוב הסימפתטי (L1-L3) ולגרום לכישלון ב-Emission (העברת הזרע מיותרת האשך עד לשופכה הפרוסטטית). ניתן לנסות טיפול בתרופות סימפטומימטיות או גירוי חשמלי להפקת זרע (Electroejaculation, EEJ). העדר שפיכה (Anejaculation) יכול לנבוע מסיבה אורגנית כפגיעת עמוד שדרה. בפגיעות גבוהות (מעל T10), רובם המכריע של החולים יצליח לפלוט זרע על ידי שימוש ב-PVS (Penile vibratory stiumlation). השאר יצליחו ע"י EEJ. במשך השנים עלולה לחול הידרדרות באיכות הזרע, ולכן חשוב לבדוק רמות FSH ולהיות ערוכים ל-SSR במקרה הצורך. גורם נוסף להעדר שפיכה הנו הפרעה פסיכוגנית. האופציות הטיפוליות הנן PVS ו-EEJ. ניתן לנסות גם טיפול פסיכו-סקסולוגי.[28]
ריכוז/תנועתיות נמוכים
חלק מסוים מהמידע המובא להלן נכון גם לגבי אזואוספרמיה, אולם קיימים הבדלים חשובים בין שני המצבים (אוליגוספרמיה ואזואוספרמיה), וצורות הטיפול בהם.
ריכוז זרע נמוך יכול להיגרם על ידי אנדוקרינופטיה (כגון פרולקטינומה, יחס נמוך בין טסטוסטרון לאסטרוגן), מגוון של מחלות גנטיות, וכן וריקוצלה. למרות שהויכוח סביב וריקוצלה נטוש עשרות שנים, נראה שהצטברות מידע, ובייחוד עיבוד נוסף של מידע קיים במטה-אנליזות עדכניות, מראה כי יש יתרון בטיפול. לקריאה בנושא הטיפול בוריקוצלה ניתן לפנות לערך העוסק בנושא בהרחבה.
ערך מורחב – וריקוצלה - Varicocele
לפי הנחיות ה-AUA (American urological society) וה-ASRM (American society for reproductive medicine), יש הצדקה לבירור הורמונלי כאשר ריכוז הזרע < 10*106/ml, ולבירור גנטי של קריוטיפ ו-Y Chromosome Microdeletions במקרים של אוליגוספרמיה חמורה (ריכוז < 5*106/ml) (16,17).
פעמים רבות תראה בדיקת זרע פתולוגית ירידה בריכוז תאי הזרע יחד עם ירידה בתנועתיות. כאשר בנוסף קיימת גם הפרעה במורפולוגיה, הממצא מכונה תסמונת OAT (Oligoasthenotertospermia). ממצא פתולוגי שכיח בבדיקת הזרע, שתואר כבר לפני למעלה מ-4 עשורים, נקרא "stress pattern" וכולל מספר רב של צורות צעירות לצד צורות מורפולוגיות של תאי זרע אמורפיים ומחודדים (Tapered). דווקא בגלל השימוש הנרחב במונח, יש לזכור שהוא חסר ספציפיות, ובעל אטיולוגיה מגוונת: וריקוצלה, מחלות חום, גונדוטוקסינים.[29]
תנועתיות ירודה כממצא יחיד בבדיקת הזרע מופיעה בכ-25% מהבדיקות הפתולוגיות.[30] גורמים אפשריים הם התנזרות ממושכת, לויקוציטוספרמיה, נוגדנים לזרע. ברוב המקרים, תאים עגולים (Round Cells) הנראים בבדיקת הזרע הם צורות צעירות של תאי זרע ולא לויקוציטים.[31] ריכוז לויקוציטים בזרע > 1*106/ml נחשב פתולוגי, ונראה כי ROS (Reactive Oxygen Species) המופרשים על-ידם הם הגורם לתנועתיות ירודה של תאי הזרע. יש לטפל בהתאם במחלות כדלקת בבלוטת הערמונית, דלקת ביותרת האשך ובמחלות מין ((Sexually transmitted disease (STD). גם רכיבה קבועה או ממושכת על אופנים עלולה לגרום לתסמונת דמוית דלקת בבלוטת הערמונית.[32] ערכן של תרביות זרע מוטל בספק, בייחוד כאשר הגבר איננו סימפטומטי, וזאת עקב צמיחת מספר פתוגנים או פלורה של העור במקרים רבים.
בדיקה לאיתור נוגדנים לזרע אינה מבוצעת בכל מעבדה אנדרולוגית. יש לשקול ביצועה בהפרעת תנועה בלבד או בבירור תת-פריון הגבר המלווה בבדיקת זרע תקינה לכאורה. טיפול בסטרואידים שנוי במחלוקת, וניתן להפנות את הזוג ל-ART.
כאשר נמצא זרע חי אך ללא תנועה, או כאשר התנועתיות נופלת עד 5-10%, יש לחשוד בהפרעות מבניות של זנב הזרע כ-PCD (Primary ciliary dyskinesia). האבחנה נעשית במיקרוסקופ אלקטרוני, והטיפול ע"י ART, אם כי נראה ששיעורי ההצלחה ירודים יחסית.
תת-פריון הגבר אידיופטי/לא מוסבר
כאשר הפרמטרים בבדיקת הזרע הקונבנציונלית תקינים, האבחנה המבדלת כוללת גורם נשי למול גורמים כהפרעות בתפקוד המיני, הרגלי משגל שגויים, ומצבים לא שכיחים אחרים. תבחין זרע לאחר משגל ((Postcoital test (PCT)) ללא זיהוי זרע מצביע על בעיה מסוג זה. בשאר המקרים, כ-10% מבדיקות הזרע תהינה חיוביות להמצאות נוגדנים לתאי זרע או למבנה כרומטין לא תקין. שתי הבדיקות לא מבוצעות לעתים קרובות, ורק בחלק מצומצם מהמעבדות האנדרולוגיות, עקב מורכבותן, בייחוד בחלק מן השיטות לבדיקת מבנה הכרומטין. למרות זאת, מקובל יותר ויותר לחשוב, כי פגמים בצורה הקומפקטית בה "ארוז" הדנ"א ככרומטין בתאי הזרע, יכולה לשמש כמדד עצמאי לפוטנציאל הפריון של הגבר, בנפרד משאר המדדים בבדיקת זרע קונבנציונלית.[33] גם בדיקת ההשלכות הקליניות, כדוגמת תיקון וריקוצלה במקרים בהם מבחן מסוג (Sperm Chromatin Structure Assay (SCSA נמצא פתולוגי, צוברת פופולריות.[34] מבחנים ביולוגיים של תפקוד הזרע כגון Sperm Penetration Assay, Acrosome Reaction Assay קשים לביצוע, מבוצעים לעתים רחוקות ביותר, והרוב המכריע של הזוגות מדלגים עליהם בדרכם ל-ART.
אזואוספרמיה
לקריאה בנושא הבירור והטיפול באזואוספרמיה ניתן לפנות לערך העוסק בנושא בהרחבה.
ערך מורחב – אזואוספרמיה - Azoospermia
טרטוספרמיה
ריבוי צורות פתולוגיות שכיח יותר בשנים האחרונות, עם המעבר של רוב המעבדות האנדרולוגיות לבדיקה לפי השיטה המחמירה על פי קרוגר (Kruger's strict criteria). למרות שלפי הערכה זו, הזרע מוגדר כתקין כאשר יותר מ-14% ממנו "נורמלי", יש לזכור כי השיטה דווחה לגבי תוצאות IVF, ולא עברה תיקוף (ולידציה) לגבי IUI או יחסי מין.[35] מעבודות מאוחרות יותר, נראה כי ניתן לחלק את התחום 0-14% לפי קרוגר לתחום שבין 4-14% בעל הפרוגנוזה הטובה יותר, ולתחום 0-3%, שבו שיעור ההריונות נמוך משמעותית. מסקנות אלה ברורות יותר לגבי הריונות ב-IUI, ופחות לגבי שיעורם בקיום יחסי מין.[36][37]
לרוב תופיע טרטוספרמיה כחלק מ-OAT. הגורמים העיקריים הינם וריקוצלה, מחלות חום ואחרות, וגורמים סביבתיים.
טיפול אמפירי בתת-פריון הגבר
לבד מטיפול ספציפי כפי שתואר לעיל, יש המצדדים בטיפול אמפירי במקרים כגון Idiopathic OAT, תסמונת קליינפלטר, אזואוספרמיה (בדרך כלל לפני SSR). הרציונאל העומד מאחורי טיפול הורמונאלי או אחר בדרך כלל מובן ופשוט. אולם, למעט הפרעות מרכזיות כהיפוגונדיזם היפוגונדוטרופי (או תסמונת קלמן במקרה של העדר חוש ריח (Anosmia) נלווה) או חסר מבודד בהורמון מגרה זקיק (Isolated FSH Deficiency), חסרות עדויות ממחקרים גדולים מבוקרים עם הקצאה אקראית (Randomized Controlled Trials),וללא חוסר-אחידות (Heterogeneity), המספקות הוכחות חד-משמעיות ליעילות הטיפול האמפירי בתת-פריון הגבר. בנוסף, ברוב העבודות המתארות שיפור במדדי הזרע לא נבדק (או לא הוכח) שיפור בשיעור ההריונות, ולעתים דווח גם על לידות לאחר תום הטיפול.[38][39]
הטיפול כולל מספר קבוצות, כשמתוכן רק הטיפול ההורמונלי הנו "תרופתי", והשאר מוגדרות כ"תוספים":
- טיפול הורמונלי
- אנדרוגנים – לטסטוסטרון תפקיד חשוב גם בתהליך ייצור הזרע. אולם, במשך השנים התרבו העדויות כי הטיפול דווקא גורם לעיכוב התהליך, ובמספר לא קטן של עבודות ניסו החוקרים אף לבסס את מעמד הטסטוסטרון כאמצעי מניעה גברי (Male contraceptive). ניסיונות טיפול במינונים נמוכים, או בחינת תופעת Rebound (שיפור מדדי הזרע לאחר הפסקת טיפול) לא הוכחו כיעילים.
- קלומיפן ציטראט ((Clomiphene Citrate (CC) – אגוניסט/אנטגוניסט חלקי לקולטן של אסטרוגן. בעל פעילות מרכזית על ידי חסימת המשוב השלילי של אסטרוגן על ייצור גונדוטרופינים. סך האפקט גורם להגברת הפרשת GnRH (Gonadotropin-releasing hormone) בהיפותלמוס, המעלה הפרשת הורמון הצהבה (והורמון מגרה זקיק) בבלוטת יותרת המוח (היפופיזה), וכתוצאה עליה ברמות טסטוסטרון אנדוגני. הצלחת הטיפול תלויה בתפקוד מינימלי מסוים של הציר היפותלמוס-היפופיזה-אשכים ובבקרה האנדוקרינית המורכבת שלו. ברמת האשך, למשל, אם משווים את שני התפקודים שלו, ייצור זרע למול ייצור טסטוסטרון, הרי שהשני עמיד יותר מהראשון לפגיעות שונות, אך במקרה של ירידה משמעותית במספר ו/או תפקוד תאי ליידיג (Leydig), טיפול ב-CC נדון לכישלון.
- גונדוטרופינים -
- הורמון הצהבה (LH): לווריס (Luveris) - סינטטי (הנדסה גנטית)
- הורמון הגונדוטרופין הכוריוני האנושי (HCG): אוביטרל (Ovitrelle) - סינטטי; פרגניל (Pregnyl) , כוריגון (Chorigon) - מופק משתן של נשים הרות (Beta-HCG).
- הורמון מגרה זקיק (FSH): פורגון (Puregon), גונל (Gonal-F) - סינטטי
- תערובות של הורמון הצהבה והורמון מגרה זקיק המופקות משתן של נשים בגיל הבלות (hMG): מנוגון (Menogon), מנופור (Menopur), פרגונל (Pergonal)
- מעכבי ארומטאז (Aromatase inhibitors)- טסטוסטרון יכול לעבור ארומטיזציה פריפרית (Peripheral aromatization) לאסטרדיול על ידי האנזים ארומטאז (Aromatase) הנמצא גם ברקמת שומן. כתוצאה, גברים (בייחוד אלו הסובלים מהשמנת יתר) עלולים לסבול מאנדוקרינופטיה המתבטאת בטסטוסטרון נמוך ו/או יחס טסטוסטרון לאסטרדיול נמוך. הטיפול אפשרי בתרופה כגון אנאסטרוזול [(Arimidex) Anastrozole], המעכבת ארומטאז ומפחיתה את דיכוי הפרשת גונדוטרופינים על ידי אסטרדיול. התוויה לטיפול היא T/E2 Ratio<10, מחושב ביחידות קונבנציונאליות (Conventional unit) .[24]
- נוגדי חמצון (אנטיאוקסידנטים) - נוכחות שומנים רב-בלתי-רוויים בממברנת תאי הזרע הופכת אותם לפגיעים במיוחד ללחץ חמצוני ול-ROS (Reactive Oxygen species). החומרים שבשימוש כוללים: גלוטתיון (Glutathione), ליקופן (Lycopene), ויטמינים מסוג A,C,E, קו-אנזים קיו 10 (Coenzyme Q10)
- "מחיי זרע" - Sperm Vitalizers - קרניטין (Carnitine), אצטיל-ל-קרניטין (Acetyl-L-Carnitine), פרוקטוז (Fructose), חומצה פולית (Folic Acid), אבץ (Zinc), סלניום (Selenium).
סיכום הטיפול בתת-פריון הגבר
הבירור בתת-פריון הגבר מבוצע בצורה מסודרת תוך כדי בחינת היבטים רפואיים ומעבדתיים לא מעטים, המובילים דרך אבחנה המבדלת לאבחנה יחידה במרבית המקרים. עם זאת, שיעור לא מבוטל של המקרים יישאר אידיופטי, ובשל כך חסר טיפול ספציפי. בשני המצבים קיימים טיפולים שיעילותם מוכחת מבחינת נקודת הסיום של השגת היריון (ולידה). טיפול תרופתי או ניתוחי בגבר יתבצע רק לאחר הערכת פוטנציאל הפריון של בת-זוגתו. ניתן לשקול טיפול אמפירי במצבים מסוימים, תוך כדי הסבר לזוג על יעילותם השנויה במחלוקת.
פרוגנוזה
רובם המכריע של הגברים הלוקים בתת-פריון הגבר ניתנים לבירור מרפאתי פשוט וקצר יחסית. רק מיעוטם יזדקקו לבדיקות מורכבות, ואלה צריכות להיעשות בצורה מושכלת. מטרת הבירור לזהות סיבות הפיכות ומחלות רקע ולטפל בהן, אם על ידי שינוי התנהגותי או באורח החיים, אם על ידי טיפול תרופתי או ניתוחי. חלק מהסיבות אינן ניתנות לתיקון כלשהו, אך בעזרת אמצעים מודרניים, גברים רבים שבעבר אובחנו כעקרים, והאפשרויות היחידות שעמדו לרשותם היו תרומת זרע או אימוץ, יכולים כיום להפוך לאבות לצאצא ביולוגי.
דגלים אדומים
ביבליוגרפיה
- ↑ 1.0 1.1 Thonneau P, Marchand S, Tallec A, Ferial ML, Ducot B, Lansac J, Lopes P, Tabaste JM, Spira A. Incidence and main causes of infertility in a resident population (1,850,000) of three French regions (1988–1989). Hum Reprod 1991; 6:811–816.
- ↑ Spira A. Epidemiology of human reproduction. Hum Reprod 1986; 1:111-115.
- ↑ Gibbs N. Making Time for a baby. Time, April 15, 2002.
- ↑ Nudell DM, Monoski MM, Lipshultz LI. Common medications and drugs: how they affect male fertility. Urol Clin North Am 2002; 29:965-973.
- ↑ Ramlau-Hansen CH, Thulstrup AM, Aggerholm AS, Jensen MS, Toft G, Bonde JP. Is smoking a risk factor for decreased semen quality? A cross-sectional analysis. Hum Reprod 2007; 22:188-96.
- ↑ Shin D, Lipshultz LI, Goldstein M, Barmé GA, Fuchs EF, Nagler HM, McCallum SW, Niederberger CS, Schoor RA, Brugh VM 3rd, Honig SC. Herniorrhaphy with polypropylene mesh causing inguinal vasal obstruction: a preventable cause of obstructive azoospermia. Ann Surg 2005; 241:553-558.
- ↑ 7.0 7.1 7.2 WHO Laboratory Manual for the Examination of Human Semen and Semen-Cervical Mucus Interaction, Fourth edition. Cambridge, Cambridge University Press, 1999.
- ↑ Mallidis C, Howard EJ, Baker HWG. Variation of semem quality in normal men. Int J Androl 1991; 14:99-107.
- ↑ Guzick DS, Overstreet JW, Factor-Litvak P, Brazil CK, Nakajima ST, Coutifaris C, Carson SA, Cisneros P, Steinkampf MP, Hill JA, Xu D, Vogel DL; National Cooperative Reproductive Medicine Network. Sperm morphology, motility, and concentration in fertile and infertile men. N Engl J Med 2001; 345:1388-1393.
- ↑ O'brien J and Zini A. Sperm DNA integrity and male infertility. Urology 2005; 65:16-22.
- ↑ Zini A, blumenfeld A, Libman J, Willis J. Beneficial effect of microsurgical varicocelectomy on human sperm DNA integrity. Hum Reprod 2005; 20:1018-1021.
- ↑ Shefi S, Turek PJ. Definition and current evaluation of subfertile men. Int Braz J Urol 2006; 32:385-397.
- ↑ Shefi S, Turek PJ: Sex Chromosome Abnormalities and Male Infertility: A Clinical Perspective. In The Sperm Cell: Production, Maturation, Fertilization, Regeneration. 2006, Cambridge University Press, England.
- ↑ Cayan S, Lee D, Black LD, Reijo Pera RA, Turek PJ. Response to varicocelectomy in oligospermic men with and without defined genetic infertility. Urology 2001; 57:530-535.
- ↑ Raviv G, Mor Y, Levron J, Shefi S, Zilberman D, Ramon J, Madgar I. Role of transrectal ultrasonography in the evaluation of azoospermic men with low volume ejaculate. J Ultrasound Med 2006; 25:825–829.
- ↑ Meng MV, Greene KL, Turek PJ. Surgery or assisted reproduction? A decision analysis of treatment costs in male infertility. J Urol 2005; 174:1926-1931.
- ↑ Honig SC, Lipshultz LI, Jarow JP. Significant medical pathology uncovered by a comprehensive male infertility evaluation. Fertil Steril 1994; 62:1028-1034.
- ↑ Sigman M, Jarow JP. Male infertility. In Wein AJ, Kavoussi LR, Novick LC, Partin AW, Peters CA (Eds) Campbell-Walsh Urology, 9th edition, 2007, pp. 609-653, Philadelphia ,Saunders
- ↑ Shefi S, Turek PJ. Definition and current evaluation of subfertile men. Int Braz J Urol 2006;32:385-397
- ↑ Turek PJ. Practical approaches to the diagnosis and management of male infertility. Nat Clin Pract Urol 2005;2:226-238
- ↑ Torres-Calleja J, González-Unzaga M, DeCelis-Carrillo R, Calzada-Sánchez L, Pedrón N. Effect of androgenic anabolic steroids on sperm quality and serum hormone levels in adult male bodybuilders. Life Sci. 2001;68:1769-1774
- ↑ Shefi S, Tarapore PE, Walsh TJ, Croughan M, Turek PJ. Wet heat exposure: a potentially reversible cause of low semen quality in infertile men. Int Braz J Urol 2007;33:50-56; discussion 56-57
- ↑ Gui YL, He CH, Amory JK, Bremner WJ, Zheng EX, Yang J, Yang PJ, Gao ES. Male hormonal contraception: suppression of spermatogenesis by injectable testosterone undecanoate alone or with levonorgestrel implants in chinese men. J Androl 2004;25:720-727
- ↑ 24.0 24.1 Raman JD, Schlegel PN. Aromatase inhibitors for male infertility. J Urol 2002;167:624-629
- ↑ Augarten A, Yahav Y, Kerem BS, Halle D, Laufer J, Szeinberg A, Dor J, Mashiach S, Gazit E, Madgar I. Congenital bilateral absence of vas deferens in the absence of cystic fibrosis. Lancet 1994;26:1473-1474.
- ↑ Smith JF, Walsh TJ, Turek PJ. Ejaculatory duct obstruction. Urol Clin North Am 2008;35:221-227
- ↑ Shin D, Lipshultz LI, Goldstein M, Barmé GA, Fuchs EF, Nagler HM, McCallum SW, Niederberger CS, Schoor RA, Brugh VM 3rd, Honig SC. Herniorrhaphy with polypropylene mesh causing inguinal vasal obstruction: a preventable cause of obstructive azoospermia. Ann Surg. 2005;241:553-558
- ↑ Bettocchi C, Verze P, Palumbo F, Arcaniolo D, Mirone V. Ejaculatory disorders: pathophysiology and management. Nat Clin Pract Urol 2008;5:93-103
- ↑ MacLeod J. Seminal cytology in the presence of varicocele. Fertil Steril 1965;16:735-757
- ↑ McConnell JD. Abnormalities in sperm motility: techniques of evaluation and treatment. In: Lipshultz LI, Howards SS (Eds) Infertility in the Male, 3rd edn, 1997, pp. 249–267, New York, Mosby
- ↑ Sigman M, Lopes L. The correlation between round cells and white blood cells in the semen. J Urol 1993;149:1338–1340
- ↑ Leibovitch I, Mor Y. The vicious cycling: bicycling related urogenital disorders. Eur Urol 2005;47:277-286
- ↑ O'Brien J, Zini A. Sperm DNA integrity and male infertility. Urology 2005;65:16-22
- ↑ Zini A, Blumenfeld A, Libman J, Willis J. Beneficial effect of microsurgical varicocelectomy on human sperm DNA integrity. Hum Reprod 2005;20:1018-1021
- ↑ Kruger TF, Acosta AA, Simmons KF, Swanson RJ, Matta JF, Oehninger S. Predictive value of abnormal sperm morphology in in vitro fertilization. Fertil Steril 1988;49:112-117
- ↑ Van Waart J, Kruger TF, Lombard CJ, Ombelet W. Predictive value of normal sperm morphology in intrauterine insemination (IUI): a structured literature review. Hum Reprod Update 2001;7:495-500
- ↑ van der Merwe FH, Kruger TF, Oehninger SC, Lombard CJ. The use of semen parameters to identify the subfertile male in the general population. Gynecol Obstet Invest 2005;59:86-91
- ↑ Isidori AM, Pozza C, Gianfrilli D, Isidori A. Medical treatment to improve sperm quality. Reprod Biomed Online 2006;12:704-714
- ↑ Kumar R, Gautam G, Gupta NP. Drug therapy for idiopathic male infertility: rationale versus evidence. J Urol 2006;176:1307-1312


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק