גלאוקומה (ברקית) - Glaucoma
הופניתם מהדף ברקית (גלאוקומה) צרת זווית לדף הנוכחי.
| גלאוקומה (ברקית) | ||
|---|---|---|
| Glaucoma | ||
| 250px | ||
| ICD-10 | Chapter H 40. Chapter H 42. | |
| ICD-9 | 365 | |
| MeSH | D005901 | |
| יוצר הערך | פרופ' דני געתון וד"ר יניב ברקנא | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – גלאוקומה
גלאוקומה (Glaucoma או בעברית ברקית) היא קבוצה של מחלות שבהן מופיע נזק לעצב הראיה, המלווה בנזק בשדה הראיה. הנזק עלול להיגרם כתוצאה מלחץ תוך עיני גבוה, אולם לעיתים הוא יכול להיגרם אף שהלחץ בעין הוא בטווח הנורמלי.
רוב סוגי הגלאוקומה השונים הן מחלות ותופעות של הגיל המבוגר, אך מיעוטן מופיעות בגיל צעיר, בילדות ואף בלידה.
לרוב, פוגעת הגלאוקומה בשתי העיניים, אם כי לעיתים המחלה אינה סימטרית ואפילו מוגבלת לעין אחת בלבד. המחלה מחמירה עם הזמן, ובהיעדר טיפול, היא עלולה להוביל לעיוורון.
אובדן הראיה בגלאוקומה הוא בלתי הפיך, אך על ידי איתור מוקדם וטיפול קבוע, ניתן למנוע או להאט את התקדמות הנזק לעצב הראיה ולשדה הראיה. מכין שהמחלה היא לרוב א-תסמינית, זו הסיבה לחשיבות הרבה של ביקור סדיר אצל רופא העיניים בקרב האוכלוסייה בכלל ואצל קרובי משפחה של חולי גלאוקומה בפרט.
אפידמיולוגיה
גלאוקומה הינה הסיבה השנייה בשכיחותה לעיוורון בעולם, עם כ-8 מיליון עיוורים.[1]
במחקרי היארעות אחרונים, המחלה הוגדרה כמקובל היום, קרי על פי נזק לעצב ושדה הראייה ולא על-פי הלחץ התוך עיני. באוכלוסייה לבנה נצפתה שכיחות של 4-3 אחוזים בסוג השכיח – גלאוקומה פתוחת זווית, כשהשכיחות עולה משמעותית עם הגיל מ-1 אחוז במבוגרים צעירים ליותר מ-4 אחוזים מעל 70[2][3] השכיחות שונה במקצת בגזעים שונים כגון באוכלוסייה שחורה ובארצות אסיה.
אטיולוגיה
המשותף לכל סוגי הגלאוקומה הוא נזק אופייני, ניתן לומר פתוגנומוני, לעצב הראיה, עם היעלמות מתמשכת של האקסונים המרכיבים אותו. לאחר נזק משמעותי בעצב הראיה, מופיע נזק בשדה הראיה של החולה, אף הוא אופייני לכלל המחלות בקבוצה ואף הוא מתמשך עד כדי עיוורון.
עדיין לא ברור תהליך הנזק לסיבי העצב ואיך ברמה התאית-מולקולרית הוא נגרם משנית לעליית לחץ עיני. התאוריה הרווחת – המכנית - גורסת שהמבנה התומך בראש עצב הראייה, ה-Lamina cribrosa, נפגע, נחלש וקורס, וכתוצאה מכך נפגעים סיבי העצב.[4] המבנה התומך והסיבים עצמם עלולים להיפגע כתוצאה מאי ספיקה וסקולרית ואיסכמיה,[5] או חומרים המופרשים בעודף על ידי תאים אסטרוציטים ומיקרוגלייה.[6][7] הרחק מראש עצב הראייה, ברשתית עצמה, יש עדויות לאפופטוזיס בגוף ה-Retinal ganglion cell, תהליך שיכול להיות משני לפגיעה בראש העצב, אך ייתכן גם ראשוני.[8]
לחץ תוך עיני
ערך מורחב – גלאוקומה - הקשר ללחץ תוך עיני מוגבר - Glaucoma and increased intraocular pressure
לחץ תוך עיני גבוה הוא גורם הסיכון העיקרי לגלאוקומה. ברוב העיניים עם גלאוקומה יש לחץ תוך עיני הגבוה מהנורמלי (ממוצע+2 סטיות תקן, כלומר 21 מילימטר כספית), וככל שהלחץ התוך עיני גבוה יותר, עולה הסיכון לפתח גלאוקומה. לחץ תוך עיני גבוה מיוחס לדגנרציה ותפקוד לקוי של מנגנון הפינוי מהעין של מי הלשכה (Aqueous humor), קרי מערכת ה-Trabecular meshwork – Schlemm’s canal. למרות המחקר הרב, עדיין לא ברור בדיוק איך נוזל מתפנה בעין הבריאה ואיך הפינוי משתבש בעין עם גלאוקומה.[9][10]
גלאוקומה עם זווית פתוחה וסגורה
יש סוגים רבים של גלאוקומה. חלוקה אחת ראשית של גלאוקומה היא לפי מבנה הזווית שבין הקשתית ודופן העין: גלאוקומה עם זווית פתוחה וגלאוקומה עם זווית סגורה (ראו תרשים 1). ברוב מקרי הגלאוקומה (לפחות באוכלוסייה לבנה), הזווית היא פתוחה, יש גישה חופשית של נוזל הלשכה אל אזור ה-Trabecular meshwork, אך הפינוי פגום ברמה התאית-מולקולרית. בעין עם זווית סגורה (מיעוט המקרים, כ-20-10 אחוזים ממקרי הגלאוקומה) הקשתית נוגעת בדופן הפנימי של העין, הגישה של נוזל אל אזור ה-Trabecular meshwork חסומה פיזית, ובמקרים אלה, הסיבה לעליית הלחץ התוך עיני ברורה יותר.
גלאוקומה ראשונית ומשנית
ברוב המקרים, הגלאוקומה היא "ראשונית", כלומר לא מזוהה מחלה בעין שבעתיה נגרמה הגלאוקומה. יש מקרים בהם הגלאוקומה משנית לגורם ראשוני שניתן לזהות.
גלאוקומה משנית לסינדרום פסוידו-אקספוליאציה
בסינדרום פסוידו-אקספוליאציה (Pseudoexfoliation syndrome) קיים פיזור של חומר פיברילרי אבנורמלי השוקע על אברוני המקטע הקדמי של העין. בגלאוקומה שמופיע בעיניים אלה אפשר להניח שפינוי הנוזל מהעין נפגע משנית לשקיעה של חומר זה באזור ה-Trabecular meshwork.[11]
גלאוקומה משנית ל-Pigment dispersion syndrome
ב-Pigment dispersion syndrome קיים פיזור אבנורמלי של גרנולות פיגמנט במקטע הקדמי של העין, ובתוך כך פגוציט וזה מוגברת של פיגמנט על-ידי תאי ה-Trabecular meshwork. רק בחלק מהעיניים עם סינדרום זה מתפתחת גלאוקומה, כאשר האופייני לה שהיא קורית כבר בעשור השני או השלישי לחיים. במקרים אלה, ניתן לייחס את ההפרעה בתאי ומרכיבי ה-Trabecular meshwork לשקיעת כמות גדולה של הפיגמנט.[12]
גלאוקומה בילדות
כשגלאוקומה מופיעה בילדות ובגיל צעיר (Juvenile) או סמוך ללידה (Congenital) מניחים כי קיים מום מולד באזור הניקוז. גלאוקומה יכולה להיות הבטוי היחיד למום כזה, או ללוות סינדרום רחב יותר של פגיעה באברוני המקטע הקדמי של העין כגון קטרקט מולד או קשת המחלות של Anterior segment dysgenesis ("Axenfeld Rieger Syndrome").
Neovascular glaucoma
כשיש איסכמיה של העין, למשל משנית לסכרת או חסימת וריד או עורק מרכזי ברשתית, מופרשים בעין Vascular growth factors הגורמים לצמיחה לא נורמלית של ריקמה נאו-ווסקולרית בזווית העין. רקמה זו גורמת לחסימת אזור ה-Trabecular meshwork ולכן לגלאוקומה קשה המחייבת בדרך כלל טיפול ניתוחי. יש לציין שאם צמיחת כלי הדם החדשים מזוהה בשלב מוקדם, ניתן לגרום להעלמה על-ידי שיפור זרימת הדם לעין או הזרקה של נוגדי Vascular growth factor לעין.
גלאוקומה נרכשת מסיבות אחרות
גלאוקומה יכולה להגרם מכל פגיעה נירכשת באזור הניקוז, כגון משנית לחבלה, שימוש ממושך בתכשירים סטרואידלים, ומחלות עיניות כמו Uveitis.
גנטיקה של גלאוקומה
הרקע הגנטי לגלאוקומה מובן רק בחלק קטן. לקרוב משפחה מדרגה ראשונה של חולה גלאוקומה יש סיכון מוגבר של כ-10 אחוזים לחלות בגלאוקומה. זוהו עד היום כ-25 מיקומים (Loci) הקשורים בגלאוקומה אך רק 3 גנים, כאשר מוטציות ידועות אלו נמצאות רק בחלק קטן מאד מחולי הגלאוקומה.[13]
קליניקה
תסמינים
אדם חולה בגלאוקומה בדרך כלל אינו סובל מתסמינים כלשהם. הוא אינו סובל מכאב, אינו מרגיש את הנזק שמתהווה לאיטו בשדה הראיה ולמעשה איננו מודע כלל לנזק ההולך ומתקדם בעצב הראיה.
אבחנה
אבחון מוקדם של גלאוקומה, לפני שנגרם נזק נירחב ובלתי-הפיך לעצב ולראייה, מאפשר מניעת המשך נזק ועיוורון. כאמור, החולים לא מרגישים סימנים כלשהם ברב שלבי המחלה ולכן איבחון מוקדם יכול להעשות רק בבדיקה של רופא העיניים.
המלצות לאבחון מוקדם
לאור זאת מומלץ בכל העולם ובישראל לכל אדם מגיל 40 שנה ומעלה להגיע לבדיקה שנתית אצל רופא העיניים שתכלול בדיקה ספציפית לגלאוקומה. לאותם אנשים אשר להם גורמי סיכון אותם מנינו בפרק הקודם, כגון קרוב משפחה עם גלאוקומה או מדידה בעבר של לחץ תוך עיני גבוה, יש צורך להגיע לבדיקות תכופות יותר ולעיתים מגיל מוקדם יותר, על פי המלצות רופא העיניים. עקב החשיבות הגדולה של איתור מוקדם של חולי גלאוקומה א-תסמיניים, בדיקת עיניים זו כלולה בבדיקות סקר רבות במקומות עבודה. כמו-כן בשנים האחרונות נעשית פעילות להעלת המודעות של הציבור להבדק, כמו ביום הגלאוקומה הבינלאומי בו מומחי גלאוקומה בכל העולם יוצאים לבדוק עוברי אורח במקומות ציבוריים.
סימנים בבדיקת העין ובדיקות עזר
בדיקת חדות הראיה
חדות הראייה, ראיית ה"פרטים" המתבצעת באזור זעיר במרכז שדה הראייה, אינה נפגעת עד לשלב מאוחר ביותר במחלה. ייתכן וחולה גלאוקומה יהיה מסוגל לקרוא את הכתב הקטן ביותר בעיתון אך מבחינה חוקית יוכר כעיוור בגלל הצמצום הניכר בשדה הראייה.
בדיקה במנורת הסדק
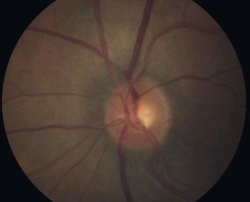
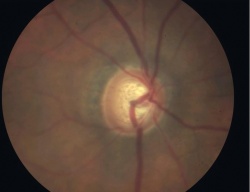
זהו המכשיר הבסיסי אשר בו יושב הנבדק מצד אחד ורופא העיניים בצד האחר המאפשר את בדיקת העין בהגדלה עם תאורה מתאימה. כחלק מבדיקת העין, ניתן לראות את ראש עצב הראייה ולהעריך אם וכמה יש פגיעה מגלאוקומה; ככל שאובדן סיבי העצב גדול יותר, כך הרקמה העצבית נהיית דקה יותר, והחלל במרכז ראש העצב (ה"שקע") נהייה גדול יותר (תרשים 2). על גבי מכשיר זה נמצא גם המכשיר אשר בעזרתו מודדים את הלחץ התוך עיני - הטונומטר על שם גולדמן. מכשיר זה משטיח שטח ידוע של הקרנית, מודד את הכח הדרוש לכך, ולפי שני נתונים אלה מציג את הערכה ללחץ התוך עיני ביחידות של מילימטר כספית. הלחץ התקין (ממוצע באוכלוסייה ± 2 סטיות תקן) נע בין 10–20 מילימטר כספית. בחלק גדול מחולי הגלאוקומה נמדד לחץ גבוה מ-20, לפחות בחלק מהזמן. אך יש לציין כי בכ-10 אחוזים מנבדקים בריאים, ללא גלאוקומה, ניתן למצוא בבדיקה אקראית לחץ גבוה מ-20; אלה נקראים Ocular hypertension ומחייבים מעקב צמוד או טיפול מונע בגלל הסיכון הגדול יותר לפתח גלאוקומה.[14] כמו-כן יש לא מעט חולים בהם נמדדים ערכי לחץ בתחום הנורמאלי אך בכל זאת מתפתחת גלאוקומה; המחלה במקרים אלה מכונה Low tension glaucoma.
בשימוש בעדשות שונות יכול רופא העיניים לבדוק את הזווית בקדמת העין כדי לאבחן אם היא פתוחה או סגורה (תרשים 1), ואזורים נוספים בעין כמו הרשתית.
לרשותו של רופא העיניים ישנן גם בדיקות עזר חשובות.
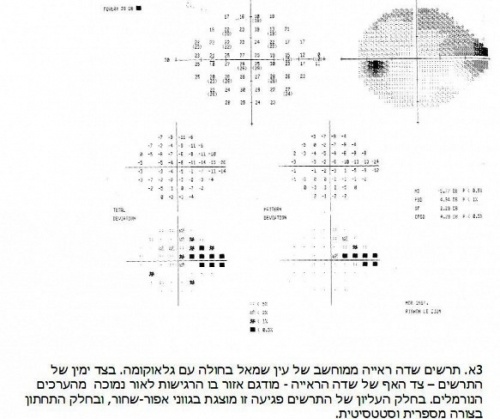
בדיקת שדה הראיה
במחלת הגלאוקומה מופיע בדרך-כלל נזק בשדה הראיה ההיקפי ועם התקדמות המחלה, השדה נפגע יותר ויותר לכיוון מרכז הראיה (תרשים 3). לכן, הבדיקה החשובה ביותר לאבחון ולמעקב אחר חולה גלאוקומה היא בדיקת שדה הראיה, שהיום הינה אוטומטית וממוחשבת. במהלך הבדיקה, האורכת מספר דקות, הנבדק מביט במרכז המכשיר בזמן שמראים לו נקודות אור, בעוצמות שונות (אם כי חלשות למדי), בהיקף שדה הראיה. הבדיקה אינה אובייקטיבית, אלא תלויה בשיתוף הפעולה המלא של הנבדק, האמור להתרכז ולהיות מסוגל ללחוץ על כפתור בכל פעם שרואה נקודת אור. כאשר מופיעים חסרים בשדה הראיה (הנקראים גם סקוטומות) מתרגם המכשיר את הנזק למפה מודפסת של הרגישות לאור בכל עין.
בדיקה זו חשובה מאד ובעזרתה מקבל רופא העיניים החלטות על המצאות מחלת הגלאוקומה, על התקדמותה ועל הצורך לשנות טיפול לאור זאת. לכן יש חשיבות מכרעת לשילוב הבדיקה באופן סדיר במהלך המעקב אחר חולי גלאוקומה.
אגב, לכל אדם מופיע חסר בצורת כתם שחור במפת שדה הראיה שלו. זהו "הכתם העיוור" המסמן את חיבור עצב הראייה לגלגל העין, אזור שבו לא קיימת רקמת רשתית ולכן לא קיימים פוטו-רצפטורים, וכמובן לא מצביע על בעיה.
ידוע כי על מנת שיופיע פגם ראשוני בשדה הראיה מגלאוקומה (לפחות בטכנולוגיה המשמשת היום לבדיקת השדה) יש צורך בנזק של קרוב ל־50 אחוזים מסיבי עצב הראיה.[15][16] כלומר קיימת רזרבה גדולה הנפגעת בתחילת המחלה, והעדר איבחון של פגם בשדה הראייה אינו מעיד בהכרח על העדר גלאוקומה.
צילום ראש עצב הראיה
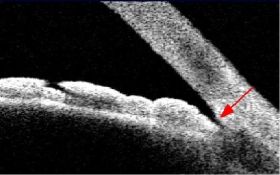
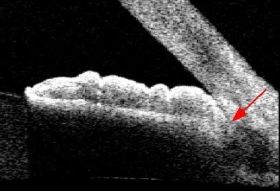
אחת הבדיקות הנוספות לגלאוקומה היא צילום של עצבי הראיה, שהיום הינו סטריאוסקופי (היינו צילום עם אפקט תלת-ממדי) והפך מצילום שיקופיות לצילום דיגיטלי. הוספת מימד העומק חשובה להערכה מלאה ונכונה יותר של מבנה עצב הראיה וזיהוי מוקדם של תהליך גלאוקומטוטי בו. תיעוד מראה העצב חשוב מאד לצורך השוואה בבדיקות עתידיות – בעין בריאה לא ייתרחש שינוי במבנה העצב, אך בעין עם גלאוקומה אפשר לגלות הדקקות פרוגרסיבית של הרקמה העצבית בראש עצב הראייה.
הדמיה לעצבי הראיה
בשנים האחרונות קיימות שיטות שונות להדמיה כמותית של עצבי הראיה. מכשירים אלה מאפשרים לספק מדדים שונים על עצב הראיה ומסביבו, כולל לגבי עובי העצב ושכבת הסיבים הנכנסת לתוכו. על-ידי השוואת המדדים הנמדדים לערכים באוכלוסייה בריאה ולערכים שנמדדו בעבר באותה העין ניתן להיעזר בבדיקות אלה לאבחון גלאוקומה והערכת התקדמות המחלה.
בארץ המכשיר המוביל בצילום והדמיה של עצבי הראיה, הוא מכשיר ה-OCT (Optical Coherence Tomography).
לעיתים רחוקות, בעיקר כשהאבחנה של גלאוקומה מוטלת בספק כמו במצבי גלאוקומה עם לחץ תוך עיני נורמלי או נמוך יש שימוש בבדיקות נוספות כגון בדיקה נוירולוגית והדמיה של ארובת העין והמוח בעזרת CT (Computed Tomography) או MRI (Magnetic Resonance Imaging).
טיפול
הטיפול בגלאוקומה מתמקד בהורדת הלחץ התוך עיני. הוכח שהורדת הלחץ מאיטה ואף עוצרת את התקדמות המחלה,[17] וזאת הן בחולי גלאוקומה עם לחץ תוך עיני מוגבר,[14][18][19] והן בחולים עם לחץ תוך עיני בתחום הנורמלי.[20]
כחלק מהמחקר הרב המושקע במציאת טיפול למחלות נוירו-דגנרטיביות אחרות, כך גם בגלאוקומה נחקרים אמצעים לשיפור זרימת הדם לראש עצב הראיה, מניעת הרס טוקסי של סיבי העצב, ועוד שיטות טיפוליות, אך אף אחת לא הגיעה לשימוש קליני.
הורדת הלחץ התוך עיני מתייחסת להורדתו לערכים כאלה שבהם צפוי כי המחלה לא תתקדם יותר ולא ייגרם נזק נוסף לעצב הראיה ולשדה הראיה. לרוב, הורדת הלחץ מביאה להאטה משמעותית בקצב התקדמות הנזק. לעיתים רחוקות למרות הורדה משמעותית בלחץ התוך עיני, עדיין מראה המחלה סימני התקדמות והופעת נזקים חדשים בעצב ובשדה.
הטיפול להורדת לחץ תוך עיני בגלאוקומה מבוסס על שלוש אפשרויות. אצל מרבית החולים מתחילים במתן תרופות לעיניים בצורת טיפות; במקרים מעטים כולל הטיפול גם כדורים בבליעה. אפשרות שנייה היא טיפול בלייזר. במיעוט החולים, אצלם לא ניתן להוריד את הלחץ התוך עיני לערכים הנדרשים בעזרת תרופות ולייזר, מבוצע טיפול ניתוחי.
ההחלטה כיצד לטפל ובאיזה מהטיפולים לבחור נעשית על ידי רופא העיניים. בבחירת האסטרטגיה הטיפולית עבור החולה מרכז הרופא מצד אחד את המידע הקיים בספרות הרפואית, המצביע על כך שככל שהורדת הלחץ גדולה יותר כך גם היעילות בעצירת המחלה גדולה יותר, ומצד שני את המידע והנתונים הרבים על מצב החולה עצמו. למעשה הטיפול "נתפר" באופן אישי, לחולה המסוים ואין הוא זהה בהכרח לחולים אחרים. על מנת להגיע להחלטה נלקחת בחשבון חומרת המחלה ומידת הנזק שנגרם כבר לעצב הראיה ולשדה הראיה. גורמים נוספים נלקחים בחשבון כמו גיל החולה (או מדויק יותר ה-Life expectancy), סוג הגלאוקומה, הלחץ התוך עיני ההתחלתי, מצב העין השנייה ועוד נתונים ומאפיינים של העיניים.
הטיפולים השונים בגלאוקומה לא מסוגלים לרפא את המחלה או לתקן נזק שכבר נגרם ממנה לעצבי הראיה, אך כאמור, יכולים למנוע או להאט משמעותית את ההתקדמות האפשרית בנזק. מטרת הטיפול אינה בהכרח לעצור את המחלה לחלוטין, אלא להביא לכך שלמטופל תישאר ראייה תפקודית עד יומו האחרון.
כאמור, מרבית חולי הגלאוקומה מטופלים בהצלחה בעזרת הטיפות השונות המיועדות להורדת הלחץ התוך עיני. מיעוט המטופלים נזקקים גם לכדורים, לטיפול לייזר ובמקרים מסוימים גם לניתוח.
ברפואת העיניים המודרנית נעשים מאמצים רבים לזיהוי ואבחון הגלאוקומה בשלבים המוקדמים ככל האפשר, לפני הופעת נזק תפקודי בשדה הראיה. התוצאה היא שכיום הרוב הגדול של מטופלי הגלאוקומה שומרים על ראיה טובה ויעילה ואילו עיוורון מגלאוקומה הוא נדיר יחסית.
הטיפול התרופתי בגלאוקומה
הטיפול התרופתי בגלאוקומה כולל טיפות מקומיות לעין ולעיתים טיפול בתרופות הנלקחות דרך הפה. הטיפול מתחיל בתכשיר אחד אך לעיתים קרובות יש צורך ביותר מתכשיר אחד על מנת להגיע להורדה משמעותית של הלחץ התוך עיני. על מנת לקבל שיתוף פעולה מלא מצד המטופל יקבע רופא העיניים את הטיפול המתאים לחולה, תוך יעילות גבוהה של התרופה, שמירת בטיחות החולה, עם מיעוט תופעות הלוואי, קלות שימוש, מעט הזלפות ביום, והקפדה על איכות חיי החולה. בדומה לטיפול במחלות כרוניות אחרות, המעקב כולל התמודדות עם הקושי המשמעותי של הענות המטופל לטיפול התרופתי.[21]
התרופות מתחלקות לשתי קבוצות עיקריות: בקבוצה אחת נמצאות כל התרופות המורידות את יכולת הייצור של הנוזל בעין וכך יורד הלחץ התוך עיני. בקבוצה השנייה נמצאים כל התכשירים בעלי היכולת להגביר את הניקוז של הנוזל הקיים בעין.
ישנן תרופות אשר להן יכולת משולבת הן בהורדת הייצור והן בהגברת הניקוז.
להלן תיאור בקצרה של הקבוצות העיקריות והשימושיות של התרופות לגלאוקומה.
חוסמי רצפטורי בטא
תכשירים אלה מורידים את הייצור של נוזל העין ונלקחים פעם או פעמיים ביום.
לקבוצת תרופות זו שייכת התרופה Tiloptic (Timolol).
לתרופות האלה יש מעט מאד תופעות לוואי בעיניים אך עקב ספיגה סיסטמית ייתכנו תופעות גופניות כמו בשימוש בחוסמי בטא סיסטמיים, קרי השפעה על קצב הלב או החמרה של מחלת ריאות כרונית כגון ברונכיטיס כרונית או אסתמה. לעיתים נדירות נגרם ירידה בפעילות מינית והגברת תחושות דיכאוניות ואף בלבול.
חוסמי האנזים קרבוניק אנהידרזה (Carbonic anhydrase)
תרופות אלה מורידות את יכולת הייצור של נוזלי העין.
בקבוצה זו נכללים שני סוגי תכשירים האחד בצורת טיפות והשני בצורת כדורים או קפסולות לבליעה.
הטיפות נלקחות פעמיים עד שלוש פעמים ביום והכדורים ניתנים במינונים שונים בהתאם לחומרת המחלה.
בקבוצת הטיפות נכללים Trusopt (Dorzolamide) וAlcon Azopt (Brinzolamide) (אלקון אזופט;ברינזולאמיד). בקבוצת הכדורים נכללים Uramox (Acetazolamide), דיאמוקס, ו-Methazolamide.
תופעות הלוואי של הטיפות פחותות בצורה משמעותית לעומת הכדורים, וכוללות תגובה אלרגית בעיניים, גירוי ואודם בעין ומסביבה וגם הרגשת טעם מר בפה. לתרופות הנלקחות בבליעה יש תופעות לוואי כלליות ובעיקר תחושת נימול בקצות האצבעות, בחילות, מחושים בבטן ועייפות. במתן ממושך (שאינו שכיח) עלולות תרופות אלה לעודד ייצור אבנים בדרכי השתן, ומאחר והיותן תרופות סולפה ייתכנו אלרגיה או תופעות נדירות מאד כגון הפסקת ייצור כדוריות דם אדומות.
אגוניסטים של רצפטורי אלפא
תרופות אלה מורידות את הלחץ התוך עיני על ידי הקטנת ייצור הנוזל מצד אחד וגם הגברת הניקוז שלו מצד שני. לקבוצה זו שייכות Alphagan P (Brimonidine) (אלפאגן P;ברימונידין) שהינו סלקטיבי לרצפטורים של אלפא-2, ו-Iopidine (Apraclonidine) (איופידין ; אפרקלונידין) והן נלקחות פעמיים ביום, בבוקר ובערב.
תרופות אלה עלולות לגרום גירוי ואודם העיניים, על רקע אלרגי אך גם תופעות כמו יובש בפה, עייפות ועוד.
אגוניסטים של רצפטורי פרוסטגלנדינים (F2alpha)
תרופות אלה מגבירות את הניקוז של נוזלי הלשכה הקדמית והן נלקחות רק פעם אחת ביום, בדרך-כלל לפני השינה. לקבוצה זו שייכות Glautan (Latanoprost), Lumigan (Bimatoprost) ו-Travatan (Travoprost).
לתכשירים אלה יש מעט תופעות לוואי כלליות. בעיניים הם עלולים לגרום לגירוי מקומי ולעיתים להארכת הריסים, התכהות עור הפנים סביב העין, ולעיתים רחוקות יותר להתכהות של צבע הקשתית לגוון יותר חום וכהה. תופעה זו אינה נחשבת לתופעה מסוכנת אלא קוסמטית בלבד. לעיתים נדירות יש קשר בין תרופות אלה לדלקות תוך עיניות ובצקת ברשתית.
תרופות משולבות
מפתחים יותר ויותר תרופות המשלבות שני תכשירים שונים יחד באותו בקבוק. המטרה בפיתוחים אלו היא להוריד את מספר הבקבוקים שמתוכם על החולה לקחת את הטיפות מדי יום ובכך לשפר את ההיענות שלו לטיפול. תופעות הלוואי של תרופות אלו דומות לתופעות של המרכיבים שלהן.
קיימים מספר תכשירים כאלה בעולם וגם בישראל:
- Cosopt (קוסופט) – זהו תכשיר משולב המכיל חוסם ביטא - Timolol וחוסם האנזים קרבוניק אנהידרז - Trusopt. הוא ניתן פעמיים ביום, בבוקר ובערב
- Xalacom (קסלקום) – משלב חוסם ביטא Timolol עם אנלוג הפרוסטגלנדין Xalatan וניתן פעם ביום
פיתוחים של תרופות משולבות כוללות את:
- Combigan (קומביגן) – זהו תכשיר המשלב חוסם ביטא Timolol עם מפעיל רצפטור אלפא (אלפגן) וניתן פעמיים ביום
- Ganfort (גנפורט) – משלב חוסם ביטא Timolol עם פרוסטגלנדין Lumigan וניתן פעם ביום
- Duotrav (דואוטרב) – משלב חוסם ביטא Timolol עם פרוסטגלנדין אחר Travatan וניתן פעם ביום
תרופות נוספות
תרופות אחרות שנמצאות הרבה פחות בשימוש כוללות את הפילוקרפין, אפינפרין (Epinephrine), פרופין ופוספולין יודיד. לתרופות אלה תופעות לוואי, בעיקר בעיניים, אשר בגללן ירד משמעותית השימוש בהן והן ניתנות רק במקרים קשים יותר של גלאוקומה.
תופעות לוואי
לכל תרופה, כולל לטיפות עיניים, ישנן תופעות לוואי העלולות להופיע אצל אדם אחד ולא בהכרח אצל אדם אחר.
להלן מספר תופעות שכיחות העלולות להופיע בשימוש בטיפות עיניים:
- תחושת צריבה, גירוי ואודם בעין ומסביבה
- הרגשת הטיפות בגרון ובלוע
- האטה בדופק הלב – ברדיקרדיה
- קשיי נשימה
- יובש בפה ושינויים בחוש הטעם
- קושי בפעילות גופנית
- כאב ראש
לא כל תופעה חדשה היא תוצאה של הטיפול העיני וכי אין צורך בכל פעם להפסיק את הטיפול המוצע. יש להיוועץ עם רופא העיניים לגבי תופעות כאלו ואחרות ובעזרתו להגיע להחלטה אם יש מקום להמשך הטיפול או החלפתו.
יש חשיבות רבה לדווח לרופא המשפחה על התרופות העיניות אותם מקבל חולה הגלאוקומה על מנת לקשרם עם תופעות של הגוף כולו, כגון בלב או במערכת הנשימה.
לייזר בגלאוקומה
ישנם סוגים שונים של טיפולי לייזר ברפואת עיניים, כל אחד למטרה אחרת. לגלאוקומה קיימים סוגים ספציפיים של טיפולי לייזר, בהתאם לסוג הגלאוקומה.
בגלאוקומה עם זווית פתוחה משתמשים בלייזר לשיפור הניקוז בזווית הלשכה הקדמית (ב-Trabecular meshwork) וזאת או כטיפול ראשוני או בחולים אשר הטיפול התרופתי בהם לא הוריד מספיק את הלחץ התוך עיני. באמצעות הלייזר צורבים אזורים מסוימים בזווית העין, ובמנגנון שאינו מובן דיו משתפרת יכולת הניקוז של העין באזור זה. זוהי פעולה אמבולטורית פשוטה יחסית. טיפול זה - Laser Trabeculoplasty - קיים כבר כ-40 שנים, כשבוצע בדרך כלל עם לייזר מסוג ארגון (Argon Laser Trabeculopalsty או בקיצור ALT). בעשור האחרון קיים לייזר שיעילותו דומה הפועל ללא יצירת כוויות והמכונה Selective Laser Trabeculopalsty או SLT.[22]
קיימים לייזרים נוספים לגלאוקומה כגון לייזר מסוג YAG (Yttrium Aluminum Garnet) המשמש לניקוב הקשתית (Peripheral iridotomy) המיועד לטיפול במצבי גלאוקומה עם זווית סגורה.
טיפול ניתוחי בגלאוקומה
ניתוחי הגלאוקומה מיועדים אף הם להוריד את הלחץ התוך עיני, אצל חולים שלא ניתן להוריד אצלם את הלחץ התוך עיני בעזרת טיפול תרופתי או לייזר. בחולים אלה או שקיימת עדות או שיש סבירות גבוהה להתקדמות המחלה ואובדן ראייה אם הלחץ יישאר ברמה הנוכחית.
העקרון בניתוחים אלו הוא שיוצרים נתיב מתוך העין החוצה לניקוז של נוזל הלשכה הקדמית ובכך מורידים את הלחץ בעין.[23][24]
טרבקולקטומיה
הניתוח הנפוץ ביותר נקרא טרבקולקטומיה (Trabeculectomy). בניתוח זה יוצרים – באופן מבוקר – נקב בדופן העין כך שנוזל יוצא מהלשכה אל מתחת ללחמית ושם נספג. הנקב הוא במחצית עובי דופן העין, כאשר המחצית הנותרת מהווה "גג" לנקב המאפשר בקרה, באמצעות מספר ומתח של תפרים, על קצב יציאת הנוזל. אחוז ההצלחה של ניתוח זה הוא כ-90 אחוזים לאחר שנה, אך זה יורד בהדרגה בהמשך.
כמו בכל ניתוח שבו יוצרים פיסטולה לא טבעית של העברת נוזלים, גם כאן יש נטייה של הגוף לסגור את הנתיב ולגרום לצלקת אשר מפריעה לנוזלים לעבור בו. כיום קיימים חומרים שונים המונחים בזמן הניתוח ולעיתים גם אחריו אשר פועלים למניעת ההצטלקות באזור הרצוי, כגון Mitomycin-C ו-Fluorouracil.[5]
לניתוח זה מספר סיבוכים אפשריים, מוקדמים ומאוחרים. תת-תפקוד או הצטלקות של הפיסטולה ייגרמו ללחץ תוך עיני גבוה מדי, אך מעבר חופשי מדי של נוזל יביא ללחץ נמוך מדי שיכול להיות הרסני לעין ומחייב התערבות ניתוחית נוספת. יצירת נקב בדופן העין משמעו שבניגוד למצב הטבעי, עכשיו בין העולם מלא החיידקים לבין פנים העין מפרידה רק הלחמית, רקמה מוקוזית דקה, וכך המנותח נמצא בסיכון למשך כל חייו לזיהום תוך עיני – Endophthalmitis. סיבוך נוסף אפשרי הינו האצה של התפתחות קטרקט.
השתלת נקז מלאכותי
במקרים בהם ניתוח טרבקולקטומיה אינו אפשרי או צפוי להכשל, משתילים בעין החולה נקז אשר בעזרת צינורית דקה מעביר את הנוזל מתוך העין אל מחוצה לה. קיימים נקזים מסוגים שונים, כגון נקזי Ahmed ו-Baerveldt שבשימוש שנים רבות,[25] וחדישים יותר שמטרתם להיות קטנים יותר ולחכות בצורה פיזיולוגית יותר את מנגנון הניקוז הטבעי.[26]
ישנם מצבים בהם לאותו חולה יש צורך בניתוח גלאוקומה אך גם להוצאת העדשה עקב הופעת ירוד (קטרקט) – במקרים אלה ניתן לשקול ביצוע ניתוח משולב.
מעקב אחר חולה גלאוקומה
גלאוקומה היא מחלה כרונית שכיום לא קיים עבורה פתרון מרפא (Curative) ולכן טיפול נכון בחולה הגלאוקומה ומניעה של פגיעה בראייה מצריכים מעקב סדיר על-ידי רופא עיניים למשך כל חיי החולה. במסגרת המעקב מתבצעת הערכה של עצב הראייה ושדה הראייה כדי לוודא שלא ממשיכה פגיעה בהם. אם אכן נצפית דינמיקה כזו, הטיפול משתנה כדי להביא ללחץ תוך עיני נמוך יותר.
ככלל על חולה גלאוקומה להגיע לרופא העיניים לביקורת תקופתית 2–4 פעמים בשנה על פי הדינמיקה וחומרת המחלה ולפי הנחייתו של הרופא המטפל.
כמו בכל מחלה כרונית המעקב כולל גם בדיקה ווידוא של היענות החולה לטיפול התרופתי. מומלץ שהחולה יביא איתו את כל התרופות הקשורות לגלאוקומה בכל ביקור אל רופא העיניים – כך יוכל רופא העיניים לוודא באם הוא מקבל את הטיפול שהמליץ, לעין הנכונה ובמינון הנדרש.
סיכום והמלצות
גלאוקומה היא מחלה כרונית ומתמשכת עם סיכון להתקדמות הנזק בצורה איטית.
מחלה זו ניתנת לעצירה או לפחות לעיכוב משמעותי בהתקדמותה לרוב על ידי טיפול פשוט יחסית אך ממושך.
מחלה זו דורשת מעקב מתמיד וקבוע אצל רופא העיניים למשך כל החיים.
טיפול מוצלח במחלה כרוך בשיתוף פעולה בין הרופא המטפל לבין החולה ולעיתים גם עם בני משפחתו.
רק בנטילה מדויקת ועקבית של הטיפות, על פי המלצתו של הרופא העיניים, או לעיתים טיפול ניתוחי, ניתן לעצור או לפחות לעכב משמעותית את המחלה ואת סיכוניה, תוך שמירה על הראייה ומכאן גם על איכות החיים.
הערות שוליים
- ↑ Quigley HA, Broman AT. The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol 2006;90(3):262-7
- ↑ Topouzis F, Wilson MR, Harris A, et al. Prevalence of open-angle glaucoma in Greece: the Thessaloniki Eye Study. Am J Ophthalmol 2007;144(4):511-9
- ↑ Mitchell P, Smith W, Attebo K, Healey PR. Prevalence of open-angle glaucoma in Australia. The Blue Mountains Eye Study. Ophthalmology 1996;103(10):1661-9
- ↑ Quigley HA, Hohman RM, Addicks EM, et al. Morphologic changes in the lamina cribrosa correlated with neural loss in open-angle glaucoma. Am J Ophthalmol 1983;95(5):673-91
- ↑ 5.0 5.1 Flammer J, Orgul S, Costa VP, et al. The impact of ocular blood flow in glaucoma. Prog Retin Eye Res 2002;21(4):359-93
- ↑ Neufeld AH, Liu B. Glaucomatous optic neuropathy: when glia misbehave. Neuroscientist 2003;9(6):485-95
- ↑ Tezel G. Oxidative stress in glaucomatous neurodegeneration: mechanisms and consequences. Prog Retin Eye Res 2006;25(5):490-513
- ↑ Kerrigan LA, Zack DJ, Quigley HA, et al. TUNEL-positive ganglion cells in human primary open-angle glaucoma. Arch Ophthalmol 1997;115(8):1031-5
- ↑ Overby DR, Stamer WD, Johnson M. The changing paradigm of outflow resistance generation: towards synergistic models of the JCT and inner wall endothelium. Exp Eye Res 2009;88(4):656-70
- ↑ Tamm ER. The trabecular meshwork outflow pathways: structural and functional aspects. Exp Eye Res 2009;88(4):648-55
- ↑ Schlotzer-Schrehardt U, Naumann GO. Trabecular meshwork in pseudoexfoliation syndrome with and without open-angle glaucoma. A morphometric, ultrastructural study. Invest Ophthalmol Vis Sci 1995;36(9):1750-64
- ↑ Tektas OY, Lutjen-Drecoll E. Structural changes of the trabecular meshwork in different kinds of glaucoma. Exp Eye Res 2009;88(4):769-75
- ↑ Ray K, Mookherjee S. Molecular complexity of primary open angle glaucoma: current concepts. J Genet 2009;88(4):451-67
- ↑ 14.0 14.1 Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol 2002;120(6):701-13; discussion 829-30
- ↑ Quigley HA, Addicks EM, Green WR. Optic nerve damage in human glaucoma. III. Quantitative correlation of nerve fiber loss and visual field defect in glaucoma, ischemic neuropathy, papilledema, and toxic neuropathy. Arch Ophthalmol 1982;100(1):135-46
- ↑ Barkana Y, Burgansky-Eliash Z, Kaplan-Messas A, et al. Quantifying retinal nerve fiber layer loss in glaucoma using a model of unilateral hypertensive pseudoexfoliation syndrome. J Glaucoma 2009;18(8):601-7
- ↑ Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression: results from the Early Manifest Glaucoma Trial. Arch Ophthalmol 2002;120(10):1268-79
- ↑ Lichter PR, Musch DC, Gillespie BW, et al. Interim clinical outcomes in the Collaborative Initial Glaucoma Treatment Study comparing initial treatment randomized to medications or surgery. Ophthalmology 2001;108(11):1943-53
- ↑ The Advanced Glaucoma Intervention Study (AGIS): 7. The relationship between control of intraocular pressure and visual field deterioration.The AGIS Investigators. Am J Ophthalmol 2000;130(4):429-40
- ↑ Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Collaborative Normal-Tension Glaucoma Study Group. Am J Ophthalmol 1998;126(4):487-97
- ↑ Budenz DL. A clinician's guide to the assessment and management of nonadherence in glaucoma. Ophthalmology 2009;116(11 Suppl):S43-7
- ↑ Barkana Y, Belkin M. Selective laser trabeculoplasty. Surv Ophthalmol 2007;52(6):634-54
- ↑ Gedde SJ, Schiffman JC, Feuer WJ, et al. Treatment outcomes in the tube versus trabeculectomy study after one year of follow-up. Am J Ophthalmol 2007;143(1):9-22
- ↑ Gedde SJ, Herndon LW, Brandt JD, et al. Surgical complications in the Tube Versus Trabeculectomy Study during the first year of follow-up. Am J Ophthalmol 2007;143(1):23-31
- ↑ Budenz DL, Barton K, Feuer WJ, et al. Treatment outcomes in the Ahmed Baerveldt Comparison Study after 1 year of follow-up. Ophthalmology;118(3):443-52
- ↑ Freedman J. What is new after 40 years of glaucoma implants. J Glaucoma;19(8):504-8


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק