הבדלים בין גרסאות בדף "גידול על שם וילמס - Wilms' tumor"
מ |
|||
| שורה 16: | שורה 16: | ||
'''הגידול ע"ש וילמס''' ('''Wilms' tumor'''), המוכר גם בשם נפרובלסטומה (Nephroblastoma), הוא הגידול הכלייתי הממאיר הנפוץ ביותר בילדים. | '''הגידול ע"ש וילמס''' ('''Wilms' tumor'''), המוכר גם בשם נפרובלסטומה (Nephroblastoma), הוא הגידול הכלייתי הממאיר הנפוץ ביותר בילדים. | ||
| − | מקור הגידול בתאים עובריים, הנקראים תאים נפרובלסטיים, המעורבים בהתפתחות הכליה בחיים העובריים, ואינם מצויים באופן נורמלי בכליה לאחר הלידה. | + | מקור הגידול בתאים עובריים, הנקראים תאים נפרובלסטיים (Nephroblasts), המעורבים בהתפתחות הכליה בחיים העובריים, ואינם מצויים באופן נורמלי בכליה לאחר הלידה. |
מקס וילמס (1867-1918), מנתח גרמני, היה הראשון שתיאר את המבנה ההיסטולוגי של הגידול, והוא נקרא על שמו. | מקס וילמס (1867-1918), מנתח גרמני, היה הראשון שתיאר את המבנה ההיסטולוגי של הגידול, והוא נקרא על שמו. | ||
| שורה 22: | שורה 22: | ||
== אפידמיולוגיה == | == אפידמיולוגיה == | ||
| − | הגידול על שם וילמס נדיר יחסית: כ - 500 מקרים חדשים מאובחנים בכל שנה בארה"ב. הוא מהווה כ - 6% מכלל הגידולים הממאירים בילדים הצעירים מגיל 15 שנים. זה הגידול התוך-בטני השני בשכיחותו בילדים | + | הגידול על שם וילמס נדיר יחסית: כ-500 מקרים חדשים מאובחנים בכל שנה בארה"ב. הוא מהווה כ-6% מכלל הגידולים הממאירים בילדים הצעירים מגיל 15 שנים. זה הגידול התוך-בטני השני בשכיחותו בילדים, אחרי נוירובלסטומה (Neuroblastoma). היארעות הגידול היא 0.8 מקרים לכל 10,000 ילדים. |
| − | הגידול נדיר במבוגרים; כ - 75% מהמקרים מאובחנים בילדים הצעירים מגיל 5 שנים, עם שיא בילדים בני שנתיים עד חמש. | + | הגידול נדיר במבוגרים; כ-75% מהמקרים מאובחנים בילדים הצעירים מגיל 5 שנים, עם שיא בילדים בני שנתיים עד חמש. הגידול מופיע לרוב בכליה אחת, אולם עד 7% מהמקרים הם דו-צדדיים. |
שכיחות הגידול שווה בין בנים לבנות, והוא שכיח יותר בגזע השחור. | שכיחות הגידול שווה בין בנים לבנות, והוא שכיח יותר בגזע השחור. | ||
| − | במשפחות מסוימות יש נטייה גנטית לפתח גידול מסוג זה; במקרים אלו הגידול יופיע לפני גיל שנתיים, יהיה שיעור גבוה של פגיעה בשתי הכליות, ולעתים קרובות יהיו לאותו פרט מומים מולדים אחרים ([[אנירידיה]], [[ | + | במשפחות מסוימות יש נטייה גנטית לפתח גידול מסוג זה; במקרים אלו הגידול יופיע לפני גיל שנתיים, יהיה שיעור גבוה של פגיעה בשתי הכליות, ולעתים קרובות יהיו לאותו פרט מומים מולדים אחרים ([[אנירידיה]]([[Aniridia]]), [[מומים בדרכי השתן]] ([[Urinary malformations]]), וכדומה). |
== אטיולוגיה == | == אטיולוגיה == | ||
גרסה מ־08:32, 7 במרץ 2012
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| גידול על שם וילמס | ||
|---|---|---|
| Wilms' tumor | ||

| ||
Cut section showing two halves of a nephroblastoma specimen
| ||
| יוצר הערך | ד"ר עמית הס, ד"ר עופרי לביד, ד"ר נחמה שרון 
|
|
הגידול ע"ש וילמס (Wilms' tumor), המוכר גם בשם נפרובלסטומה (Nephroblastoma), הוא הגידול הכלייתי הממאיר הנפוץ ביותר בילדים.
מקור הגידול בתאים עובריים, הנקראים תאים נפרובלסטיים (Nephroblasts), המעורבים בהתפתחות הכליה בחיים העובריים, ואינם מצויים באופן נורמלי בכליה לאחר הלידה.
מקס וילמס (1867-1918), מנתח גרמני, היה הראשון שתיאר את המבנה ההיסטולוגי של הגידול, והוא נקרא על שמו.
אפידמיולוגיה
הגידול על שם וילמס נדיר יחסית: כ-500 מקרים חדשים מאובחנים בכל שנה בארה"ב. הוא מהווה כ-6% מכלל הגידולים הממאירים בילדים הצעירים מגיל 15 שנים. זה הגידול התוך-בטני השני בשכיחותו בילדים, אחרי נוירובלסטומה (Neuroblastoma). היארעות הגידול היא 0.8 מקרים לכל 10,000 ילדים.
הגידול נדיר במבוגרים; כ-75% מהמקרים מאובחנים בילדים הצעירים מגיל 5 שנים, עם שיא בילדים בני שנתיים עד חמש. הגידול מופיע לרוב בכליה אחת, אולם עד 7% מהמקרים הם דו-צדדיים.
שכיחות הגידול שווה בין בנים לבנות, והוא שכיח יותר בגזע השחור.
במשפחות מסוימות יש נטייה גנטית לפתח גידול מסוג זה; במקרים אלו הגידול יופיע לפני גיל שנתיים, יהיה שיעור גבוה של פגיעה בשתי הכליות, ולעתים קרובות יהיו לאותו פרט מומים מולדים אחרים (אנירידיה(Aniridia), מומים בדרכי השתן (Urinary malformations), וכדומה).
אטיולוגיה
האטיולוגיה לגידול ע"ש וילמס גם כיום אינה ידועה במלואה, אך ידועות מספר מוטציות גנטיות המשתתפות בתהליך התפתחות הגידול (WT1 ,WT2).
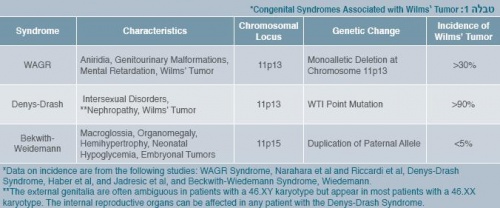
מרבית המקרים של WT הם ספורדיים, אולם הוא מופיע גם בתסמונות גנטיות (טבלה 1), או מתייצג במשפחות בתורשה אוטוזומלית דומיננטית.
התסמונות הגנטיות הידועות הן: WAGR (חוסר של הקשתית בעין, אנומליות של מערכת השתן ופיגור שכלי), Beckwith Wiedemann (מקרוגלוסיה, אורגנו מגליה, המי-היפרטרופיה והיפוגליקמיה בתקופת היילוד) ו-Denys-Drash Syndrome (מלפורמציה במערכת השתן והמין) [1].
היפותזת שני האירועים ב-1971 הציע קנודסון (Knudson) מודל להסברת הופעה בגיל מוקדם ודו-צדדית של גידולי עיניים אצל ילדים עם היסטוריה משפחתית של רטינובלסטומה, לעומת הופעה חד-צדדית במקרים ספורדיים. שנה לאחר מכן הוצע מודל דומה להופעת הגידול על שם וילמס.
המודל צופה כי היווצרות גידול תלויה בשני אירועים גנטיים מגבילי קצב. לילד עם רגישות גנטית יש פגיעה מבנית ראשונית, מורשת מאחד ההורים או בשל מוטציה ספונטנית. דרוש אירוע גנטי נוסף כדי שייווצר גידול, והסיכוי להיווצרות גידול בילדים אלו גדול בהרבה מזה של המקרים הספורדיים שבהם דרושות שתי מוטציות נדירות, בלתי תלויות זו בזו.
מחקרים גנטיים נוספים של מספר גידולים אישרו את תאוריית שני האירועים, כשהראו כי שני האירועים הגנטיים המשוערים נגרמים על ידי שיתוק (אינאקטיבציה) של שני האללים של הגן מדכא-הגידול. במקרים רבים, האלל הראשון משותק על ידי מוטציה בתוך הגן עצמו, ואילו האלל השני משותק על ידי איבוד חומר כרומוזומלי, שנחשף על ידי איבוד הטרוזיגוטיות, לכאורה, באחד או יותר אתרים פולימורפיים סמוכיםׁ(LOH). מנגנונים גנטיים כאלו אפשרו מיקום כרומוזומלי של גנים הקשורים בסוגי סרטן שונים, כולל הגידול על שם וילמס[2].
- WT1 - גן מדכא הגידול בכרומוזום 11p13
ב-1964 דיווחו מילר וחב' על קשר בין אנירידיה (Aniridia), אנומליה מולדת של הקשתית, לווילמס. בעקבות זאת, קומפלקס נדיר של אנומליות התפתחותיות, כולל אנירידיה, מלפורמציה גניטואורינרית ופיגור שכלי, נמצא קשור בסבירות גבוהה (יותר מ-30%) להתפתחות גידול וילמס (WAGR Syndrome).
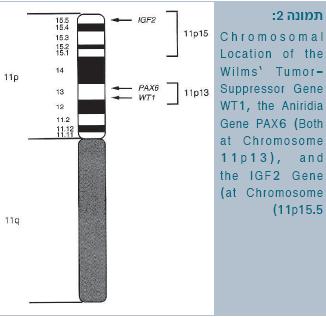
ניתוח הקריוטיפ של ילדים עם סינדרום WAGR הדגים מחיקה בזרוע הקצרה של עותק אחד של כרומוזום 11, ברצועת p13 (תמונה 2). מחיקה ראשונית זו נתנה את הרמז הראשון למיקום גן המעורב בהיווצרות גידול וילמס. כעת ידוע כי המחיקה ב-WAGR כוללת בתוכה מספר גנים סמוכים, כולל הגן לאנירידיה - PAX6, והגן המדכא גידול וילמס – WT1. איבוד אלל אחד של PAX6 אחראי לאנירידיה, ואילו מוטציה באחד מהאללים של WT1 עלולה לגרום לפגיעה גניטואורינרית, נוסף על האירוע הראשון המבני הדרוש להיווצרות גידול וילמס. עם זאת, החלק של מוטציות ב-WT1 בחולים עם וילמס חד-צדדי וללא פגמים מולדים נוספים הוא מוגבל, דבר שמצביע על כך כי קיים יותר מאזור גנטי אחד המעורב בהתפתחות גידול וילמס [3] [4] [5].
- Wilms' Tumor 2 Gene) WT2)
גן נוסף האחראי על WT הוא WT2 המצוי על כרומוזום 15.5P11, ומוטציה בו גורמת לתסמונת Beckwith-Wiedemann. כב-3% מהילדים עם WT יש שינוי בגן הזה ללא סימנים של התסמונת. אלו הילדים שלהם נטייה גדולה יותר לפתח גידול בשתי הכליות. ב-WT ספורדי ליותר מ-80% יש LOH בתאים הסומטיים או איבוד חומר בכרומוזום 15.5P11. [6]
- Nephrogenic Rests
נוכחות גידול וילמס בכליה קשור לעתים קרובות לבעיות בתהליך התפתחות הכליה. Nephrogenic Rests הם מוקדים קטנים של תאים בלסטמיים פרימיטיביים היכולים להימצא בכליות של יילודים. הכליות של מרבית הילדים עם נטייה גנטית ל-WT, מכילים מוקדים כאלו ומהווים הוכחה לפגם בסיסי בהתפתחות הכליה. עם זאת, גם ל-40-25 אחוזים מהילדים עם WT ספורדי ניתן למצוא בכליה צברים של תאים בלסטמיים ברקמה הבריאה. צברי תאים אלו מקורם בתא אב משותף שממנו מתפתח קלון של תאים. המהלך הטבעי של צבר תאים זה משתנה: חלקם יסווגו באופן ספונטני, ואילו האחרים יתפתחו לגידול מסוג WT.
העובדה שבתסמונת Beckwith Wiedeman (11p13) הגידולים מתפתחים באזור הפריפרי של אונת הכליה (p1511), ואילו באברציות גנטיות אחרות מיקום הגידול באזורים אינטרלובריים, מרמזת כי לגנים השונים של WT תפקידים שונים בתהליך התפתחות הכליה, וכי אינאקטיבציה שלהם יכולה להפריע להתפתחות תקינה של הכליה בזמנים שונים [7] Chromosomal Location of the Wilms' Tumor-Suppressor Gene WT1, the Aniridia Gene PAX6 (Both at Chromosome 11p13), and the IGF2 Gene (at Chromosome 11p15.5).
- Other Genes -Wilms' Tumor Gene on the X Chromosome) WTX )
הגן WTX נמצא על כרומוזום X ולו תפקיד חשוב בהתפתחות הנורמלית של הכליה. מוטציה בגן מתרחשת ב-17% מ-WT, שווה בין זכרים לנקבות והוא מושבת בכשליש מ-WT אך לא נראה מוטציה בגרמלין בחולי WT [8].
בתוך כרומוזום 16q ו-p1 יש עדות לגנים מעכבים או מפעילים של הגידול Tumor-Suppressor Or Tumor-Progressive Genes)) ב-17% וב-11%, בהתאמה. לחולים אלו יש פרוגנוזה רעה עם אחוזי רילפס גבוהים, וילדים כאלו גם אם הם בעלי היסטולוגיה טובה, יקבלו טיפול אגרסיבי [9] [10].
- Genetics of Familial Wilms' Tumor
למרות מספר רב של גנים המעורבים ב-WT, המחלה לרוב איננה תורשתית. בכ-2% יש סיפור משפחתי. לאחים לילדים עם WT שכיחות נמוכה של התפתחות הגידול. בילדים שאחד מהוריהם חלה בגידול מהסוג הספורדי והחד-צדדי שכיחות נמוכה מ-2% של התפתחות הגידול.
קליניקה
הסימן הנפוץ ביותר (80%) להימצאות הגידול הוא תפיחות הבטן ומישוש של מסה בטנית, שלרוב אינה עוברת את קו האמצע, להבדיל מנוירובלסטומה. לעתים קרובות אין תלונות נוספות, אך ב - 50% מהמקרים הממצאים הללו מלווים בכאבי בטן. בכ-25% מן המקרים יש יתר לחץ דם, עקב איסכמיה כלייתית הנובעת מלחץ של הגידול על עורק הכליה. בכ-25% מן המקרים מופיעה המטוריה מיקרוסקופית או מאקרוסקופית.
בחלק מן המקרים יש סינדרומים פרה-נאופלסטיים, כגון: עלייה בהפרשת אריתרופויטין, עלייה בהפרשה של ACTH והופעה של היפוגליקמיה. כמו כן, ייתכן חוסר תיאבון וירידה במשקל במקרים מפושטים יותר.
Bilateral Wilms' Tumor בכ-7% מהחולים הפגיעה היא בשתי הכליות, לרוב בחולים עם הנטייה התורשתית. בדרך כלל האבחנה נעשית בו-זמנית בשתי הכליות (Synchronous).
פתולוגיה
במרבית החולים נמצא הגידול בכליה אחת, בפחות מ-7% מהמקרים מאובחן הגידול בשתי הכליות. צבעו של הגידול הוא לבן-אפור. לרוב הוא עטוף בקפסולה ולא חוצה את קו האמצע של הבטן. הגידול מורכב משלוש שכבות תאים: בלסטמה (Blastema), מזנכימה (Mesenchyme), אפיתל (Epithelium) ותאים פרימיטיביים.
ישנה חלוקה היסטולוגית נוספת לשלוש תת-קבוצות על פי דרגת בשלות התאים וסוגי התאים: באחת דרגת המיון גבוהה - Favorable or Low Risk. בשניה, דרגת בשלות נמוכה יותר - נכנסת לקבוצת ה-Intermadiate Risk, ובשלישית תאים מיטוטיים, אנפלסטיים והיא נכנסת לקבוצת ה - High Risk. בקבוצה השלישית נכנסים הגידולים שאינם וילמס והם:
- נפרומה מזו-בלסטית
זהו גידול ממאיר נדיר וסולידי, שנוטה להופיע קרוב לשער הכליה. הגידול מאופיין בתאים פרימיטיביים מאוד, ללא תבנית מסוימת. התאים הם בעלי ציטופלזמה אאוזינופילית, לגידול אין קפסולה, ויש בו פעילות מיטוטית גבוהה.
- Clear Cell Sarcoma
זהו גידול ממאיר מוגבל, בעל צבע צהבהב, שמכיל תאים פרימיטיביים עם הרבה פעילות מיטוטית. התאים יכולים להיות אפיתליואידיים או כישוריים. לגידול זה נטייה לשלוח גרורות לריאות ולמוח, ולכן הפרוטוקול הטיפולי אגרסיבי יותר והפרוגנוזה טובה פחות.
- Rhabdoid Tumor
גידול ממאיר של תאים אטיפיים עם גרעין גדול ובזופילי, שנקרא כך משום שהתאים מזכירים תאי שריר משורטט פרימיטיביים. צבעו של הגידול חום, ועל פי ההרכב ההיסטולוגי והאיסטוכימי שלו, מקורו במערכת העצבים.
לסוג זה של גידול יש נטייה מוגברת לשלוח גרורות למוח, לגרום להתפתחות של גידול ראשוני משני במוח, התגובה לטיפול כימותרפי היא נמוכה והפרוגנוזה רעה.
אבחנה
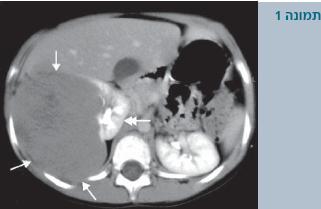
מלבד בדיקה גופנית שמצביעה במרבית המקרים על קיום של מסה בטנית, יש לבצע בדיקות מעבדה שיכללו: ספירת דם כימיה גדולה (הכוללות תפקודי כליה), שתן לכללית ובדיקות דימות הכוללות על-קול בטן, צילום חזה ו-CT בטן (תמונה 1). במקומות מסוימים אף נהוג לבצע CT חזה או MRI.
סיווג (Staging)
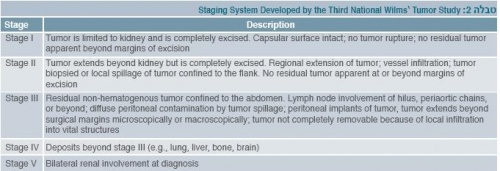
קיים סיווג על פי מיקום הגידול (טבלה 2):
- Stage 1- הגידול מוגבל לכליה וניתן לכריתה בשלמותו.
- Stage 2 - הגידול התפשט מחוץ לכליה, אך ניתן לכריתה בשלמותו.
- Stage 3- פיזור מקומי של הגידול לבטן.
- Stage 4- מופיעות גרורות המטוגניות רחוקות בריאות (הכי שכיח), בכבד, בעצמות, במוח.
- Stage 5 - הגידול קיים בשתי הכליות.
אבחנה מבדלת
ממצאים שפירים, כגון מבנים ציסטיים שונים (Polycystic Kidney, Multicystic Kidney, Hydronephrosis וכו') ׂניתן לאבחן לרוב באמצעות על-קול בטן.
הנושא החשוב ביותר באבחנה המבדלת הוא התשובה לשאלה אם מדובר בנוירובלסטומה או שלא, שכן הטיפול בשני גידולים אלה הוא שונה לחלוטין. מקור הגידול האחרון הוא בלוטת האדרנל, הגידול עצמו עובר את קו האמצע וזאת ניתן לבחון באמצעות על-קול או MRI וכן באמצעות בדיקות מעבדה, כמו איסוף שתן לקטקולאמין. גידול ממאיר אחר הוא נפרומה מזובלסטית וכן לימפומה לרוב מסוג Burkitt's. ביופסיה פותרת את בעיית האבחון.
טיפול
יש שתי קבוצות גדולות שאחראיות על טיפול ב-WT:
- The National Wilms' Tumor Study Group in North (cog) America
- The International Society of Pediatric (SIOP) Oncology, Involving European.
הראשונה דוגלת בכריתת הגידול עם הכליה עצמה ולאחר מכן מתן כימותרפיה ובמידת הצורך הקרנות, והשנייה במתן כימותרפיה לפני כריתת הגידול (ללא ביצוע ביופסיה) ובשלב מאוחר יותר כריתת שארית הגידול כולל כריתת הכליה לרוב [11].
הטיפול בגידול הוא כריתה כירורגית, גם אם יש גרורות ריאתיות. במקרים מסוימים ניתן אף לכרות גרורות בריאות ובכבד. הניתוח כולל כריתה של הגידול ושל הכליה, וכן חיפוש גרורות בכבד, בבלוטות הלימפה ובכליה השנייה. הגידול רגיש לכימותרפיה ולקרינה. אם הגידול הוא דו-צדדי (בשתי הכליות) יש לבצע כריתה לכליה הפגועה יותר וכריתה חלקית (כריתת יתד) בכליה הפחות מעורבת, ולאחר מכן הקרנה למקום.
בחזית המחקר כיום האתגר לאתר מדדים מולקולריים והיסטולוגיים חדשים היכולים להעיד על דרגת הממאירות, כדי לבנות את הפרוטוקול הטיפולי המתאים לכל חולה. בדרך זו ניתן לתת טיפול אגרסיבי פחות ועם פחות תופעות לוואי למקרים המתאימים (דרגת ממאירות נמוכה), ולעומת זאת במקרים עם דרגת ממאירות גבוהה לטפל בפרוטוקולים אגרסיביים יותר ולעלות את דרגת ההישרדות [12].
- Screening Children Predisposed to Wilms Tumor
ילדים עם מלפורמציה המעלה שכיחות לפתח WT (כמו: Beckwith-Wiedemann Syndrome, WAGR Syndrome, Denys-Drash Syndrome, Hemihypertrophy, or Sporadic Aniridia) עליהם לעבור על-קול בטן כל שלושה חודשים עד גיל 8 שנים [13].
פרוגנוזה
הפרוגנוזה של WT בילדים השתפרה באופן דרמטי ב-30 השנים האחרונות, ושיעור ההישרדות שעמד בעבר על 30% עומד כיום על 90%. תמורה זו היא תוצאה של שילוב פרוטוקול טיפולי הכולל כריתת הגידול, כימותרפיה ובמצבים מיוחדים גם קרינה.
הפרוגנוזה תלויה בכמה מרכיבים מרכזיים: הביולוגיה המולקולרית של הגידול (LOH for Chromosomes 1p and 16 q), ההיסטולוגיה של הגידול (Favourable Versus Anaplastic), פיזור המחלה, גיל ההופעה והתגובה לטיפול. לרוב, שנתיים ללא מחלה פירושם הבראה.
גידול משני מתפתח ב - 1-3% מהילדים שטופלו בהצלחה בגידול ראשוני (Metachronous). בקבוצת הסיכון ילדים שאובחנו בגיל צעיר מגיל שנה, או כאלה שבהיסטולוגיה של הכליה שנכרתה נמצאו צברים של Nephrogenic Rests. באוכלוסייה זו דרוש לבצע על-קול (US) של הבטן בתדירות גבוהה במיוחד כדי לבצע אבחון מוקדם של Metachronous Bilateral Wilms Tumor [14] [15]
בחולים המאובחנים בשלב 1 בגיל צעיר משנתיים שיעור ההישרדות הוא 90% ו-80% בגיל מבוגר משנתיים. הפרוגנוזה לשלבים 2 ו-3 היא כ-80% בכל גיל. בכל מקרה של חזרת המחלה, הפרוגנוזה היא גרועה. במקרים כאלו מנסים לשפר את ההישרדות על ידי השתלת מוח עצם אוטולוגית.
דגלים אדומים
ביבליוגרפיה
- ↑ Ng A, Griffiths A, Cole T, et al. Congenital abnormalities and clinical features associated with Wilms' tumour: A comprehensive study from a centre serving a large population. Eur J Cancer 2007;43(9):1422-1429
- ↑ Knudson AG. Genetics and the etiology of childhood cancer. Pediatr Res 1976;10(5):513-517
- ↑ WLee SB, Haber DA. ilms' tumor and the WT1 gene. Exp Cell Res 2001;264(1):74-99
- ↑ Davis LK, Meyer KJ, Rudd DS, et al. Pax6 3' deletion results in aniridia, autism and mental retardation. Hum Genet 2008;123(4):371-378
- ↑ Mahale A, Poornima V, Shrestha M. WAGR syndrome-a case report. Nepal Med Coll J 2007; 9(2):138-140
- ↑ Karnik P, Chen P, Paris M, et al. Loss of heterozygosity at chromosome 11p15 in Wilms tumors: identification of two independent regions. Oncogene 1998;17(2):237-240
- ↑ Beckwith JB, Kiviat NB, Bonadio JF. Nephrogenic rests, nephroblastomatosis, and the pathogenesis of Wilms' tumor. Pediatr Pathol 1990;10(1-2):1-36
- ↑ Wegert J, Wittmann S, Leuschner I, et al. WTX inactivation is a frequent, but late event in Wilms tumors without apparent clinical impact. Genes Chromosomes Cancer 2009;48(12):1102-1111
- ↑ Grundy PE, Breslow N, Li S, et al. 1p and 16q is an Adverse Prognostic Factor in Favorable Histology Wilms’ Tumor. A Report from the National Wilms’ Tumor Study Group. Loss of Heterozygosity for Chromosomes Clin Oncol 2005;23:7312–7321
- ↑ Ruteshouser EC, Robinson SM, Huff V. Wilms tumor genetics: mutations in WT1, WTX, and CTNNB1 account for only about one-third of tumors. Genes Chromosomes Cancer 2008;47(6):461-470
- ↑ Management of Wilms' tumor: NWTS vs SIOP. J Indian Assoc Pediatric Surg 2009;14(1):6-14. Hum Genet 1994;94(4):331-338
- ↑ Kalapurakal JA, Dome JS, Perlman EJ, et al. Management of Wilms' tumour: Current practice and future goals. Lancet Oncol 2004;5:37-46
- ↑ Porteus MH, Narkool P, Neuberg D, et al. Characteristics and outcome of children with Beckwith-Wiedemann syndrome and Wilms' tumor: A report from the National Wilms Tumor Study Group. J Clin 2000;18(10):2026-2031
- ↑ Sarhan OM, El-Baz M, Sarhan MM, et al. Bilateral Wilms' tumors: Single-center experience with 22 cases and literature review. Urology 2010;76(4):946-951
- ↑ Hamilton TE, Ritchey ML, Argani P, et al. Synchronous bilateral Wilm's tumor with complete radiographic response managed without surgical resection: a report from the National Wilm's Tumor Study 4. J Pediatr Surg 2008;43(11):1982-19843
קישורים חיצוניים
- Wilms' Tumor, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר עמית הס, ד"ר עופרי לביד, ד"ר נחמה שרון, מחלקת הילדים, יחידה המטואונקולוגית ילדים, מרכז רפואי צאנז, בית חולים לניאדו, נתניה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק