גנוטיפ של Dihydropyrimidine dehydrogenase
| מדריך בדיקות מעבדה | |
| גנוטיפ של (Dihydropyrimidine Dehydrogenase (DPYD | |
|---|---|
| שמות אחרים | dihydrouracil dehydrogenase, dihydrothymine dehydrogenase, uracil reductase. |
| מעבדה | כימיה בדם וברוק |
| תחום | אנזים המונע נזק ציטו-טוקסי מוגבר של התכשיר fluorouracil-5 |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
זיהוי מטופלים עם וריאנטים גנטיים של האנזים DPYD המצויים בסיכון מוגבר לטוקסיות בהיותם מועמדים לכימותרפיה עם תכשירים ממשפחת הפלואורו-פירימידינים דוגמת fluorouracil-5 (FU-5) או capecitabine.
רקע פיזיולוגי
fluorouracil-5 (להלן FU-5) הוא אנלוג פלואורי של פירימידין, המשמש בטיפולים משולבים של כימותרפיה במקרים של סרטן השד, המעי הגס, הקיבה, הלבלב, הריאות וגידולים סולידיים אחרים. האנזים dihydropyrimidine dehydrogenase (להלן DPYD) המקודד על ידי הגן DPYD, הוא האנזים החיוני בקטבוליזם של פירימידין, וגורם לדה-אקטיבציה של למעלה מ-80% המינונים הסטנדרטיים של FU-5 הנלקח פומית, או של capecitabine שהוא pro-drug של FU-5. הגן DPYD ממוקם על הזרוע הקצרה של כרומוזום 1 בעמדה 1p21.3 (Wei וחב' ב-Genomics משנת 1998).
חסר אמיתי של DPYD משפיע על כ-5% מהאוכלוסייה הכללית. באלה עם חסר זה בפעילות האנזימטית, מוגברת תקופת מחצית החיים של התרופה, מה שמעלה את ריכוזה גורם להצטברותה וגורם לרעלנות שלה (Lee וחב' ב-Clin Adv Hematol Oncol משנת 2004). בנוסף, ל-3-5% באוכלוסייה יש חסר חלקי של DPYD כתוצאה מווריאציות של ריצוף בגן DPYD, המגביל באופן פוטנציאלי את היכולת לגרום למטבוליזם מלא של FU-5, מה שמגביר את הטוקסיות שלה (Gross וחב' ב-PLos One משנת 2008Amstutz , וחב' ב-Pharmacoegenomics משנת 2011, Kim וחב' ב-Chemotherapy משנת 2010, ו-Rumiato וחב' ב-2013 Cancer Chemother Pharmacol).
הווריאנט המוכר ביותר הגורם בחסר חלקי DPYD וטוקסיות של FU-5, היא המוטציה IVS14+1G>A ב-intron 14, משולב בשֶמֶט (deletion) ב-exon 14 הידוע כ-DPYD*2A. וריאנטים מוכרים נוספים הכרוכים בטוקסיות כוללים שחלוף 496A>G ב-exon 6, שחלוף 2846A>T ב-exon 22||כ}} (van Kuilenburg ב-Clin Cancer Res משנת 2000, ו-Schwab וחב' ב-J Clin Oncol משנת 2008), וכן שחלוף (T1679G (DPYD*13 ב-exon 13 ( Johnson וחב' ב-Clin Cancer Res משנת 2002), למרות שווריאנטים משולבים נוספים התגלו במשפחות מסוימות על ידי ריצופים שלמים של הגן.
שפעול ופירוק של FU-5
FU-5 מומר לצורה הפעילה, fluorodeoxyuridine monophosphate-5 (FdUMP) לאחר גלוקוזילציה שיכולה להתבצע ב-3 מסלולים:
- מסלול א' הידוע כ-OPRT הנעזר בקו-פקטור phosphoribosyl pyrophosphate או PRPP
- מסלול ב' הידוע כ-uridine phosphorylase הנעזר בקו-פקטור R-5'-P או ribose-5'-monophosphate
- מסלול ג' הידוע כ-thymidine phosphorylase הנעזר בקו-פקטור dR-5'-P או deoxyribose-5'-monophosphate ( Dohden וחב' ב-Cancer משנת 1993).
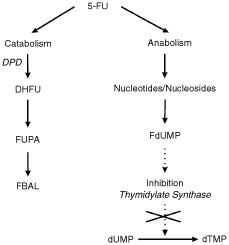
בין שלושת מסלולים אלה, מסלול ה-OPRT נחשב לעיקרי בגין הכמות העודפת של הקו-פקטור שלו, PRPP. DPYD הוא האנזים הקובע את קצב הקטבוליזם של FU-5 המותמר למטבוליט הבלתי-פעיל dihydrofluorouracil או FUH2-5 בצעד אנזימטי שהוא בעיקרו בלתי הפיך (Lu וחב' ב-J Biol Chem משנת 1992). השלב הראשון באינאקטיבציה של FU-5 היא בהפיכתו ל-dihydrouracil-5,6.
משמעות קלינית של המוטציות הגנטיות
מטופלים עם חסר DPYD המטופלים ב-FU-5 או ב-catecitabine, נמצאים בסיכון מוגבר לפתח נויטרופניה חמורה (grade III/IV) שעלולה אף להיות קטלנית, mucositis ושלשולים (Diasio ו-Johnson ב- Clin Cancer Resמשנת 1999, ו-Deenen וחב' ב- Clin Cancer Resמשנת 2011). כפי שצוין על אריזות התכשירים, חל איסור לצרוך את 2 תכשירים האמורים, במטופלים עם חסר ידוע של DPYD. לעומת זאת, ההשפעה הקלינית של וריאנטים של DPYD וחסר חלקי של אנזים זה, אינה ברורה לחלוטין.
מחקרים שונים הדגימו טוקסיות בדרגות שונות של FU-5, אך מוטציות ב-DPYD לא היו יכולות ברוב המקרים להסביר את דרגת הטוקסיות, שמוצאים באוכלוסייה הכללית. מחקרים עדכניים החלו בהערכה של מוטציות בגנים "מועמדים" אחרים, אך ההשפעות של גורמים גנטיים ולא-גנטיים תישארנה בלתי ברורות על לפיענוח מלא של כל המסלולים המטבוליים של FU-5 (Ezzeldin ו-Diasio ב-J Clin Oncol משנת 2008). בהתבסס על מה שידוע כיום על תפקידו של DPYD במטבוליזם של capecitabine/FU-5, מטופלים עם חסר ידוע של אנזים זה או כאלה עם סיפור משפחתי של מוטציות ידועות, צריכים להינע מטיפול כימותרפי זה (Saif ב- Cancer Genomics Proteomics משנת 2013).
באשר לאוכלוסייה הכללית, כיוון שחסר אמיתי של DPYD נדיר, וכיוון שהמשמעות הקלינית של חסר חלקי אינה ברורה עדיין, לא מומלץ לבצע בדיקת סריקה למוטציות בגן לפני התחלת טיפול כימותרפי. בנוסף, אפילו אם חסר חלקי מתגלה, אין הנחיות כיצד "לתפור" את הטיפול כדי למזער את הטוקסיות, כך שהתועלת הקלינית מבחינת וריאנטים של DPYD עדיין אינה ברורה (Jennings וחב' ב-PLos One משנת 2013, ו-Offer וחב' ב-Clin Pharmacol Ther משנת 2013, ו-Loganayagam וחב' ב-Br J Cancer משנת 2013).
בדצמבר 2015, אישר ה-FDA את השימוש ב-uridine triacetate (שם מותג Vistogard), שהוא אנלוג של פירימידין, כטיפול חירום לאחר מתן של מינון יתר של FU-5 או של capecitabine במטופלים עם סימנים מוקדמים של טוקסיות חמורה ומסכנת חיים, המשפיעה על הלב או על מערכת העצבים המרכזית, כמו גם במקרים של הופעה מוקדמת של neutropenia תוך 96 שעות ממתן טיפול ב--FU-5 או של capecitabine. לאחר מתן פומי, uridine triacetate עובר דה-אצטילציה על ידי אסטראזות בלתי-ספציפיות, שמביא להופעת uridine בצירקולציה, המעכב באופן תחרותי נזק לתאים או מות תאים שנגרם על ידי 5FU. בשני ניסויים בהם טופלו ב-uridine acetate חולי סרטן שקיבלו מנת יתר של FU-5, נותרו בחיים לאחר 30 יום 97% מהמטופלים. באלה המטופלים עם uridine triacetate במקרים של טוקסיות חמורה ומסכנת חיים, נותרו בחיים לאחר 30 יום, 89% מתוכם (מנתוני חברת Wellstat Therpeutics במרילנד, משנת 2015).
מדידת המוטציה הגנטית
בין המבדקים הגנטיים הזמינים כיום באשר לגן DPYD בדיקת הווריאנט DPYD*2A או IVS14+1G>A DPYD היא השכיחה ביותר. פעילות אנזימטית במטופלים חשודים לחסר DPYD יכולה להיקבע או על ידי מדידת רמת thymine ו-uracil בשתן או בדם, או בקביעה ישירה של פעילות DPYD דרך מיצוי RNA מתאי דם חד-גרעיניים בצירקולציה ומדידת DPD mRNA copy number (van Staveren וחב' ב-Pharmacogenomics משנת 2013, ו-Meulendijks וחב' ב-Cancer Treat Rev משנת 2016). אחת השיטות היא אנליזה בשיטה של DHPLC או denaturing high performance liquid chromatography אם החולה סובל מנויטרופניה חמורה (Saif וחב' ב-Cancer Chemother Pharmacol משנת 2007). בדיקה של וריאנטים אחרים עדיין אינה זמינה באופן חלקי בשגרת המעבדות הקליניות.
פעילות DPYD והפרמקולוגיה של FU-5
פעילות DPYD משתנה באופן אינדיבידואלי (Lu וחב' ב-Clin Pharmacol Ther משנת 1995). תקופת מחצית החיים של FU-5 נעה בין 4-25 דקות לאחר עירוי תוך ורידי (Heggie וחב' ב-Cancer Res משנת 1987). משך למעלה מ-4 עשורים לא היה ברור מדוע הפרמקו-קינטיקה של FU-5 היא כה ואריאבילית. אחת הסיבות היא שפעילות DPYD נתונה גם לשינויים צירקדיאניים (Harris וחב' ב-Cancer Res משנת 1990). במטופלים המקבלים עירוי מתמשך של FU-5 על ידי משאבה אוטומטית, דגימות נסיוב שנדגמו ממטופלים אלה הכילו רמות של FU-5 שאופיינו על ידי מתווה צירקדיאני. יתרה מכך, מדידת פעילות DPYD של תאים חד-גרעיניים בדם היקפי שהתקבלו מאותו מטופל בשעות שונות לאורך היום, הראתה אף היא פרופיל צירקדיאני, שהיה הוֹפכי לריכוזי FU-5. נתונים אלה מרמזים ש-DPYD עשוי להיות אחראי על השינויים הצירקודיאניים ברמות FU-5. מספר אונקולוגים מציעים על כן על מתו עירויי FU-5 בשעות שונות במשך היממה (Levi וחב' ב-Cancer משנת 1999).
פעילות DPYD בתוך הגידול בתגובה לכימותרפיה עם FU-5
אנזים היעד של FU-5 הוא thymidylate synthase (להלן TS): אנזים זה קובע את קצב הסינתזה de novo של פירימידין נוקלאוטיד, והוא מקטלז את המתילציה של dUMP ליצירת dTMP (Omura וחב' ב- Cancer Res משנת 1995). העיכוב של TS על ידי FdUMP מושג על ידי תפיסת האתר הפעיל של האנזים על ידי FdUMP וכן על ידיMTHF (אחת הצורות המחוזרות של חומצה פוֹkלינית), ליצירת קומפלקס בלתי פעיל. על מנת לעכב מולקולה אחת של TS, נחוצות מולקולה אחת של FdUMP ומולקולה אחת של MTHF. לכן, ריכוז נמוך של FdUMP בתוך הגידול יגרום לפעילות דלה של הטיפול האנטי-סרטני.
ברור כבר שרמת הביטוי של אנזימים אנאבוליים של פירימידין חשובה בקביעת היעילות האנטי-סרטנית של FU-5. אך פחות תשומת לב התמקדה בואריביליות של האנזימים הקטבוליים של פירימידין. גידולים סרטניים עמידים ל-FU-5 הם בעלי פעילות גבוהה של DPYD (על פי Jiang וחב' ב-Clin Cancer Res משנת 1997, ו-Salonga וחב' באותו כתב-עת משנת 2000). היפוכו של דבר, גידולים עם רמה נמוכה של פעילות DPYD מראים תגובה טובה יותר ל-FU-5 מאשר גידולים בהם מגלים רמות מוגברות של DPYD mRNA (על פי Ishikawa וחב' ב-Clin Cancer Res משנת 1999). כתוצאה מכך, למעלה מ80% מכמות FU-5 המוזרקת, עוברת דה-טוקסיפיקציה ומופרשת בשתן כ- β-alanine (על פי Heggie וחב' ב-Cancer Rearch משנת 1987).
וריאנטים של הגן DPYD ופעילותו
הגן DPYD מכיל שני תַּעְתִּיקים (transcripts). התַּעְתִּיק הארוך מבין השניים (NM_000110.3) מכיל 23 אקסונים, ואילו התַּעְתִּיק הקצר מכיל 6 אקסונים כאשר אקסון 6 הוא אחד מהם. התַּעְתִּיק הגדול מכיל כאמור 23 exons המשתנים בגודלם מ-69bp (אקסון 15) ועד 961bp (אקסון 23) עם גודל intron ממוצע של 43bp (על פי Wei וחב' ב-Genomics משנת 1998). מחקרים מראים שפגיעות גנטיות בגן DPYD התורמות לפנוטיפ של חסר פעילות האנזים DPYD, כוללים exon skipping (על פי Meinsma וחב' ב-DNA Cell biol משנת 1995), שֶמֶט (deletion) על פי Vreken וחב' ב-Hum Genet משנת 1997, ומוטציות missense (על פי Van Kuilenburg וחב' ב-Hum Genet משנת 1999). בהתבסס על אנליזה של האוכלוסייה הלבנה לגבי הפעילות הקטליטית של DPYD, נמצא שלפחות 3% ממנה עלולים להיות בעלי פעילות אנזימטית חלקית (Lu וחב' ב-Cancer Res משנת 1993, ו-Milano ו-Etienne ב-Pharmcogenetics משנת 1994).
המוטציה השכיחה ביותר במטופלים עם חסר מלא או חלקי של DPYD היא מוטציה נקודתית G-to A בתוך ה- splicing site-5' של intron 14 הידועה כ-IVS14+1G>A על פי Van Kuilenburg וחב' ב-Clin Cancer Res משנת 2001). סריקה של מוטציה זו במספר קטן יחסית של נבדקים לא הראתה זיגוטיוּת של מוטציה זו בקרב יפנים (100 אללים), בקרב בריטים (60 אללים), או בקרב אפרו-אמריקנים (210 אללים) (על פי Wei וחב' ב-Genomics משנת 1998, ו-Vreken וחב' ב-J Inherit Metab Dis משנת 1996). לעומת זאת, יש שכיחות גבוהה יחסית של האלל IVS14+1G>A באוכלוסייה ההולנדית, עם שכיחות אלל של 0.91%, ושכיחות של הטרוזיגוטיות של 1.8%. מספר ההולנדים הומוזיגוטים למוטציה זו יכול להגיע ל-1.2 מקרים לכל 10,000 איש.
מוטציה זו גורמת ל"דילוג" על פני exon 14 בתהליך הביקוע (splicing) של DPYD mRNA. כתוצאה מכך, DPYD mRNA הבשל חסר מקטע של 165 נוקלאוטידים המקודדים לרצף חומצות האמינו 581-635, וכתוצאה מכך מאבד החלבון את פעילותו הקטליטית. אך גם בהטרוזיגוטים למוטציה זו עם מחצית הפעילות האנזימטית, תבוא לביטוי טוקסיות חמורה של FU-5 (על פי Wei וחב' ב-J Clin Invest משנת 1996, ו-Van Kuielenberg וחב' ב-Eur J Cancer משנת 1997). נמצא שלא רק פעילות DPYD משפיעה על הפינוי מהגוף של --FU-5, אלא גם משתנים אחרים כגון גיל ורמה גבוהה של האנזים alkaline phosphatase בנסיוב (Etienne וחב' ב-Eur J Cancer משנת 1998). עיקר ההבדל בין אלה עם רמת DPYD נמוכה לבין אלה עם אנזים תקין היא בהופעת נויטרופניה דרגה IV, (כאשר 55% מבין החסרים את האנזים מראים נויטרופניה לעומת 13% מבין בעלי האנזים התקין).
חסר DPYD כרוך גם בתסמינים נירולוגיים כגון פרכוסים, פיגור שכלי, אפילפסיה ומיקרוצפליה (Van Gennip וחב' ב-J Inherit Metab Dis משנת 1997). דיווחים נוספים מצביעים על כך שגורמים נוספים, כולל סביבתיים, יכולים לתרום לתסמינים הקליניים של חסר DPYD (על פי Holopainen וחב' באותו כתב-עת מאותה שנה).
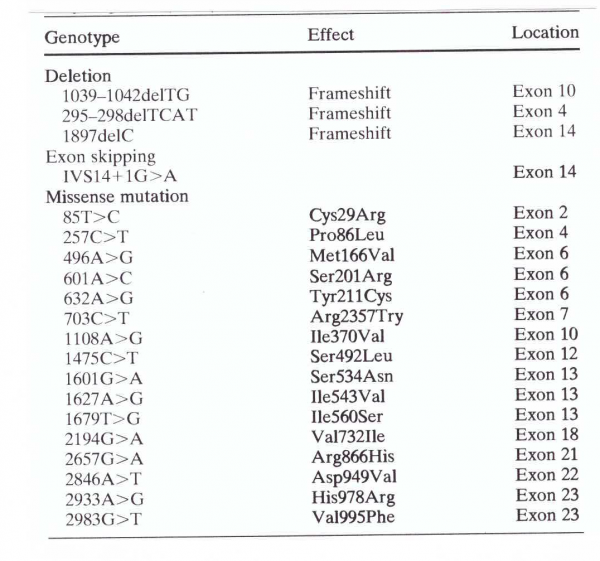
שיבושים גנטיים אחרים בגן DPYD הכרוכים ברמות שונות של חסר בפעילות האנזימטית, כוללים מוטציות שֶמֶט או מוטציות missense, ששכיחותם נמוכה משמעותית מאשר זו של IVS14+1G>A, מתוארים בטבלה הבאה (Mattison וחב' ב-Pharmacogenetics משנת 2002, ו-Van Kuilenberg וחב' ב-Biochem J משנת 2002):
תכשירים ממשפחת fluoropyrimidines המעוכבים על ידי DPYD
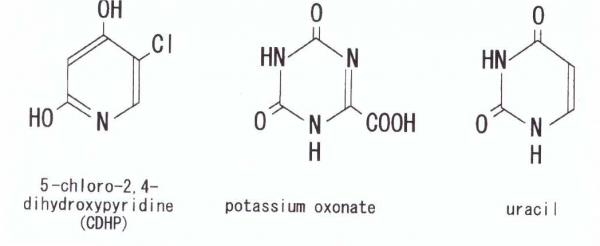
כאשר פעילות DPYD מעוכבת, יותר FU-5 יכול להיכנס למסלול אנאבולי, ולכן עיכוב פעילות DPYD יכול להגביר פוטנציאלית את הפעילות האנטי-סרטנית של FU-5. בשנים האחרונות, מספר תכשירים פלואורו-פירימידיניים נכנסו לשימוש קליני, והן מכונים DIFs או DPYD inhibitory fluoropyrimidines (על פי Diasio ב-Cancer Therapeutics משנת 1999). הם כוללים UFT או uracil+tegafur ביחס מולארי של 4 ל-1, ו-TS-I או tegalfur+5-chloro-2,4-dihydroxypyridine+potassium oxonate (הידוע כ-CHDP) ביחס מולארי של 1 ל-0.4 ל-1 (על פי Sugimachi וחב' ב-Oncology משנת 1999). תרופות אלה שונות באופי ובשיעור העיכוב שלהן על ידי DPYD.
המבנה הכימי של מודולטורים של FU-5
UFT היה ה-DIF הראשון שסונתז ונמצא בשימוש נרחב (Takino ב-Jpn J Cancer Chemotherapy משנת 1980). כאשר uracil ניתן במשולב עם tegafur, נקשר uracil באופן תחרותי ל-DPYD, מה שמפחית את קצב הפירוק של FU-5 ומאריך את פעילותו האנטי-סרטנית של האחרון. מתן פומי של UFT מראה פעילות אנטי-סרטנית לגבי גידולים כגון סרטן השד וסרטן המעי הגס, או כטיפול יחידני או בשילוב עם leucovorin (על פי Gonzales וחב' ב-Therapeutic Res משנת 1992). ניסויים קליניים הראו שצורת טיפול זו לא פחות יעילה מאשר עירוי של FU-5. יתרה מכך, הפרופיל הטוקסי של טיפול זה סביל (בעיקר בחילות והימנעות מאכילה), שעלולים להופיע במינונים גבוהים של התכשיר. אך תופעות לוואי אחרות נמנעות כגון תסמונת יד-רגל, טוקסיות נוירולוגית, וטוקסיות לבבית (Pazdur וחב' ב-Anti Cancer Drugs משנת 1996). בעוד שטיפול ב-FU-5 יוצר קטבוליטים כמו β-alanine שעלול כשלעצמו להיות טוקסי, קטבוליטים כאלה אינם נוצרים בטיפול עם UFT (על פי Diasio ב-Oncology משנת 2001).
באשר לתכשיר TS-1, אחד משלושת מרכיביו (CDHP), מעכב באופן תחרותי את פעילות DPYD באופן שהוא פי-200 יותר יעיל מאשר uracil במערכת in vitro. ניסויי phase II עם TS-1, במקרים של גסטרו-קרצינומה מתקדמת או נשנית, התגובה הייתה 46.5% (ב-60 מתוך 129 מטופלים) (על פי Sakata וחב' ב-Eur J Cancer משנת 1998). הטוקסיות הגסטרו-אינטסטינאלית של TS-1 נמצאה נמוכה בהרבה בהשוואה לזו של UFT או של Furtulon שהוא doxifluridine. לעומת זאת, דיכוי מוח העצם לאחר טיפול ב-TS-1 היה מוגבר בהשוואה לזה שנמצא בטיפול פומי עם UFT או עם Furtulon. ממצאים אלה מצביעים על כך שהטוקסיות של tegafur חוץ מאשר הטוקסיות שלו למערכת הגסטרו-אינטסטינאלית, מוגברת על ידי CDHP.
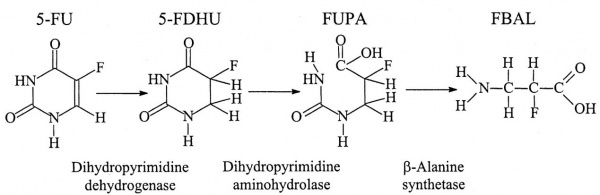
מטבוליזם של FU-5 :(FdUMP) Fluoro-2'-deoxyuridine-5'-monophosphate-5 הוא התוצר הציטוטוקסי הנובע מהמסלול רב השלבים של שפעול FU-5. התוצר FdUMP מעכב את האנזים thymidylate synthase (TS), מה שמוליך להצטברות בתא של deoxy-uridine-monophospate (dUMP), ולעומת זאת לחסר של deoxy-thymidine-monophosphate (dTMP), מה שגורם לעצירת הסינתזה של DNA. האנזים ההתחלתי ומגביל הקצב בקטבוליזם של FU-5 הוא DPYD, המקטלז את חיזורו של FU-5 ל-dihydrofluorouracil-5,6 (DHFU). כתוצאה מכך, DHFU מתפרק ליצירת fluoro-β-ureidopropionic acid (FUPA) ו-fluoro-β-alanine (FBAL).
הוראות לביצוע הבדיקה
בדיקת הגנוטיפ של DPYD על ידי Real-Time Polymerase Chain Reaction (PCR) with Allelic Discrimination analysis , יכולה להתבצע או על ידי משלוח של דם מלא במבחנת ספירת דם (צבע פקק סגלגל המכילה EDTA). לאחר ערבוב טוב של הדם במבחנה יש לשלוח את הדגימה למעבדה במבחנה המקורית בטמפרטורת החדר (מועדף) או בקירור. ניתן לבצע את האנליזה גם ב-DNA בדגימת רוק של הנבדק ויש לשלוח למעבדה את מבחנת איסוף הרוק בטמפרטורת החדר. ניתן כמו כן לבצע את הבדיקה בדגימת DNA שכבר עבר מיצוי ורצוי נפח של 100 מיקרוליטר עם ריכוז DNA של 0.25 מיליגרם/מיליליטר. דגימת ה-DNA צריכה להישלח למעבדה בהקפאה (מועדף) אך ניתן גם לשלחה בטמפרטורת החדר או בקירור.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - בדיקות ביוכימיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק