דלקת מפרקים ניוונית של הברך - הזרקה תוך-מפרקית של חומצה היאלורונית - Osteoarthritis of the knee - intra-articular injections of hyaluranic acid
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| הזרקה תוך-מפרקית של חומצה היאלורונית בדלקת פרקים ניוונית של הברך | ||
|---|---|---|
| Intra-articular injections of hyaluranic acid for treating osteoarthritis of the knee | ||
| יוצר הערך | ד"ר לינה קאסם, ד"ר אמנון להד 
|
|
דלקת פרקים ניוונית- מבוא
דלקת פרקים ניוונית (OA; Osteoarthritis) של הברך היא הסיבה השכיחה ביותר לנכות בארה"ב. בקרב מבוגרים מעל גיל 55 נמצא שב- 30% קיימת עדות דימותית ל- OA של הברך, ל- 10% סימפטומים של OA ול- 2.5% OA חמורה שגורמת לירידה תפקודית משמעותית [1].
ישנם מספר גורמי סיכון אפשריים ל- OA: שימוש יתר, טראומה, עודף משקל וגורמים תורשתיים [1].
הסימנים הקליניים של OA כוללים: כאב אזורי, רגישות במפרק, ירידה בטווח התנועה, קרפיטוס, נוזל ודלקת. סימנים אלו עלולים לגרום לנכות ולירידה בתפקוד היום-יומי [1]. הממצאים הרדיולוגיים כוללים: היצרות במרווח המפרקי, אוסטאופיטים, טרשת תת-סחוסית (Subchondral sclerosis) וכיסות (ציסטות) בעצם. לא תמיד קיימת התאמה טובה בין הממצאים הרדיולוגיים לבין הקליניקה [1].
עקב הזדקנות האוכלוסייה המערבית ומכיוון ששכיחות OA עולה עם הגיל, צפוי שהשכיחות של נכות והגבלה עקב OA יגדלו בשנים הבאות. גם ההשמנה של האוכלוסייה צפויה לתרום לכך. העלויות הגבוהות, הן הישירות והן הבלתי ישירות, יגרמו ל- OA להפוך לאחת הבעיות המובילות בעולם הרפואה [2].
טיפול בדלקת פרקים ניוונית
- טיפול לא תרופתי כולל: חינוך, פעילות גופנית, ירידה במשקל, פיזיותרפיה, עזרי הליכה ותוספי מזון [1]
- טיפול תרופתי כולל: תכשירים נוגדי דלקת לא סטרואידיים (NSAIDs; Nonsteroidal anti-inflammatory drugs), Paracetamol ואופיאטים [1]
- טיפול תוך-פרקי כולל: הזרקה של קורטיקוסטרואידים, שטיפות (Tidal irrigation) והזרקה של חומצה היאלורונית (HA; Hyaluranic acid או Hyaluronan) [1]
- טיפול ניתוחי כולל: תצפית מפרק (ארתרוסקופיה), פיום עצם (Osteotomy) והחלפת מפרק [1]
ההנחיות הקליניות היום ממליצות על שילוב של טיפולים תרופתיים ולא-תרופתיים בהתאם לגורמי הסיכון, חומרת הכאב והנזק המבני [1].
HA היא סוג של גלוקוזאמינוגליקן GAG שמורכב מחומצה גלוקורונית וגלוקוזמין בפוליסכרידים עם אורכים ומשקלים סגוליים שונים. HA היא חומר ויסקואלסטי שעוזר למפרקים נושאי משקל בסיכה, בבלימת זעזועים ובשמירת נוזל במפרק תוך כדי תנועה [1].
מנגנון הפעולה של HA מובן רק בחלקו. ההשפעה הפרמקולוגית של HA יכולה לנבוע מבקרה של יצירת סחוס, עיכוב של ציטוקינים ומטווחים דלקתיים ועידוד של ייצור HA טבעית. הפעילות הנ"ל עשויה להיות קשורה למשקל הסגולי של HA. [1]
בארה"ב יש 5 סוגי תכשירים של HA (טבלה 1).
בארץ קיימים 3 סוגים של HA בשימוש: (Euflexxa) Ostenil, csivnyS
ו-Arthrease (Hyalgan).
ה-American College of Rheumatology וה-American Pain Society ממליצים היום על שימוש ב-HA לטיפול ב-OA של הברך בחולים שלא הגיבו לפרצטמול ול-NSAIDs , [3], [4].
המטרה של סקירה זו היא לסקור את הנתונים הקיימים בספרות לגבי היעלות והבטיחות של הזרקה תוך-מפרקית של HA לטיפול בכאב ברכיים הנגרם על ידי OA.
מטה-אנליזה משנת 2005 שבדקה את היעילות של הזרקת HA בהשוואה להזרקת אינבו לטיפול ב-OA של הברך כללה 22 מחקרים מבוקרים (RCT) על 8 תכשירים שונים של HA. נבדקה רמת הכאב בתנועה. בהשוואה לאינבו הייתה ירידה ממוצעת של 4% בדירוג הכאב עם HA לאחר 6-2 שבועות, 4% לאחר 14-10 שבועות ו-7% לאחר 30-22 שבועות [5].
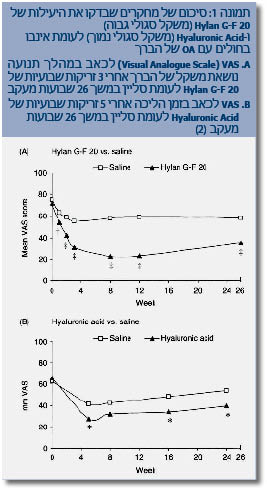
ממטה-אנליזה אחרת של 22 RCT שכללה 2,927 חולים והשוותה HA לאינבו, עולה גודל השפעה (Effect Size) של 0.32 בשינוי הכאב מהבסיס לאחר 4-2 חודשי טיפול לטובת HA. אנליזה זו מעלה גם של-HA עם משקל סגולי גבוה יותר, קיימת יעילות גבוהה יותר בהפחתת הכאב (תמונה 1). יש לציין שנצפתה יעילות נמוכה יותר של HA בחולים מעל גיל 65 ובחולים עם איבוד מלא של המרווח המפרקי [1].
בשנת 2006 בוצע Cochrane Meta-Analysis שסקרה 76 RCTs שהעריכו את האפקט של 12 סוגים שונים של HA על OA של הברך. המחקרים בדקו HA לעומת אינבו (40 מחקרים), לעומת הזרקת סטרואידים למפרק [6], ולעומת טיפול ב-NSAIDs[7], פיזיותרפיה [4] ומאמץ [2], [7]. טווח תקופת המעקב הוא יום עד 18 חודשים לאחר הזריקה האחרונה של HA [7].
באופן כללי המחברים הגיעו למסקנה שהזרקת HA לעומת אינבו מורידה כאב באופן משמעותי סטטיסטית, עם אפקט מקסימלי של הורדת כאב של 54%-28% ושיפור תפקוד של 32%-9% לאחר 13-5 שבועות. בהשוואה ל-NSAIDs, נמצאה יעילות דומה ל-HA בהפחתת הכאב. נמצאה השפעה חיובית ארוכת טווח של HA לעומת הזרקת סטרואידים תוך-מפרקית [5].
בסקירה של 6 מאמרי סקירה סיסטמיים נמצאה השפעה קטנה, אך משמעותית של HA על הכאב והתפקוד, דומה לסטרואידים בהזרקה כעבור חודש, אך גדולה יותר כעבור 6 חודשים. מכאן נובע שהפעילות של HA היא איטית יותר מסטרואידים, אך נמשכת לפרק זמן ארוך יותר [8]. מסקירה זאת עולה שההשפעה של HA מתחילה בשבועות ה-4-2, מגיעה לשיא בשבועות 13-5, ונמשכת עד 6 חודשים. קיימת עדות לכך ש-HA דומה ביעילותה ואף עולה על NSAIDs [2].
ב-RCT שהשווה HA, נפרוקסן ואינבו, HA היה לא פחות יעיל מנפרוקסן בהפחתת כאב ושיפור תפקוד [9]. לחולים שקיבלו HA היו פחות תופעות לוואי גסטרואינטסטינליות לעומת חולים שקיבלו נפרוקסן. השימוש ב-HA בשלב מוקדם של המחלה עשוי להפחית את הצורך ב-NSAIDs [2].
לגבי הבטיחות של HA, הסקירות השונות מגיעות למסקנה שהתרופה נסבלת ובטוחה עם מעט תופעות לוואי גם בשימוש חוזר. התופעות השכיחות ביותר הן: נוזל מקומי (2.4%), נפיחות (1.3%), ארתרלגיה (1.2%), חום מקומי (0.6%) ואודם (0.3%) (9). קיימים דיווחים נדירים על תופעות קשות יותר, כמו תגובה דלקתית חמורה, זיהום, תגובה אלרגית ואנפלקסיס [1].
הפרוטוקול של HA כולל 6-3 זריקות שבועיות כל 6 חודשים (תלוי בסוג ה-HA). העלות של HA בארה"ב היא 500-300 דולר לקורס. העלות בארץ היא כ-900 ש"ח לקורס Ostenil, 1,463 ש"ח לקורס Arthrease ו-2,563 ש"ח לקורס Synvisc. HA אינו כלול בסל הבריאות. מבחינה כלכלית ומנקודת ראות של בריאות הציבור, אפילו טיפול ב-Synvisc היקר יחסית, הוריד בצרפת את הצורך בתרופות, בטיפולים לא-פרמקולוגיים ובאשפוזים [10]. בקנדה, הוספה של Synvisc לטיפול המקובל ב-OA של הברך נמצא כ-Cost-Effective [6]. בארה"ב, הוספה של HA לטיפול הסטנדרטי יכול לחסוך 4,706 דולר לחולה במשך 3 שנים. HA בשילוב NSAIDs עשוי להשיג שיפור ב-7 מ"מ ב-VAS בעלות של 1,070 דולר [11]. כמו כן, יש מספר דיווחים על כך ששימוש ב-HA עשוי לדחות את הצורך בניתוח החלפת ברך בממוצע של שנתיים בחולים עם מחלה מתקדמת [12].
לסיכום, טיפול ב-HA תוך-מפרקי בחולים עם OA של הברך נמצא כיעיל בחולים צעירים מגיל 65 עם מחלה קלה-בינונית ובחולים שאינם מגיבים או אינם יכולים לקבל טיפולים אחרים. מכאן יש לשקול להכליל טיפול זה כחלק מהאסטרטגיה הטיפולית ב-OA בשלב מוקדם של המחלה [1] , [2].
בשנים הקרובות נראה דרישה הולכת ועולה ל-HA, דבר שדורש הכשרת יותר רופאי משפחה, ראומטולוגים ואורתופדים להזרקות תוך-מפרקיות [1].
עד היום רוב ההזרקות של HA בארץ בוצעו על ידי רופאים יועצים, במסגרת רפואה פרטית. לנוכח היעילות המוכחת, אם כי המוגבלת, של HA, נראה שיש הצדקה לצרפו לטיפולים הניתנים על ידי רופאי משפחה במרפאותיהם. אומנם החומר עצמו איננו בסל התרופות, בין היתר כי ההתייחסות אליו היא כאל "תוסף תזונה" (ולכן גם לא נדרש מרשם לקנייתו), אולם אין כל סיבה להוסיף על כך את הצורך בתשלום ביקור אצל רופא פרטי. יש מקום לשקול גם את הוספתו כתרופה במסגרת סל התרופות העתידי מכיוון שנמצא כיעיל ואפילו חוסך הוצאות.
ביבליוגרפיה
- Harrison SA. Liver disease in patients with diabetes mellitus. J Clin Gastroenterol 2006;40(1):68-76. Review
- Bugianesi E, Vanni E, Marchesini G. NASH and the risk of cirrhosis and hepatocellular carcinoma in type 2 diabetes. Curr Diab Rep 2007;7(3):175-180. Review
- Targher G, Bertolini L, Poli F, et al. Nonalcoholic fatty liver disease and risk of future cardiovascular events among type 2 diabetic patients. Diabetes 2005;54(12):3541-3546
- Targher G, Bertolini L, Rodella S, et al. Nonalcoholic fatty liver disease is independently associated with an increased incidence of cardiovascular events in type 2 diabetic patients. Diabetes Care 2007;30(8):2119-2121. Epub 2007
- Targher G, Bertolini L, Scala L, et al. Non-alcoholic hepatic steatosis and its relation to increased plasma biomarkers of inflammation and endothelial dysfunction in non-diabetic men. Role of visceral adipose tissue. Diabet Med 2005;22(10):1354-1358
- Toledo FG, Sniderman AD, Kelley DE. Influence of hepatic steatosis (fatty liver) on severity and composition of dyslipidemia in type 2 diabetes. Diabetes Care 2006;29(8):1845-1850
- Targher G, Marra F, Marchesini G. Increased risk of cardiovascular disease in non-alcoholic fatty liver disease: causal effect or epiphenomenon? Diabetologia 2008;51(11):1947-53. Epub 2008. Review
- Loria P, Lonardo A, Targher G. Is liver fat detrimental to vessels?: intersections in the pathogenesis of NAFLD and atherosclerosis. Clin Sci (Lond) 2008;115(1):1-12. Review
- McKimmie RL, Daniel KR, Carr JJ, et al. Hepatic steatosis and subclinical cardiovascular disease in a cohort enriched for type 2 diabetes: the Diabetes Heart Study. Am J Gastroenterol 2008;103(12):3029-35. Epub 2008
- Targher G, Bertolini L, Padovani R, et al. Non-alcoholic fatty liver disease is associated with carotid artery wall thickness in diet-controlled type 2 diabetic patients. J Endocrinol Invest 2006;29(1):55-60
- Targher G, Bertolini L, Padovani R, et al. Relations between carotid artery wall thickness and liver histology in subjects with nonalcoholic fatty liver disease. Diabetes Care 2006;29(6):1325-1330
- Targher G, Bertolini L, Rodella S, et al. Non-alcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and proliferative/laser-treated retinopathy in type 2 diabetic patients. Diabetologia 2008;51(3):444-450. Epub 2007
הערות שוליים
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 Zelber-Sagi S, Nitzan-Kaluski D, Halpern Z, et al. Prevalence of primary non-alcoholic fatty liver disease in a population-based study and its association with biochemical and anthropometric measures. Liver Int 2006;26(7):856-863
- ↑ 2.0 2.1 2.2 2.3 2.4 Marchesini G, Bugianesi E, Forlani G, et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology 2003;37:917–923
- ↑ de Marco R, Locatelli F, Zoppini G, et al. Cause-specific mortality in type 2 diabetes. The Verona Diabetes Study. Diabetes Care 1999;22(5):756-761
- ↑ 4.0 4.1 Kim CH, Younossi ZM. Nonalcoholic fatty liver disease: a manifestation of the metabolic syndrome. Cleve Clin J Med 2008;75(10):721-728. Review
- ↑ 5.0 5.1 Targher G, Bertolini L, Padovani R, et al. Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients. Diabetes Care 2007;30(5):1212-1218. Epub 2007
- ↑ 6.0 6.1 Garcia-Compean D, Jaquez-Quintana JO, Gonzalez-Gonzalez JA, et al. Liver cirrhosis and diabetes: risk factors, pathophysiology, clinical implications and management. World J Gastroenterol 2009;15(3):280-288. Review
- ↑ 7.0 7.1 7.2 Leite NC, Salles GF, Araujo AL, et al. Prevalence and associated factors of non-alcoholic fatty liver disease in patients with type-2 diabetes mellitus. Liver Int 2009;29(1):113-119. Epub 2008
- ↑ Prashanth M, Ganesh HK, Vima MV, et al. Prevalence of nonalcoholic fatty liver disease in patients with type 2 diabetes mellitus. J Assoc Physicians India 2009; 57:205-210
- ↑ Kim CH, Park JY, Lee KU, et al. Fatty liver is an independent risk factor for the development of Type 2 diabetes in Korean adults. Diabet Med 2008;25(4):476-81. Epub 2008
- ↑ Shibata M, Kihara Y, Taguchi M, et al. Nonalcoholic fatty liver disease is a risk factor for type 2 diabetes in middle aged Japanese men. Diabetes Care 2007;30(11):2940-2944. Epub 2007
- ↑ Angulo P, Keach JC, Batts KP, et al. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology 1999;30(6):1356-1362
- ↑ Younossi ZM, Gramlich T, Matteoni CA, et al. Nonalcoholic fatty liver disease in patients with type 2 diabetes. Clin Gastroenterol Hepatol 2004;2(3):262-265. Erratum in: Clin Gastroenterol Hepatol 2004;2(6):522
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר לינה קאסם, ד"ר אמנון להד - החוג לרפואת המשפחה, האוניברסיטה העברית בירושלים, שירותי בריאות כללית, מחוז ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק