דלקת מפרקים שגרונתית - טיפול באבטספט - Abatacept in the treatment of rheumatoid arthritis
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| דלקת מפרקים שגרונתית - טיפול באבטספט | ||
|---|---|---|
| Abatacept in the treatment of rheumatoid arthritis | ||
| שמות נוספים | שחקן חדש־ישן במגרש השיגרוני, ORENCIA) Abatacept): עידכונים וחידושים | |
| יוצר הערך | פרופ' הווארד עמיטל |
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – דלקת מפרקים , Abatacept
דלקת מפרקים שיגרונית (Rheumatoid arthritis) היא מחלה המערבת מפרקים רבים ומסבה להם נזק מבני ותפקודי. מחלה זו פוגעת ב-0.5-1% מכלל האוכלוסייה הבוגרת ומעבר לפגיעה המפרקית הקשה היא מובילה להאצת התהליך של טרשת עורקים (Atherosclerosis), לפגיעה ריאתית ועינית ולקיצור תוחלת החיים[1],[2].
הדגש בטיפול המודרני בדלקת מפרקים שיגרונית עיקרו בבלימת הנזק המפרקי ודיכוי הדלקת. עם השגת מטרות אלו מובטחים הפגת הכאבים ושיפור באיכות החיים והתפקוד של החולים. מטרות אלו מושגות בראש ובראשונה באמצעות שימוש ב-DMARDs (Disease Modifying Antirheumatic Drugs) בין אם במתן בודד ובין אם בשילוב של מספר תכשירים גם יחד. תכשירים אלה מביאים להטבה משמעותית במחצית מהחולים לפחות, בכך שהם מאטים את קצב ההרס שפוקד את המפרקים. לרוב נדרשים מספר שבועות עד שמורגשת הטבה קלינית משמעותית. בישראל, על פי הגדרות סל הבריאות מוגדרת חובה לנסות לפחות שלושה תכשירים מקבוצת ה-DMARDs (כשאחד מהם הוא Methotrexate) בטרם מתקדמים לטיפול בתכשירים ביולוגיים. על פי הקווים המנחים של האיגודים האירופאי והאמריקאי לראומטולוגיה, עיקרון זה אינו נדרש, אם כי רבים בכל זאת גורסים כי יש ערך ממשי בשילוב של תכשירים פומיים בטרם פונים לטיפול ביולוגי[3],[4]. מחקר שנערך ב-2013 אף הצביע על השפעה יעילה וזהה בשילוב של תכשירים פומיים בהשוואה לשימוש בתכשיר ביולוגי מקבוצת נוגדי ה-TNF-α (Tumor Necrosis Factor alpha)[5].
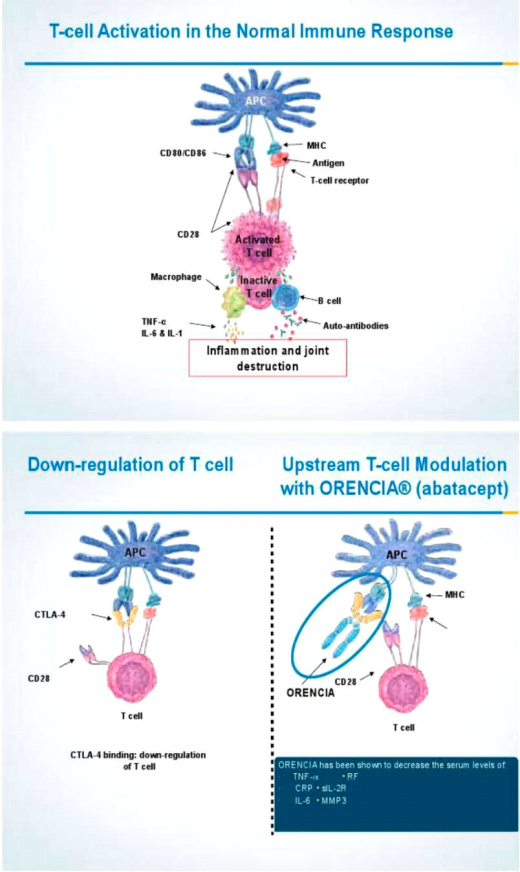
אל ארסנל תכשירים אלה הצטרף לאחרונה בארץ חלבון אנושי המורכב ממקטע החלק הקבוע (Fc) של הנוגדן 1gG1 ומהחלבון האנושי Human Cytotoxic Lymphocyte Antigen 4 (CTLA4). חלבון מלאכותי זה זכה לשם Orencia (Abatacept) . ה-Orencia מעכב את ההתקשרות שבין CD28 הנישא על גבי תאי ה-T לבין CD80/86 המצויים על קרומי התאים מציגי האנטיגן (Antigen presenting cells) (ראו תרשים 1).
תפקידם של תאי ה־T בהתפתחות דלקת מפרקים שיגרונית
הפתוגנזה של דלקת מפרקים שיגרונית מורכבת מהשפעות שונות של זרועות מערכת החיסון (Immune system), הן המולדת והן הנרכשת. כל תאי מערכת החיסון משתתפים בתגובה הדלקתית המערבת את המפרקים. מעורבותם של תאי ה-T מתבצעת באמצעות הקולטן הסגולי המאפיין את תאי ה-T יחד עם האנטיגן הנישא על פני קרומי התאים מציגי האנטיגן. במקביל להתקשרות זאת מתקיימת תגובה נוספת באמצעות המשיכה שבין קולטנים CD80/86 לבין CD28 המצוי על תאי ה-T. תגובה בו זמנית של שתי מערכות אלו מביאה את תאי ה־T להשלים את תהליך שפעולם ולשגשג, לייצר ולהפריש ציטוקינים מעוררי דלקת (Proinflammatory cytokines). מולקולת ה-Orencia מעכבת זרוע חשובה בתהליך זה (ראו תרשים 1).
עקרונות הטיפול ב-Orencia
שימוש תוך ורידי של Orencia אושר על ידי ארגון המזון והתרופות האמריקני (FDA) בארצות הברית ב-2005 ובאירופה על ידי ה-European Medicines Agency (EMA) במהלך 2007. מאוחר יותר אישרו שתי רשויות אלה גם מתן תת עורי של התכשיר. כיום ה-Orencia מאושרת לשימוש במבוגרים הלוקים בדלקת מפרקים שיגרונית בינונית וקשה בחומרתה אשר לא הגיבה די לטיפול בתכשירים מקבוצת ה-DMARDs הכוללת בין השאר Methotrexate, או לטיפול בתכשירים נוגדי TNF-α. באירופה יש לשלב את הטיפול ב-Orencia יחד עם Methotrexate ואילו בארצות הברית הותר שימוש ב-Orencia גם כמונותרפיה. ה-Orencia ניתנת בעירוי אל תוך הווריד במשך כ-30 דקות בשבועות 0,2,4 ומדי ארבעה שבועות במינון של כ-10 מיליגרם (מ"ג) לקילוגרם (ק"ג) עד למינון מירבי של 1 גרם (טבלה מספר 1). היא מצליחה להפחית את ריכוזם של ציטוקינים רבים בנסיוב כגון אינטרלויקין 2 (IL-2), אינטרלויקין 6 (IL-6) ו-TNF-α, של אנזימים קטליטיים כגון מטלופרוטאינזות וגורם שגרוני (Rheumatoid Factor, RF) וגם של חלבון מגיב עם סי (C-Reactive Protein, CRP)[6].
| משקל גוף בק"ג | מינון ה-Orencia במ״ג |
|---|---|
| <60 | 500 |
| 100-60 | 750 |
| >100 | 1,000 |
טיפול ב-Orencia תוך ורידית
מספר מחקרים אקראיים כפולי סמיות הדגימו את השפעתה הברוכה של ה-Orencia על התסמינים, על התפקוד הגופני ועל איכות החיים של החולים בדלקת מפרקית שיגרונית. כמו כן, הודגמה באופן ברור ההשפעה של Orencia על עיכוב הנזק המפרקי, כפי שמשתקף בצילומי רנטגן עוקבים. מחקרי יסוד אלו יוצגו בפסקאות הבאות.
השפעה קלינית בחולים אשר לא הגיבו למטוטרקטט באופן מספק
מחקרי AIM ו-ATTEST הדגימו את ההשפעה המיטיבה של Orencia בחולים בדלקת מפרקים שיגרונית שלא השתפרו באופן מספק באמצעות טיפול ב-Methotrexate[7],[8]. מחקרי שלב IIB הדגימו יתרון של טיפול משולב ב-Orencia עם Methotrexate על פני Methotrexate בלבד. במחקרים אלה הובהר כי המינון המקובל כיום (10 מ"ג לק"ג) היה האופטימלי גם לאחר טיפול בן שישה חודשים[9]. השפעה קלינית מיטיבה יחד עם מניעת נזק מפרקי ומניעת נכות הודגמו גם בטיפול ארוך טווח של 5 ו-7 שנים[10],[11].
מחקר ה-AIM הדגים את היתרון הקליני הגלום בשילוב Methotrexate עם Orencia בהשוואה לטיפול ב-Methotrexate בלבד החל מהחודש הראשון לטיפול. יתר על כן, המשתנים של כאב והערכה עצמית של חומרת המחלה הוטבו כבר לאחר שבועיים מתחילה הטיפול[7].
מחקר המשך פתוח שארך 5 שנים אישר שמתקיימות השפעות קליניות ורדיוגרפיות ארוכות טווח המתבטאות גם במדדי איכות חיים ותפקוד.
מחקר ה-ATTEST היה מורכב יותר וכפול סמיות, והוא כלל קבוצה שטופלה בפלצבו בלבד, קבוצה של מטופלי Orencia וקבוצה נוספת של חולים שטופלה בתרופה הביולוגית מקבוצת נוגדי ה-TNF-α, הניתנת אף היא אל תוך הווריד - Remicade (Infliximab). מחקר זה הוכיח יעילות משמעותית אך שווה בחולים שטופלו בתכשירים הביולוגיים בהשוואה למטופלי הפלצבו, אולם פרופיל הבטיחות של ה-Orencia היה טוב יותר בהשוואה לזה של Remicade. מחקר המשך שארך שנה נוספת הדגים שההשפעה המבורכת של שתי התרופות הביולוגיות ממשיכה להתקיים ואף להתעצם[12].
השפעה קלינית בחולים אשר לא הגיבו לנוגד TNF-α באופן מספק
במחקר ATTAINS הוערכו לראשונה חולי דלקת מפרקית שיגרונית אשר לא הגיבו באופן משביע רצון לטיפול ביולוגי קודם בנוגדי TNFα. מטבע הדברים מדובר באוכלוסיית חולים הלוקים במחלה אגרסיבית וארוסיבית יותר מאשר זו שנכללה במחקרים שהוזכרו לעיל{הערה|שם=הערה13|Genovese MC, Schiff M, Luggen M, Le BM, Aranda R, Elegbe A, Dougados M. Longterm safety and efficacy of Abatacept through 5 years of treatment in patients with rheumatoid arthritis and an inadequate response to tumor necrosis factor inhibitortherapy.J Rheumatol 2012;39:1546-1554.}}. גם פה הודגם שהחל מהשבוע השני לטיפול ניכר הבדל בין החולים שטופלו במטוטרקסט בלבד לבין אלה שטופלו בשילוב של מטוטרקסט ואורנסיה. ניתן היה גם לראות ששיעור התגובה לאורנסיה לא היה תלוי במשך הטיפול הקודם בנוגדי TNFα ובנסיבות הפסקתו, כלומר בין אם מדובר בהפסקת נוגדי ה-TNFα בגין נסיגה בתגובה הקלינית או בגין התפתחותן של תופעות לוואי. דהיינו, כישלון של טיפול בתכשיר ביולוגי מסוג אחד לא העיב על התגובה הצפויה בטיפול ביולוגי מקבוצה אחרת, אשר פועלת במנגנון אחר, דוגמת האורנסיה. גם במחקר ההמשך למחקר זה ניתן היה להיווכח שחולים רבים נהנו מהשפעת האורנסיה גם 5 שנים מתום מחקר ATTAINS הראשוני[13].
מספר מחקרים דוגמת מחקרי ה-ARRIVED וה-ATTEST הוכיחו שאין כל צורך בתקופת ביניים של "התנקות"(washout) מנוגדי TNFα בטרם יוחל הטיפול באורנסיה אלא ניתן בהחלט, עם הפסקת השימוש בתכשיר הראשון, לעבור ללא זמן ביניים לאורנסיה ובכך להימנע מסכנה פן דלקת המפרקים תתלקח[8],[14].
התנובה הקלינית בחולים נאיביים לטיפול ב- DMARDs
שני מחקרים עסקו בקבוצה זו של חולים, שבהם נבחנה תגובה קלינית עוד בשלב מוקדם של התפתחות מחלתם: מחקר AGREE ומחקר ADJUST. בשניהם נמצאה יעילות קלינית במקביל לשיפור במניעת נזקים רדיוגראפיים[15],[16].
במחקר AGREE נכללו חולים הלוקים במחלה מוקדמת מאוד שמשכה הממוצע עמד על 6.5 חודשים בלבד. כמו כן נכללו חולים בעלי מנבאים שהעידו על קיומה של מחלה אגרסיבית, כנוכחות גורם שיגרור, נוגדנים כנגד CCP או עדות רנטגנית לארוזיות. שיעור החולים אשר הצליחו להשיג הפוגה קלינית באמצעות הטיפול באורנסיה המשולבת עם מטוטדקסט עמד על 41.4% בהשוואה ל-23.3% בחולים אשר טופלו במטוטרקםט ופלצבו. במחקר המשך בחולי ה- AGREE שארך שנתיים הוכח שיעילות התכשיר נשמרת ואפילו משתבחת עם הזמן. 80% מהחולים שהשיגו הפוגה קלינית הצליחו לשמרה לאורך שנתיים של טיפול רציף באורנסיה.
במחקר ADJUSTS נבחנה השפעת התכשיר בחולים הלוקים בדלקת מפרקית עוד בטרם ענו לקריטריונים הפורמאליים של דלקת מפרקית שיגרונית. חולים אלה לקו, מטבע הדברים, בתסמינים תוך זמן קצר והוגדרו כלוקים במחלה מאוד מוקדמת (very early disease). לאחר שנה מתחילת הטיפול ניתן היה לראות כי רק 46% ממטופלי האורנסיה ענו להגדרת האבחון של דלקת מפרקית שיגרונית בעוד ש-67% מכלל מטופלי הפלצבו ענו על קריטריונים אלה. תוצאות אלה רומזות כי מתן מוקדם של אורנסיה במחלה עשוי לשנות את המהלך הטבעי שלה ואולי אף קוטע את הרצף שמוביל להתפתחותה של דלקת מפרקית שיגרונית. יש, כמובן, צורך לסייג שזו תצפית ראשונית ושיש צורך בקבוצה גדולה של חולים ובזמן מעקב ארוך יותר כדי לבסס טענה זו[15].
למרוח האופטימיות המתקבלת מנתונים אלה ראוי לציין שטרם אושר על ידי גורמי הרישוי בעולם שימוש באורנסיה או בתרופות ביולוגיות אחרות בחולים שלא קיבלו טיפול קודם ב- DMARDs.
השפעה על התקדמות רדיוגרפית
מחקר ה-AIM הוא הראשון אשר הדגים כי טיפול באורנסיה המשולב עם מטוטרקסט הוביל להאטה משמעותית בהתקדמות השחיקה במפרקים כפי שנמדד בצילומי רנטגן עוקבים. במחקר זה, ששילב טיפול באורנסיה ובמטוטרקסט, הודגמה הפחתה של 50% בקצב השחיקה של המפרקים על פי צילומי רנטגן עוקבים בהשוואה לטיפול במטורקסאט בלבד. יתר על כן, במחקר המשך פתוח וארוך טווח, ניתן היה להיווכח כי בשנה השנייה למחקר קצב ההתקדמות נסוג אף יותר ואותו הדין באשר לשנה השלישית למחקר הפתוח, כלומר ככל שנקף הזמן, פחת קצב ההתקדמות של הנזק הרדיוגראפי [10],[17],[18].
מחקר ה- ASSET הדגים השפעה משמעותית של אורנסיה על סינוביטיס של שורשי כפות הידיים, אוסטאיטיס והיווצרות ארוזיות באמצעות שימוש בטכניקת MRI. אוכלוסייה זו הייתה בעלת מדדים פרוגנוסטיים פחות טובים (לאור קיומם של נוגדנים כנגד CCP , RF, נוכחות ארוזיות והיסטוריה של היעדר השפעה מספקת לטיפול מטוטרקסט) ונצפתה בהם השפעה חיובית לטיפול באורנסיה כבר לאחר 4 חודשים וביתר שאת לאחר שנה של טיפול באמצעות MRI. השפעה ברורה הייתה לאורנסיה על המטבוליזם של העצם ועל דיכוי האוסטאיטיס, דבר זה ניתן לייחס להשפעה הממתנת של האורנסיה על התמיינותם של אוסטאטקלסטים ועל מניעת ספיגת העצם[19].
מחקר AGREE אשר נערך בחולים הלוקים באבחנה של דלקת מפרקית מוקדמת הדגים השפעה חיובית של אורנסיה על שחיקת העצם בהשוואה למטופלי מטוטרקסט בלבד, שינוי אשר לא הגיע להבדל סטטיסטי מובהק וזאת כנראה בשל השלב המקדמי בו נמצאו החולים. יחד עם זאת, אותם החולים שלכאורה לא ניכרה בהם עדיין השפעה מטיבה של אורנסיה על ההתקדמות הרדיוגראפית, נהנו מהשפעה קלינית מטיבה של התכשיר והשיגו מדדים נמוכים של פעילות המחלה[16].
טיפול באורנסיה באמצעות זריקות תת עוריות
המנה המקובלת לטיפול כיום עומדת על 125 מ"ג בזריקה תת עורית מדי שבוע.
מחקר מרכזי בטיפול באורנסיה במתן תת עורי היה מחקר ה-ACCOMPANY עם וללא תוספת של מטוטרקסט. תגובה קלינית התפתחה תוך 15 ימים מתחילת הטיפול וכ-80% ממשתתפי המחקר השיגו תגובה קלינית יפה או מתונה על פי כללי EUALR בפרק זמן של 18 חודשים. מעניינת העובדה שרק כרבע מהחולים שהוגרלו לקבוצת המונותרפיה נזקקו בהמשך לתוספת מטוטרקסט[20].
מחקר ACQUIRE הדגים את היעדר הנחיתות (noninferiority) של אורנסיה במתן תת עורי (עם מנת העמסה ראשונית אל תוך הווריד) אל מול טיפול תוך ורידי חודשי סטנדרטי. הן התוצאות הקליניות המשקפות פעילות של מחלה שיגרונית והן התוצאות המלמדות על תפקוד היו זהות בשתי זרועות הטיפול[21]. מחקר ה- ATTUNE הדגים כי ניתן, ללא כל בעיה, לעבור מטיפול ארוך טווח שניתן בעירוי לווריד אל טיפול תת עורי באורנסיה. החולים, שטופלו בתכשיר באמצעות עירוי לווריד לפרקי זמן של מספר שנים, לא איבדו מיעילותו וכן לא נחשפו לסיכונים או לתופעות לוואי יוצאות דופן. מחקר זה הורכב מחולים שהשתתפו במחקרי המשך למחקרי AIM ו-ATTAIN שכזכור הורכבו מחולים שלא הגיבו די לטיפול ראשוני במטוטרקסט או בנוגדי TNFα, בהתאמה. בתום תקופה בת 12 חודשים שבמהלכה טופלו החולים בתכשיר תת עורי, מעל ל-51% השיגו דרגת פעילות נמוכה (low disease activity) ומעל ל-40% השיגו הפוגה קלינית מלאה על פי סקלת DAS28-CRP[22].
דומה שלתשומת לב מרובה זכה מחקר AMPLE שעסק בחולים שלא הגיבו לטיפול מטוטרקסט באופן מספק וטרם נחשפו לטיפולים ביולוגיים מסוג נוגד TNFα. במחקר השתתפו חולים רבים בהם המחלה הייתה מוקדמת (משך הזמן הממוצע של המחלה עמד על 1.7 שנים). הייחודיות של המחקר נבעה מכך שהוא נערך כמחקר ראש בראש בין שתי תרופות ביולוגיות שניתנו באופן תת עורי ומיטבי, כאשר ברקע החולים טופלו במעון קבוע של מטוטרקסט. הראשונה היא אורנסיה ואילו השנייה הייתה Adalimumab (HUMIRA), תרופה קלאסית ממשפחת נוגדי TNFα. המחקר תוכנן לשם בחינת היעדר נחיתות בין שני התכשירים בהיבטים של יעילות ובטיחות ואמנם כעבור שנה, 63.4% מקבוצת מטופלי HUMIRA הגיעו לשיפור של כ-20% (ACR20) כאשר מטופלי האורנסיה השיגו יעד דומה של 64.8%. בתום מעקב של שנתיים, התוצאות היו 60.1% ו-59.7% בהתאמה. מעבר לכך שהיעדים הקליניים שהוצבו במחקר היו זהים לחלוטין כך גם הייתה הדינאמיקה של קצב השפעת התכשירים[23],[24].
נתוני יעילות ממסד נתונים של חולים המטופלים בתכשירים ביולוגיים
מסדי נתוני האמת אודות חולים מסקרנים במיוחד בנוגע לפרמטר "הישרדות הטיפול", כלומר מה משך הזמן בו נותרים החולים המטופלים בתכשיר ללא שינויו בשל אובדן/היעדר יעילות או תופעות לוואי. דבר זה מלמד אותנו רבות אודות היעילות האמיתית שלא באמצעות מחקרים קליניים ואת מידת ההפרעה להמשך טיפול בשל תופעות לוואי.
במסד הנתונים מדנמרק, הידוע באיכות נתוניו, נמצא שבקרב חולים אשר טיפול בנוגדי TNFα לא סייע להם, 19% ו-26% השיגו הפוגה קלינית שנמדדה על פי DAS28-CRP כעבור 24 ו-48 שבועות, בהתאמה[25]. תוצאות אלה לא נופלות מההישגים של המרות אל נוגד TNFα אחר או מעבר לטיפול ביולוגי המכוון כנגד 6-IL ACTEMRA) tocaiizumab). מסד הנהונים של חולים שטופלו באורנסיה (0RA) הדגים שלחולים אשר להם כייל גבוה של נוגדנים כנגד CCP יש את הסיכוי הגבוה ביותר ליהנות משיפור קליני ומהיוותרות עם התרופה לאורך זמן[26]. מנתוני DANBIO נמצא ששיעורי ההיוותרות בשימוש באורנסיה עומדים על 54% מקץ 48 שבועות לטיפול ומנתוני ORA עולה כי שיעור ההיוותרות עומד על 73% לאחר 28 שבועות מתחילת הטיפול[25],[26].
נתוני בטיחות
ככלל, נתוני הבטיחות של אורנסיה הם טובים מאוד, שיעורם על פי מחקרים אקראיים וכפולי סמיות, מטא-אנליזות ומסד נתוני חולים ממדינות שונות, נמוך.
במחקר ASSURE, שכלל חולים עם תחלואות צולבות כאי ספיקת לב, מחלת ריאות חסימתית כרונית וסוכרת, לא נצפתה נסיגה במצבם הרפואי של המשתתפים להם תחלואה נוספת. סך כלל תופעות הלוואי המדווחות ובפרט הרציניות לא היה שונה ממטופלי הפלצבו[27].
מחקר כפול סמיות שבחן שילוב של הנוגד TNFα etanercept (ENBREL) או פלצבו יחד עם אורנסיה, הראה ששילובם של התכשירים הביולוגיים הביא לעלייה בשיעור הזיהומים מבלי שנתקבל ערך מוסף בשיפור הקליני[28].
כיום המידע שהצטבר ממחקרים ארוכי טווח (המשכם של המחקרים הקלאסיים שפורטו לעיל) מצביעים על היעדר סכנה בטווח הארוך במטופלי האורנסיה. מטא-אנליזה שפורסמה לאחרונה ב-Cochrane חיזקה את הממצא ששיעור תופעות הלוואי החמורים והזיהומים החמורים בהשוואה לתכשירים ביולוגיים אחרים היה נמוך באורנסיה ועמד על 0.65 ו-0.57, בהתאמה מול 1.11 ו-1.19 בתכשירים הביולוגיים האחרים, בהתאמה[29].
במחקר ה־ ATTEST נמצא ששיעור הפסקות הטיפול בגין תופעות לוואי היה נמוך יתר בקרב מטופלי האורנסיה בהשוואה למטופלי infliximab. תוצאות דומות נצפו במחקר AMPLE בו השוותה האורנסיה ל-adalimumab, בעוד ששיעור הזיהומים היה זהה בשתי הקבוצות, הרי שפחות מטופלים הפסיקו את הטיפול בזריקות תת עוריות בקרב מטופלי האורנסיה לאור מספר נמוך יותר של תופעות לוואי מקומיות באתר ההזרקה[8],[23].
שיעור התגובות לעירוי התוך ורידי הוא נמוך יותר בהשוואה לתכשירים ביולוגיים אחרים ועומד על 5%-10% כאשר על פי רוב, הפסקה זמנית והאטה בקצב העירוי פותרת בעיות אלה. רק 0.6% מהמטופלים מפתחים תופעות לוואי חמורות לעירי המחייבות הפסקת הטיפול[27],[29].
כמצוין לעיל, שיעור התגובות באחר ההזרקה של אורנסיה נמוך בהשוואה לתכשירים ביולוגיים אחרים ונע בין 8.2%-1.2% ובמחקר AMPLE הוא עמד על 4.1% בהשוואה ל־10.4% מקרב מוזרקי adalimumab[23].
שיעורם של זיהומים הוא נמוך ואינו עולה עם הימשכות הטיפול. הזיהומים החמורים שהובילו לאשפוזם הם, על פי שיעור הדיווח, דלקת ריאות, דלקת דרכי האוויר העליונות וסלוליטיס. שיעור הזיהומים האופורטיוניסטים הוא נמוך ביותר ועומד על 0.35 ל-100 שנות חולה כאשר הנפוץ מביניהם הוא הקנדידיאזיס. שחפת ריאתית נמצאת בשיעור נמוך במיוחד העומד על 0.01-0.05 ל-100 שנות חולה, אולם יש להקפיד על כללי הסיקור לשחפת פעילה וסמויה בדומה למקובל בכל יתרת התכשירים הביולוגיים. יש לציין כי אין כל הבדל בשיעור הזיהומים בין שיטות הטיפול באורנסיה אם בעירוי לווריד ואם בזריקה תת עורית[9],[10],[11] , [22],[23],[24],[27],[29].
- ממאירויות
מניתוח מלוא הנתונים של המחקרים הקליניים ניתן ללמוד שלא חלה עלייה בשיעור הממאירויות בקרב מטופלי האורנסיה בהשוואה לחולי דלקת מפרקים שיגרונית אשר טופלו בDMARDs או בפלצבו. העלייה היחידה שנצפתה בדומה לתכשירים ביולוגיים אחרים היא בממאירויות העור שאינן מלנומה. שיעור הממאירויות נע בין 0.8-1.2 ל-100 שנות חולה, נתונים המתאימים לאוכלוסיית חולי המפרקים שלא מטופלים בתכשירים ביולוגיים[9],[10],[11],[22],[23],[24] , [26],[27],[29],[30].
הופעתן של מחלות אוטואימוניות תוארה בקרב מטופלי האורנסיה. פסוריאזיס, וסקוליטיס, תסומנת סיוגרן ואריתמה נודוזום דווחו בשכיחות נמוכה. לא חלה עלייה בהיארעות מחלות בקרב חולים אשר טופלו באופן ממושך באורנסיה[27].
באשר לחשיפה בעת היריון המידע עדיין מצומצם וההמלצה הקיימת כיום היא להפסיק היריון אם האישה נחשפה לאורנסיה. אמנם יש מספר מועט של אירועים לא מטוניס של הרות בעת טיפול ואף מתואר היריון שהסתיים בהצלחה וללא כל בעיה לאחר חשיפה במהלך השליש הראשון של ההיריון, אך כאמור ההמלצה היא שלא להרות במהלך הטיפול באורנסיה[31].
בדומה לטיפולים ביולוגיים אחרים, קיימת הוריית נגד מוחלטת לחיסון בחיסונים חיים מטופלים באורנסיה, כמו כן מומלץ שלא לחסן שבועיים טרם התחלת טיפול ועד שלושה חודשים מתום הטיפול בתכשיר. באשר לחיסון שאינו חי, הרי שנמצא שיש ירידה ביעילותו כפי הנראה לאור הפגיעה במערכת החיסון התאית. תצפיות שכאלה דווחו במחוסנים כנגד שפעת, פנאומווקס וחיסוני טוקסואיד של טטנוס[29],[32],[33],[34].
סיכום
החלופות הטיפוליות העומדות לרשות המטפלים והמטופלים בדלקת מפרקית שיגרונית הציבו אותנו בפני מציאות ואתגרים חדשים. לתכשירים השונים יש יכולות אשר התרופות ההיסטוריות היו רחוקות מלתת. יחד עם זאת יש לזכור כי העלות הגבוהה של התכשירים הללו מציבה מחסום שעדיין מעכב חולים מלקבל תכשירים אלה בשלב מוקדם של מחלתם.
הנתונים שהוצגו במאמר סקירה זה מציבים את ORENCIA) Abatacept) בהחלט כשווה בין שווים בהשוואה לתכשירים הביולוגיים האחרים הקיימים בשוק התרופות הישראלי.
דגלים אדומים
ביבליוגרפיה
- ↑ BieberV, Cohen AD, Freud T, Agmon-Levin N, Gertel S, Amital H. Autoimmune smoke and fire-coexisting rheumatoid arthritis and chronic obstructive pulmonary disease: a cross-sectional analysis. Immunol Res 2013;56:261-266.
- ↑ Mclnnes IB, Schett G.The pathogenesis of rheumatoid arthritis. N Engl J Med 2011;365:2205-2219.
- ↑ Colebatch AN, Edwards CJ, Ostergaard M, van der Heijde D, Balint PV, D'Agostino MA, Forslind K, Grassi W, Haavardsholm EA, Haugeberg GJurik AG, LandeweRB, Naredo E, O'Connor PJ, Ostendorf B, Potocki K, Schmidt WA, Smolen JS, Sokolovic S, Watt I, Conaghan PG. EULAR recommendations for the use of imaging of the joints in the clinical management of rheumatoid arthritis. Ann Rheum Dis 2013;72:804-814,
- ↑ Harrold LR, Harrington JT, Curtis JR, Furst DE, Bentley MJ, Shan Y, Reed G, Kremer J, Greenberg JD. Prescribing practices in a US cohort of rheumatoid arthritis patients before and after publication of the American College of Rheumatology treatment recommendations. Arthritis Rheum 2012;64:630-638.
- ↑ O'Dell JR, Mikuls TR, Taylor TH, Ahluwalia V, BrophyM, Warren SR, Lew RA, Can-nella AC, Kunkel G,PhibbsCS, Anis AH, Leatherman S, Keystone E. Therapies for ac¬tive rheumatoid arthritis after methotrexate failure. N Engl J Med 2013;369:307-318.
- ↑ Maneiro RJ, Salgado E, Carmona L, Gomez-ReinoJJ. Rheumatoid factor as predic¬tor of response to abatacept, rituximab and tocilizumabin rheumatoid arthritis: Systematic review and meta-analysis. Semin Arthritis Rheum 2013;43:9-17.
- ↑ 7.0 7.1 Kremer JM, Genant HK, Moreland LW, Russell AS, Emery P, Abud-Mendoza C, Szechinski J, Li T, Ge Z, Becker JC, Westhovens R. Effects of Abatacept in patients with methotrexate-resistant active rheumatoid arthritis: a randomized trial. Ann Intern Med 2006;144:865-876.
- ↑ 8.0 8.1 8.2 Schiff M, Keiserman M, Codding C, SongcharoenS, Berman A, Nayiager S, Saldate C, Li T, Aranda R, Becker JC, Lin C, Cornet PL, Dougados M. Efficacy and safety of Abatacept or infliximab vs placebo in ATTEST: a phase III, multi-centre, randomised, double-blind, placebo-controlled study in patients with rheumatoid arthritis and an inadequate response to methotrexate. Ann Rheum Dis 2008:67:1096-1103.
- ↑ 9.0 9.1 9.2 Kremer JM, Westhovens R, Leon M, Di GE, Alten R, Steinfeld S, Russell A, Dougados M, Emery P, Nuamah IF, Williams GR, Becker JC, Hagerty DT, Moreland LW. Treatment of rheumatoid arthritis by selective inhibition of T־cell activation with fusion protein CTLA4lg. N Engl J Med 2003;349:1907-1915.
- ↑ 10.0 10.1 10.2 10.3 Schiff M. Abatacept treatment for rheumatoid arthritis. Rheumatology (Oxford) 2011;50:437-449.
- ↑ 11.0 11.1 11.2 Westhovens R, Kremer JM, Moreland LW, Emery P, Russell AS, Li T, Aranda R, Becker JC, Qi K, Dougados M. Safety and efficacy of the selective costimulation modulator Abatacept in patients with rheumatoid arthritis receiving background methotrexates 5-year extended phase IIB study. J Rheumatol 2009;36:736-742.
- ↑ Kremer JM, Russell AS, Emery P, Abud-Mendoza C, Szechinski J, Westhovens R, Li T, Zhou X, Becker JC, Aranda R, Peterfy C, Genant HK. Long-term safety, efficacy and inhibition of radiographic progression with Abatacept treatment in patients with rheumatoid arthritis and an inadequate response to methotrexate: 3-year results from the AIM trial. Ann Rheum Dis 2011;70:1826-1830.
- ↑ Genovese MC, Schiff M, Luggen M, LeBM, Aranda R, Elegbe A, Dougados M. Longterm safety and efficacy of Abatacept through 5 years of treatment in patients with rheumatoid arthritis and an inadequate response to tumor necrosis factor inhibitor therapy.J Rheumatol 2012;39:1546-1554.
- ↑ Schiff M, Pritchard C, Huffstutter JE, Rodriguez-Valverde V, Durez P, Zhou X, Li T, Bahrt K, Kelly Sr Le BM, Genovese MC. The 6-month safety and efficacy of Abatacept in patients with rheumatoid arthritis who underwent a washout after anti-tumour necrosis factor therapy or were directly switched to abatacept: the ARRIVE trial. Ann Rheum Dis 2009;68:1708-1714.
- ↑ 15.0 15.1 Emery P, Durez P, Dougados M, Legerton CW, Becker JC, VratsanosG, Genant HK, Peterfy C,Mitra P, Overfield S, Qi K, Westhovens R. Impact of T-cell costimulation modulation in patients with undifferentiated inflammatory arthritis or very early rheumatoid arthritis: a clinical and imaging study of Abatacept (the ADJUST trial). Ann Rheum Dis 2010;69:510-516.
- ↑ 16.0 16.1 Westhovens R, RoblesM, Ximenes AC, NayiagerS, Wollenhaupt J, Durez P, Gomez-Reino J, Grassi W, Haraoui B, Shergy W, Park SH, Genant H, Peterfy C, Becker JC, Covucci A, Helfrick R, Bathon J. Clinical efficacy and safety of Abatacept in metho-trexate-naive patients with early rheumatoid arthritis and poor prognostic factors. Ann Rheum Dis 2009;68:1870-1877.
- ↑ Genant HK, Peterfy CG, Westhovens R, Becker JC, Aranda R, Vratsanos G, Teng J, Kremer JM. Abatacept inhibits progression of structural damage in rheumatoid arthritis: results from the long-term extension of the AIM trial. Ann Rheum Dis 2008;67:1084-1089.
- ↑ Kremer JM, Russell AS, Emery P, Abud-Mendoza C, Szechinski J, Westhovens R, Li T, Zhou X, Becker JC, Aranda R, PeterfyC, Genant HK. Long-term safety, efficacy and inhibition of radiographic progression with Abatacept treatment in patients with rheumatoid arthritis and an inadequate response to methotrexate: 3-year results from the AIM trial. Ann Rheum Dis 2011;70:1826-1830.
- ↑ Buch MH, Boyle DL, Rosengren S, Saleem B, Reece RJ, Rhodes LA, Radjenovic A, English A, Tang H, VratsanosG, O'Connor P, Firestein GS, Emery P. Mode of action of Abatacept in rheumatoid arthritis patients having failed tumour necrosis factor blockade: a histological, gene expression and dynamic magnetic resonance imaging pilot study. Ann Rheum Dis 2009;68:1220-1227.
- ↑ Nash P, Nayiager S, Genovese MC, Kivitz AJ.OelkeK, Ludivico C, Palmer W, Rodri-guezC, Delaet I, Elegbe A, CorboM. Immunogenicity, safety, and efficacy of abata-cept administered subcutaneously with or without background methotrexate in patients with rheumatoid arthritis: results from a phase III, international, multicenter, parallel-arm, open-label study. Arthritis Care Res (Hoboken ] 2013;65:718-728.
- ↑ Genovese MC, Covarrubias A, Leon G, Mysler E, Keiserman M, Valente R, Nash P, Simon-Campos JA, Porawska W, Box J, Legerton C, III, Nasonov E, Durez P, Aranda R, Pappu R, Delaet I, Teng J, Alten R. Subcutaneous Abatacept versus intravenous abatacept: a phase Nib noninferiority study in patients with an inadequate response to methotrexate. Arthritis Rheum 2011;63:2854-2864.
- ↑ 22.0 22.1 22.2 Keystone EC, Kremer JM, Russell A, Box J, Abud-Mendoza C, ElizondoMG, Luo A, Aranda R, Delaet I, Swanink R, Gujrathi S, Luggen M. Abatacept in subjects who switch from intravenous to subcutaneous therapy: results from the phase lllb AT¬TUNE study. Ann Rheum Dis 2012;71:857-861.
- ↑ 23.0 23.1 23.2 23.3 23.4 Schiff M, Weinblatt ME, Valente R, van der Heijde D, Citera G, Elegbe A, Mai-donado M, Fleischmann R. Head-to-head comparison of subcutaneous Abatacept versus Adalimumab for rheumatoid arthritis: two-year efficacy and safety findings from AMPLE trial. Ann Rheum Dis 2013
- ↑ 24.0 24.1 24.2 Weinblatt ME, Schiff M, Valente R, van der Heijde D, Citera G, Zhao C, Maldonado M, Fleischmann R. Head-to-head comparison of subcutaneous Abatacept versus Adalimumab for rheumatoid arthritis: findings of a phase lllb, multinational, pro¬spective, randomized study. Arthritis Rheum 2013;65:28-38,
- ↑ 25.0 25.1 Letters HC, Ostergaard M, Glintborg B, Krogh NS, Foged H, Tarp U, Lorenzen T, Hansen A, Hansen MS, Jacobsen MS, Dreyer L, Hetland ML. Efficacy of Abatacept and tocilizumabin patients with rheumatoid arthritis treated in clinical practice: results from the nationwide Danish DANBIO registry. Ann Rheum Dis 2011;70:1216-1222.
- ↑ 26.0 26.1 26.2 G0ttenberg JE, Ravaud P, Cantagrel A, Combe B, FlipoRM, SchaeverbekeT, Houvenagel E, Gaudin P, Loeuille D, Rist S, Dougados M, Sibilia J, Le L, X, Marcelli C, Bardin T, Pane I, Baron G, MarietteX. Positivity for anti-cyclic citrullinated peptide is associated with a better response to abatacept: data from the'Orencia and Rheuma¬toid Arthritis1 registry. Ann Rheum Dis 2012;71:1815-1819.
- ↑ 27.0 27.1 27.2 27.3 27.4 Weinblatt M, Combe B, Covucci A, Aranda R, Becker JC, Keystone E. Safety of the selective costimulation modulator Abatacept in rheumatoid arthritis patients receiv¬ing background biologic and nonbiologic disease-modifying antirheumatic drugs: A one-year randomized, placebo-controlled study. Arthritis Rheum 2006;54:2807-2816.
- ↑ Weinblatt M, Schiff M, Goldman A, Kremer J, Luggen M, Li T, Chen D, Becker JC. Selective costimulation modulation using Abatacept in patients with active rheuma¬toid arthritis while receiving etanercept: a randomised clinical trial. Ann Rheum Dis 2007;66:228-234.
- ↑ 29.0 29.1 29.2 29.3 29.4 Maxwell LJ, Singh JA. Abatacept for rheumatoid arthritis: a Cochrane systematic review. Rheumatol 2010;37:234-245.
- ↑ Simon TA, Smitten AL, Franklin J, Askling J, LacailleD, Wolfe F, Hochberg MC, Qi K, Suissa S. Malignancies in the rheumatoid arthritis Abatacept clinical development programme: an epidemiological assessment. Ann Rheum Dis 2009;68:1819-1826.
- ↑ Ruperto N, Lovell DJ, Quartier P, Paz E, Rubio-Perez N, Silva CA, Abud-Mendoza C, Burgos-Vargas R, Gerloni V, Melo-Gomes JA, Saad-Magalhaes C, Chavez-Corrales J, Huemer C, Kivitz A, Blanco FJ, Foeldvari I, Hofer M, Horneff G, Huppertz HI, Job-Deslandre C, Loy A, Minden K, PunaroM, Nunez AF, Sigal LH, Block AJ, Nys M, Martini A, Giannini EH. Long-term safety and efficacy of Abatacept in children with juvenile idiopathic arthritis. Arthritis Rheum 2010;62:1792-1802.
- ↑ Borba EF, Saad CG, Pasoto SG, Calich AL, Aikawa NE, Ribeiro AC, Moraes JC, Leon EP, Costa LP, Guedes LK, Silva CA, Goncalves CR, Fuller R, Oliveira SA, Ishida MA, Precioso AR, Bonfa E. Influenza A/H1N1 vaccination of patients with SLE:can antimalarial drugs restore diminished response under immunosuppressive therapy? Rheumatology (Oxford) 2012;51:1061-1069.
- ↑ Ribeiro AC, Laurindo IM, Guedes LK, Saad CG, Moraes JC, Silva CA, Bonfa E. Abatacept and reduced immune response to pandemic 2009 influenza A/H1N1 vaccination in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2013;65:476-480.
- ↑ Tay L, Leon F, VratsanosG, Raymond R, Corbo M. Vaccination response to tetanus toxoid and 23-valent pneumococcal vaccines following administration of a single dose of abatacept: a randomized, open-label, parallel group study in healthy subjects. Arthritis ResTher 2007;9:R38.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' הווארד עמיטל, מומחה לרפואה פנימית וריאומטולוניה, מנהל מחלקה פנימית ב', המרכז הרפואי ע"ש שיבא, תל-השומר.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק