האנזים גלוטמאט דהידרוגנאז כמדד להדבקה עם החיידק קלוסטרידיום דיפיצילה
| מדריך בדיקות מעבדה | |
| האנזים גלוטמאט דהידרוגנאז כמדד להדבקה עם החיידק קלוסטרידיום דיפיצילה | |
|---|---|
| שמות אחרים | GLDH , clostridium difficile, glutamate dehydrogenase |
| מעבדה | כימיה בצואה |
| תחום | זיהוי מחלת מעיים |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – קלוסטרידיום דיפיצילה
האנזים glutamate dehydrogenase (להלן GLDH), הוא אנזים המופיע במיטוכונדריה של יצורים פרוקריוטים ואאוקריוטים. גלוטמאט הוא מטבוליט מפתח המשמש כקשר בין המטבוליזם של פחמן ושל חנקן (Feehily ו-Karatzas ב-J Appl Microbiol משנת 2013). בערך 88% של החנקן התאי מגיעים מגלוטמאט (Wohlheuter וחב' ב-glutamine metabolism The enzymes of משנת 1973). המטבוליזם של גלוטמאט נמצא חיוני לאלימות של חיידקים פתוגניים כגון Staph aureus (על פי Somerville ו-Proctor ב-Microbiol Mol Biol Rev משנת 2009), Neisseria meningitides (על פי Schoen וחב' ב-Front Cell Infect Microbiol משנת 2014), ו-Helicobacter pylori (על פי Shibayama וחב' ב-Mol Microbiol משנת 2007). הצריכה של גלוטמאט חיונית גם ל-Clostridium difficile בקוֹלוֹנִיזַצְיָה in vivo, ולהתפתחות תחלואה. פעילות GLDH מייצרת אמוניה שביצורים אאוקריוטים משמשת בסיס במעגל ה-urea. במאופיין, הריאקציה ההופכת α-קטו-חומצה גלוטרית לגלוטמאט, אינה מתרחשת ביונקים, כיוון ששיווי המשקל של GLDH מעדיף את היצירה של אמוניה. ל-GLDH יש זיקה מאוד נמוכה לאמוניה, (עם קבוע מיכאליס גבוה של בערך 1mM), ולכן רמות טוקסיות של אמוניה היו צריכות להיות נוכחות בגוף לקידום הריאקציה ההפוכה, דהיינו ש-α-קטו-חומצה-גלוטרית ואמוניה היו מגיבים ליצירת גלוטמאט ו-+(NAD(P.
עם זאת, במיטוכונדריות של המוח היחס בין NAD+/NADH מעודד דה-אמינציה חמצונית, (דהיינו הפיכת גלוטמאט לα-קטו-חומצה גלוטרית ואמוניה על פי McKenna ו-Ferreira ב-Springer Int משנת 2016). בחיידקים, האמוניה מוטמעת עם חומצות אמינו דרך גלוטמאט ואמינו-טרנספראזות (Lightfoot וחב' ב-Plant Mol Biol משנת 1988). האנזים GLDH מהווה קשר ישיר למסלולים אנאבולים וקטבולים ולכן הוא כה נפוץ באאוקריוטים. באדם, אנזים זה מקודד על ידי 2 גנים: GLUD1 ו-GLUD2, וישנם בגנום האנושי לפחות עוד 8 פסבדוגנים של GLDH, המשקפים כנראה השפעות מיקרוביאליות על האבולוציה האאוקריוטית.
קו-פקטורים: +NAD או +NADP הוא קו-פקטור של ריאקציית GLDH, לייצור α-קטו-חומצה-גלוטרית ואמוניום (Botman וחב' ב-J Histochem Cytochem משנת 2014). בהתבסס על איזה קו-פקטור נמצא בשימוש, אנזים GLDH מתחלק ל-3 הקבוצות הבאות:
- L-glutamate + H2O + NAD+ 2-oxoglutarate + NH3 + NADH + H+
- L-glutamate + H2O + NAD(P)+ 2-oxoglutarate + NH3 + NAD(P)H + H+
- L-glutamate + H2O + NADP+ 2-oxoglutarate + NH3 + NADPH + H+
ההחדרה של אמוניה בבעלי חיים ובחיידקים מתבצעת על ידי הפעולות של GLDH ושל glutamine synthetase. החיוניות של גלוטמאט בשטף החנקן היא בכך שגלוטמאט יכול לשמש הן כתורם של חנקו כמו גם כ-acceptor של חנקן. באדם, הפעילות של GLDH מבוקרת על דרך ADP-ribosylation, הנשלטת על ידי הגן sirt4. רגולציה זו עוברת רגיעה בתגובה למגבלה קלורית וריכוז נמוך של גלוקוזה בדם. במצבים אלה, הפעילות של GLDH מוגברת על מנת להגדיל את הכמות הנוצרת של α-קטו-חומצה-גלוטרית, שיכול לשמש לספק אנרגיה על ידי היותו משתתף במעגל החומצה הציטרית לייצר ATP. בחיידקים, פעילות האנזים מבוקרת על ידי ריכוז האמוניום ו/או על ידי ריכוזי היון rubidium הנקשר לאתר האלוסטרי על פני GLDH ומשנה את Km (קבוע מיכאליס) של האנזים (Wootton ב-Biochem J משנת 1983).
הבקרה של GLDH דרך ADP-ribosylation חשובה במיוחד בתאי β מייצרי אינסולין, המפרישים אינסולין בתגובה לעלייה ביחס ATP/ADP, וכאשר חומצות אמינו מוּסבוֹת על ידי GLADH ל-α קטו-חומצה גלוטרית, יחס זה גדל ומגביר את הפרשת אינסולין. Sirt4 נחוץ לצורך בקרה של המטבוליזם של חומצות אמינו, כשיטה לבקרה על הפרשת אינסולין וויסות רמת גלוקוזה בדם. בבקר נמצא על ידי Frieden ש-GLDH מווסת על ידי הנוקלאוטידים ATP ,ADP ו-GTP. (על פי Frieden ב-J Biol Chem מהשנים 1959 ו-1965). אנזים זה היה אחד האנזימים הראשונים שהושפע "מהתנהגות אלוסטרית" (Monod וחב' ב-J Mol Biol משנת 1965). מוטציות המשנות את האתר הקישור האלוסטרי של GTP, גורמות לשפעול מתמיד של GLDH, ולתסמונת הידועה כ-hyperinsulinism-hyperammonemia.
התחלואה הנגרמת על ידי Clostridium difficile
Clostridium difficile (להלן Cd) הוא פתוגן הגורם לשלשולים ולקוליטיס. הוא חיידק גראם-חיובי אנארובי היוצר נבגים (spores). אם התרחיש לא מטופל כראוי הוא עלול להתרחש שנית, ואף להתדרדר למצבים מסכני-חיים כגון ספסיס, megacolon טוקסי, וכשל של איברים רבים. הנחיות משנת 2018 כבר אינן ממליצות על metronidazole כטיפול קו-ראשון במבוגרים, בהם מומלץ כעת טיפול פומי עם vancmycin או עם fidaxomicin. הנחיות עכשוויות ממליצות על החדרה פומית של מיקרוביוטה באותם מטופלים הסובלים מהישנות תרחישי Cd שאינם מגיבים לטיפול אנטיביוטי. ה-CDC באטלנטה מעריך שחיידק זה גורם מדי שנה לחצי מיליון מקרים חדשים, כאשר 20% מתוכם עלולים להידבק בו שנית, ועל פי אומדני מרכז זה כ-9% מהנדבקים עם Cd מעל גיל 65, נפטרו ממחלות הכרוכות בחיידק תוך חודש מאבחון ההדבקה. גורמי סיכון להסתבכות המחלה הם שימוש באנטיביוטיקה לא ראויה, גיל מעל 65, מהלך של אשפוז, מערכת חיסון מוחלשת, וחשיפה קודמת לחיידק (Hopkins ו-Wilson ב-Gastroenterol Rep משנת 2017, ו-Brown ו-Wilson באותו כתב עת משנת 2018). שלשולים שנגרמו על ידי טוקסין A מהווים 15-25% מאלה הנגרמים בהשריית אנטיביוטיקה (Bartlett ב-Clin Infect Dis משנת 1992(. נתונים אפידמיולוגיים מעריכים שהתמותה הממוצעת מהדבקה ב-Cd היא 5.7% (Gravel וחב' ב- Clin Infect Dis משנת 2009).
החיידק מתפשט במסלול צואתי-פומי, במגע ידיים, והתפשטות החיידק דרך האוויר בבתי חולים. תסמיני החיידק מופיעים בדרך כלל זמן קצר לאחר טיפול אנטיביוטי, כאשר סיכון זה עלול להימשך עד 90 יום. טיפול אנטיביוטי מתמשך, או השימוש במספר תכשירים אנטיביוטיים מגביר את הסיכון של הדבקה עם Cd. כימותרפיה, ניתוחי מעי, והשימוש בתכשירים מדכאי חומציות כגון מעכבי משאבת פרוטון או חוסמי histamine-2 אף הם גורמי סיכון (McDonald וחב' ב-Clin Infect Dis משנת 2018). התסמינים של הדבקה ב-Cd הם צואה מימית, פעולת מעיים תדירה הנמשכת מספר ימים, חום, רגישות או כאבי קיבה, איבוד תיאבון ובחילה. צריכת אנטיביוטיקה מקרולידית כולל clindamycin, צפלוספורינים מהדור השלישי או הרביעי, פניצילינים, fluoroquinolones ו-carbapenems נכרכים לעיתים קרובות עם הדבקה ב-Cd, שכן סוגי אנטיביוטיקה אלה מדכאים את המיקרוביוטה הנורמלית במעי, מה שמאפשר התרבות בלתי מרוסנת של Cd {כ}}(Bartlett וחב' ב-Gastroenterology משנת 1978). חומצות מרה כגון taurocholate מסייעות לנביטה של נבגי Cd במעי (Giel וחב' ב-PLos One משנת 2010). לאחר נביטת הנבגים, התאים הווגטטיביים הגדלים במעי מייצרים את הטוקסינים A ו-B, שהם הגורמים האלימים הפוגעים במעי ומעצימים את הפגיעה של Cd (Braun וחב' ב-Gene משנת 1996, ו-Voth ו-Ballard ב-Clin Microbiol Rev משנת 2005). מחקרים in vitro של Cd, הראו שהשעתוק של הגנים המקודדים לטוקסינים משופעלים בתגובה למספר איתותים תזונתיים (Antunes וחב' ב- Nucleic acids Res משנת 2012, Dineen וחב' ב- J Bacteriol משנת 2010, Karlsson וחב' ב- Infect Immun משנת 2000, Maegawa וחב' ב- J Med Microbiol משנת 2002, ו-Nawrocki וחב' ב- J Bacteriol משנת 2016).
החיידק Cd מייצר 2 טוקסינים המסוגלים לגרום לקוליטיס: אנטרוטוקסינים A ו-B, כאשר טוקסין A הוא יותר פוטנטי. הטוקסינים מגרים ניטרופילים ונגרמת דלקת של רירית המעי, כמו גם נמק תאי, הגברת הפריסטלזיס של המעי, וחדירות מוגברת של קפילרות המעי, מה שגורם לשלשולים ולקוליטיס. זן NAP1 של Cd, גרם להתפרצויות חמורות של המחלה בארצות הברית ובאירופה, והוא מייצר טוקסין שְׁנִיּוֹנִי וטוקסין A שכמותו גדולה פי-16 וטוקסין B שכמותו גדולה פי-23 ממה שמיצרים זנים אחרים (Hedge וחב' ב-Ther Clin Risk Manag משנת 2008). בשנת 2013, ה-CDC קבע ש-Cd הוא אחד מהאיומים הדחופים העמידים לתכשירים אנטי-מיקרוביאליים שגורם לדאגה חמורה ביותר באשר לבריאות האדם. הנבגים שיוצר Cd עמידים מאוד לג'לים של אלכוהול ולתכשירים מונעי זיהומים אחרים, ונבגים אלה יכולים לשרוד על פני משטחים משך חודשים, אם משטחים אלה אינם מנוקים באופן ראוי. כאשר הם נבלעים, נבגים אלה יכולים לִנְבּוט במעי ולייצר טוקסינים, שמסוגלים לגרום להצטברות נוזלים במעי, לגרום לשלשולים, ולסיבוכי מעי נוספים. החיידק Cd מסוגל לשהות בגוף במצבים שונים: ניקח כמקרה אישה בת 92 השוהה בבית אבות, שאושפזה עם שינויים במצבה הנפשי לאחר שטופלה משך 3 שבועות עם levofloxacin כתוצאה מדלקת בדרכי השתן. לא היו לה יציאות ביומיים שלפני האשפוז. באשפוזה, ספירת התאים הלבנים שלה הייתה 90,000/ממ"ק, כאשר הערך הנורמלי הוא בין 3,600-11,100 תאים לבנים/ממ"ק. כן נמדדו אצלה 24% של תאי band, שהם צורות לא בשלות של ניטרופילים שהם התאים הלבנים השכיחים ביותר. התחום הנורמלי של תאי band הוא 0-6%. בדיקת CT של הבטן גילתה באופן דיפוזי רירית מעי דיפוזית, המתאימה למצב של megacolon. בוצעה במטופלת זו בדיקת A/B toxin immunoassay בחומר שהתקבל ממטוש של פי הטבעת, והיא נמצאה חיובית. במטופל נוסף מודבק ב-Cd, נמצאו פסבדו-ממברנות אופייניות בבדיקת sigmoidoscopy והיסטופתולוגיה הנראות כשכבות מעובות ודביקות של תאים ורירית המעי. לעיתים יש אנשים אשר המעיים שלהם מכילים מושבות של Cd, ללא כל תסמינים. יצירת מושבות עם חיידקי Cd המייצרים טוקסינים מתרחשת עד 15% מהמקרים, ואילו ב-6% מהאנשים מושבות Cd אינן יוצרות טוקסינים (Alasmri וחב' ב-Clin Infect Dis משנת 2014). יותר קשה לאבחן הדבקת Cd בילדים. תאי מעי של תינוקות אינם מכילים קולטנים אליהם טוקסינים של Cd יכולים להיקשר. לפיכך תינוקות לאחר לידה או בגיל הרך, יכולים להכיל בצואה חיידקי Cd ללא מחלה. לכן, מספר מעבדות אף לא מבצעות בדיקות לנוכחות CD בילדים מתחת לגיל 1–2 שנה.
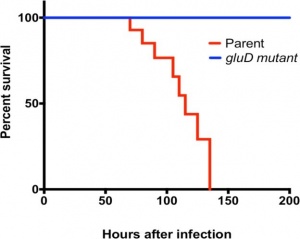
גלוטמאט במעי הגס מנוצל במהירות על ידי CD בהתרבותו
ידוע שטיפול מוקדם ב-clindamycin מגביר את הסיכון להדבקה ב-Cd (על פי Chang וחב' ב-Infect Immun משנת 1978). אנטיביוטיקה גורמת לשינויים דרמטיים בהרכב החיידקים במעי (Fujimura וחב' ב-Expert Rev Anti Infect ther משנת 2010, ו-Britton ו-Young ב-Gastroenterology משנת 2014). Girinathan וחב' בחנו מספר קבוצות אוגרים: קבוצת הביקורת לא קיבלה כל טיפול, בעוד שקבוצת הניסוי טופלה ב-clindamycin בלבד במינון של 30 מיליגרם/ק"ג משקל גוף, והוקרבה 6 ימים לאחר הטיפול האנטיביוטי. קבוצות האוגרים השלישית והרביעית טופלו ב-clindamycin, ו-4 ימים לאחר מכן הוזרקו עם 2,000 חיידקי CD של זן האם (JIR8094) או עם המוטנט (gluD). כיוון שנצפתה קוֹלוֹנִיזַצְיָה של הזן JIR8094 כבר יומיים לאחר הזרקת החיידק, הוקרבו אוגרים אלה יומיים לאחר ההַאֲבָסָה שלהם עם זן האם של Cd או עם המוטנט. נמדדה כמות החיידקים במְּעִי הָעִוֵּר (cecum) על ידי זריעת התכולה על פני פלטות CCFA-TA, וכן נמדדה תכולת חומצות האמינו. האנליזה של חומצות האמינו תוך שימוש בערכת EZ-fast של חברת Phenomenex-Torrance. תכולת חומצות האמינו בוטאה ב-ננומולר/מיליגרם תכולת cecum.
ההבדלים בתכולת החיידקים ב-cecum היו דרמטיים: עם זן האם נמדדו 105CFU בעוד שעם המוטנט נספרו 0–100 CFU בלבד, זאת בגרם של תכולת cecum. חומצות האמינו אספרגין, אלנין, גליצין, ליזין, ואלין, פרולין, איזולאוצין, מתיונין, סרין, תראונין ואורניטין היו מוגברות פי-4 ומעלה בבעלי חיים מטופלים ב-clindamycin בהשוואה לביקורת. טיפול ב-clindamycin הגביר את ריכוז גלוטמאט פי-2 ואת ריכוז גלוטאמין פי-3. לעומת זאת, הרמות של גלוטמאט וגלוטמין ירדו באופן דרמטי (פי-30 עד 40) לאחר צמיחת CD במעי, מה שמשקף את הצריכה המועדפת הגדולה של 2 חומצות אמינו אלו על ידי החיידק.
מחקרים על המטבוליזם ועל הדרישות התזונתיות של Cd, הצביעו על כך שחיידק זה יכול להתסיס חומצות אמינו חופשיות, כאשר מצעים מועדפים עליו הם פפטידים עם משקל מולקולרי קטן (Bouillaut וחב' ב-J Bacteriol משנת 2013, ו-Karasawa וחב' ב-Microbiology משנת 1995). כיוון שגלוטמאט היא חומצת אמינו מרכזית במטבוליזם של חומצות אמינו, והביוסינתזה של חומצות אמינו רבות תלויה בגלוטמאט, השערת Girinathan וחב' הייתה שהיכולת של Cd לצמוח במעי תלויה במסלול הצריכה של גלוטמאט. האנזימים ממשפחת GLDH הם בעלי נפיצות גדולה (Barker ב-Ann Rev Biochem משנת 1981, ו-Merrick ו-Edwards ב-Microbiol Rev משנת 1995), והם מקטלזים את הדה-אמינציה החמצונית של גלוטמאט לאלפא-קטו-חומצה גלוטרית ולאמוניה על פי המשוואה:
(Glutamate + NAD+ + H2O →αKG + NADH + H+ + NH4+).
מספר אנזימי GLDH מסוגלים לקטלז את הריאקציה ההפוכה המייצרת גלוטמאט על ידי דחיסה של אמוניה ו-α-קטו-חומצה גלוטרית. התפקיד הפיזיולוגי של GLDH לשמש כאנזים אנבולי או קטבולי נקבע על פי הספציפיות של הקו-פקטור שלו, NAD או NADH, ו-NADP או NADPH. באשר לחיידק Cd, הקו-פקטור הספציפי של האנזים GLDH הוא NAD (על פי Anderson וחב' ב-Arch Biochem Biophys משנת 1993).
Enzyme immunoassays (להלן EIA) הספציפיים ל-GLDH לזיהוי Cd זמינים מסחרית. זיהוי החיידק מתבצע בתהליך דו-שלבי: בדיקת ELISA לזיהוי GLDH של Cd מתבצעת ראשונה, ודגימות חיוביות ל-GLDH, נמדדות על ידי ELISA לרמת יצירת טוקסינים (Carroll ב-Anaerobe משנת 2011, ו-Shetty וחב' ב-J Hosp Infect משנת 2011). היעילות של GLDH כסמן אבחוני תועדה היטב, אך החשיבות של אנזים זה לפתוגנזה של Cd הייתה פחות ברורה. נמצא קודם לכן, תוך שימוש בזן האם של החיידק (JIR8094) ושל המוטנט (GluD), שהזן המוטנט רגיש יותר ל-H2O2 מאשר זן האם (Girinathan וחב' ב-Microbiology משנת 2014). תוך שימוש במודל של אוגרים הראתה קבוצת החוקרים האחרונה לראשונה את התלות של Cd במעי בגלוטמאט, ואת אי היכולת של הזן המוטנט GluD לצמוח במעי או לגרום לתחלואה כיוון שאינו יכול לצרוך גלוטמאט למטרות אלה.
החל משנת 2000 יש עלייה בולטת בהדבקות עם Cd שנגרמו בקהילה (Gupta ו-Khanna ב-Infect & Drug Resistance משנת 2014). הסיבות לעלייה זו בהדבקות עם חיידק מעי זה אינן ברורות, ויש השערה שהיא תוצאה של שימוש גובר ב-monosodium glutamate בשימור מזון (Rangan ו-Barceloux ב-Disease-a-Month משנת 2009).
התבצעה מטה-אנליזה לקבוע את דיוק האבחון של כימות GLDH כמדד להדבקה ב-Cd, תוך התבססות על מודל היררכיאלי. כבדיקות reference התבצעו CCNA או stool cell cytotoxicity neutralization assay ו-TC או stool toxigenic cuture. דרך נוספת להעריך את דיוק הכמות של GLDH בהערכת הדבקה ב-Cd ניתן לחשב את ה-diagnostic odds ratio (להלן DOR) תוך שימוש במודל DerSimonian-Laird אקראי, וחישוב של השטח מתחת ל-receiver operating characteristics (או AUC) על בסיס Hollings' proportional hazard models. לאחר ניתוח של 42 דיווחים עם סך של 3,055 השוואות reference חיוביות ושל 26,188 השוואות reference שליליות, נקבע DOR של 115 ו-AUC נקבע כ-0.970. ההערכה של רגישות וספציפיות הבדיקה של GLDH כמדד להדבקה ב-Cd, מעלה נתונים של 0.911 ו-0.912, בהתאמה, דהיינו ערכים גבוהים מאוד.
הזנים היחידים שהיו מוכרים בעבר של Cd שאינם אלימים באוגרים הם הזנים עם מוטציה כפולה ביצירת טוקסינים A ו-B (על פי Kuehne וחב' ב-J Infect Dis משנת 2014, ו-Carter וחב' משנת 2015). הזן JIR8094 משמש באופן סדיר ליצירת מוטנטים בגנים שונים, כולל אלה הקשורים לפונקציות מטבוליות המשמשים באוגרים ללימוד הפתוגניות של Cd (על פי Fimlaid וחב' ב-PLos Pathogens משנת 2015, Wu ו-Hurdle ב-Can J Microbiol משנת 2014, Ho וחב' ב-Infect Immun משנת 2014, ו-Lyras וחב' ב-Natuire משנת 2009). אלא שזן זה הוא חסר תנועתיות ונמצא מייצר רק כמויות מתונות של טוקסינים בהשוואה לזן 630∆erm (על פי McKee וחב' ב-J Bacteriol משנת 2013).
אבחון של הדבקה ב-Cd
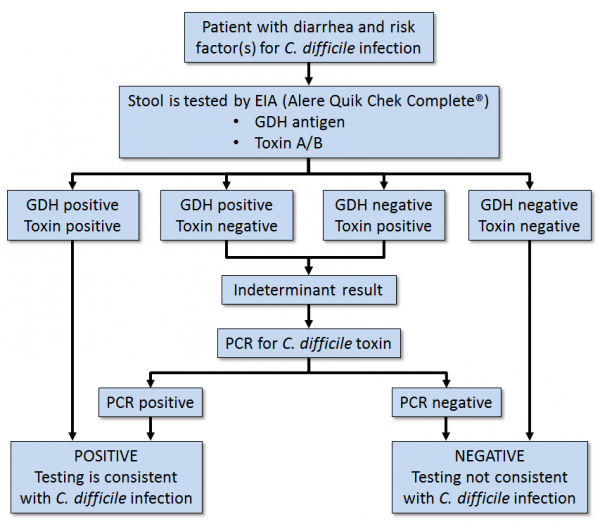
מטופלים עם 3 או יותר צואות דלילות ובלתי מוסברות במהלך 24 שעות, נחשדים להדבקה עם Cd (על פי Truong וחב' ב-J Clin Microbiol משנת 2017). החיידק יכול להיות מאובחן על ידי זיהוי של טוקסין A ו/או טוקסין B בדגימת צואה. בדיקת טוקסין בצואה צריכה להתבצע כחלק של אלגוריתם רב-שלבי, עם GLDH פלוס טוקסין, בבדיקת NAAT (או nucleic acid amplification test) בנוסף לבדיקת טוקסין. גם EIA עשוי לשמש לזיהוי טוקסין A או B. היתרון של בדיקת EIA הוא בזמן הביצוע הקצר. בדיקת GLDH מגלה נוכחות Cd בצואה, אך אינה מסוגלת לזהות יצירת טוקסין. גם בדיקת ELISA לנוכחות טוקסינים A או B היא בעלת זמן ביצוע קצר, והיא בעלת ספציפיות גבוהה (McDonald ו-Diekema ב-J Clin Microbiol משנת 2018). ניתן לבצע בדיקות ELISA ל-GLDH בעזרת הערכה CDiff Check - 60 של חברת .TechLab Inc.
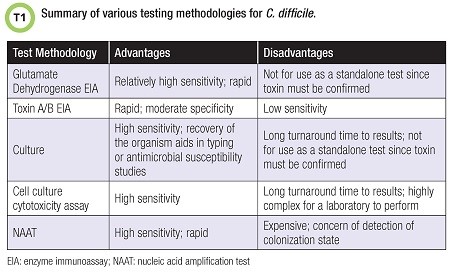
שיטות אבחון מעבדתיות אחדות קיימות כאשר מטרת הבדיקה היא זיהוי החיידק עצמו או זיהוי הטוקסין שלו. בטבלה למטה מפורטות שיטות לזיהוי Cd:
טוקסין A המקודד על ידי הגן tcdA הוא אנטרו-טוקסין הגורם לשלשולים. טוקסין B המקודד על ידי tcdB גורם לעיוות תאים in vitro, וכנראה משפיע על תאי המעי in vivo. שני הגנים הללו ממוקמים ליד PaLoc. זן החיידק הידוע כ-NAP1/BI/027, התגלה בתחילת שנות ה-2000, והוא מייצר טוקסין נוסף, הידוע כטוקסין בינארי שתפקידו לא ברור. ניתן לבצע גם בדיקת cell culture cytotoxicity, לזיהוי ישיר של הטוקסין בצואה, אם כי פרק הזמן עד לקבלת תשובה יכול להימשך 24–48 שעות. בדיקת NAAT מזהה את הגנים המקודדים לטוקסינים, אך לא מזהה את הטוקסינים עצמם.
הרגישות להדבקה עם Cd לאחר טיפול אנטיביוטי בעכברים נכרכה עם הגברה הריכוז של חומצת המרה העיקרית TCA, המסייעת להנבטה של הנבגים של Cd, כמו גם ההגברה בריכוז חומצות אמינו, סוכרים פשוטים ו אלכוהולים סוכריים, המהווים כולם מצעי גידול של תאי Cd וגטטיביים (Theriot וחב' ב-Nature Commun משנת 2014). בדיווח אחר, חקירת המבנה והתפקוד של מיקרוביוטה לאחר השתלת צואה במטופל עם הדבקות נשנות של Cd, נמצאה ירידה בפעילות של מערכות טרנספורט של חומצות אמינו (Seekatz וחב' ב-Am Soc Microbiol משנת 2014). במחקר נוסף, מדידה של חומצות אמינו חופשיות בחומר שנאסף מה-cecum של אוגרים שהודבקו עם Cd, נמצא שהחיידק העדיף צריכה של גלוטמאט וגלוטמין. ממצאים אלה תומכים בדעה שהמטבוליזם של חומצות אמינו היא תכונת מפתח של Cd בתהליך הקולוניזציה in vivo. גלוטמאט הייתה חומצת האמינו הפחות נצרכת על ידי Cd בניסוי in vitro, כאשר החיידק גדל המדיום המכיל חומצות casamino, שהיא תערובת של חומצות אמינו ופפטידים מאוד קטנים המתקבלים לאחר פירוק הידרוליטי של casein (על פי Neumann-Schaal וחב' ב-BMC Microbiol משנת 2015). ההבדל בצריכה של חומצות אמינו כאשר החיידק גדל בתנאי in vitro או in vivo, קשור במורכבות הגדולה יותר של הדרישות המטבוליות של צמיחת Cd בתנאי in vivo.
בחיידק Cd, האנזים GLDH נמצא הן בציטופלזמה ובנוזל החוץ תאי, שהרי החיידק מפריש את האנזים הזה, מה שמסייע להתרבותו המהירה in vivo במודל של אוגרים. גלוטמאט הוא הקודמן (precursor) של גלוטתיון שהוא נוגד חמצון פּוטנטי בתאי אפיתל של המעי (Pompella וחב' ב-Biochem Pharmacol משנת 2003). על ידי טיהור של המעי מגלוטמאט חיצוני, החיידק Cd עשוי להפחית יצירת גלוטתיון על ידי תאי הפונדקאי וזו גם תופחת או על ידי חיידקים אחרים, מה שעלול לסייע ל-Cd להשרות נזק נוסף לתאי המעי. קולטנים של גלוטמאט זוהו גם בלימפוציטים תוך פגיעה ביכולת תאים אלה לגרום למודולציה של תגובות חיסוניות (Xue ו-Field ב-Front Bioscience משנת 2011).
ה-GLDH החוץ-תאי משפר את הקולוניזציה של Cd ואת התקדמות המחלה. אנזים זה זקוק ל-NAD כמצע נוסף כדי לגרום למטבוליזם של גלוטמאט במעי. NAD נוכח בכל תאי הגוף, וכמה סוגי תאים ידועים כמפרישים של +NAD ו/או מגיבים ל+NAD במתחם החוץ-תאי (Romanello וחב' ב-Biochim Biophys Res Commun משנת 2001, ו-Stringari וחב' ב-Sci Rep משנת 2012). NAD מתאי אפיתל במעי יכול להיות מופרש לנהור (lumen) המעי במהלך תהליך אפופטוזיס. NAD היא מולקולה לא יציבה, ולעיתים קרובות קשה למדוד את זמינותה בדגימות ביולוגיות, כגון בתכולת ה-cecum של אוגרים. בדומה לגלוטמאט ידוע ש-+NAD יכול לפעול כמולקולת איתות למספר תפקודים תאיים. במעי, NAD חוץ-תאי משמר את תפקוד תאי האפיתל כמחסום למעבר מולקולות שונות אל תוך המעי והחוצה ממנו (Han וחב' ב-J Pharmacol Exp Therap משנת 2003). לכן, על ידי שימוש ב-NAD החוץ-תאי, ה-GLDH החוץ-תאי של Cd יכול לעודד את הנזק הנגרם על ידי טוקסין B של החיידק למעי של הפונדקאי.
אפליקציות קליניות
ניתן למדוד GLDH במעבדה הקלינית להערכת תפקוד הכבד, שכן רמות מוגברות של האנזים בנסיוב מצביעות על נזק בכבד, ויכולות לסייע באבחנה מבדלת של מחלות כבד, בעיקר במשולב עם אמינו-טרנספראזות. כיוון ש- GLDH ממוקם במיטוכונדריה, הוא אינו משתחרר לדם במפגעים דלקתיים של הכבד, כגון במחלות הפטיטיס נגיפיות. לעומת זאת, מחלות כבד בהם מתרחש נמק של הפטוציטים, כגון במחלת כבד אלכוהולית שהוא טוקסי לכבד, או במחלת כבד היפוקסית רמות GLDH בנסיוב גבוהות. בניסויים קליניים, GLDH יכול לשמש כמדד לבטיחותיות של תרופה ניסיונית.
הטיפול והבקרה במקרי הדבקה ב-Cd
בשנת 2011 אישר ה-FDA את השימוש במקרוליד האנטי-מיקרוביאלי fidaxomicin לטיפול בהדבקות Cd, מה שהופך תכשיר זה לשני לאחר vancomycin למטרה זו. ההנחיות העדכניות של ה-IDSA/SHEA לטיפול בהדבקה עם Cd ממליצות על שימוש ב-vancomycin או ב-fidaxomicin במקום הטיפול ב-metronidazole באפיזודה ראשונה של הדבקה זו. אם לעומת זאת, האפיזודה הראשונה לא הייתה חמורה, metronizazole יכול להילקח בחשבון אם הזמינות של vancomycin ו-fidaxomicin מוגבלת. בשנת 2017, אישר ה-FDA לשימוש את hezlotoxumab, נוגדן חד-שבטי אנושי הנקשר לטוקסין B ומנטרל אותו, זאת כדי למנוע הישנות של ההדבקה ב-Cd במבוגרים המטופלים באנטיביוטיקה. עירוי ורידי בודד של התכשיר האחרון היה כרוך בשיעור נמוך משמעותית של הישנות ההדבקה בניסויים קליניים.
שיטות מעבדה לזיהוי GLDH
בעבר, זיהוי GLDH בצואה בשיטת צימות של חלקיקי latex הייתה שיטה מקובלת (Lyerly וחב' ב- J clin microbiol משנת 1991), בעוד שבמועד כתיבת המאמר, מובלת שיטת הכימות ב-immunoassay שהיא שיטה רגישה יותר. בשישה מדגמים בוצעה הערכה של בדיקת Culturette Latex agglutination שכללה 2,151 השוואות. ה-AUC שהתקבל היה 0.852 שעשוי להיחשב כמבטא דיוק אבחוני טוב. אך ערך הרגישות של שיטה זו היה 0.610, שהוא נמוך מזה שהתקבל בשיטות Chek-60 ו-Quik-Chek. ה-PLR נקבע כ-8.6, המצביע על עלייה מתונה בהסתברות של הדבקה ב-Cd כאשר תוצאת בדיקת ה-latex חיובית. ה-NLR נקבע כ-0.420, המצביע על ירידה קטנה בהסתברות של הדבקה ב-Cd, כאשר תוצאת בדיקת ה-latex מתקבלת שלילית. יש הסכמה ש-Culturette Brand Rapid Latex Test היא בעלת משמעות אבחונית נמוכה, ולכן בדיקה זו כמעט אינה מבוצעת במעבדות קליניות.
שיטה זמינה של lateral flow אינה דורשת מיומנות מיוחדת של איש המעבדה (Grimes ו-Schulz ב-Lancet משנת 2005). בה בשעה שתוצאה שלילית בבדיקת GLDH היא בעלת תועלת אבחונית, תוצאה חיובית בבדיקה זו עלולה להוליך לאבחון מוטעה ב-25–30 אחוזים מהנבדקים. לכן אלגוריתם רב-שלבי המקובל נותן פתרון סביר.
בדיקות NAAT מספקות תוצאות מהירות ומדויקות בשלב הבדיקות השני. אם בדיקת NAAT אינה זמינה, גילוי טוקסין היא החלופה, אף על פי שבדיקה לזיהוי הטוקסין אינה רגישה מספיק. לכן יש הגורסים שבדיקת NAAT תתבצע רק בשלב השלישי, כאשר בדיקת GLDH מתקבלת חיובית, ואילו בדיקת טוקסין נמצאת שלילית (Larson וחב' ב-J Clin Microbiol משנת 2010). בדיקת Quik-Chek עברה הערכה ב-15 קבוצות נבדקים עם 6,205 השוואות. בדיקות אלה העלו DOR של 152 ו-AUC של 0.980, מה שמצביע על דרגת דיוק גבוהה. הרגישות של בדיקה זו נמצאה כ-0.925, והספציפיות נקבעה כ-0.918.
שיטות האמפליפיקציה של חומצת גרעין (NAATs) כגון PCR ו- loop-mediated isothermal amplification מספקות אבחון מהיר ומדויק אך עלותן גבוהה (Deshpande וחב' ב- Clin Infect Dis משנת 2011, Wei ב- Arch Med Sci משנת 2015, ו-O'Horo וחב' ב- Mayo Clin Proc משנת 2012). נראה ששיטת זיהוי וכימות GLDH היא שיטת הסריקה הסבירה ביותר שעלותה נמוכה, וביצועה מהיר (Shetty וחב' ב- J Hosp Infect משנת 2011). שיטות reference אחרות שנכנסות בהדרגה לשגרת המעבדה הן cell cytotoxicity neutralization assay (CCNA) ו- toxigenic culture המתבצעות בדגימת הצואה.
בדיקת Triage עברה הערכה של דיוקה האבחוני ב-5 מדגמים גדולים, שכללו 2,353 השוואות. אף על פי שבאופן כללי לערכה זו יש דיוק אבחוני מעולה, עם AUC של 0.975, הספציפות וה-PLR של שיטת Triage נמוכות מאלה של ערכות אחרות. בסך הכול נסקרו 7 שיטות בדיקה מורכבות יותר ונמצא ש-Chek-60 ו-Quik-Chek הן 2 הערכות הנמצאות בשימוש הנרחב ביותר במעבדות בגין הביצועים המצוינים שלהן (Planch וחב' ב-Lancet Infect Dis משנת 2013, Jensen וחב' ב-Eur J Clin Microbiol Infect Dis משנת 2015, Killgore וחב' ב- J Clin Microbiol משנת 2008, ו-Eastwood וחב' אותו כתב עת משנת 2009). השיטות שנסקרו הן CD: restriction endonuclease analysis, pulsed-field gel electrophoresis, PCR-ribotyping, multilocus sequence typing, multilocus ,variable-number tandem-repeat analysis amplified fragment length polymorphism ו-surface layer protein A gene sequence typing. כאמור, השיטות האחרונות אינן מבוצעות ברוב המעבדות, בגלל הצורך במכשור יקר, ומיומנות גבוהה בפירוש התוצאות.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - מחלות בקטריאליות/ זיהום בקטריאלי-אלח-דם
- בדיקות מעבדה - מחלות מעי
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק