הומוציסטאין - Homocysteine
הופניתם מהדף הומוציסטאין לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| הומוציסטאין | |
|---|---|
| Homocysteine | |
| מעבדה | כימיה בדם |
| תחום | קביעת מדד המשמש להערכת חסר ויטמינים מקבוצת B, ומהווה לכאורה גורם סיכון משני לתחלואה קרדיו-, וצרברו-וסקולארית |
| יחידות מדידה | מיקרומול' לליטר |
| טווח ערכים תקין | בתינוקות וילדים עד גיל 4 שנים - 3.6-7.3; גברים: גיל 12-19 שנה - 4.3-9.9; גיל 20-60 שנה - 5.2-13.1; מעל גיל 60 שנה - 5.9-15.3. נשים: גיל 12-19 שנה - 3.3-7.8; גיל 20-60 שנה - 3.9-8.9; מעל גיל 60 שנה - 6.6-14.6 |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הסיבה המיידית למדידת רמת הומוציסטאין היא לקבוע האם לנבדק יש חסר בוויטמינים B12 ו-folate (ויטמין B9). לעתים רמת הומוציסטאין מוגברת או לפני שמוצאים רמות נמוכות מהנורמאליות של ויטמין B12 ו-folate. מדידת הומוציסטאין תופסת מקום משמעותי יותר במטופלים עם בעיה מוכרת של ספיגה במעי, אנשים במצבי תת-תזונה, קשישים, אלכוהוליסטים, כמו גם צמחונים וטבעונים.
מדידת רמת הומוציסטאין בדם ובשתן יכולה להידרש בתינוק עם חשד להומוציסטינוריה, במיוחד ביילודים בהם התגלתה במסגרת סקר-יילודים עם לידתם רמת מתיונין גבוהה בדם. מדידת הומוציסטאין נדרשת כחלק מבירור פרופיל גורמי-סיכון באלה עם סיכון גבוה להתקף לב או לשבץ מוחי. יש הגורסים ביצוע בדיקה זו באלה עם רקע משפחתי של מחלת לב כלילית ללא גורמי סיכון ידועים אחרים. ביצוע הבדיקה נדרש לעתים לאחר אירוע לבבי או מוחי כדי לסייע בהחלטה על טיפול המשך מיטבי.
בסיס פיזיולוגי
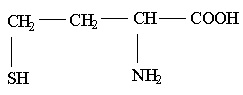
הומוציסטאין היא חומצת אמינו שאינה מהווה מרכיב בחלבוני הגוף. הומוציסטאין דומה במבנה שלה לחומצת האמינו ציסטאין, ונבדלת מהאחרונה בהכילה קבוצת מתילן (- CH2 -) נוספת לפני קבוצת התיול (SH-).
ביוסינתזה של הומוציסטאין
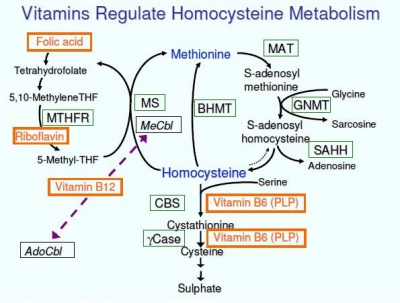
הומוציסטאין אינו מגיע ממקורות של מזון, שכן הוא אינו מרכיב את חלבוני הגוף. הוא מסונתז בגוף ממתיונין, בתהליך רב שלבי. בשלב הראשון, מתיונין מקבל קבוצת אדנוזין מ-ATP, ריאקציה היוצאת לפועל בעזרת האנזים S-adenosyl-methionine synthase, ליצירה של S-adenosyl methionone או SAM. התוצר SAM מעביר שייר מתיל למולקולה הקולטת אותו (שיכולה להיות נור-אפינפרין בעת הסינתזה של אפינפרין, או האנזים DNA methyltransferase כתוצר ביניים בעת המתילציה של DNA). דה-מתילצליה של מתיונין מביאה בסוף התהליך ליצירה של הומוציסטאין, שיכול להיכנס לאחד משני המסלולים הבאים: א. רה-מתילציה בעזרת THF או tetrahydrofolate בחזרה ליצירת מתיונין; ב. טרנס-סולפורציה ליצירה של ציסטאין.
כל הריאקציות האנזימטיות המשיקות באופן ישירה למטבוליזם של הומוציסטאין זקוקות לויטמינים מקבוצת B המשמשים כקו-פקטורים של ריאקציות אלה: במסלול ה-trans-sulfuration, הומוציסטאין הופך ביונקים לציסטאין בשני שלבים אנזימטיים: האנזים cystathionine β-synthase או CBS, מקטלז את הדחיסה של הומוציסטאין ו-serine ליצירת cystathionine. ריאקציה זו נזקקת לויטמין B6 (pyridoxine) משופעל בצורת pyridoxal-5-phosphate כקו-פקטור. בשלב השני, האנזים cystathionine β-lyase, הופך את ציסטאטיונין לציסטאין, אמוניה וחומצה α-קטו גלוטארית. גם הריאקציה של האנזים lyase דורשת ויטמין B6 כקו-פקטור.
המסלול האחר של re-methylation בו יכול הומוציסטאין להפוך בחזרה למתיונין, האנזים המוסיף שייר methyl להומוציסטאין לקבלת מתיונין הוא methionone synthase הזקוק לוויטמין B12 (cobalamin) כקו-פקטור. שייר מתיל זה מתקבל במסלול שתחילתן ב-THF או tetrahydrofolate בו האנזים הפעיל הוא MTHFR או methylene tetrahydrofoalte reductase כאשר אנזים זה נעזר ב-folate או ויטמין B9.
הרמות התקינות של ההומציסטאין מצביעות על עליה מתונה עם הגיל. בילדים הרמות התקינות הן 4-6 מיקרומולר, בעוד שבמתבגרים ובמבוגרים צעירים בני 20-40 שנה הן בתחום של 6-8 מיקרומולר, כאשר מכאן ואילך רמות הומוציסטאין עולות בשיעור של 1 מיקרומולר לעשור. בנשים רמות הומוציסטאין נמוכות יותר ב-10-12% ביחס לגברים בגיל זהה עד לגיל המעבר, כאשר רמות הומוציסטאין משתוות לאלה שמוצאים בגברים באותו גיל.
הומוציסטינוריה
הגילוי של פתולוגיה קרדיו-וסקולארית הנגרמת מרמות מוגזמות של הומוציסטאין בדם, מיוחס לרופא הילדים האמריקני Kilmer McCully, שפרסם את תצפיתו בשנת 1969 ב-Amer J Pathol. במאמר זה תוארו 2 מקרים של ילד וילדה בני 10 ו-12 שנה שנפטרו לאחר אירוע מוחי ואירוע לבבי, שהתבררו בניתוח שלאחר המוות כפועל יוצא של תהליכי פקקת או טרשת עורקים כליליים מתקדמת, מאוד בלתי אופייניים לילדים בגילים אלה. בדיעבד התברר שבילדים אלה נמצאו רמות הומוציסטאין בדם מעל 240 מיקרומול' לליטר, רמות העולות פי-50 על רמות חומצת אמינו זו בגילים האמורים.
McCully טבע את המושג הומוציסטינוריה במה שנראה היום מיסנומר כי במקור נמדדו רמות הומוציסטאין המוגברות בשתן, אך למעשה רמות הומוציסטאין המאוד מוגברות בשתן משקפות את הרמה המוגברת של חומצת אמינו זו בדם. הפגם שתואר על ידי McCully הוא מפגע גנטי המועבר בהורשה אוטוזומאלית רצסיבית, הנובעת מחסר באנזים ציסטאטיונין-בטא-סינטאזה או CBS, מה שמונע יצירת ציסטאין מהומוציסטאין, והצטברות רבה של האחרון בדם.
מפגע זה מוביל לפגיעות רב-מערכתיות, ברקמת החיבור, בשרירים, במערכת העצבים המרכזית, ובמערכת הקרדיו-וסקולארית. המפגע נדיר ביותר ומתרחש באחת מ-180,000-200,000 לידות חי, כאשר תינוקות עם מפגע זה נראים נורמאליים בלידתם. בהמשך עלולים להופיע מכלול של תסמינים כגון סומק בולט בלחיים בחודשי החיים הראשונים או פרכוסים, ובגיל מעט מתקדם יותר בילדות ניתן למצוא את התסמינים הבאים: מפגעי שריר-שלד כגון מבנה גבוה וצר, עם כיפוף אופייני של עמוד השדרה הדומה לתמסמונת מרפנואידית, נטייה לאוסטיאופורוזיס, גפיים ארוכות, רגליים מקושתות (pes cavus); פיגור שכלי או תסמינים פסיכאטריים; פגיעה עינית כגון הסטת העדשה הקריסטלינית (subluxation of lens), קריעת סיבי הזונולות (ectopia lentis), קוצר ראיה, גלאוקומה, ואטרופיה של עצב הראיה; מחלה וסקולארית ביצירת רובד טרשתי בגיל צעיר במיוחד המשפיעה בעיקר על עורקים לא כליליים, נטייה מוגברת לפקקת תוך-וסקולארית. תוחלת החיים של מקרי הומוציסטינוריה פוחתת בחוסר טיפול באופן משמעותי, כאשר התמותה מתחוללת בדרך כלל לפני גיל 30 שנה. רוב הפטירות מקורן בסיבוכים וסקולאריים הנובעים מקרישת-יתר.
הטיפול המקובל הוא על ידי מתן לכל החיים של פירידוקסין במינונים גבוהים, אם כי רק כ-45% מהלוקים בהומוציסטינוריה מגיבים לטיפול זה (B6 responsive). אלה שאינם מגיבים לטיפול בוויטמין זה, נזקקים לדיאטה דלת-מתיונין, וחלק גדול מהם יטופלו גם ב-betaine או trimethylglycine המשמש ספק יעיל של שיירי מתיל המסייעים לאנזים MTHFR, ובהמשך להפוך יותר הומוציסטאין למתיונין. הטיפול בבטאין בא במקביל לדיאטה דלת מתיונין, כאשר המטרה היא בשמירה על רמת הומוציסטיאן בפלזמה הנמוכה מ-30 מיקרומול' לליטר. יש המטפלים גם על ידי מתן חומצה פולית.
היפר-הומוציסטאינמיה
בניגוד למצב הנדיר של הומוציסטינוריה בו יש חסר של האנזים CBS, המצב הרווח יותר מבחינת כלל האוכלוסייה הוא מצב של יתר מתון של הומוציסטאין או hyperhomocysteinemia, בו רמות חומצת אמינו זו הן בטווח שבין 15 ל-100 מיקרומול' לליטר. באוכלוסייה לבנה בארצות מפותחות מקובלת היפר-הומוציסטאינמיה ב-4-5% מהנבדקים. הפגם הגנטי העיקרי הגורם לתרחיש של יתר- הומוציסטאין, נגרם על ידי המוטציה באלל C677T, בה יש שחלוף של חומצת האמינו alanine על ידי valine, בעמדה 677 של רצף חומצות האמינו של האנזים MTHFR. הקשר בין מוטציה זו לבין תחלואות שנות התגלה בשנת 1972, אם כי הגן המקודד לאנזים זה מופה לראשונה רק בשנת 1994 לכרומוזום 1. יש מובהקות אתנית ברחבי העולם לגבי שכיחות המוטציה C677T, שנעה בין 2% ל-42%, ובממוצע באוכלוסיות לבנות שכיחות המוטציה הזו מוערכת בין 12-15%, מה שהופך אותה למוטציה השכיחה ביותר בקרב בעלי חיים עילאיים. כ-40% באוכלוסייה הם הטרוזיגוטיים מבחינת הנשאות של מוטציה זו, אם כי מבחינת התופעות הקליניות, ההתבטאות שלהן מתרחשת באופן מובהק הרבה יותר בהומוזיגוטים לאלל הפגום.
מקובל שהמוטציה הנקודתית המתוארת פגיעתה מתונה יחסית מבחינת הפעילות האנזימטית, באופן שהאנזים "הפגום" מאבד בערך רק מחצית מפעילותו התקינה, מה שאין בו בדרך כלל לגרום לפתולוגיה של ממש. כאשר רמת חומצה פולית בדם תקינה למעשה לא יורגש הפגם האנזימטי ב-MTHFR כלל ועיקר, שכן חומצה פולית המהווה קו-פקטור של MTHFR תסייע לו להשיג רמת תפעול פיזיולוגית תקינה גם בנוכחות המוטציה האמורה. יחד עם זאת, באותם מקרים בהם גם רמת חומצה פולית ירודה, חסך בפעילות MTHFR וברמת הקו-פקטור שלו, עלולים להוריד את פעילות האנזים לרמה הפחותה מ-20% מפעילותו הנורמאלית, באופן שעלול לבוא לביטוי בעיכוב בהתפתחות פיזית ושכלית, להפרעות פסיכיאטריות שונות כגון סכיזופרניה, ולעתים גם להפרעות מוטוריות והתקפים דמויי אפילפסיה. פגמים מולדים העלולים להתרחש בפגיעה משמעותית בפעילות MTHFR קשורים לתעלה העצבית, כגון שדרה שסועה (spina bifida), שפה או חך שסועים (facial clefts), ואף לתופעות של אנאנצפאלי. אך המשמעות הרבה ביתר באוכלוסייה הכללית, היא תופעת קרישיות-יתר (thrombophilia) הנכרכת לתופעות קרדיו-וסקולאריות, ולהפלות טבעיות בשיעור גבוה בנשים הרות.
המשמעות הוסקולארית של יתר-הומוציסטאין (hyper-homocysteinemia)
למעלה מ-20 שנה לאחר התצפית המקורית של McCully שהביאה לגילוי היישות של הומוציסטינוריה והשפעתה הדרמטית על מערכות גוף שונות, החל בשנת 1991 להתברר שגם הגברה מתונה ברמות הומוציסטאין בדם, עלולה להיות כרוכה בתחלואות שונות, בעיקר התחום הוסקולארי. היה זה המאמר שלClarke וקב' במאמר מכונן ב-New England Journal of Medicine, שתיאר קשר אפידמיולוגי בין רמות מוגברות של הומוציסטאין מעל 15 מיקרומול' לליטר ותחלואה קרדיו-וסקולוארית.
בין השנים 1990 ו-2005 התפרסמו כ-6,000 מחקרים קליניים מתוך סך של כ-6,600 מחקרים שהופיעו בדפוס באותן שנים בנושאים הקשורים להומוציסטאין, מהם השתמע שיש קשר נסיבתי לפחות בין רמות מוגברות של הומוציסטאין לבין תחלואות שונות. ברמות גבוהות שמעל 30 מיקרומול' לליטר, הומוציסטאין הוא בעל תכונות רעילות ופוגע בתפקוד של תאי האנדותל. תאים אלה מפרישים חד תחמוצת החנקן (NO) המסייע בהרחבת כלי-דם, וידוע שהומוציסטאין מסוגל ליצור קשר nitroso או S-N=O , המסוגל לקשור ולנטרל את מולקולת NO, ובכך לסייע לתהליכי היצרות כלי-דם. כמו כן דווח שהומוציסטאין ברמה גבוהה מנטרל את הפרשת הגליקופרוטאין האנדותליאלי Thrombomodulin, שתפקידו לשפעל את החלבון נוגד הקרישה protein C. בכך עלול הומוציסטאין לסייע לקרישיות יתר. בנוסף, עודף בהומוציסטאין מגביר את תהליך החמצון של כולסטרול-LDL ושל שומנים אחרים, ובכך מגביר את האתרוגניות שלהם.
יש ראיות ביוכימיות משמעותיות לכך שהומוציסטאין לא רק פוגע ישירות, אלא אף מונע יצירתם של מרכיבים מבניים של דופן העורק: קולאגן, elastin, fibrillin ופרוטאוגליקנים. הומוציסטאין מפרק באופן קבוע קשרים די-סולפידיים של ציסטאין, וכן מגיב עם חומצת האמינו ליזין, באופן המשבש את תפקודן של שתי חומצות אמינו אלו.
שני מחקרים גדולים שפורסמו ב-2006 (NORVIT או The Norwegian Vitamin Trial, ו-The Heart Outcome Preventiob Evaluation (HOPE) 2 , מצאו כי למרות שמתן תוספי שלושת הויטמינים מקבוצת B הפחית משמעותית את הרמות הנמדדות בדם של הומוציסטאין, הסיכון להתקף לב חוזר לא פחת, מה שמעיד על כך שהפחתת רמות ההומוציסטאין אינה מתקנת ביעילות נזקים מבניים קיימים בעורקים. עם זאת, במחקר HOPE-2 נמצאה הפחתה יחסית של 24% בסיכון לשבץ מוחי אף בקרב חולים שכבר סבלו מפגיעה בעורקים מוחיים או בעורקים התרדמניים. מטה-אנליזה שהתפרסמה ב-Lancet ב-2007, הדגימה גם כן שנטילת חומצה פולית מפחיתה משמעותית את הסיכון לשבץ מוחי בעקבות הפחתת רמות הומוציסטאין. על פי סקירה זו של 8 ניסויים קליניים באיכות גבוהה, תוספת של חומצה פולית מפחיתה את הסיכון לשבץ ב-18%. עוד נמצא, כי היתרון בצריכת חומצה פולית גדל עם הזמן, ותוך שלוש שנים, שיעור ההפחתה בסיכון לשבץ הגיע ל-29%. המחקר אף הראה כי הפחתת הרמות של ההומוציסטאין בגוף ביותר מ-20% מובילה להפחתה של 23% בסיכון לשבץ.
הנתונים האפידמיולוגיים המוסכמים זה זמן הם שחסימת עורקים כליליים מתרחשת פי -2 ומעלה באלה עם רמות הומוציסטואין ברביעון העליון באוכלוסייה, בהשוואה לאלה עם רמות הומוציסטאין ברביעון התחתון. איגוד הלב האמריקני (AHA) מכיר בעדות הגורפת לקשר בין רמות הטמוציסטאין לנתוני ההישרדות התקפי לב או אירועים מוחיים, אך אינו מגדיר נכון להיום "ערך מוגבר של הומוציסטאין" כגורם סיכון עיקרי לתחלואה קרדיו-וסקולארית.
נעשו מספר ניסיונות להסביר את כישלונה של הפחתת רמת הומוציסטאין בהפחתת השכיחות של אירועים קרדיו-וסקולאריים. הסבר אחד הוא בכך שחומצה פולית עצמה עלולה לגרום באופן ישיר להעצמת התהליך הטרשתי, ללא קשר להשפעתו בהפחתת רמת הומוציסטאין. לחילופין, חומצה פולית וויטמין B12 יכולים לגרום לשינוי ברמות מתילציה בתאים וסקולאריים, באופן שעלול לדוגמה להגביר את המתילציה של חומצת האמינו ארגינין ליצירה של ADMA או asymmetric dimethylarginine, מולקולה שמייחסים לה הגברת הסיכון למפגעים וסקולאריים.
נימוק אחר לנסות להסביר את העובדה שהפחתת רמת הומוציסטאין אינה מבטיחה שיפור באירועי לב הוא שמירב הניסויים הקליניים בכיוון זה התבצעו במתווה של מניעת אירועים וסקולאריים חוזרים, באוכלוסיות מטופלים שכבר חוו אירועים אלה בעבר. כך לדוגמה ניסוי NORVIT התקיים בקרב כ-5,000 נורווגים עם מחלת לב חמורה, ונראה שהוספת ויטמינים מקבוצת B במטופלים אלה, אין בה כדי "לתקן" את נזק מבני שכבר קיים בכלי הדם. ראוי יהיה להמתין לניסויים רב אוכלוסייתיים ארוכי טווח בנוסח של ניסוי Framingham, בו ינסו לעקוב מגיל צעיר אחר התפתחות מחלות באלה שרמת הומוציסטאין בדמם הייתה מוגברת בגיל צעיר וטופלה כל השנים על ידי הפחתת רמה מוגברת זו, לעומת אלה שרמת הומוציסטאין המוגברת אצלם לא טופלה כל השנים.
תרחישים קליניים המשפיעים על רמות הומוציסטאין בדם
א. רמות גבוהות במיוחד של הומוציסטאין (בדרך כלל מעל 175 מיקרומול' לליטר) מתקבלות בהומוציסטינוריה קלאסית (חסר פעילות של האנזים CBS), במצבים של חסר בפעילות האנזים methionine synthase שהוא מצב נדיר ביותר בו מוטציה בגן MTR על כרומוזום 1 המקודד לאנזים זה גורמת למפגע הידוע כ-methylcobalamin deficiency G או cblG, וכן שיבושים תוך-תאיים במטבוליזם של קובלמין הידועים כ-cblC (השכיח ביותר), cblD וכן cblD variant 1, ואחריו מבחינת השכיחות cblD variant 2, וכן cblF ,cblE ו-cblG.
ב. רמות מוגברות של הומוציסטאין (בדרך כלל לא מעל 100 מיקרומול' לליטר): הטרוזיגוטים לפגם באנזים CBS, הומוזיגוטים למוטציה C677T באנזים MTHFR, מצבי חסר בוויטמין B12, חסר בחומצה פולית, חסר בוויטמין B6, עישון סיגריות, צריכת קפאין מרובה, כשל כליות, היפו-תירואידיזם, מפגעים היפר-פרוליפרטיביים, סוכרת, מפגעים פסיכיאטריים, מצבי שיטיון בגיל המתקדם, סיבוכי הריון (pre-eclampsia, לידת תינוקות במשקל ירוד, הפלות חוזרות, הינתקות השליה) או לידת תינוקות עם פגמים של הצינור העצבי (NTDs). ניתן למצוא ערכים מוגברים של הומוציסטאין באלה עם מפגעי ספיגה כגון קרוהן, צליאק, כיבי קיבה ומעי, או לאחר ניתוחים בריאטריים, כריתה חלקית של הקיבה, תסמונת המעי הקצר ואחרים, כאשר מסתמנת תופעת חסר כללי ברמת ויטמינים. פעילות גופנית ממושכת בעצימות גבוהה מעלה באופן זמני רמת הומוציסטאין, כנראה בהגברת תהליך ההסבה של מתיונין להומוציסטאין.
ג. רמות נמוכות של הומוציסטאין: תסמונת Down, הריון תקין, היפר-תירואידיזם, שלבים מוקדמים של סוכרת.
השפעת תרופות על רמת הומוציסטאין
תרופות שונות יכולות להעלות באופן פיזיולוגי את רמת הומוציסטאין בפלזמה. בולטות תרופות המשמשות כאנגוניסטיות של פולאט הפוגעות במטבוליזם של חומצה זו, כמו methotrexate ,trimethoprim, חמצן דו חנקני nitrous oxide וכן metformin ,niacin ,theophyline ,L-dopa, אנדרוגנים, aminoglutethimide, ציקלוספורין, נגזרות של פיבראט, תכשירים מְשַתנים ו-phenytoin. המְשַתן hydrochlorothiazide יכול להעלות רמת הומוציסטאין ב-20% כתוצאה מהשפעתו על ה-GFR. חשיפה לחמצן דו-חנקני (גז הצחוק) יכולה להעלות משמעותית רמת הומוציסטאין על ידי חסימת הפעולה של ויטמין B12. שימוש ב-L-dopa יכול להעלות רמת הומוציסטאין בדם עד ל-30%, זאת כנראה בהגברת יצירת הומוציסטאין, הנובעת מחסר שיירי מתיל הנצרכים לצורך המתילציה של תרופה זו. גם תכשירים נוגדי –פרכוסים כגון carbamazepine משפיעים בהעלאת רמת הומוציסטאין. צריכה כרונית של כמויות משמעותיות של אלכוהול מעלה רמת הומוציסטאין, כנראה בגלל השפעה שניונית על ספיגת ויטמינים מהמזון.
תרופות אחרות יכולות להביא להורדת רמת הומוציסטאין בדם כגון D-penicillamine, אסטרוגנים, טמוקסיפן, betaine, N-acetylcysteine, mesna וכן simvastatin.
מבחן העמסת מתיונין
מבחן זה נועד לגלות אי-סדירויות במטבוליזם של הומוציסטאין, תוך מדידת רמת האחרון לאחר העמסת מתיונין. המבחן מתבצע לאחר צום של 12 שעות, תוך שתייה של מתיונין מומס במים או במיץ תפוזים במינון של 100 מיליגרם לק"ג משקל גוף. לפני העמסת מתיונין נוטלים דגימת דם כדי לקבוע בה את רמת הומוציסטיאן בבסיס הבדיקה, וכן שעתיים ו-6 שעות לאחר ההעמסה.
בבריאות מלאה, רמת הומוציסטאין הנמדדת בממוצע 4 שעות לאחר ההעמסה עולה בפלזמה עד פי-3 מרמת הבסיס של חומצת אמינו זו: לדוגמה, בנבדקים עם רמת הומוציסטאין בבסיס של 6-8 מיקרומול' לליטר, רמתו לאחר העמסת מתיונין היא בממוצע 18-20 מיקרול' לליטר. לעומת זאת במטופלים עם פגמים במטבוליזם של הומוציסטאין או כתוצאה מחסר משמעותי בוויטמינים מקבוצת B, או כתוצאה מהומוזיגוטיות לפגם באנזים MTHFR, ובפרט בפגם באנזים CBS, יכולה להתקבל רמת הומוציסטאין לאחר העמסת מתיונין בתחום הריכוזים של 32 -35 מיקרומול' לליטר. כיום, פחתה בהרבה ההמלצה לביצוע העמסת מתיונין לאחר דיווחים על תופעות לוואי לא צפויות של התעלפות, סחרחורת או בחילות קשות לאחר ההעמסה.
הוראות לביצוע הבדיקה
יש להיות בצום של 8-10 שעות לפני דיגום הדם, שכן ארוחה מקדימה בטווח של 6-8 שעות המכילה חלבונים גורמת לקבלת תוצאה מוגברת כזובה בשיעור של 10-15%, שכן חומצת האמינו מתיונין המהווה כ-5-7% בממוצע מהרכב החלבונים במזון משמשת כקודמן (precursor) של הומוציסטאין ויכולה לגרום להעלאת רמת האחרון בפלזמה בשעות שלאחר הארוחה. ניתן לדגום את הדם כנסיוב במבחנה כימית או מבחנת ג'ל (פקק אדום או צהוב), או כפלזמה במבחנה EDTA (פקק סגלגל), מבחנת הפארין (פקק ירוק) או מבחנת ציטראט (פקק תכול). מומלץ במידת האפשר ליטול דם במבחנת EDTA שכן נוגד קרישה זה משמר בצורה האופטימאלית את שלמותן של הכדוריות האדומות, באופן המונע זליגה של הומוציסטאין שרמתו בתוך כדוריות הדם האדומות גבוהה בהרבה מזו שבפלזמה. אכן, מקובל, שרמת הומוציסטואין המתקבלת בנסיוב גבוהה ב-5-10% בממוצע מרמתו בפלזמה, שכן בתהליך קרישת הדם יש פגיעה בשלמות הכדוריות האדומות וזליגת התוכן שלהם לפלזמה.
יש להקפיד על שמירת דגימות הדם בקור, ולסרכז אותן לא יאוחר מ-1-2 שעות מנטילת הדם, למניעת התחלת המוליזה של הכדוריות ותוצאה מוגברת כזובה של הומוציסטאין. לאחר הפרדת התאים ניתן לשמור את דגימת הפלזמה או הנסיוב עד 4 ימים בטמפרטורת החדר, מספר שבועות בקירור, או ללא הגבלה בהקפאה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק