הורמון פאראתירואיד - Parathyroid hormone
הופניתם מהדף הורמון הפארא-תירואיד לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| הורמון פאראתירואיד | |
|---|---|
| Parathyroid hormone | |
| שמות אחרים | PTH, parathormone, parathyrin |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | הערכה הורמונאלית של תפקוד בלוטות יותרת התריס ומשק סידן ופוספאט בגוף. |
| יחידות מדידה | פיקוגרם למ"ל (pg/ml) |
| טווח ערכים תקין | בדם טבורי: פחות מ-3.0; בגיל 2-18 שנה: 9.0-52.5; מעל גיל 18 שנה: 12.0-70.0 |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הבדיקה משמשת לזיהוי תרחיש של hyperparathyroidism או חשד לתוצאה חריגה של PTH, או למצוא סיבה לרמות סידן או זרחן לא תקינות. כאשר מטופל מראה תסמינים של היפרקלצמיה כגון עייפות, בחילות, כאבי בטן, צמא. הבדיקה יכולה להידרש כאשר המטופל מראה תסמינים של היפוקלצמיה כגון כאבי בטן, התכווצויות שרירים, עקצוץ באצבעות. הבדיקה עשויה להידרש לזיהוי בעיות במטופלים עם מחלת כליות כרונית. אבחון הפרעות בתפקוד בלוטת יותרת התריס. מדידת PTH רלוונטית במקרים של אוסטיאופורוזיס בלתי מוסברת, שאינה מגיבה לטיפול. מדידת PTH רלוונטית לניטור הטיפול של היפר-פאראתירואידיזם שניונית במצבים של כשל כליות כרוני.
בדיקת PTH ביחד עם מדידת סידן תידרש בהקשר להסרה ניתוחית של גידול בבלוטת יותרת בלוטת התריס, או הסרה ניתוחית של רקמת פאראתירואיד במקרי hyperparathyroidism. מצבים נוספים בהם תידרש מדידת PTH הם Multiple endocrine neoplasia (MEN) I ו-Multiple endocrine neoplasia (MEN) II.
בסיס פיזיולוגי
ארבעת בלוטות הפאראתירואיד שגודל כל אחת מהן כגודל אפון, ממוקמות באזור הגרון, מאחורי בלוטת התריס, והן אחראיות על ייצורו של הורמון הפאראתירואיד, שחשיבתו במשק הסידן והזרחן בגוף, ובהתאם בחילוף החומרים בעצמות. תפקידו העיקרי של הורמון זה הוא לסייע בספיגת סידן ובהפרשת זרחן.
PTH מופרש מתאי chief בבלוטות יותרת התריס והוא פוליפפטיד המכיל 84 חומצות אמינו. במקור מופרש פוליפפטיד המורכב מ-115 חומצות אמינו המוגדר כ-pre-pro-hormone, שעובר מייד הידרוליזה לאחר הסינתזה שלו ליצירת פפטיד בעל 90 חומצות אמינו המכונה “pro-PTH”, הנחשף להסרה הידרוליטית של עוד 6 חומצות אמינו מהקצה הקרבוקסילי שלו ליצירת ההורמון הבשל בן 84 חומצות אמינו שמשקלו המולקולארי הוא 9,400 דלטון. כל הפעילות הביולוגית של PTH ממוקמת ב-34 חומצות האמינו בקצה האמינו-טרמינלית של ההורמון, כאשר החלק המרכזי של PTH וכן הקצה הקרבוקסילי שלו (חומצות אמינו 35-84) משוללים פעילות ביולוגית אם כי הם מאוד פעילים מבחינת אימונולוגית.
בעוד ש-calcitonin המופרש מהתאים הפארא-פוליקולאריים של בלוטת התריס פועל להפחתת רמת סידן בדם, PTH פועל להגברת רמת סידן בדם על ידי שהוא נקשר לקולטן הידוע כ- PTH 1 receptor המרוכז בעיקר בעצמות ובכליות, ולקולטן הידוע כ-PTH 2 receptor המרוכז בעיקר במערכת העצבים המרכזית, בלבלב, באשכים ובשליה. תקופת מחצית החיים של PTH בדם היא קצרה-כ- 4 עד 5 דקות.
הפפטידים הקודמנים (precursors) של PTH נשארים בדרך כלל בתוך תאי יותרת בלוטת התריס, ואילו הפפטיד PTH כשלעצמו המופרש לדם עובר ביקוע הידרוליטי ומטבוליזם ליצירה של המקטעים הבאים:
- carboxyi-terminal fragment או PTH-C, שהוא מקטע חסר פעילות עם תקופת מחצית חיים של 24-36 שעות, מהווה יחד עם מקטעי אמצע המולקולה, יותר מ-90% מסך ה-PTH בדם, ומתפנה מהגוף דרך הכליות. במטופלים עם כשל כלייתי, המקטע PTH-C יכול להגיע לריכוזים גבוהים. באלה עם כשל כלייתי גם ההורמון השלם (PTH 1-84) מוגבר ברמתו בדם, כאשר עליה מתונה ברמתו נחשבת כתגובה מפצה חיובית לתנגודת ל-PTH הנצפית בחולים עם כשל כלייתי.
- amino-terminal fragment או PTH-N, שהוא המקטע הפעיל ביולוגית והוא בעל תקופת מחצית חיים של 4-5 דקות.
- mid-molecule fragment או PTH-M עם מקטעים 53-84, וכן מקטעים 44-68 ו-35-64. אורך מחצית חייהם בדם קצרה (1-2 דקות) בהיותם מתפנים ביעילות על ידי הכליות.
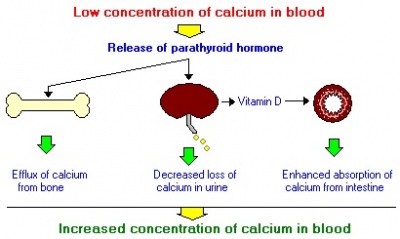
הורמון יותרת התריס מופרש מאחת מארבע בלוטות יותרת התריס הקיימות בגוף תפקידו של ההורמון לשמור על רמת סידן תקינה בדם. כאשר רמת הסידן בדם יורדת, PTH מופרש מבלוטות יותרת התריס וגורם לעליית רמת הסידן בדם בשלוש דרכים עיקריות: שחרור סידן מהעצמות למחזור הדם; הגברת ההפיכה של ויטמין D לצורתו הפעילה באמצעות הכליה (ויטמין D מגביר את ספיגת הסידן במעי); הפחתת איבוד הסידן בכליה. כאשר רמת הסידן בדם עולה, רמת PTH יורדת וכך נשמר האיזון במערכת. מחלה של בלוטת יותרת התריס עלולה לגרום לייצור מוגבר של PTH. מצב זה מוגדר יתר פעילות ראשונית של בלוטת יותרת התריס. במרבית המקרים המצב הוא תוצאה של גידול שפיר המפריש את ההורמון.
עודף PTH גורם לעלייה ברמת הסידן בדם, מצב שיכול לגרום להיווצרות אבנים בכליה ולשקיעת סידן ברקמות. היות ש-PTH גורם לשחרור סידן מן העצמות, ייצור מוגבר שלו יפגע בצפיפות העצם ויגרום לנטייה מוגברת לשברים. במצב זה גם רמת ה-PTH וגם רמת הסידן בדם תהיינה גבוהות. תת-פעילות של בלוטות יותרת התריס תביא לייצור מופחת של PTH ולרמה נמוכה של סידן בדם.
היפומגנזמיה כרונית משבשת את הפרשת PTH ופוגעת גם בפעילות ה-PTH על רקמות המטרה. יוני מגנזיום חיוניים לשחרור PTH מתאי chief בפאראתירואיד, פעילות המתווכת על ידי adenylate cyclase. לכן, חסר במגנזיום יכול לגרום להיפוקלציה שניונית. יחד עם זאת גם היפרמגנזמיה מדכאת את הפרשת PTH.
ההשפעות הפיזיולוגיות של PTH
PTH מעודד לפחות שלושה תהליכים:
- גיוס סידן מרקמת העצם: למרות שהמנגנון של פעילות זו עדיין בלתי מפוענח, ברורה השפעת PTH לעודד תאים אוסטיאוקלסטים לספוג מינרלים מהעצם, ולשחרר סידן לדם
- עידוד ספיגת סידן במעי הדק: עידוד ספיגת סידן מהמעי הדק נועד להעלות את רמות סידן בדם. PTH מסייע לתהליך זה אך משיג זאת באופן בלתי ישיר על ידי עידוד היצירה של המולקולה הפעילה של ויטמין D בכליות. ויטמין זה משרה את הסינתזה של חלבון-קושר-סידן בתאי האפיתל של המעי, המאפשר ספיגה יעילה של סידן לדם
- דיכוי של איבוד סידן בשתן: בנוסף לעידוד זרימת סידן לדם מהעצם ומהמעי, PTH בולם את הפרשת סידן בשתן, ובכך גם כן משמר את רמתו בדם. השפעה זו מושגת על ידי עידוד הספיגה מחדש של סידן באבוביות הכליה. השפעה נוספת של PTH על הכליות היא עידוד הפרשת יוני פוספאט בשתן. PTH היה ההורמון הראשון שנמצא מגיב עם חלבון G, ומביא להשפעה תאית על ידי מערכת ה-messenger השניונית של adenylyl cyclase.
וויסות ההפרשה של PTH
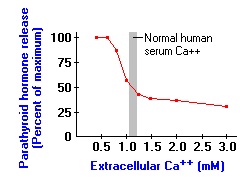
הפרשת PTH מבוקרת בעיקר על ידי רמת סידן בפלזמה על ידי משוב שלילי. על פני תאי הפאראתירואיד קיימים "חיישני סידן" המשופעלים כאשר רמת הסידן החופשי נמוכה. כאשר רמת סידן נופלת מתחת לסף הנורמה התחתון, יש עליה ניכרת בהפרשת PTH, אם כי גם כאשר רמת סידן בדם גבוהה, יש הפרשה נמוכה של הורמון זה. שינוים ברמת פוספאט בדם כרוכים אף הם בשינויים בהפרשת PTH, אך שינויים אלה אינם נובעים מהשפעה ישירה שכן פוספאט כשלעצמו אינו מווסת הפרשת PTH. באדם, הפחתה של ריכוז סידן בפלזמה ב-1.5 מיליגרם לד"ל, יכולה להעלות את רמת PTH ב-400%.
תרחישים המפחיתים רמת PTH
רמת סידן מוגברת; ירידה משמעותית ברמת מגנזיום בפלזמה המביאה להופעה תסמינים של hypoparathyroidism, כגון היפוקלצמיה. כמו כן תוגבר הפרשת PTH בהיפרתירואידיזם; היפו-פאראתירואידיזם אוטואימוני; נזק לבלוטות הפארא-תירואיד כתוצאה מהקרנות, סרקואידוזיס (אפילו בנוכחות של כשל כלייתי); histiocytosis X, בהיפרקלצמיה שלא על רקע פאראתירואידי ללא כשל כלייתי; לאחר הרחקה ניתוחית של בלוטת התריס הגורמת להיפו-פאראתירואידיזם (תרחיש שהוא כנראה חולף אם PTH ניתן לגילוי בשיטת RIA); היפוקלצמיה חולפת של הילוד; תסמונת DiGeorge. רמת PTH נמוכה אופיינית גם למצבי הרעלת ויטמין D, במצבים של מחלה גרורתית לעצמות, ובמחלת Grave’s. בלימפומה וב-multiple myeloma מוצאים לעתים קרובות רמות PTH נמוכות.
- תרחישים המגבירים רמת PTH
רמת סידן נמוכה, ירידה מתונה ברמת מגנזיום בפלזמה, ורמה מוגברת של פוספאט: יוני פוספאט נוטים ליצור עם סידן קומפלקס קלציום-פוספאט, כאשר אותם קולטנים הרגישים לסידן (CaSr) אינם מצליחים "לחוש" בקומפלקס זה, מה שמגביר סינתזת PTH.
כמו כן תוגבר הפרשת PTH בתרחישים כגון היפר-פאראתירואידיזם ראשוני (לעתים כתוצאה מגידול שפיר של התירואיד); היפר-פאראתירואידיזם משני כתוצאה ממחלת כליות כרונית (בה רמת PTH יכולה להיות גבוהה פי-10 מהנורמה); pseudohypoparathyroidism; חסר מולד של ויטמין D (סוגים 1 ו- II); חסר נרכש של ויטמין D; תסמונת Zollinger-Ellison; פלואורוזיס; טראומה לעמוד השדרה; pseudogout; קרצינומה מֶדולרית משפחתית של התירואיד; ו-multiple endocrine neoplasia או NEM סוגים I, IIa ו-IIb.
- PTH-related peptide או PTHRP
PTH הוא הווסת האנדוקריני העיקרי לגבי ריכוזי סידן וזרחן בנוזל החוץ-תאי בדם. הורמון נוסף, PTHRP, או PTH-related protein הוא פפטיד בעל 110 חומצות אמינו הנקשר לאותו קולטן של PTH, ויש לו משמעות בתהליכי התפתחות. קיימת הומולוגיה מוחלטת ברצף של 8 חומצות האמינו הראשונים בקצה האמינו טרמינלי של PTHRP ו-PTH. בעוד שסינתזת PTH מוגבלת לבלוטות הפאראתירואיד באנשים נורמאליים, ניתן למצוא את ה-mRNA של PTHRP ברקמות שונות כמו בעור, בתירואיד, במח העצם, בהיפותלמוס, ביותרת המוח, בקורטקס האדרנל, ובקיבה. אחד המקומות בעיקריים בגוף ליצירת PTHRP היא רקמת השד בתקופות הנקה, ואמנם PTHRP נמצא בכמויות גדולות בחלב אם.
עירוי של PTHRP גורם לעלייה ברמת 1,25dihydroxyVitD, ולהגברת תהליכי בניית עצם. PTHRP עשוי לשחק תפקיד בתופעת ההיפרקלצמיה של ממאירויות שונות, וייתכן ש-PTHRP ו-PTH פועלים על אותם קולטנים בעצם להגביר ספיגת עצם או בניית עצם. סבורים ש-PTHRP המיוצר בבלוטות הפאראתירואיד של העובר, יכול להיות אחראי בתהליכי הטרנספורט של סידן בשליה.
פענוח התוצאות
א. כאשר רמות סידן ו-PTH בדם בתחום הנורמה, מערכת הבקרה של סידן פועלת כשורה.
ב. אם רמות סידן בדם נמוכות ורמת PTH מוגברת, נראה שבלוטות הפארא-תירואיד מגיבות כפי שהיה צפוי מהן ומפרישות כמות מוגברת של ההורמון.
ג. כאשר רמות סידן נמוכות ורמת PTH נורמאלית או נמוכה, נראה ש-PTH אינו מגיב כראוי מה שאופייני ל-hypoparathyroidism, (זאת כאשר רמת מגנזיום בדם תקינה) תרחיש שיכול להיות קבוע, מתקדם או חולף. סיבות לתרחיש זה כוללות מפגע אוטואימוני, נזק לבלוטות הפארא-תירואיד או הרחקתן במהלך ניתוח, מצב גנטי או מחלה חריפה. בתרחיש זה, לעומת רמות נמוכות של סידן ו-PTH רמת זרחן בדם גבוהה. רמה נמוכה של מגנזיום יכולה לעכב הפרשה ופעילות של PTH ובכך יכולה לחקות מצב של hypoparathyroidism.
ד. כאשר רמות סידן ו-PTH גבוהות, נראה שבלוטות הפארא-תירואיד מייצרות כמויות בלתי ראויות של ההורמון, ואת הסיבה ודרגת החומרה של מצב זה של hyperparathyroidism ניתן לבדוק בשיטות דימות.
- ניתן לחלק היפר-פאראתירואידיזם לשלושה מצבים
תרחיש ראשוני שמקורו בעיקר מגידול שפיר (אדנומה בדרך כלל) בבלוטות הפארא-תירואיד, המפריש PTH בלי שהוא כפוף לבקרת משוב של רמות סידן בדם. היפר-פאראתירואידם מתגלה בדרך כלל בשנות הבגרות באופן בולט יותר בנשים בגיל חידלון הווסת. ב-90% מהמקרים של היפר-פאראתירואידיזם ראשוני רמות PTH גבוהות, ובשאר המקרים רמות PTH נורמאליות (מה שאינו ראוי בעודף סידן). ברוב המטופלים בתרחיש זה רמות הזרחן נמוכות.
בתרחיש זה עלולה להיווצר היפרקלצמיה עד כדי יצירת אבני כליות, שקיעת סידן באיברים שונים, ודה-קלציפיקציה של עצמות. בתרחיש זה, לצד רמות גבוהות של סידן ו-PTH, רמות זרחן בדרך כלל נמוכות. כאשר רמת PTH מוגברת ורמת סידן תקינה, אין הדבר מעיד בהכרח על היפר-פאראתירואידיזם ראשוני, כיון שהעלייה ברמת PTH יכולה להיות תגובה לסיבה שניונית כמו חסר ויטמין D.
דה-מינרליזציה של העצם בהיפר-פאראתירואידיזם ראשוני יכולה להיגרם כתוצאה מפעילות ממיסת עצם של PTH, ותרחיש זה מתאפיין באזורי עצם נרחבים עם תהליכי ספיגה ניכרים. האבחון של היפר-פאראתירואידיזם ראשוני מתבסס על רמות גבוהות של סידן ו-PTH בנסיוב, לעומת רמת זרחן נמוכה. אך לא בכל המטופלים עם היפר-פאראתירואיד נמצא רמת סידן או רמות PTH מוגברות.
חלק מהמטופלים עם היפרקלצמיה מתונה, בהם רמת PTH גבוהה באופן מתון או נורמאלית (באופן בלתי ראוי), עלולים לסבול מ-familial hypocalciuric hypercalcemia, הנגרמת ממוטציות המדכאות את הקולטנים בפאראתירואיד החשים בשינויים ברמת סידן (CaSR).
היפר-פאראתירואידיזם שניוני מופיע בדרך כלל בעקבות מחלת או כשל כליות, כאשר זרחן אינו מופרש מהגוף ביעילות, מה שגורם לשיבוש המאזן בינו לבין סידן בדם. מחלת כליות עלולה גם למנוע את יצירת המרכיב הפעיל של ויטמין D, מה שיפחית את ספיגת סידן מהמזון. כאשר רמות זרחן עולות ואילו רמות סידן פוחתות, מוגברת הפרשת PTH. רמות גבוהות של זרחן יכולות להופיע או בתרחיש של עירוי נוזליים המכילים פוספאט, שתיית חלב בו תכולת זרחן גבוהה (כגון חלב פרה הניתן ליילודים ), או אצירת זרחן בדם בגלל כשל של הכליות.
היפר-פאראתירואידיזם שניוני עלול גם להיגרם על ידי כל אחד מהגורמים המביאים לרמת סידן נמוכה, כגון ספיגה לקויה שלו בגין מחלת מעי אן חסר ויטמין D מסיבות דיאטתיות או אי-חשיפה לשמש. תרחיש של היפר-פאראתירואידיזם שניוני יכול להופיע בדיאטה עתירת חלבון העשירה בזרחן, והוא עלול גם כן לגרום לדה-קלציפיקציה של עצמות ולשברים מרובים בעקבות מה שקרוי "עצמות גומי".
ה. בהיפר-פאראתירואידיזם שניוני, למטופל יש בדרך כלל רמות PTH גבוהות ורמות סידן נמוכות או נורמאליות. אם פעילות הכליות תקינה יכול תרחיש של היפר-פאראתירואידיזם ראשוני להופיע כתוצאה מהופעת תנגודת לפעילות PTH מה שידוע כ-pseudohypoparathyroidism, או במקרים מאוד נדירים של הפרשת PTH פגום שאינו פעיל ביולוגית.
לעתים, אלה עם מחלת כליות מתקדמת עם היפר-פאראתירואידיזם שניוני כרוני מפתחים רמת סידן גבוהה, ועדיין מוצאים אצלם רמת PTH גבוהה: ההתייחסות לתרחיש זה היא כאל היפרפאראתירואידיזם שלישוני. לעיתים נדירות עשוי גידול ממאיר להפריש הורמון דמוי PTH ולגרום לרמת PTH גבוהה יחד עם רמת סידן גבוהה.
ו. כאשר רמות סידן גבוהות ורמות PTH נמוכות (במקביל לרמות זרחן נמוכות), הדבר צפוי מבחינת פעילות הבלוטות ותידרש בדיקה לגילוי הסיבות לרמת סידן גבוהה שאינן קשורות לבלוטת הפארא-תירואיד.
ז. כאשר רמת PTH נמוכה, רמת סידן גבוהה ורמת זרחן נמוכה, שזהו לכאורה תרחיש צפוי, יש גם אפשרות של paraneoplastic hypercalcemia, הנגרמת על ידי הפרשת החלבון PTHRP או parathyroid related peptide, על ידי סוגי סרטן ממאירים אחדים (בעיקר לימפומה, סרטן תאי קשקש, וסרטן השד). החלבון PTHRP יכול להיקשר לקולטני PTH ולשפעל אותם. הרמה הנורמאלית של PTHRP בפלזמה נמוכה מ-1.5 פיקומול' לליטר. מדידת רמת PTHRP שימושית להבדיל בין היפר-פאראתירואידיזם ראשוני לבין היפרקלצמיה הנובעת ממאירות.
ח. במטופלים עם רמת סידן בתחום העליון של הנורמה, עם רמת PTH מוגברת, יכול להיות תרחיש של היפר-פאראתירואידיזם ראשוני הממוסך על ידי חסר בוויטמין D. במקרים אלה יש אפשרות של normocalcaemic hyperparathyroidism.
- פעילות PTH לוויסות רמות סידן בפלזמה
- ההורמון PTH מווסת רמת סידן בדם על ידי השפעתו על מספר רקמות
עצם- PTH יכול להביא לשחרור של סידן מהמאגר הגדול שלו ברקמת העצם. ספיגת העצם הוא תהליך מטבולי נורמאלי המתבצע על ידי אוסטיאוקלסטים, שפעולתם מושרית באופן עקיף על ידי PTH. גירוי האוסטיאוקלסטים הוא בלתי עקיף כיוון שתאים אלה אינם מכילים קולטנים ל-PTH; לכן PTH נקשר דווקא לאוסטיאובלסטים שהם התאים בוני העצם, ומעודד בהם הם הגדלת הביטוי של הליגנד המשפעל אוסטיאוקלסטים הידוע כ-RANKL, ומנגד מעכב בתאים אלה את ביטוי של OPG או אוסטאופרוטגרין. כאשר OPG נקשר ל-RANKL הוא חוסם את האחרון מלהגיב עם RANK שהוא הקולטן של RANKL. ההתקשרות שלRANKL לקולטן שלו, מעודדת את האיחוי של תאים פרקורסורים של אוסטיאוקלסטים, ליצירת אוסטיאוקלסטים חדשים המעודד ספיגת עצם.
כליה- PTH מעודד ספיגה מחדש נמרצת של סידן ומגנזיום באבוביות הדיסטליות, ובקטע העולה העבה של לולאת Henle. כאשר רקמת העצם עוברת פירוק משתחררים לדם סידן ופוספאט, ו-PTH מפחית את הספיגה מחדש של פוספאט, באופן שבסך הכול יש ירידה ברמת פוספאט בדם.
מעי-PTH מגביר את ספיגת סידן מהמזון במעי על ידי הגדלת הייצור הנגזרת הפעילה של ויטמין D. השפעול של ויטמין D מתרחש בכליות: PTH משדרג את האנזים 25hydroxyvitamin D3 1-alpha-hydroxylase, האחראי להידרוקסילציה של 25hydroxy vitamin D, ההופך ויטמין D לצורתו הפעילה 1,25dihydroxy vitamin D. אנזים זה ידוע גם כ- CYP27B1 כאשר PTH מגביר את שפעולו של האחרון, ולעומת זאת מדכא את פעילות אנזימי CTYP24 המפרקים את ויטמין D הפעיל. צורת ויטמין פעילה זו מגבירה את ספיגת סידן במעי הדק בסיוע החלבון calbindin.
- PTH מווסת רמת פוספאט בפלזמה
PTH מפחית את הספיגה מחדש של יוני פוספאט מהאבוביות הפרוקסימליות בכליה, מה שמביא להפרשה מוגברת של פוספאט בשתן. יחד עם זאת, PTH מגביר ספיגת פוספאט מהמעי ומהעצמות לדם. העצמות בתהליך ספיגה משמשות מקור פחות עשיר של פוספאט מאשר של סידן. במעי ויטמין D גם מעודד ספיגת פוספאט בדומה לזו של סידן, אם כי ספיגת פוספאט אינה תלויה בוויטמין D באותה מידה כמו ספיגת סידן. התוצאה הכוללת של הפרשת PTH היא בירידה קלה ברמת פוספאט בפלזמה.
הקןלטנים החשים בנוכחות סידן (CaSR), מגיבים לסידן חוץ-תאי וניתן למצוא אותם על פנ מגוון של תאים במוח, בעור, בקיבה, וברקמות נוספות. בבלוטות הפאראתירואיד, החישה של ריכוזי סידן חוץ-תאיים גבוהים גרמו לשפעול של מפל (cascade) אירועים דרך פעולתו של האנזים פוספוליפאזה C. פעולת אנזים זה גרמה להידרוליזה של PIP2 או phosphatidylinositol 4,5-bisphosphate, ולשחרור של השליחים (messengers) התוך תאיים IP3 ו-DAG או diacylglycerol. לבסוף, שני השליחים האחרונים גורמים לשחרור סידן ממאגריו התוך-תאיים ולשטף חוץ-תאי של סידן אל החללים הציטופלמטיים בתוך תאי פאראתירואיד, מה שגורם לעיכוב שחרור PTH מתוך הגרנולות בהם הם אגורים בתוך תאים אלה. בתוך בלוטות הפאראתירואיד, מגנזיום הוא בעל תפקיד משמעותי, כאשר חסר מגנזיום בדם יכול להביא לעצירת הפרשת PTH, ולתרחיש דמוי היפו-פאראתירואידיזם הפיך, אך ראוי לציין גם היפרמגנזמיה מסתיים בעיכוב הפרשת PTH.
- הומאוסטזיס של PTH ביילוד
באופן תיאורטי, כיוון ש-PTH אינו מסוגל לעבור את השליה בעוד שסידן חודר את השליה בקלות. ההיפרקלצמיה היחסית בעוברים אמורה הייתה לדכא את פעילות ה-PTH בבלוטות הפאראתירואיד, אך באופן פרדוקסאלי הפרשת PTH בעובר אינה עוברת דיכוי. הסבר אפשרי לאי הדיכוי של הפרשת PTH בעובר למרות ההיפרקצמיה היחסית, הוא בכך שמערכת המשוב השלילי המווסת הפרשת PTH על ידי רמת סידן, היא בעלת סף גבוה יותר בעובר, באופן שדיכוי הפרשת PTH דורש בעובר רמות סידן גבוהות יותר, מאלה הנדרשות לדכא הפרשה זו לאחר הלידה. יחד עם זאת נראה שדיכוי הפרשת PTH בעובר הוא עדיין בתוקפו תקופה קצרה לאחר הלידה וזו כנראה גם הסיבה להיפוקלצמיה ב-3 הימים הראשונים לאחר הלידה, במיוחד בפגים.
- Primary idiopathic hypoparathyroidism
תרחיש של היפו-פאראתירואידיזם אידיופתי מתייחס למצב בו יש ירידה ביצירת PTH מסיבה לא ידועה. בפסבדו-היפו-פאראתירואידיזם יצירת PTH נשמרת, אך יש עמידות של איברי המטרה לפעולת ההורמון, כלומר למרות נוכחות PTH הוא אינו מבטא את פעילותו הפיזיולוגית המתבקשת. בטרמינולוגיה עדכנית מדובר בקולטן ל-PTH שאינו מגיב. להבדיל בין idiopathic hypoparathyroidism לבין pseudohypoparathyroidism, ניתן לבצע עירוי של PTH: לאחר העירוי מודדים רמות סידן, בנסיוב ורמת זרחן בשתן, וכן רמת cAMP בדם. במטופל עם pseudohypoparathyroidism ניתן למצוא דרגות שונות של "חסימה" בתגובה לעירוי של PTH. אלה עם היפו-פאראתירואידיזם מטופלים עם תחליפי מלחי סידן וכן עם ויטמין D.
- מפגעים גנטיים של בלוטות פאראתירואיד
מפגעים אלה אינם שכיחים ונמנה אחדים מהם:
- Multiple endocrine neoplasia (סוגים 1 ו-2a);
- פסבדו-היפופאראתירואידיזם סוג 1 בו יש תנגודת או עמידות לפעילות PTH;
- פסבדו-היפופאראתירואידיזם סוג 1b בו יש עמידות או תנגודת לפעילות PTH בכליות;
- Pseudopseudohypoparathyroidism או PPHP, גם בו יש תנגודת כלייתית לפעילות PTH;
- Albright hereditary osteodystrophy או AHO;
- תסמונת McCune-Albright, בה יש הפרשת עודף של PTH;
- Neonatal hyperparathyroidism;
- Blomstrand chondrodysplasia;
- Jansen metaphyseal chondrodysplasia;
- היפוקלצמיה משפחתית, מפגע אוטוזומאלי שולטני עם חסר PTH, היפוקלצמיה, והיפר-פוספאטמיה.
שני מפגעים אוטוזומאליים, familial hypocalciuric hypercalcemia או FHH, ו-neonatal severe primary hyperparathyroidism או NSHPT, נובעים מחסר בתפקוד של CASR או parathyroid calcium-sensing receptor. תסמונת FHH מתאפיינת על ידי עלויות מתונות ברמת סידן בדם, הפרשה נמוכה של סידן בשתן, ורמה נורמאלית באופן בלתי ראוי של PTH. לעומת זאת, NSHPT מייצג את הסממנים החמורים ביותר של FHH. ברוב המטופלים עם המוטציה ב-CASR, שני עותקי הגן פגומים, מה שמתבטא ביילוד בהיפר-פאראתירואידיזם חריף, גורם לעליות גדולות ברמת סידן ו-PTH בימי החיים הראשונים, כאשר התינוק מפגין היפוטוניה, מתקשה באכילה, ובהמשך תופעות של FTT, מצוקה נשימתית ודפורמציות של הצלעות. התרחיש זה רמת PTH גבוהה מאוד, ורמות סידן מוגברות באופן המסכן חיים.
תרופות המעלות רמת PTH בדם: תכשירים נוגדי פרכוסים, קורטיקוסטרואידים, furosemide, ליתיום, isoniazide, תכשירים המכילים פוספאטים, rifampin, מְשַתנים ממשפחת התיאזידים. תרופות המפחיתות רמת PTH בדם: cimetidine (שם מותג Tagemet), פרופרנולול, pindolol.
הוראות לביצוע הבדיקה
יש להיות בצום של 8-10 שעות לפני הבדיקה. נטילת הדם מועדפת סמוך להשכמה שכן רמות PTH נוטות להשתנות במהלך פעילות גופנית, וכן ידוע על שינויים במהלך היממה (diurnal) כאשר שיא הפרשת PTH לדם חלה בין השעות 2-4 לפנות בוקר. יש לבצע מדידות רמת סידן וזרחן בדם במקביל למדידת PTH. את הדם יש לקחת במחנה כימית (פקק אדום או צהוב) או במבחנת ספירת דם (EDTA, פקק סגלגל).
יש ליטול את הדם במבחנות מקוררות, ויש להקפיד על אחסון המבחנה בקרח עד לסרכוז בצנטריפוגה מקוררת. לאחר הפרדת הנסיוב או הפלזמה יש להקפיא מייד אם הבדיקה לא מתבצעת בזמן אמת. בדיקת רפואה גרעינית עם הזרקה של רדיו-איזוטופים שבוע קודם לביצוע הבדיקה יכולה להשפיע על התוצאות. יש המלצה לחזור על בדיקה זו בשלושה ימים שונים כדי לקבל מיצוע מדויק יותר של רמת ההורמון. שתיית חלב או אכילת מוצרי חלב בסמוך לבדיקה הם עילה לפסילתה. ערכי PTH בפלזמה נמוכים ב-5-10% בהשוואה לערכים שלו בנסיוב. כיוון ש-PTH הוא הורמון בהחלט לא יציב ונוטה לפירוק סמוך לנטילת הדם לכן הנטייה כיום להעדיף נטילת דם במבחנות EDTA תוך הקפדה על קירור בכל שלב של טיפול בדגימת הדם. בנשים הרות או מניקות, או באלה עם רמת טריגליצרידים גבוהה במיוחד, רמת PTH עלולה להיות בלתי אמינה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק