הבדלים בין גרסאות בדף "הטיפול הכימי וההורמונלי בסרטן השד - Chemotherapy and hormonal therapy for breast cancer"
יונתן שוורץ (שיחה | תרומות) |
|||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
[[קובץ:כותרתשד.jpg|מרכז]] | [[קובץ:כותרתשד.jpg|מרכז]] | ||
{{ספר| | {{ספר| | ||
| שורה 13: | שורה 11: | ||
}} | }} | ||
{{הרחבה|סרטן השד}} | {{הרחבה|סרטן השד}} | ||
| − | כיום הטיפול בסרטן השד הוא רב צדדי, וכולל טיפול מקומי (כירורגיה | + | כיום הטיפול בסרטן השד הוא רב צדדי, וכולל טיפול מקומי (כירורגיה ו[[הקרנות בסרטן השד|רדיותרפיה]]) וטיפול סיסטמי (כימותרפיה והורמונותרפיה). העובדה ששיעור החזרות המקומיות במחלה מדרגה 1 הוא 25% ל-10 שנים, ואילו במחלה מדרגה 2 כ-75% ל-10 שנים, מעידה על כך שהמחלה, בזמן אבחנתה, מפושטת מעבר לאזור השד, בחלק לא קטן של החולות. הממצא בולט יותר בחולות שבהן נמצאו בלוטות נגועות. כאשר 3-1 בלוטות נגועות, שיעור חזרת המחלה הוא 65%, ואילו כאשר 4 בלוטות ויותר נגועות שיעור חזרת המחלה עולה ל-88%. בעבר ייחסו ממצאים אלה לטכניקה כירורגית לקויה, הגורמת לפיזור השאת, או להשארת רקמה שאתית באזור המנותח. כיום ברור שכישלון הטיפול הכירורגי מקורו בכך, שבעת קביעת האבחנה והטיפול המקומי הראשוני קיים כבר פיזור גרורתי, כך שאין ביכולתו של הטיפול המקומי, ככל שיהיה רדיקאלי, לטפל בבעיה סיסטמית. |
באופן תיאורטי, סרטן מתחיל במוטציה של תא אחד. התא מתחלק בצורה בלתי מבוקרת עד שהוא מגיע לידי ביטוי קליני. תא שאת צריך לעבור לפחות 30 חלוקות כדי שיגיע לגודל של 1 ס"מ, שהינו שאת הניתנת לזיהוי קליני. לאחר 10 חלוקות נוספות השאת מגיעה למסה קריטית של 1012 תאים, שזהו מצב שבו החולה מוכרע על-ידי המחלה. מכאן ברור, שבזמן גילוי השאת היא כבר עברה חלק ניכר מתהליך גדילתה. היא זקוקה לאספקת דם סדירה ולניקוז לימפתי, כך שפוטנציאל ההתפשטות של השאת גדול. התאים שפוזרו מהשאת מתיישבים ברקמות אחרות ומתחילים להתחלק. הם זקוקים לכ-30 חלוקות על מנת לבוא לידי ביטוי קליני. משך הכפלת המסה נע בין 40 ל-380 יום, ולכן הביטוי הקליני יכול להופיע בין שנתיים ל-20 שנה לאחר הפיזור הגרורתי. כאשר מגלים סרטן ראשוני, קיימת הסתברות גבוהה להימצאות פיזור גרורתי מיקרוסקופי תת קליני בגודל שבין תא אחד ל-109 תאים, אשר אליהם ניתן להגיע רק בטיפול כימי סיסטמי. | באופן תיאורטי, סרטן מתחיל במוטציה של תא אחד. התא מתחלק בצורה בלתי מבוקרת עד שהוא מגיע לידי ביטוי קליני. תא שאת צריך לעבור לפחות 30 חלוקות כדי שיגיע לגודל של 1 ס"מ, שהינו שאת הניתנת לזיהוי קליני. לאחר 10 חלוקות נוספות השאת מגיעה למסה קריטית של 1012 תאים, שזהו מצב שבו החולה מוכרע על-ידי המחלה. מכאן ברור, שבזמן גילוי השאת היא כבר עברה חלק ניכר מתהליך גדילתה. היא זקוקה לאספקת דם סדירה ולניקוז לימפתי, כך שפוטנציאל ההתפשטות של השאת גדול. התאים שפוזרו מהשאת מתיישבים ברקמות אחרות ומתחילים להתחלק. הם זקוקים לכ-30 חלוקות על מנת לבוא לידי ביטוי קליני. משך הכפלת המסה נע בין 40 ל-380 יום, ולכן הביטוי הקליני יכול להופיע בין שנתיים ל-20 שנה לאחר הפיזור הגרורתי. כאשר מגלים סרטן ראשוני, קיימת הסתברות גבוהה להימצאות פיזור גרורתי מיקרוסקופי תת קליני בגודל שבין תא אחד ל-109 תאים, אשר אליהם ניתן להגיע רק בטיפול כימי סיסטמי. | ||
גרסה מ־20:47, 20 בינואר 2013
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של השד | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
כיום הטיפול בסרטן השד הוא רב צדדי, וכולל טיפול מקומי (כירורגיה ורדיותרפיה) וטיפול סיסטמי (כימותרפיה והורמונותרפיה). העובדה ששיעור החזרות המקומיות במחלה מדרגה 1 הוא 25% ל-10 שנים, ואילו במחלה מדרגה 2 כ-75% ל-10 שנים, מעידה על כך שהמחלה, בזמן אבחנתה, מפושטת מעבר לאזור השד, בחלק לא קטן של החולות. הממצא בולט יותר בחולות שבהן נמצאו בלוטות נגועות. כאשר 3-1 בלוטות נגועות, שיעור חזרת המחלה הוא 65%, ואילו כאשר 4 בלוטות ויותר נגועות שיעור חזרת המחלה עולה ל-88%. בעבר ייחסו ממצאים אלה לטכניקה כירורגית לקויה, הגורמת לפיזור השאת, או להשארת רקמה שאתית באזור המנותח. כיום ברור שכישלון הטיפול הכירורגי מקורו בכך, שבעת קביעת האבחנה והטיפול המקומי הראשוני קיים כבר פיזור גרורתי, כך שאין ביכולתו של הטיפול המקומי, ככל שיהיה רדיקאלי, לטפל בבעיה סיסטמית.
באופן תיאורטי, סרטן מתחיל במוטציה של תא אחד. התא מתחלק בצורה בלתי מבוקרת עד שהוא מגיע לידי ביטוי קליני. תא שאת צריך לעבור לפחות 30 חלוקות כדי שיגיע לגודל של 1 ס"מ, שהינו שאת הניתנת לזיהוי קליני. לאחר 10 חלוקות נוספות השאת מגיעה למסה קריטית של 1012 תאים, שזהו מצב שבו החולה מוכרע על-ידי המחלה. מכאן ברור, שבזמן גילוי השאת היא כבר עברה חלק ניכר מתהליך גדילתה. היא זקוקה לאספקת דם סדירה ולניקוז לימפתי, כך שפוטנציאל ההתפשטות של השאת גדול. התאים שפוזרו מהשאת מתיישבים ברקמות אחרות ומתחילים להתחלק. הם זקוקים לכ-30 חלוקות על מנת לבוא לידי ביטוי קליני. משך הכפלת המסה נע בין 40 ל-380 יום, ולכן הביטוי הקליני יכול להופיע בין שנתיים ל-20 שנה לאחר הפיזור הגרורתי. כאשר מגלים סרטן ראשוני, קיימת הסתברות גבוהה להימצאות פיזור גרורתי מיקרוסקופי תת קליני בגודל שבין תא אחד ל-109 תאים, אשר אליהם ניתן להגיע רק בטיפול כימי סיסטמי.
יעילות הטיפול הכימי מותנית בעומס תאי השאת. ככל שהעומס גבוה יותר, הסיכוי לרפא את החולה נמוך יותר, ולכן יעילות הטיפול הכימי, בשלבים התת קליניים, היא גבוהה יותר. הוכח שככל שמסת הגידול קטנה יותר השפעת הטיפול רבה יותר. הסיבה לכך היא, שמהירות התחלקות התאים גדולה יותר ככל שהמסה קטנה יותר, כך שבזמן נתון, אחוז גדול יותר מהתאים מתחלקים במסה קטנה יותר. מכיוון שמרבית התרופות הכימותרפיות פוגעות בתאים מתחלקים, הרי השפעתם על מסה קטנה היא רבה יותר ולהיפך. ככל שהמסה קטנה יותר אספקת הדם לכל חלקיה טובה יותר, ולכן החומר הכימי מגיע אליה בריכוזים גבוהים יותר. התרופות משמידות את התאים לפי first order kinetics, כלומר כמות מסוימת של תרופה תפגע בשיעור מסוים קבוע של תאי שאת, ולא במספר קבוע. כל מנה נוספת תהרוס רק אותו שיעור מהתאים, כך שבאופן תיאורטי לא ניתן להגיע לאפס תאי גידול, אולם במצב של תאים בודדים כנראה הגוף מסוגל להגיב טוב יותר מבחינה אימונולוגית, ולכן פירוש הדבר ריפוי. כדי להקטין את עומס התאים, מתחת למסה הקריטית, יש צורך להוציא את מסת הגידול על-ידי כריתה כירורגית ולהמשיך את הטיפול על-ידי כימותרפיה. לכן, בכל חולה שבה עלולות להימצא גרורות מיקרוסקופיות, יש להתחיל טיפול כימי מוקדם ככל האפשר.
כימותרפיה מסייעת לטיפול בסרטן שד בשלבים מוקדמים (Adjuvant chemotherapy)
סרטן שד בשלבים I ו-II, הקרוי גם סרטן שד מוקדם, הוא סרטן שד שניתן לריפוי. ב-70% מהחולות סילוק השאת מהשד (מקומית-אזורית) בלבד היא הטיפול היחיד הנדרש להשגת ריפוי. 30% יפתחו גרורות וימותו מהמחלה. גורמים מנבאים הישנות כוללים: נגיעות בלוטות בית השחי, גודל בשאת הראשונית בשד, דרגת בשלות השאת, רמת הקולטנים להורמונים, נוכחות גורמי צמיחה, הפרופיל הגנטי של השאת והפלואידיות של השאת. למצב בלוטות הלימפה בבית השחי חשיבות מכרעת: ככל שמספר הבלוטות הנגועות בבית השחי גבוה, כך שיעור ההישנות גבוה יותר. כישלון מערכתי זה הוא תוצאה של פיזור תאי שאת בתקופה פרה-קלינית הנודדים מהשד בדרך הלימפה או כלי הדם ומתיישבים באיברים שונים בגוף. המקומות המועדפים הם: השלד, הריאות, הכבד והרקמות הרכות. מושבות אלה סמויות, לא ניתנות לאבחון ומוכרות כמיקרו-גרורות. טיפול כימי מסייע, המוכר גם כטיפול משלים או אדגיוונטי (adjuvant), מיועד לחסל מיקרו- גרורות ולמנוע את הפיכתן למאקרו-גרורות. מטה-אנליזה שכללה מעל 75,000 חולות, הראתה בין השאר, שמתן משלבים של תרופות כימותרפיות הניב תוצאות טובות יותר מאשר תרופות בודדות. יתרון נוסף למשלבים הוא, שאפשר בחלקם להקטין את מינון התרופות ולכן גם את טוקסיות שלהן. משלב כזה שעשה מהפכה ראשונה בטיפול בסרטן השד היה ה-CMF.
CMF (ציקלופוספאמיד + מטוטרקסט + פלורואורציל): ב- Milan National Cancer Institute Trial השוו שתי קבוצות של חולות לאחר כריתת שד, שלהן בלוטות נגועות; האחת קיבלה CMF והשנייה לא. המעקב נמשך 9 שנים. נמצא שחולות שקיבלו את הטיפול היו חופשיות מהמחלה לטווח ארוך יותר מאלה שלא קיבלו את הטיפול. גם כאן עיקר הנהנות היו נשים לפני גיל הבלות (66% / 43% - Placebo CMF/). בהשוואה בין ה-CMF לבין + L-PAM לא נמצא כל הבדל בין השניים.
מהפכה שנייה שחלה הייתה השילוב של האנטראציקלינים כמו: אדרימיצין, אפירוביצין ואחרים בטיפול בסרטן השד. מתן תרופות אלה, על אף הטוקסיות שלהן במיוחד הלבבית, הביא לשיפור משמעותי בהיוותרות בחיים ללא מחלה ובהישרדות של חולות סרטן שד בשלב 2 . לכן, תרופה זו הפכה להיות התרופה הכימי המחוייבת בכל משלב של טיפול כימי מסייע. המשלב המקובל היה AC (אדריאמיצין עם ציקלופוספמיד) ב-4 עד 6 מחזורים אחת לשלושה שבועות. המשלב עם אנטראציקלינים מקנה יתרון נוסף של 5%-4% בהישרדות, בהשוואה לטיפולי כימותרפיה אחרים. יעילות האנטראציקלינים ניכרת במיוחד בתת קבוצה של החולות עם Her2 חיובי ונוכחות של topoisomerase2a.
המהפכה השלישית היא הופעת תרופות מקבוצה חדשה הטקסנים (Taxan). מקור התרופה היה בקליפת עץ, אולם כיום היא מיוצרת באופן סינטטי. דרך פעולת הטקסול שונה מזו של תרופות כימותרפיות אחרות. מכאן, חשיבותה של התרופה במקום שבו החולה לא הגיבה לתרופות האחרות. כאשר תאים נורמלים מתחילים להתחלק, נוצרות צורות הנקראות מיקרוטובולים (microtubules). אותם מיקרוטובולים נשברים או נהרסים כאשר התאים הנורמלים חדלים להתחלק. במקרה של תאי סרטן, הטקסול מפסיק את הריסתם של המיקרוטובולים. תאי הסרטן נחסמים על ידי המיקרוטובולים, ולכן אין ביכולתם להתרבות ולגדול. מחקרים הראו ששילוב AC X4, שלאחריו נתנו טקסנים ב-12 מנות שבועיות, שיפר את אחוזי התגובה הקליניים (25% במעקב חציוני של 30 חודשים ), אבל במיוחד את אחוזי החולים שבהם דווח על היעלמות מלאה פתולוגית של תאי השאת בטיפול טרום ניתוחי (34% לעומת 16%). עבודות מחקר חדשות הראו שמישלב של טקסנים עם ציקלופוסאמיד (TC) נתן תוצאות דומות ל-AC בתוספת טקסנים עם רעילות נמוכה יותר וסבילות גבוהה יותר אפילו בנשים מאוד מבוגרות. ממצאים אלה מעלים את השאלה בצורך באנטראציקלינים בטיפול המשלים בסרטן השד.
המהפכה האחרונה היא פיתוח תרופות הנקראות תרופות ביולוגיות. קבוצה אחת, הקרויה בשם הגנרי טראסטוזומב, מיוצגת אצלנו בשם המסחרי הרצפטין. הרצפטין משתייך לקבוצה חדשה של תרופות נגד סרטן הנקראים נוגדנים חד שבטיים. פעולתו מתבצעת על ידי התערבות באחת מהמנגנונים שבאמצעותן תאי סרטן שד מתחלקים. תאי סרטן שד מקבלים גירוי להתחלק, כאשר חלבון שהוא גורם גדילה (human epidermal growth factor) נצמד לקולטן שנמצא על ממברנת התא ולו קטע (domain) חוץ ממברנלי אליו נקשר גורם הגדילה וקטע פנים ממברנלי המגיב בשרשרת פעולות ביוכימיות בציטופלסמה לקשירה החוץ תאית. קולטן זה נקרא HER2 (לפעמים נקרא CerbB2). קיימים ארבעה קולטין מסוג זה היכולים לפעול בזוגות או כבודדים. הרצפטין בולם פעולה זו על ידי כך שהוא נקשר ל-HER2 וחוסם אותו מבלי להפעילו. כך, גורם הגדילה לא יכול לפעול על תאי סרטן השד, ונעצרת החלוקה וההתפשטות של התאים. ההרצפטין פועל גם בכך שהוא מושך אליו את תאי המערכת החיסון, כדי שיסייעו להרוס את תאי הסרטן. פעולת ההרצפטין תלויה ברמת הקולטן על ממברנת התא - ככל שהרמה גבוהה יותר, כך הפעולה משמעותית יותר. לכן, תרופה זו מוגבלת רק לחולות המוגדרות כ- HER2 חיוביות. מדידת הרמה של חלבון HER2 יכולה להתבצע על חומר טרי או ישן מקובע מניתוחים קודמים. הבדיקה הראשונה המתבצעת היא בדיקת צביעה בשיטת ה-IHC (אימונו-היסטו-כימיה) (תמונה 61.12).
אם בצביעה נצבעים מעל ל-30% מהתאים היא נקראת +3 חיובית. אם הקריאה היא נמוכה, הרי היא מוגדרת + 1 או 0. בין קבוצות אלה יש קבוצת ביניים המוגדרת+2, המחייבת ביצוע בדיקה נוספת בשיטת פיש (Fish). אם היא חיובית, החולה מוגדרת +3. מחקרים הראו שרק נשים עם ביטוי חזק של ( 3+ HER2) מגיבות לטיפול בהרצפטין, המתבטא בירידה בשיעורי הישנות המחלה ובעליה בהישרדות. באישה אחת מתוך ארבע חולות סרטן שד נמצא קולטני HER2 חיובים. ההרצפטין ניתן בשילוב עם AC וטקסול, כאשר השיטה המועדפת היא מתן המשכי של הרצפטין לשנה לאחר מתן ה-ACT בדרך שתוארה קודם לכן. הרצפטין נמצא יעיל גם בחולות סרטן שד מתקדם כתוספת לטיפול טרום ניתוחי מקובל באנטראציקלינים בשילוב עם טקסנים. נמצא שתוספת זו מעלה את שיעורי היעלמות השאת קלינית ופתולוגית בצורה משמעותית. תופעות הלוואי הקשורות בתרופה הן: תסמינים דמויי-שפעת, תגובה אלרגית, כאבי גוף קלים, שלשול, כאבי ראש והשפעות על תפקוד הלב. ה-Avastin (anti VEGF) הוא למעשה נוגדן מונוקלונאלי הנוגד Isoforms של VEGF-A(Vascular Endothelial Growth Factor). התרופה נמצאת היום בתהליך מחקר, שבו משווים מתן טקסול עם אווסטין לעומת טקסול בלבד. תוצאות ראשוניות מראות יתרון ברור ל-TA. תרופה נוספת ביולוגית הנכנסת לשוק התרופות היא ה-Lapatinib, הגורמת לדיכוי טירוזין קינז ופועלת בחולות העמידות להרצפטין שלהן ביטוי יתר של HER2. תרופה זו מאושרת כיום לחולות עם שאת גרורתית.
בכנסים האונקולוגים האחרונים, הוצגו עבודות ראשונית המראות כי ניתן לוותר על האנטראציקלינים ולתת לחולות משלבי של טקסנים עם ציקלופספאמיד או קסלודה ואחרים.
תחנה נוספת בהתפתחותו של הטיפול המסייע היא השימוש ב- Dose Dense Chemotherapy. משמעותה של שיטה זו היא מתן מנות של אותה כימותרפיה במרווחי זמן קצרים יותר. המחיר של שיטה זו הוא רעילות יותר גבוהה בעיקר המטולוגית כמו נויטרופניה ועייפות. יתרון השיטה הוא בהשגת תוצאות טובות יותר - 80% מהחולות שורדות ללא הישנות במעקב של שלוש שנים. גישה אחר היא מתן Dose Intensity, מינון גבוה של התרופה לפעמים עד פי 6 מהמינון המקובל הגורם להרס של השורה המיאלואידי של מוח העצם ולכן דורש השתלת תאי אב (מוח עצם) לאחר הטיפול. שיטה זו יעילה רק בפלח קטן יחסית של חולות סרטן שד, וסיבוכיה רבים כולל תמותה משמעותית.
לגבי זמן התחלת הטיפול, העבודות מצביעות על כך שהתוצאות הטובות ביותר הן כאשר מתחילים את הטיפול סמוך ככל האפשר לניתוח. כריתת השאת והקטנת מסת השאת גורמים להאצת הגדילה של הגרורות המיקרוסקופיות, כלומר רוב התאים מתחלקים מהר יותר, ולכן יש לתת את הטיפול מוקדם ככל האפשר, ובמינון גבוה, בשלבים הראשונים של הטיפול.
לגבי מנת הטיפול, כעיקרון, ככל שהמנה גדולה יותר הישגי הטיפול טובים יותר. כאשר עומס השאת קטן, קיים סיכוי להצליח גם במנות קטנות. בעומס שאתי רב, רק מנה מירבית יש בכוחה להשמיד את תאי השאת. בטיפול המשולב יש לשקול את המינון של כל תרופה. לדוגמה, הורדה קטנה במינון הציקלופוספאמיד תוריד את יעילות התרופה במידה ניכרת. לעומת זאת, הורדת המינון של ה-5 פלורואורציל מורידה את היעילות בצורה מתונה בלבד.
משך הטיפול הכימי המסייע, אותו יש לתת, אינו ברור. יש להמשיך בטיפול תקופה ארוכה יחסית מאחר שזמן הכפלת תאי הסרטן ארוך. עבודות מצביעות על כך שייתכן שהפעולה העיקרית מבחינת הרס התאים מתרחשת בעיקר בששת החודשים הראשונים לטיפול, ולכן כנראה אין טעם לתת טיפול מעבר לטווח זה. בדרך כלל נותנים מחזור טיפול אחת ל-3 שבועות, ומכיוון שזמן הכפלת המסה הממוצע הוא 69-56 ימים, הרי הסכנה, שתוך מחזור טיפול זה יצמחו תאי שאת - קטנה.
קיימים לבטים לגבי הסדר שבו יש לתת את הטיפולים השונים לחולות העוברות למפקטומיה. האם יש לתת קודם את הכימותרפיה ולאחר מכן את ההקרנות או להפך. בעבודות שבדקו את השאלה הזו נמצא ששיעור החזרות המקומיות של חולות שקיבלו קודם כימותרפיה ואחר הקרנות, היה גבוה יותר אך שיעור הגרורות המרוחקות היה נמוך יותר. כאשר החולות קיבלו קודם הקרנות ולאחר מכן טיפול כימי המצב היה הפוך: יותר גרורות מרוחקות ופחות חזרות מקומיות. לכן ההמלצה כיום היא להתחיל בטיפול כימי ולאחר מכן בטיפול קרינתי. השילוב בין השניים קשה לחולות, מה עוד שחלק מהתרופות מגבירות את השפעת הקרינה על העור (רדיוסנסיטזרס) ומחמירות את הנזק הקרינתי.
הורמונותרפיה מסייעת
טמוקסיפן: בפרוטוקול של 09-NSABP-B נבדקה השפעת ההוספה של טמוקסיפן לטיפול מונע כימי (L-PAM + 5-FU). נמצא שהוספת הטמוקסיפן שיפרה בהרבה את ההיוותרות בחיים של חולות בעלות קולטני אסטרוגן חיוביים שקיבלו את הטיפול המשולב. בחולות בעלות קולטנים שליליים לא נמצא שיפור בפרוגנוזה. בחולות בנות 50 שנה ומעלה ההיוותרות בחיים היתה טובה יותר מאשר בחולות צעירות יותר. בחולות בנות 50 שנה ומטה, בעלות קולטנים שליליים נעלם היתרון המושג על-ידי מתן תוספת טיפול הורמונלי. ככל שמספר הבלוטות גדול יותר התוצאות המושגות טובות יותר.
לסיכום, מפרוטוקולים קליניים מבוקרים נמצא שתוספת טמוקסיפן לטיפול הכימי המסייע היא יעילה. היא קשורה בגיל וברמת הקולטנים להורמונים: בתקופת הבלות היא יעילה, ויעילותה עולה עם כמות הקולטנים החיוביים. ניתן להשיג תועלת מעטה גם כאשר אין קולטנים להורמונים. בתקופת הפוריות, לעומת זאת, מתן טמוקסיפן הביא תועלת רק כאשר נמצאו קולטנים להורמונים.
השאלה הנשאלת היא מי מבין החולות בסרטן בשד זקוקות לטיפול מסייע ? ההמלצות הן:
- כל החולות המוגדרות כשלב 3.
- חולות בשלב 2:
- ללא קולטנים לאסטרוגן או עם HER2 חיובי, עם או ללא בלוטות נגועות תקבלנה טיפול כימי מסייע.
- חולות בגיל הבלות שלהן קולטני אסטרוגן ופרוגסטרון חיובי תקבלנה טיפול אנטי-אסטרוגני מסייע
- חולות ללא בלוטות נגועות עם קולטנים חיוביים אולם עם מרכיבים פרוגנוסטיים גרועים כמו: עם שאתות הגדולות משלושה ס"מ, דרוג פתולוגי 3, צעירות מגיל 35 ועוד.
- כל החולות עם קולטנים חיובים לאסטרוגן שקיבלו טיפול כימי מסייע יקבלו טיפול אנטי-אסטרוגני לחמש שנים לפחות.
- חולות בשלב 1 : חולות אלה עם קולטנים חיובים לאסטרוגנים תקבלנה טיפול מסייע אנטי אסטרוגני. חולות עם גורמים פרוגנוסטיים גרועים תקבלנה טיפול כימי מסייע, שלאחריו טיפול אנטי אסטרוגני לחמש שנים. כיום הנטייה היא להעריך טיפול זה ל-10-7 שנים.
בדיקה חדשה המסייעת כיום לפלח חולות לקבוצות שתקבלנה או לא טיפול מסייע כימי היא האונקוטייפ (Oncotype DX) והממפרינט (Mammaprint). הבדיקות הללו מבוססות על הפרופיל הגנטי של הגידול ומסוגלות לזהות פרופילים "טובים" או "רעים". פרופילים רעים הם הפרופילים שבהם נמצאו הרבה שינויים ברמה הגנטית, ואילו פרופילים טובים הם אלה שבהם נמצאו מעט שינויים. במסגרת המחקר הצליחו לבודד מספר מצומצם של גנים שלהם חשיבות בקביעת הפרופיל הגנטי של השאת. האונקוטיפ בוחנת את הפרופיל הגנטי באמצעות ניתוח של רמת הפעילות של 21 גנים הנמצאים על chip, ואילו הממפרינט בוחנת את הפרופיל הגנטי של הגידול באמצעות ניתוח של רמת הפעילות של 70 גנים מתוך דגימה של הגידול. לצורך בדיקת האונקוטיפ, ניתן להשתמש ברקמה שעברה שיקוע בפפרפין (לא טריה), ואילו לממפרינט דרושה דגימה רקמה טריה המקשה מבחינה טכנית על לקיחתה. האונקוטיפ נמצאה מאוד מדוייקת בחיזוי הישנות המחלה והצורך במתן טיפול כימי מסייע בחולות עם קולטנים חיובים לאסטרוגן וללא בלוטות נגועות. בדיקה זו מהווה כיום בדיקה שגרתית בחולות שהגדרנו, והיא מסייעת בהחלטה האם החולה תקבל טיפול כימי מסייע או אנטי-אסטרוגני בלבד. מחקרים חדשים ביותר מראים שגם בחולות עם קולטנים לאסטרוגנים שלילים ניתן לפלח בעזרת הממפריט לקבוצות עם סיכויי הישנות גבוהים ונמוכים. ההשערה היא שהקבוצה בעלת הסיכוי הנמוך לפתח גרורות לא זקוקה לטיפול כימותרפי. עבודות דומות נעשות היום בניסיון לזהות קבוצות עם בלוטות חיוביות שלא יהנו מכימותרפיה.
הטיפול המסייע הכימי או האנטי אסטרוגני מהווים יסוד בטיפול בסרטן השד אולם הם מעוררים שאלות חשובות במיוחד בחולות עם סרטן שד מוקדם. נשאלת השאלה האם הטיפול אכן משפר את ההישרדות בחולות אלה? התשובה לכך בחולות סרטן שד מוקדם אינה ברורה, וכנראה שלא. הטיפול כן משפר את תקופת תסוגת המחלה. המחיר הנדרש מבחינת החולה הוא גבוה, שכן הטיפול הכימי המסייע כרוך הסיבוכים כולל תמותה, לעומת הסיבוכים הקלים יחסית והנסבלים של הטיפול האנטי-אסטרוגני, שאין חולק כיום שיש לתת אותו לכל החולות עם קולטנים חיובים לאסטרוגן. המחיר הכללי הוא עצום ומגיע למאות מליוני דולרים בשנה בארה"ב ובמחיר של 50 -100 חולות שימותו מהסיבוכים. לכן, כל הניסיונות לפלח את החולות לכאלה שייהנו מהטיפול ולכאלה שלא שוות את ההשקעה.
טמוקסיפן (Tamoxifen) כטיפול בסרטן השד
הטמוקסיפן הינו triphenylethylene compound אשר פותח במסגרת מחקרים שעסקו בחיפוש אחר אנטגוניסטים לאסטרוגן שישמשו כמונעי הריון (contraceptive) בתחילת שנות החמישים והשישים. התוצר הראשון שיוצר אז היה ה-ethamoxytriphetol{כ}} (ה-MER-25) אשר לא הוכנס לשימוש עקב פעילותו הנמוכה ורעילותו הגבוהה. מאז פותחו מספר תכשירים אנטי-אסטרוגנים מאותה קבוצה: nafoxidene tamoxifen- ,clomiphen, אשר נמצאו יעילים כאנטי-אסטרוגנים ואשר רעילותם נמצאה נמוכה, במיוחד זו של הטמוקסיפן.
Jensen וחבריו ב-1967 הם הראשונים המדווחים בספרות על השימוש בטמוקסיפן כתכשיר אנטי-אסטרוגני לטיפול בסרטן השד. מאז דיווח זה רבו הפרסומים על יעילות הטמוקסיפן בטיפול בסרטן השד. העבודה הראשונה שהדגימה יעילות זו היה מחקר של NATO (Novadex Ajuvant Trial Organisation) אשר הראה בעבודה אקראית גדולה עם מעקב ארוך שיפור משמעותי סטטיסטי בהיוותרות בחיים ל-5 שנים בחולות שטופלו בטמוקסיפן למשך שנתיים. ממצאיה של עבודה זו אושרו גם בעבודות רבות אחרות שהתפרסמו בספרות. הטמוקסיפן פותח כתכשיר אנטי-אסטרוגני הפועל ישירות על הקולטן לאסטרוגן התוך תאי ומונע על-ידי כך את קשירת האסטרוגן לקולטן ואת תגובת השרשרת המטבולית הנוצרת בעקבות קשר זה. מחקרים הראו שפעילות הטמוקסיפן היא יותר מורכבת ממה שנראה מהמודל הפשוט שהוצג. עבודות מצביעות על כך שהטמוקסיפן פועל גם דרך פקטורי הגדילה (growth factors). במיוחד מושפע על-ידי הטמוקסיפן ה-TGF-BETA (transforming growth factor beta), אשר בעיקר מעכב צמיחת תאי סרטן שד בתרבית רקמה ופרוליפרציה של לימפוציטים, אולם מעודד צמיחה של פיברובלסטים ותאי אנדותל. בתאי סרטן שד מסדרה 7-MCF ניתן להראות עיכוב בגדילה על-ידי טמוקסיפן, ובמקביל עלייה של פי 27 ברמות ה-TGF-BETA, וזה האחרון יכול לעכב צמיחת תאי סרטן שד שהם קולטנים שליליים לאסטרוגן (-ER). עבודות אחרות מצביעות על הקשר שבין ייצור פקטור הגדילה TGF-ALPHA לבין ייצור פיברובלסטים ברקמת השד. ממצא זה מסביר מדוע הטמוקסיפן משפיע על שאתות מזנכימליות. לטמוקסיפן יש גם דרכי פעולה אחרות כפי שמדווח בספרות כמו עיכוב ה-calmodulin-mediated cell proliferation ובדרך זו מעכב צמיחת תאים.
בשנים האחרונות נמצא שלטמוקסיפן גם השפעה אסטרוגנית על איברים אחדים בגוף. חולות שקיבלו טמוקסיפן הראו פחות ספיגת עצם בהשוואה לקבוצת ביקורת שלא קיבלה טמוקסיפן. כנראה הטמוקסיפן משפיע על האוסטאוקלסטים ומאט את פעולתם ומשפיע גם על האוסטאובלסטים דרך פקטור הגדילה.
תוצאות הטיפול המשלים בטמוקסיפן למשך חמש שנים בשאתות עם קולטנים חיוביים להורמונים, מראים כי הטיפול מוריד לחצי את האחוז החזרות של המחלה בזמן הטיפול. תוצאה זו נשמרת מספר שנים לאחר הפסקת הטיפול. התוצאה של הטיפול היא עוד יותר מרשימה מבחינת תמותה: התמותה יורדת בערך בשליש לאחר מעקב במשך 15-10 השנים הבאות. הטיפול המשולב (כימותרפיה + חמש שנים טמוקסיפן) הוא יותר יעיל לעומת טיפול כימותרפי בלבד, כדי למנוע חזרה של סרטן השד ותמותה ממנו. טמוקסיפן הניתן לחמש שנים מוריד את הסיכון השנתי למוות ב-26% וזאת ללא הבדל בין נשים צעירות למבוגרות, וללא קשר עם כן או לא קיבלו כימותרפיה. השפעת הטמוקסיפן עולה ביחס לריכוז של קולטני האסטרוגן בשאת. בנשים עם רמות גבוהות של קולטנים, הירידה המדווחת היא של 60%, בעוד שבריכוז קולטנים נמוך הירידה היא בכ-43%. בחולות ללא קולטנים אין כמעט תגובה לטמוקסיפן. משך המתן המומלץ הוא חמש שנים. במחקר ^ATLAS, שבו חולקו נשים באופן אקראי למתן טמוקסיפן לחמש או עשר שנים, נמצא בנתונים שפורסמו ב-2007 שמסתמן יתרון לקבוצה שהמשיכה עשר שנים לעומת חמש שנים.
מספר עבודות בדקו את יעילות הטמוקסיפן למשך שנתיים וחמש שנים ומצאו שמתן הטמוקסיפן ל-5 שנים מקנה תוצאות טובות יותר מאשר לשנתיים, בעוד שהמינון של 20 מ"ג או יותר אינו משנה. בשנים האחרונות, עקב השימוש הנרחב יותר בטמוקסיפן, נבדקו גם השפעות לוואי אחרות שלו. נמצא שנשים שקיבלו טמוקסיפן הראו נטייה לספיגת עצם מופחתת בהשוואה לקבוצת הביקורת. התמותה ממחלות קרדיווסקולריות פחתה בצורה משמעותית בקבוצת הטמוקסיפן וכן נמצאה ירידה משמעותית בתמותה שלא מסרטן בקבוצה זו. נמצאה ירידה בשכיחות נגעים ממאירים בשד השני בנשים שקיבלו טמוקסיפן.
כל היתרונות הללו הביאו לפתיחת עידן חדש של ניסויים אשר מטרתם לבדוק את יעילות הטמוקסיפן במניעת סרטן השד בנשים המוגדרות כנמצאות בסיכון גבוה. עבודות ראשוניות בנושא של Cusick וחבריו הראו שאכן ניתן להפחית את מספר החולות בסרטן השד על-ידי שימוש בטמוקסיפן כטיפול מונע. בעקבות זאת בוצעו מחקרים שתמכו במסקנה זו ומתן טמוקסיפן למניעה הפך למקובל (ראה פרק מניעת סרטן השד).
תופעות הלוואי עקב שימוש בטמוקסיפן היו קלות בדרך כלל ושיעורן נמוך, אך אם יהיה שימוש נרחב בתרופה, ייחסו לתופעות הלוואי חשיבות רבה. התופעות השכיחות ביותר הן גלי חום (hot flashes), בחילות והרגשה רעה, המופיעות בכ-25% מהחולות המטופלות, אולם רק לעתים רחוקות תופעות אלה מחייבות הפסקה של הטיפול. הפרעות במחזור, דימום לדני, הפרשות מהלדן וגרד בפות שכיחים פחות. היפרקלצמיה, בצקת פריפרית, דיכאון, חוסר תיאבון, כאבי ראש - מדווחים בשיעורים נמוכים. תרומבוציטופניה, ליקופניה, היווצרות קטרקטות, שינויים קורנאליים וריטינופתיות - מדווחים במספר עבודות, כאשר השכיחות המדווחת היא אחת ל-1000 מטופלות. העלייה בשכיחות התופעות התרומבואמבוליות מיוחסת לירידה באנטיתרומבין 3.
בסקירה רחבה של הספרות על מתן טמוקסיפן לחולות הנמצאות בשלב מתקדם של סרטן השד מדווח על 11 חולות מתוך 1,122 חולות אשר פיתחו תופעות של תרומבופלביטיס. בסדרות אחרות, קטנות יותר, מדווחים על מקרים של תסחיפים לריאה בעקבות טיפול בטמוקסיפן. בנוסף מדווחים בספרות תיאורי מקרים של חולים שפיתחו פקקת של העורק המזנטריאלי העליון (superior mesenteric artery) , פקקת של המערכת הווורידית העמוקה, פקקת של אבי העורקים ותסמונת של קרישה מפושטת בתוך כלי הדם.
Raloxifene היא תרופה מקבוצה של האסטרוגן רצפטור מודולטור, בדומה לטמוקסיפן, אולם ללא השפעה על האנדומטריום ולכן לא גורמת לאנדומטריל קרצינומה. השימוש הראשון שלה היה למניעת אוסטואופורוזיס אולם עבודות בשנים האחרונות הראו שהיא גם יעילה במניעת סרטן השד. בהיותה סלקטיבית הרלוקסיפן מקטינה את רמת השומנים בדם ואת התופעות הטרומבואמבוליות ולכן תחליף בעתיד את הטמוקסיפן.
מעכבי ארומטאז (AI - (Aromates Inhibitors
תרופות מקבוצת מעכבי ארומטאז שייכות לקבוצה של התרופות אנטי-הורמונליות, והן מעכבות את יצור האסטרוגן. האנזים ארומטאז הוא אנזים חשוב בתהליך הפיכת הסטרואידים בכל תחנות היצירה של האסטרוגן (שחלות, אדרנלים ושד). אנזים הארומטאז הוא קומפלקס של אנזימים אשר אחראי למעבר מטבולי של טסטוסטרון ודומיו לאסטראדיאול (1E, E2). עיכובו מוריד עד לרמות אפסיות את האסטרוגן במחזור הדם ועל ידי כך קולטן האסטרוגן אינו מופעל, ובעקבות זאת הקסקדה המטבולית שהוא מעורר אינה מופעלת. לכן, מתן מעכבי ארומטז מעקב את צמיחת התא השאתי. בנשים צעירות, רמת הארומטז גבוהה יחסית ולכן העיכוב של מעכבי הארומטז אינו טוב כשרמת האסטרוגן בדם גבוהה. קיימים מספר סוגים של מעכבי ארומטאז: מעכבים לא סטרואידלים הפיכים וסטרואידים בלתי הפיכים. האנסטרזול והלטרזול שייכים לקבוצה הראשונה ואקסמסטן שייך לקבוצה השנייה. ל-Exemestane יש שני יתרונות:
- היא גורמת לחוסר פעילות של האנזים לא דרך עיכוב תחרותי ובכך אינה מאפשרת את התאוששות הארומטז. מנגנון זה עשוי להתגבר על עמידות לתרופות מן הקבוצה הראשונה.
- היות והתרופה היא סטרואידית, יכולה להיות לה השפעה מיטיבה-ואנבולית על העצם ועל פרופיל השומנים, וזאת בניגוד לתרופות האחרות.
בתחילה הושוו מעכבי הארומטז מול תכשירי קו שני ונמצאו שיעורי תגובה טובים יותר ללטרזול על פני המגאסטרון, כולל יתרון בשיעורי ההישרדות. עבודות המשוות בין טמוקסיפן בקו ראשון לבין מעכבי ארומטז בקו ראשון מראות תגובה טובה יותר בחולות עם סרטן שד מתקדם שטופלו במעכבי ארומטז. בחולות עם סרטן שד מוקדם המקבלות טיפול אנטי-אסטרוגני מסייע נמצא תגובה שווה ואף טובה יותר עם מעכבי ארומטזה ולכן הם נכנסו היום לשגרת הטיפול המסייע בחולות סרטן שד בשלב מוקדם. מקובל לתת שנתיים טמוקסיפן ושלוש שנים מעכבי ארומטאז. בשיטה זו, התוצאות המושגות זהות לחמש שנים של מעכבי ארומטז אולם תופעות הלוואי קטנות משמעותית. הירידה ברמת האסטרוגן קשורה במספר תופעות לוואי כמו ירידה במסת העצם מלווה אוסטאופורוזיס מתקדמת, כאבי שרים ומפרקים. בגלל השימוש הקצר יחסית בתרופה לסרטן שד הניסיון המצטבר בתופעות הלוואי של התרופה הולך וגובר.
טיפול אנטי שחלתי כטיפול מונע בסרטן שד בשלב מוקדם
האפשריות לטיפול אנטי שחלתי הן: כירורגיות (כריתת שחלות), קרינה ופרמקולוגיה (LHRH agonists). במטה אנליזה שכללה 12 מחקרים אקראיים נמצא שטיפול אנטי שחלתי אינו יעיל בנשים שלאחר בלות. לעומת זאת, בצעירות יש יתרון ברור לאחר הוספת טיפול זה: ירידה בחזרת המחלה ב-25% וירידה של 25% בעודף תמותה (odd ratio). הוספת כימותרפיה לחולות אלה לא הוסיפה על ההישגים של טיפול שחלתי בלבד. נכון להיום, ההמלצה לגבי נשים צעירות עם קולטני אסטרוגן חיוביים בשאת ובסיכון גבוה לחזרת המחלה להוסיף טיפול אנטי שחלתי פרמקולוגי למשך שנתיים, בנוסף לטיפול טיפול כימותרפי וטמוקסיפן. בנשים בסיכון נמוך אפשר להסתפק באואופורקטומיה בתוספת לטמוקסיפן.
מניעת סרטן שד
הכרת האפידמיולוגיה של סרטן השד, הביאה לזיהוי גורמים להתהוותו ועם זיהויים לבחינת תוכניות מניעתיות. מדובר בגורמים גנטיים סביבתיים והורמונליים. היסטוריה משפחתית של סרטן שד מהווה את גורם הסיכון הגבוה ביותר בהתפתחות סרטן השד ובמיוחד בגיל צעיר. זיהוי הגנים אשר מוטציות בהם מנבאות תחלואה מאפשרת זיהוי קבוצת סיכון להתערבות מניעתית. מבין הגורמים ההורמונליים, חשיפה ממושכת לאסטרוגנים מהווה את הגורם המסכן אם על ידי נטילת טיפול הורמונלי ממושך לאחר גיל הבלות, אם על ידי העדר הריונות, או שנות מחזור ארוכות בנשים שהחלו לווסת מוקדם וסיימו את המחזור בגיל מאוחר. גם שנים ארוכות של עודף משקל מעלות את בסיכון לסרטן שד מכיוון שהשומן התת עורי מהווה מקור לאסטרוגנים בגיל הבלות.
גורמים סיבתיים מוכרים, כמו קרינה, צריכת אלכוהול ממושכת או צריכה גבוהה של שומנים - ניתן למצוא את הקשר ההורמונלי: נערות ונשים צעירות שחלו במחלת הודגיקין וקיבלו טיפול קרינתי לניקוז הלימפתי שמעל הסרעפת נמצאות בסיכון גבוה לפתח סרטן שד.
צריכת יתר של אלכוהול מעלה את רמת האטרדיול בדם: חשיפת יתר לאסטרוגנים. פעילות גופנית מסודרת של ארבע שעות שבועיות מפחיתה את הסיכון לסרטן שד, קרוב לוודאי דרך עליה ברמות הטסטוסטרון המגנות על האישה.
טמוקסיפן: עבודות ראשונות בנושא מניעה של סרטן שד על ידי מתן תכשירים אנטי אסטרוגנים היו מאכזבות מכיוון שלא הראו הבדל בין נוטלות לכאלה שקבלו אינבו בטווח של שמונה שנים. בתת קבוצה של חולות שקיבלו טיפול הורמונלי חלופי נצפתה הבדל בהיארעות המחלה. פריצת דרך בנושא באה בעקבות מחקר ה-NSABP P1 שהשווה שני קבוצות שנבחרו באופן אקראי לקבל או לא טמוקסיפן מניעתי. הקבוצה הוגדרה כקבוצת נשים בעלות סיכון מוגבר לחלות בסרטן שד. המחקר הראה ירידה של 50% בשיעור סרטן השד בקבוצה שקיבלה טמוקסיפן, וכן תוצר לוואי של הפחתה בשיעור השברים מאוסטאופורוזיס. נצפתה עליה בשיעור שאתות ממאירות ברחם מ-1.9 ל-1000 נשים ל-2.3 בנוטלות טמוקסיפן רובן בשלב 1 הניתן לריפוי מלא. כמו כן, נצפתה עליה בשיעורי האירועים של פקקת ורידית מלווה בתסחיפים ריאתיים ואוטם מוחי. נמצא גם שטמוקסיפן מפחית את שיעורי סרטן השד בנשאיות מקבוצת ה- BRCA2 אבל לא BRCA1 וכן בחולות עם קולטנים חיוביים בשאת המתפתחת ולא באלה עם קולטנים שליליים. תרופה דומה לטמוקסיפן היא הרלוקסיפן, שאיתה ניתן להשיג אפקט דומה עם פחות תופעות לוואי.
רטינואידים: רטינואידים טבעיים ממלאים תפקיד בחלוקת התאים ובדיפרנציאציה שלהם ומכאן מקומם במניעת יצירתם של שאתות ממאירות. רעילותם באנשים בריאים היא בעיה רצינית המונעת שימוש למטרות מניעה אלא לטיפול בלבד. בעבודות בהן השוו בין קבוצות של חולות סרטן שד בצד אחד, שחולקו אקראית לכאלה שקבלו ולא קבלו רטינואידים, נמצא שקבוצת חולות לפני גיל הבלות שקבלו רטינואידים פיתוחו פחות (35%) סרטני שד בצד השני בהשוואה לאלה שלא קבלו. חולות שלאחר גיל הבלות, לעומת זאת, פתחו יותר ב-20% שאתות בשד השני.
כריתת שחלות: מחקרים הראו שבחולות סרטן שד הנושאות מוטציה גנטי ב-BRCA כריתת שחלות הקטינה את התחלואה בסרטן השד ב-50%.
כריתת שדים: עבודות מראות ירידה משמעותית בתחלואה בסרטן השד בחולות שעברו כריתה מונעת דו-צדדית של השדים. שיעורי התחלואה שנמצאו היו 0.5% במעקב של עשר שנים לעומת 5% צפויים. מודלים מתמטיים ניסו להעריך את הרווח בשנות חיים ובאיכות החיים מניתוח זה. הם דווחו, שניתוח בגיל צעיר, 40-30 שנים, יביא לארכת חיים בסדר גודל של 5-3 שנים. מעל גיל 50, כריתת שד מונעת דו- צדדית תאריך את חיי המטופלות בשנה עד שנתיים.
שינוי אורח החיים: נערות עם עודף משקל המצליחות לרדת למשקל אידיאלי עד אמצע שנות השלושים שלהן, מפחיתות את סיכוייהן לחלות בסרטן שד בגיל 55. פעילות גופנית נמרצת של לפחות ארבע שעות שבועיות מגנה מפני סרטן שד. לידה מוקדמת מגיל 20 מגינה מפני סרטן שד. הפסקת צריכת אלכוהול מקטינה בצורה משמעותי את שכיחות סרטן השד.
טיפול מקל (Palliative)
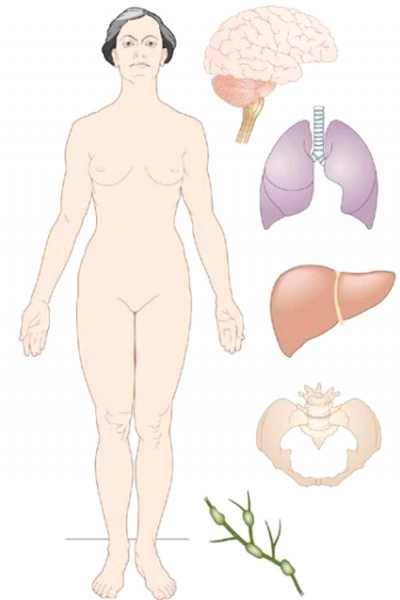
טיפול זה נועד להקלת הכאבים ולמניעת כיבים בעור. האפשרויות הטיפוליות בגרורות מרוחקות מסוכמות בטבלה 12.10. גרורות מרוחקות יכולות להופיעה במקומות שונים השכיחים שביניהם הם עצמות ריאות וכבד. בחולות עם שאת לובולרית אפשר למצוא גם גרורות למעי ולמוח . האיברים הנפגעים מופיעים באיור 33.12.
הקרנות
הקרנות יעלות בגרורות ברקמות הרכות או בעצמות שמקורן בשאת ממארת בשד.
טיפול הורמונלי
טיפול באסטרוגנים: הטיפול באסטרוגנים יעיל רק בנשים בתקופת הבלות, וככל שמספר שנות חייהן לאחר הפסקת המחזור רב יותר, כך השפעת הטיפול טובה יותר. 56% מהנשים בגיל הפוריות יגיבו למתן אסטרוגנים בהתפשטות השאת, ולכן אין לתת להן אסטרוגנים במסגרת הטיפול. כמו-כן אין לתת טיפול זה לחולות בתקופת הבלות, אשר נמצאה אצלן עדות לפעילות אסטרוגנית, במשטחים שנלקחו מהלדן.
30% מהנשים בתקופת הבלות מגיבות לטיפול אסטרוגני, במיוחד נשים בעלות גרורות ברקמות הרכות. נוכחות קולטנים לאסטרוגן מעלה את אחוז התגובה ל-65%, בעוד אשר בקבוצה ללא קולטנים לאסטרוגן ניתן למצוא תגובה רק ב-9% מהחולות.
התכשיר המקובל הוא דיאטילסילבסטרול 5 מ"ג 3x ליממה. ההשפעה של הטיפול נצפתה בשבוע ה-4, אבל יש להמשיך אותו לפחות חודשיים לפני שמחליטים שאינו יעיל. משך התגובה הממוצע הוא 16 חודשים. ההיוותרות בחיים של חולות המגיבות לטיפול זה היא כפולה מזו של אלה שאינן מגיבות.
תופעות הלוואי השכיחות בעקבות הטיפול הן:
- חוסר תיאבון.
- בחילות והקאות אשר נעלמות מספר שבועות לאחר תחילת הטיפול.
לאחר שימוש ממושך ניתן לראות:
- פיגמנטציות בעור.
- הגדלת השדיים.
- אגירת מים ונתרן.
- דימומים מהרחם.
כאשר מופיעים דימומים שלא ניתן להשתלט עליהם יש להפסיק את האסטרוגנים. לפעמים יש לתת אנדרוגנים על מנת להפסיק את הדימומים.
טיפולים אנטי-אסטרוגניים: תרופות אלה מתחרות עם האסטרוגנים על הקולטנים הרקמתיים ועל-ידי כך חוסמות את השפעת האסטרוגנים. התרופות האנטי-אסטרוגניות המקובלות הן טמוקסיפן, נאפוקסידין וכלומיפן. התרופה המקובלת ביותר היא הטמוקסיפן, הניתן במינון של 20 מ"ג ליממה דרך הפה. רוב החולות המגיבות הן חולות בתקופת הבלות, אולם גם חלק מהחולות בתקופת הפוריות מגיבות.
בחולות בגיל הבלות עם קולטני אסטרוגן חיוביים ניתן לטפל במעכבי ארומטז. נמצא, שחולות המטופלות במעכבי ארומטז מגיבות בשיעור גבוה יותר בהשוואה לחולות המטופלות בטמוקסיפן, וחולות שהשאת שלהן עמידה לטמוקסיפן יגיבו לטיפול במעכבי ארומטז.
טיפול באנדרוגנים: טיפול זה ניתן לחולות בתקופת הפוריות, בעלות שאת ממארת מפושטת של השד. טיפול זה משפר את התגובה של חולות שעברו כריתת שחלות, או של חולות שלא הגיבו כלל לכריתת השחלות. בנשים לאחר תקופת הבלות, שבמשטחים הואגינאליים שלהן נמצאה עדות לפעילות אסטרוגנית, אפשר לנסות טיפול אנדרוגני, אולם אחוז התגובה שלהן הוא נמוך - 15%.
התגובה של חולות בעלות גרורות בעצמות לטיפול אנדרוגני היא טובה יותר מאשר תגובתן לאסטרוגנים. בעבור חולות שאינן מגיבות לטיפול במשך 6 שבועות יש לחפש דרכי טיפול אחרות.30%-25% מהחולות שעברו טיפול באסטרוגנים או כריתת שחלות, ואשר המחלה התלקחה אצלן מחדש, מגיבות לטיפול באנדרוגנים. 45% מהחולות בעלות קולטנים חיוביים לאסטרוגן מגיבות לטיפול, לעומת 8% מהחולות בעלות קולטנים שליליים. את הטיפול יש להמשיך עד אשר החולה נכנסת לתקופת רגיעה ואז להפסיק. ניתן לחדש את הטיפול כאשר החולה מראה סימנים של התלקחות מחודשת.
התכשירים המקובלים הם: טסטוסטרון 100 מ"ג 3x לשבוע לשריר. בלוטסטין אפשר לתת במינון של 40-20 מ"ג ליממה דרך הפה. טיפול הנמשך 3 חודשים נותן תוצאות מירביות, 80% מהחולות הסובלות מכאבים בעצמות מגיבות לטיפול זה. סיבוכי הטיפול כוללים:
- הירשוטיזם.
- מסקולינזציה.
- עלייה בליבידו.
- צרידות.
- נשירת שיער ואקנה.
- בחילות והקאות.
- רעלת כבד.
- צבירת נוזלים.
לטיפול באסטרוגנים או באנדרוגנים אין השפעה על גרורות בכבד או בריאות.
סטרואידים - הטיפול בסטרואידים ניתן כאשר:
- לחולה יש גרורות בריאות.
- לחולה יש גרורות בכבד.
- החולה לוקה בהיפרקלצמיה.
- החולה לוקה בצהבת.
- החולה במצב קשה ולא תעמוד בטיפולים אחרים.
התגובה לסטרואידים אינה מרמזת על תגובה גם ל-adrenalectomy. משך ההקלה בחולות אלה הוא 6 חודשים בממוצע. 15% מהחולות המקבלות טיפול זה מספרות על שיפור בתיאבון ובהרגשה; בחלק מהחולות ניתן למצוא גם נסיגה של גרורות ברקמות הרכות והקלה במצוקה הנשימתית.
סיבוכי הטיפול הם: חשיפת יתר לזיהומים, הופעת כיבים פפטיים ודימומים ממערכת העיכול, יתר-לחץ-דם, סוכרת ובצקות.
בחירת הטיפול ההורמונלי
את הטיפול התרופתי יש להתאים לחולה:
- בחולות בתקופת הבלות הטיפול היעיל יותר בגרורות ברקמות הרכות, בגרורות בבית החזה ובריאות הוא על-ידי אסטרוגנים.
- בגרורות בעצמות - על-ידי אנדרוגנים.
- בגרורות בכבד ובמוח - על-ידי סטרואידים.
- כיום, בחולות בגיל הבלות, הטיפול בתכשירים אנטי-אסטרוגניים הוא טיפול הבחירה במחלה הגרורתית. רק לאחר כישלון טיפול זה עוברים להורמונותרפיה אחרת או לטיפול משולב.
טיפולים אנדוקריניים כירורגיים
כריתת השחלות
35% מהחולות בגיל הפוריות, שלהן גרורות או חזרה מקומית, מגיבות לכריתת השחלות. עוצמת התגובה תלויה בהימצאות קולטנים חיוביים לאסטרוגנים בשאת. חולות אשר לא מגיבות לכריתת השחלות אינן מגיבות גם לכריתת האדרנל. מבין אלה המגיבות לכריתת השחלות 50% מגיבות גם לכריתת האדרנל או להיפופיזקטומיה. מאלה אשר אינן מגיבות לכריתת השחלות, רק 15% מגיבות לניתוחים אנדוקריניים אחרים. לא מקובל לבצע כריתת שחלות פרופילקטית. את כריתת השחלות אפשר לבצע באופן כירורגי או על-ידי הקרנות. חולות העוברות כריתת שחלות ומקבלות טיפול כימי מיד לאחר מכן, מגיבות ברגיעה ארוכה.
טיפול תרופתי המעכב הפרשת אסטרוגן מהשחלות הוא הטיפול בנוגדי LHRH agonist -Zoladex) LHRH). כתוצאה ממתן תרופה זו יורדת הפרשת LHe בצורה משמעותית ולכן הגירוי להפרשת אסטרוגן על ידי השחלות. התגובה למתן תרופה זו דומה לכריתת שחלות, ולכן הוא יכול להחליף את כריתת השחלות הטיפולית. השילוב של זולדקס עם טמוקסיפן משפר את שיעורי התגובה בצורה משמעותית במיוחד בחולות לפני גיל הבלות או סביב גיל זה.
אדרנלקטומיה והיפופיזקטומיה
30% מהחולות הלוקות במחלה מפושטת מגיבות לאדרנלקטומיה או להיפופיזקטומיה. חולות המגיבות למניפולציות הורמונליות או לכריתת שחלות מגיבות טוב יותר לניתוחים אלה. כללית עדיף לבצע אדרנלקטומיה, מכיוון שקל יותר לטפל מבחינה אנדוקרינית בחולות לאחר כריתת האדרנל מאשר לאחר כריתת ההיפופיזה. בנשים פוריות כריתת שחלות, המביאה לנסיגה של השאת, לא מחייבת לבצע אדרנלקטומיה. אולם אם המחלה חוזרת יש להוסיף גם אדרנלקטומיה. בנשים, בתקופת הבלות, אפשר לבצע כריתת השחלות והאדרנלים באותה ישיבה. יש מחברים הטוענים שגם בחולות פוריות יש לבצע את הניתוח באותה ישיבה מכיוון שתוצאות הניתוח המשולב הן טובות יותר.
ניתוחים אלה הם ניתוחים גדולים, מלווים בשיעור תמותה של 5% ובסיבוכים אנדוקריניים, ולכן יש לבחור בקפדנות את קבוצת החולות שתהנינה מניתוחים אלה. חולות שלהן גרורות בעלות פוטנציאל גדילה איטי, וחולות המגיבות לטיפולים הורמונליים, נמצאו מגיבות טוב יותר לניתוחים אלה. חולות שלהן גרורות ברקמות הרכות, בעצמות ובפלאורה מגיבות טוב יותר מחולות בעלות גרורות בכבד או במוח. ככל שגיל החולות גבוה יותר, כך התגובה טובה יותר. 50% מהחולות בעלות קולטנים חיוביים לאסטרוגן מגיבות לאדרנאלקטומיה, לעומת 8% מהחולות שלהן קולטנים שליליים. 30% מהחולות שלהן קולטנים גבוליים תגבנה לניתוח.
לפני ביצוע האדרנלקטומיה יש לנסות את האדרנלקטומיה הכימית, על-ידי מתן של אמינוגלוטתיאימיד במינון של 1 גרם ליממה ובתוספת של 40 מ"ג הידרוקורטיזון. חומר זה מעכב את יצירת הסטרואידים באדרנל.
מקום האדרנלקטומיה בטיפול בסרטן השד איבד מחשיבותו בשנים האחרונות עקב הופעתן של התרופות האנטי הורמונליות, במיוחד מקבוצת מעכבי הארומטז אשר נמצאו יעילות כמו כריתת בלוטת האדרנל.
כימותרפיה
לחולות בעלות שאתות מתקדמות, או שאתות הגדלות מהר , יש לתת טיפול כימותרפי. שילוב של תרופות, היא השיטה המקובלת יותר. 87% מהחולות מקבלות את השילוב של אדריאמיצין, ציקלופוספן ופלאורואורציל. שילובים יותר עדכניים של AC עם טקסול ובחולות שהן HER2 חיוביות הוספת הרצפטין מעלים את אחוזי התגובה וההישרדות בחיים של חולות גרורתיות.
השילוב של כימותרפיה עם הורמונותרפיה לא הוכח כיעיל יותר מאשר הטיפול על-ידי כימותרפיה לבד.
התוספת של Taxol והרצפטין לרשימת התרופות המאושרות לטיפול העלתה בצורה משמעותית את יכולת ההתמודדות עם סרטן השד.
נוזל ממאיר בחלל הצדר (pleura)
במחצית מהחולות הנמצאות בשלבי מחלה מתקדמים ניתן למצוא נוזל המכיל תאים ממאירים בצדר. נוזל זה יש לנקז, ולאחר מכן לגרום להידבקויות של הצדר על-ידי הכנסת חומר סקלרוזנטי כמו טטראציקלין 500 מ"ג ב-30 סמ"ק של תמיסת מלחים איזוטונית (סליין) או טלק סטרילי. את החומר מחדירים לחלל הצדר, סוגרים את הנקז ל-6 שעות ומבקשים מהחולה להסתובב במיטה על מנת לפזר את החומר, ולאחר מכן פותחים את הנקז. תוך 5-4 ימים נוצרות הידבקויות בפלאורה ואז מוציאים את הנקז. למרות הטיפול, בחלק מהחולות מופיעה הצטברות חוזרת של הנוזל, ולכן יש צורך לחזור על הטיפול מספר פעמים. יש המכניסים לחלל הצדר thiotepa, אולם מכיוון שהיא גורמת בחילות עדיפה השיטה הקודמת.
היפרקלצמיה
היפרקלצמיה שכיחה בכ-10% מהשאתות הממאירות בשד. בחלק מהחולות הסיבה היא גרורות אוסטאוליטיות. בחלק אחר, לא נמצאו גרורות, אולם נמצא בהן פיטוסטריל אסטר, שהוא בעל תכונות הדומות לויטמין D, כלומר משחרר סידן מהעצם. ההיפרקלצמיה הזו אינה מלווה בירידה בפוספט או עליה ב- PTH, כמו בהיפר פאראתירואידיזם.
במצבים הקלים יש לטפל על-ידי הידרציה טובה, להמשיך בפעילות גופנית ובדיאטה דלת סידן. במצבים חריפים יותר יש לתת כמות מרובה של נוזלים דרך הווריד עם משתנים, סטרואידים וסודיום סולפט, הקושר סידן ומופרש במהירות בשתן. במצבים חריפים אפשר לטפל גם במיטראמיצין שהיא תרופה אנטימיטוגנית, המעכבת את פעולת האוסטאוקלאסטים. טבלה 12.12 מסכמת את החלופות הטיפוליות בחולות עם גרורות מרוחקות.
| 1. | Local radiation | |
| 2. | Radiation to painful metastasis | |
| 3. | Estrogen treatment (diethylstilbestrol) | |
| a. | Postmenopausal (30% - 5 YS) | |
| b. | ER (+) (65%) | |
| c. | Soft tissue metastasis (30%) | |
| Contraindicated in: | ||
| * | Premenopausal | |
| * | Estrogen activity in vaginal smear | |
| 4. | Antiestrogen treatment (tamoxifen) | |
| a. | Perimenopausal patients ER (+) (30%) | |
| b. | Vaginal smear (+) | |
| c. | Premenopausal ER (+) | |
| 5. | Androgen treatment (testosterone) | |
| a. | Pre and perimenopausal patients (30%) | |
| b. | ER (+) (45%) | |
| c. | Bone metastasis | |
| d. | Nonresponders to estrogen therapy | |
| 6. | Steroids treatment (15%) | |
| a. | Lung metastasis | |
| b. | Liver metastasis | |
| c. | Hypercalcemia | |
| d. | Jaundice | |
| e. | Brain metastasis | |
| 7. | Radiation or surgical castration | |
| a. | Responders to estrogen treatment with relapse | |
| b. | Premenopausal | |
| c. | Slow growing tumors ER (+) | |
| d. | Combine with chemotherapy | |
| 8. | Adrenalectomy (surgical or chemical) | |
| a. | Same as castration | |
| b. | Combined with castration | |
| 9. | Hypophysectomy (surgical or radiation) Same as adrenalectomy | |
| 10. | Chemotherapy | |
| 11. | Immunotherapy |
פרוגנוזה של חולות סרטן השד
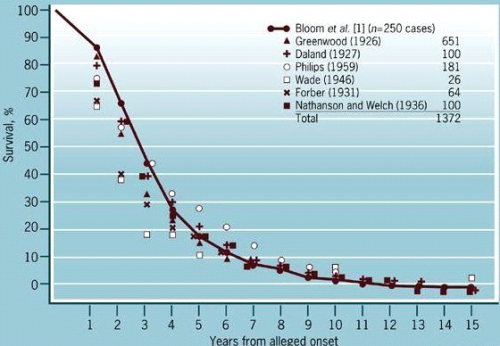
הפרוגנוזה תלויה בדירוג, בסוג הפתולוגי של השאת ובטיפול. 50% מהחולות שלא קיבלו כל טיפול נפטרות תוך 3 שנים לאחר האבחנה. 5% מהחולות הללו חיות 10 שנים ללא טיפול (גרף 12.12).
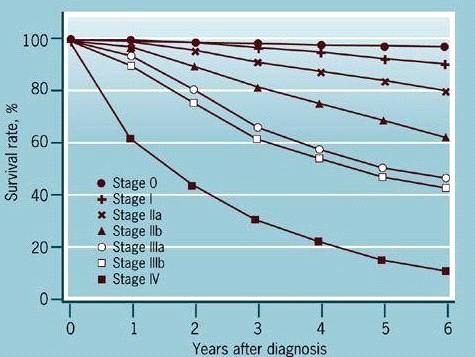
שיעור ההיוותרות בחיים ל-5 שנים של חולות סרטן השד שטופלו הוא - 63%, ולעשר שנים - 46%. שיעור ההיוותרות בחיים ל-5 שנים של חולות מדרגה 1 הוא 95%, מדרגה 2 - 75%, מדרגה 3 - 60% ומדרגה 4 - 18% (טבלה 14.12).
| שלב | 0 | I | II | III | IV |
|---|---|---|---|---|---|
| היוותרות בחיים | |||||
| 5 שנים | 98% | 95% | 75% | 60% | 18% |
| 10 שנים | 90% | 63% | 53% | 25% | 0% |
שיעור ההיוותרות בחיים ל-5 שנים של חולות ללא בלוטות לימפה נגועות הוא 90%-75%, ול-10 שנים - 65%. לעומת זאת, שיעור ההיוותרות בחיים ל-5 שנים של חולות בעלות בלוטות לימפה נגועות יורד ל-60%-40%, ול-10 שנים ל-25%. ככל שמספר הבלוטות הנגועות רב יותר, כך ההיוותרות בחיים פוחתת. בחולות שלא טופלו בכלל (גרף 13.12).
במעקב שנמשך 40 שנה, ובו נכללו חולות סרטן השד שהיו צעירות מגיל 40 בזמן האבחנה, נמצא שלכל אורך המעקב ההיוותרות בחיים של החולות הללו היתה גרועה יותר מזו של נשים באותן קבוצות גיל ללא סרטן השד. המסקנה מתצפית זו: חולה שחלתה בסרטן השד נשארת כל חייה בקבוצת סיכון גבוה למות מהמחלה היסודית.
השאתות ממאירות יותר בנשים צעירות ובחולות שבהן השאת ממוקמת ברביע פנימי. העובדה שההיוותרות בחיים ל-10 שנים נמוכה כל כך, מעלה את ההשערה, שבזמן האבחנה כבר קיימות גרורות מיקרוסקופיות אשר לא נראות באמצעי הגילוי השגרתיים הקיימים, המתפתחות עם השנים והורגות את החולות. לכן הרעיון של טיפול כימי מסייע כה מקובל בשנים האחרונות. והפך לסטנדרט טיפולי מקובל שכיום מעטות הן חולות סרטן השד שאינן מקבלות טיפול מסיע אנטי-הורמונלי או כימי או שילוב של שניהם, למרות שידוע שב-75% מהחולות הטיפול הזה לא ישנה את מהלך המחלה.
מכיוון שהטיפול מסובך וכולל הרבה תחומים הוא חייב להתבצע על-ידי מספר מומחים: כירורגים, אונקולוגים, רדיותרפיסטים ופסיכיאטרים. גישה רב תחומית זו הביאה להתפתחות של מרכזי שד במקומות שונים בעולם.
ראו גם
- לנושא הקודם: טיפול קרינתי בסרטן השד
- לנושא הבא: היריון וסרטן השד
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: כירורגיה של הטחול
- לפרק הבא: בקעים
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק