הבדלים בין גרסאות בדף "הליקובקטר פילורי - גישה וטיפול 2018 - קוים מנחים - Helicobacter pylori - approach and treatment"
| שורה 307: | שורה 307: | ||
;מקרא | ;מקרא | ||
| − | + | * APT {{כ}}- Alimentary Pharmacology & Therapeutics Journal | |
| − | + | * IMAJ - {{כ}} The Israel Medical Association Journal | |
| − | + | * Dig Dis Sci {{כ}}- Digestive Diseases and Sciences Journal | |
| − | + | * Digestion {{כ}}- Digestion Journal | |
| − | + | * Mol Nutr Food Res {{כ}}- Molecular Nutrition & Food Research Journal | |
| − | + | * J Clin Gastro {{כ}}- Journal of Clinical Gastroenterology | |
| − | + | * Pediatrics{{כ}} - Pediatrics Journal | |
| − | + | * J Ped Gastro Nutr{{כ}}- Journal of Pediatric Gastroenterology and Nutrition | |
| − | *A-אמוקסיצילין | + | *A - אמוקסיצילין |
| − | *O- אומפרזול | + | *O - אומפרזול |
| − | *M- מטרונידזול | + | *M - מטרונידזול |
| − | *C- קלריטרומיצין | + | *C - קלריטרומיצין |
| − | *T- טינידזול | + | *T - טינידזול |
| − | *SEQ- טיפול עוקב | + | *SEQ - טיפול עוקב |
==טבלה 3: שעורי עמידות להליקובקטר פילורי במבוגרים וילדים נאיביים או לאחר כישלון טיפולי קודם בישראל == | ==טבלה 3: שעורי עמידות להליקובקטר פילורי במבוגרים וילדים נאיביים או לאחר כישלון טיפולי קודם בישראל == | ||
גרסה מ־14:28, 10 בנובמבר 2018
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
|
| |
|---|---|
| הליקובקטר פילורי – קוים מנחים לגישה וטיפול 2018 | |
| תחום | גסטרואנטרולוגיה |
| |
| האיגוד המפרסם | האיגוד לגסטרואנטרולוגיה ומחלות כבד ואיגוד רופאי המשפחה בישראל |
| יוצר הערך | דר' דורון בולטין; דר' יאן מיסקין; פרופ' חיים שירין |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הליקובקטר פילורי
הקדמה
הנחיות קליניות מהוות את אחד הכלים המרכזיים בתחום הבטחת איכות ובטיחות הטיפול הרפואי במסגרת עקרון "תורת העבודה הקלינית". הצורך בכתיבת הנחיות ישראליות מעודכנות לאבחון וטיפול בחיידק הליקובקטר פילורי (ה.פ., Helicobacter pylori) נובע מההנחיות החדשות שפורסמו על ידי האיגוד האמריקאי [1] [2], האירופאי [3] והקנדי [4] וכן מההנחיות החדשות שפורסמו על ידי קבוצת מומחים לפני כ 3 שנים בקיוטו (Kyoto), יפן [5]. הנחיות אלו משנות בצורה מהותית את הגישה והטיפול בחיידק ובמשלבים האנטיביוטיים (Antibiotics) השונים שבהם מומלץ לטפל. המלצה חשובה של כל האיגודים היא שההנחיות המקומיות צריכות להתבסס על נתונים מקומיים של עמידויות החיידק.
מטרת הוועדה המשותפת לאיגוד הישראלי לגסטרואנטרולוגיה (Gastroenterology) ומחלות הכבד ולאיגוד רופאי המשפחה היא להגדיר את הקווים המנחים לגישה וטיפול בהליקובקטר פילורי בישראל בהתבסס על הפרסומים הבינלאומיים וכן על שכיחות, עמידות והצלחה טיפולית של המשלבים השונים שדווחו במהלך השנים בישראל. ההמלצות שתפורטנה להלן אינן באות להחליף את שיקול הדעת הקליני של הרופא המטפל, ויש לשפוט בכל מקרה את מידת התאמתן ויכולת יישומן.
אפידמיולוגיה
הליקובקטר פילורי הוא אחד הפתוגנים (Pathogens) החיידקיים השכיחים בעולם וככל הנראה האדם הוא המאכסן העיקרי ואולי היחיד של חיידק זה. השכיחות גבוהה יותר בארצות מתפתחות (50.8 אחוזים) לעומת ארצות מפותחות (עד 34.7 אחוזים) ויותר בקרב מבוגרים (48.6 אחוזים) מאשר בילדים (32.6 אחוזים)[6]. דרך ההעברה המדויקת של החיידק טרם הובררה וההנחה היא שההדבקה היא Fecal-oral בארצות מתפתחות ו-Gastro-oral בארצות מפותחות. ככלל, שכיחות הזיהום גבוהה יותר בקרב שכבות סוציו-אקונומיות נמוכות. ישנן עדויות רבות על הידבקות בגיל צעיר, כאשר סביבת ההדבקה העיקרית הוא הבית, על רקע מגע קרוב עם בני משפחה כמו הקשר הפיזי הקרוב בין האם לילדיה או קשר בין אחים. זאת, למרות ש-Delport וחבריו לא הצליחו להראות העברה אנכית במשפחות [7]. הנתון העדכני באוכלוסייה הישראלית אינו ידוע אך הנחת היסוד שלנו כי שכיחותו בקרב האוכלוסייה המבוגרת (מעל גיל 50) גבוהה וגם בקרב הילדים עולה על 20 אחוזים.
אצל מי מומלץ לבדוק הליקובקטר פילורי
השינוי הבולט ביותר בהנחיות הבינלאומיות האחרונות הוא שמומלץ להכחיד את החיידק, שהוכרז כקרצינוגן (Carcinogen) בשנת 1994 [8], אצל כל מטופל כאשר הוא מאובחן. זו החלטה שמייתרת למעשה את השאלה "במי לטפל" ומתרכזת בשאלה אצל מי מומלץ לבדוק את החיידק. למרות האמור לעיל, אין הנחיה לבדיקת החיידק אצל כלל האוכלוסייה אלא בחולים עם האבחנות הבאות: כיב פפטי בתריסריון או בקיבה (פעיל או בעבר), גסטריטיס אטרופית (Atrophic gastritis), מלטומה של הקיבה (MALToma, Mucosa-Associated Lymphoid Tissue), אדנוקרצינומה (Adenocarcinoma) של הקיבה, קרובים מדרגה ראשונה של חולי סרטן קיבה, חולי דיספפסיה (Dyspepsia), שימוש ממושך באספירין, NSAIDs או ב-PPI, אנמיה (Anemia) מחסר ברזל או חסר ויטמין B12 מסיבה לא ברורה ו-ITP (Idiopathic Thrombocytopenic Purpura) [9].
אבחנה
בדיקת הנשיפה ובדיקת אנטיגן (Antigen) בצואה הן שתי השיטות הלא פולשניות המקובלות והאמינות ביותר הן לגילוי החיידק והן לוודא הכחדה בסיום הטיפול. אם החולה עובר גסטרוסקופיה (Gastroscopy), האבחנה תיעשה על ידי אחת משתי השיטות המבוססות על ביופסיה מרירית הקיבה והן: מבחן אוראז מהיר (Rapid Urease Test) או היסטולוגיה (Histology). שתי שיטות נוספות המבוססות על ביופסיה (Biopsy) הן תרבית ו-PCR (Polymerase Chain Reaction) שאינן נמצאות בשימוש שוטף. שימוש באנטיביוטיקה, בתרופות מקבוצת ביסמוט (Bismuth) וב-PPI בעת המבדק עלול להביא לתוצאות שליליות מזויפות בכל הבדיקות הללו, פרט ל-PCR . ההתפלגות הלא אחידה של החיידק בקיבה ונוכחות מטפלזיה אינטסטינלית (Intestinal metaplasia), מקטינים עוד יותר את מהימנות התבחינים. על כן מומלץ להפסיק PPI ל-14 ימים ואנטיביוטיקה ותרופות מקבוצת ביסמוט 4 שבועות לפני בדיקות אלו, אלא אם קיימת התווית נגד להפסקת הטיפול (מחשש לדימום למשל). אם בוצעה בדיקת הליקובקטר פילורי על ידי תבחין אוראזה או היסטולוגיה תחת טיפול של אחת מהתרופות הנזכרות למעלה, הבדיקות בוצעו תחת טיפול ב-PPI או אנטיביוטיקה וקיימת אפשרות שהתוצאה תהיה שלילית כוזבת (False negative) [10]. מומלץ לוודא הכחדה של החיידק לפחות 4 שבועות לאחר סיום טיפול אצל כל המטופלים על ידי תבחין נשיפה או אנטיגן בצואה (אלא אם כן קיימת הוריה לחזור על גסטרוסקופיה).
הליקובקטר פילורי ומחלות ממאירות של הקיבה
הדלקת הכרונית הנגרמת על ידי הליקובקטר פילורי עלולה להוביל להתפתחות אדנוקרצינומה של הקיבה. תהליך זה עובר דרך מספר שלבים טרום סרטניים הכוללים גסטריטיס אטרופית, מטפלזיה אינטסטינלית, דיספלזיה (Dysplasia) ולבסוף קרצינומה של הקיבה. תהליך זה נמשך עשרות שנים ומושפע מגורמים גנטיים וסביבתיים נוספים. Correa שתיאר שרשרת התפתחויות זו עוד לפני גילוי הליקובקטר פילורי התלבט לא פעם בשאלה מהו הגורם לגסטריטיס כרונית שמניע את התהליך הזה [11]. גילוי הליקובקטר פילורי ב-1983, סיפק את התשובה לחוליה החסרה בשרשרת ופתר חידה זו. כעת נשאלה השאלה מהו שלב ה "אל חזור" – שממנו והלאה לא ניתן למנוע התפתחות של סרטן קיבה. מקובל להניח שהכחדת החיידק בשלב של גסטריטיס אטרופית, ולא בשלב מאוחר יותר של מטפלזיה אינטסטינלית, יכולה למנוע התפתחות סרטן קיבה [12] [13]. אכן ממצאים אלו הביאו את ההנחיות על הצורך במעקב אנדוסקופי (Endoscopic) אצל חולים עם ממצאים טרום סרטניים בקיבה [14]. למרות האמור לעיל, מומלץ לבדוק ולטפל בהליקובקטר פילורי גם אצל מטופלים עם מטפלזיה אינטסטינלית במחשבה להקטין את קצב התקדמות התהליך הקרצינוגני, ואף בחולים לאחר כריתת גידול מסוג אדנוקרצינומה של הקיבה וזאת במטרה להקטין את הישנות המחלה [15].
העובדה שהליקובקטר פילורי נחשב כגורם סיכון משמעותי בהתפתחות סרטן קיבה ולימפומה (Lymphoma) מסוג-B, מלטומה בקיבה, הובילה להמלצה להכחיד את החיידק אצל כל חולה שאובחן עם הליקובקטר פילורי זאת במחשבה שהדבר יבלום את התהליך הדלקתי הכרוני שעלול להוביל לממאירות בקיבה.
ספור משפחתי של קרצינומה או לימפומה של הקיבה
למטופלים עם ספור משפחתי של סרטן קיבה נמצאה שכיחות גבוהה יותר של ממצאים טרום סרטניים בקיבה ואף סיכון מוגבר לסרטן קיבה. על כן מומלץ לבדוק נוכחות החיידק אצל חולים אלו ולטפל אם נמצאו חיוביים [16] [17].
הליקובקטר פילורי ודיספפסיה
אצל מטופל מתחת לגיל 60 עם דיספפסיה ללא סימני "אזהרה" (ירידה במשקל, דימום ממערכת העיכול, דיספגיה (Dysphagia), מסה בטנית, אנמיה מחסר ברזל) הגישה המקובלת היא "בדוק וטפל" (Test and treat) [18] [19]. זאת, למרות התועלת הנמוכה של הכחדת הליקובקטר פילורי אצל חולים עם דיספפסיה, שמתבטאת בהחלמה קלינית ב-8 אחוזים בלבד בהשוואה לטיפול ב-PPI או פלצבו (Placebo)[20]. אחד השינויים בהנחיות האחרונות הוא שלא ניתן לאבחן דיספפסיה פונקציונלית (Functional) אלא לאחר שמוודאים שלחולה אין הליקובקטר פילורי או שאצל חולה עם הליקובקטר פילורי מוודאים את הכחדת החיידק.
הליקובקטר פילורי ומחלת ההחזר הקיבתי ושטי
חיסול החיידק בחולים עם אטרופיה של רירית הקיבה והפרשה מועטה של חומצה בקיבה, עלול להביא לשגשוג מחדש של תאים פריאטליים (Parietal) והפרשת חומצה מרובה. בחולים עם הרפיה פתולוגית של השסתום בין הקיבה לושט עלול הדבר, לפחות בתאוריה, לגרום לרפלוקס של חומצה[21]. סקירה גדולה בסוגיה זו הגיעה למסקנה שהליקובקטר פילורי אינו קשור ל- GERD (GastroEsophageal Reflux Disease). יתרה מכך, הכחדת החיידק אינה מעלה את הסיכון להתפתחות GERD או להחמרתו בחולים שסבלו מכך לפני הטיפול [22]. בנוסף, Rokkas וחבריו הראו שיש קשר הפוך ומשמעותי בין הליקובקטר פילורי לבין ושט על שם Barrett ואדנוקרצינומה של הוושט[23]. העובדה שקיים קשר הפוך בין שתי המחלות הללו שקשורות באופן ישיר ל-GERD לבין הליקובקטר פילורי מחלישה מאד את הטענה בדבר הקשר בין GERD לחיידק. על כן מומלץ להפסיק לייחס GERD להליקובקטר פילורי ולפתח ציפיות שווא אצל המטופלים שהכחדת החיידק תביא להפסקת ה-GERD. מנגד, אצל מטופלים שמשתמשים באופן כרוני ב-PPI מומלץ לבדוק את נוכחות החיידק ולטפל באלו שנמצאו חיוביים. המחשבה מאחורי המלצה זו היא ששימוש ממושך ב-PPI משנה את מיקום הדלקת בקיבה מהאנטרום (Antrum) לגוף הקיבה וזו עלולה להוביל לגסטריטיס אטרופית והכחדת החיידק יכולה להקטין את הסיכון למעבר מדלקת שפירה לדלקת שמעלה את הסיכון לסרטן קיבה.
הליקובקטר פילורי ואספירין/NSAIDs
הליקובקטר פילורי ואספירין או NSAIDs הם גורמי סיכון בלתי תלויים זה בזה להתפתחות כיב פפטי ודימום ממערכת העיכול העליונה. לכן ההנחה הקלינית היא שהכחדת החיידק לפני או במקביל לטיפול באספירין או NSAIDs יכולה להקטין תופעות לוואי אלו ואולי אף לשמש כטיפול תחליפי לסותרי חומצה ולמנוע את תופעות הלוואי הקשורות בטיפול ממושך ב-PPI ולהביא גם לחסכון כלכלי משמעותי. Lanas וחבריו הראו שהליקובקטר פילורי הוא גורם סיכון בלתי תלוי לדמום מדרכי העיכול העליונות אצל חולים המטופלים במינון נמוך של אספירין [24]. Chan וחבריו השוו את יעילות הטיפול באומפרזול (Omeprazole), לעומת הכחדה של הליקובקטר פילורי אצל חולים שטופלו באספירין ודיממו ממערכת העיכול העליונה. בסוף המעקב, שיעור הישנות הדימום היה זהה אצל שתי הקבוצות. המסקנה הייתה שהכחדה של הליקובקטר פילורי יעילה במניעת דימום חוזר כמו טיפול קבוע באומפרזול[25]. באותה העבודה התוצאות הראו גם יתרון ברור לטיפול מניעתי באומפרזול אצל חולים שטופלו בנפרוקסן (Naproxen) בהשוואה לאלו שטופלו בהכחדה של הליקובקטר פילורי. תוצאות דומות נתקבלו אצל חולים עם מחלות ראומטיות שטופלו ב-NSAIDs .
על כן מומלץ לשקול הכחדה של הליקובקטר פילורי אצל חולים המשתמשים במינון נמוך של אספירין ו/או בשילוב של אספירין ופלביקס (Plavix) ו/או ב-NSAIDs באופן כרוני. כל החולים עם כיב פפטי בעברם או שדיממו תחת טיפול באספירין או ב-NSAIDs צריכים לעבור בדיקה לגילוי הליקובקטר פילורי ולטפל אם נמצאו חיוביים. אם הדימום היה על רקע טיפול באספירין בלבד, ייתכן והכחדת החיידק יכולה למנוע טיפול כרוני ב-PPI למרות שההחלטה תלויה בנסיבות הקליניות המיוחדות של כל חולה. אם הדימום היה על רקע שימוש ב-NSAIDs מומלץ טיפול מניעתי ב-PPI גם לאחר טיפול להכחדת הליקובקטר פילורי[26].
הליקובקטר פילורי ומחלות שאינן קשורות למערכת העיכול
בשלב זה נמצא קשר בין הליקובקטר פילורי לבין אנמיה מחוסר ברזל ו-ITP ולכן מומלץ להכחיד את החיידק אצל חולים עם ITP ובחולים עם אנמיה מחוסר ברזל ללא סיבה ברורה לאחר ברור מקובל. בנוסף, למרות שאין הוכחות חד משמעיות, מומלץ לבדוק ולהכחיד את החיידק גם בחולים עם חסר ויטמין B12 ללא אתיולוגיה ברורה.
טיפול
מחקרים בכל העולם מצביעים על ירידה ביעילות הטיפול האנטיביוטי ועליה בעמידות הליקובקטר פילורי לטיפול. הגורם העיקרי לכך הוא העלייה בעמידות לקליטרומיצין (Clarithromycin). ההנחיות ממליצות שלא להשתמש בטיפול המשולש המסורתי באזורים בהם העמידות לקליטרומיצין היא מעל 15 אחוזים ו/או קיימת עמידות גבוהה למטרונידזול (Metronidazole)/ טינידזול (Tinidazole). נסקור בקצרה את הטיפולים הקיימים (טבלה 1) וההמלצות שלנו לטיפול בישראל. בסקירה גדולה שפורסמה על הצלחת טיפול קו ראשון בקרב 48,509 מטופלים בין השנים 2010–2015 בישראל, התוצאה הייתה 65.4 אחוזים. ההצלחה הטיפולית עלתה במהלך תקופת המחקר (59.2, 63.3, 65.7, 66, 69, ו-73.1 אחוזים בין השנים 2010, 2011, 2012, 2013, 2014 ו 2015 בהתאמה). ההצלחה בקרב המטופלים שקיבלו קו טיפול שני הייתה 44.7 אחוזים ללא שיפור במהלך המחקר[27].
משך הטיפול המומלץ
מרבית העבודות ממליצות על טיפול במשך 14 ימים שהוא יעיל יותר בהשוואה ל-7 או 10 ימי טיפול. מספר עבודות בעיקר מאירופה, הראו שההבדלים אלו אינם מאד משמעותיים וחלק מהאיגודים מאפשרים לטפל במשך 10 ימים בהסתמך על מחקרים השוואתיים מקומיים. בהיעדר מחקר השוואתי כזה בארץ, הרי שאין לנו את היכולת להמליץ על משך הטיפול המומלץ בישראל. במטרה להעלות את ההיענות לטיפול ולהקטין עלויות כלכליות, רופאים רבים מטפלים במשך 10 ימים. עובדה זו באה לידי ביטוי גם בהמלצות האמריקאיות שממליצות על טיפול במשך 10–14 ימים. לכן גם אנו ממליצים על משך טיפול בין 10–14 ימים.
מינון ה-PPI המומלץ והאם יש העדפה ל-PPI מסוים
אנו ממליצים על טיפול בנקסיום (Nexium) (Esomeprazole) במינון 40 מיליגרמים פעמיים ביום למשך כל תקופת הטיפול כדי להעלות את יעילות הטיפול בקרב מטופלים שהם Rapid metabolizers של PPI[28]. אין צורך בהמשך טיפול ב-PPI מעבר לתקופת ההכחדה אלא אם קיימת התוויה מפורשת לכך.
טיפול קו ראשון
אנו ממליצים על אחד מהטיפולים הבאים:
- טיפול מרובע ללא ביסמוט
- טיפול מרובע עם ביסמוט
- טיפול עוקב
לא מומלץ טיפול משולש או טיפול מבוסס על לבופלוקסצין (Levofloxacin). ניתן לשקול טיפול משולש רק במקרים שלא נמצאה עמידות הליקובקטר פילורי לקלריטרומיצין לפני התחלת הטיפול.
טיפול מרובע ללא ביסמוט (Concomitant- non-bismuth quadruple therapy)
טיפול מרובע זה כולל שילוב של PPI, אמוקסיצילין (Amoxicillin), קלריטרומיצין ומטרונידזול/טינידזול למשך 10–14 ימים והוא מומלץ כקו טיפולי ראשון באזורים עם עמידות גבוהה לקלריטרומיצין כמו בישראל. משלב זה נחשב יעיל.
טיפול מרובע עם ביסמוט (Bismuth quadruple therapy)
טיפול מרובע זה כולל שילוב של PPI, טטרציקלין (Tetracycline), ביסמוט ומטרונידזול/טינידזול למשך 10–14 ימים והוא מומלץ כקו טיפולי ראשון באזורים עם עמידות גבוהה לקלריטרומיצין ומטרונידזול/טינידזול גם יחד כמו בישראל. גם משלב זה נחשב יעיל אך עם הענות ירודה יחסית. טיפול זה מומלץ בעיקר אצל חולים עם חשיפה קודמת, מכל סיבה כלשהי, למאקרולידים (Macrolides) או רגישים לפניצילין (Penicillin).
טיפול עוקב (Sequential therapy)
בהנחיות האירופאיות והקנדיות החדשות גם הטיפול העוקב, כמו הטיפול המשולש, הוצא מרשימת הטיפולים היעילים בגלל המשלב של קלריטרומיצין ומטרונידזול/טינידזול[3] [4]. בהיעדר נתונים עדכניים על יעילותו בארצות הברית ההנחיות האמריקאיות המליצו להשאיר טיפול זה[1]. העבודה היחידה בישראל עם הטיפול העוקב שפורסמה ב-2011 הדגימה יעילות גבוהה עם היענות גבוהה ותופעות לוואי מועטות [29]. בשלב זה החלטנו להשאיר טיפול זה למשך 10–14 ימים, כאפשרות טיפול קו ראשון בישראל.
טיפול קו שני- הטיפול המומלץ לחולה שנכשל בטיפול קו ראשון
טעות נפוצה היא לחזור על הטיפול הלא יעיל ומומלץ להימנע מכך. מומלץ להימנע בטיפול קו שני ממשלב שמכיל את אותן אנטיביוטיות שהיו בשימוש בקו הטיפולי הראשון. בקו טיפול שני אנו ממליצים על אחד מהטיפולים הבאים:
- טיפול מרובע עם ביסמוט (עדיף בחולה שטופל במשלב שמכיל קלריטרטמיצין)
- טיפול משולש עם לבופלוקסצין (עדיף בחולה שטופל במשלב שמכיל קלריטרטמיצין)
- טיפול מרובע ללא ביסמוט (עדיף בחולה שטופל במשלב שלא מכיל קלריטרטמיצין)
- טיפול משולש עם ריפבוטין (Rifabutin)
- לא מומלץ טיפול עוקב כקו טיפול שני
טיפול קו שלישי
לאחר שני כישלונות טיפוליים מומלץ לבצע גסטרוסקופיה עם תרבית באחד המרכזים שבהם המעבדה הבקטריולוגית מצליחה לגדל את החיידק בהצלחה. לחלופין ניתן לנסות טיפול משולש עם ריפבוטין.
הטיפול לחולה אלרגי לפניצילין
ניתן לטפל בחולים אלו בטיפול מרובע שכולל ביסמוט. הרושם שלנו הוא שמרבית החולים שמדווחים על אלרגיה לפניצילין אין להם רגישות אמיתית לפניצילין. על כן ניתן ומומלץ לשלוח חולים אלו למרפאה אלרגית לביצוע מבחן תגר לוודא האם האלרגיה היא אמיתית. כאמור מרביתם יוכלו לבסוף להיות מטופלים במשלב שכולל אמוקסיצילין.
סיכום
חיידק המאה ה-20, הליקובקטר פילורי, הביא למהפכה בהבנה ובגישה הטיפולית לכיב פפטי ולקשר בין דלקת כרונית על רקע זיהום חיידקי והתפתחות מחלות ממאירות בקיבה. אין מידע עדכני ומספיק באשר לאפידמיולוגיה ופרופיל עמידות החיידק בארץ ואנו קוראים למחקר ורישום בנושא כפי שמקובל לגבי זיהומים אחרים כמו דלקת ראות או זהום בדרכי השתן. על פי הפרסומים ממרכזים שונים בישראל ההצלחה של הטיפול המשולש, כאשר ניתן כקו טיפולי ראשון, היא כ-60-80 אחוזים. אחוזי הצלחה אלו נמוכים ואינם מקובלים בעולם המערבי. לכן ההמלצה שלנו היא להפסיק שימוש בטיפול משולש להכחדת החיידק. לחלופין, אנו מאמצים משלבים אנטיביוטיים שהומלצו בקווים המנחים הבינלאומיים העדכניים אך ערים לעובדה שיכולה להיות שונות גאוגרפית. בחירות אלו ישפרו את סיכויי הצלחת הטיפול ויקטינו את עמידות החיידק.
אנו כקלינאים נמשיך להתעדכן בגילויים החדשים לגבי פעילותו ועמידותו של הליקובקטר פילורי וחשוב יותר שנמשיך ליישם את ההנחיות הקליניות אצל החולים שלנו.
תקציר ההמלצות
- המלצה 1- להכחיד את החיידק אצל כל חולה שאובחן עם הליקובקטר פילורי ללא קשר להתוויה שבגללה נבדק
- המלצה 2- לבדוק את נוכחות החיידק אצל כל המטופלים עם:
- מחלת כיב פעילה או סיפור עבר של כיב פפטי
- אדנוקרצינומה או לימפומה מסוג MALT בקיבה
- דיספפסיה
- אנמיה מחסר ברזל או חסר B12 ללא סיבה ברורה לאחר ברור
- מבוגרים עם ITP
- מטופלים שמיועדים לקבל מינון נמוך של אספירין או טיפול ממושך ב-NSAIDs או טיפול ממושך ב-PPI
- ספור משפחתי של אדנוקרצינומה בקיבה
- אין צורך בבדיקת נוכחות החיידק במטופלים עם תסמינים אופייניים של GERD
- המלצה 3- למי מתאימה הגישה של "בדוק וטפל"?
- הגישה של "בדוק וטפל" (Test and treat) ללא ביצוע גסטרוסקופיה מומלצת למטופלים מתחת לגיל 60 ללא סימני אזהרה (ירידה במשקל, קושי בבליעה, הקאה, שחרה או אנמיה מחסר ברזל)
- המלצה 4- כיצד לאבחן?
- תבחין נשיפה הוא הבדיקה העדיפה הן לאבחון ראשוני והן למעקב אחר הצלחת הטיפול. בדיקת אנטיגן בצואה היא חלופה אפשרית. מומלץ להפסיק טיפול ב-PPI שבועיים טרם ביצוע התבחין וביסמוט או תכשירים אנטיביוטיים – חודש קודם לכן. יש צורך בהפסקת תרופות אלו גם לפני ביצוע מבחן אוראז מהיר או ביופסיות לגילוי החיידק בגסטרוסקופיה
- אין צורך בהפסקת חוסמי H2 או סותרי חומצה קצרי טווח כמו [מלוקס (Maalox) או טמס (Tums)] לפני ביצוע הבדיקות
- בעת ביצוע תבחין אוריאז מהיר במהלך גסטרוסקופיה יש ליטול ביופסיות משני אזורים- מהאנטרום ומגוף הקיבה
- תשובה חיובית לנוכחות הליקובקטר פילורי שהתקבלה תחת טיפול ב-PPI תיחשב חיובית. מנגד תשובה שלילית תחת טיפול ב-PPI תיחשב לא אמינה ויש צורך לחזור עליה לאחר הפסקת PPI
- המלצה 5- מהו משך הטיפול המומלץ?
- במטרה להעלות את ההיענות לטיפול ולהקטין עלויות כלכליות, מומלץ לטפל לפחות 10 ימים ולא יותר מ 14 ימים
- המלצה 6- מהו מינון ה-PPI המומלץ והאם יש העדפה ל-PPI מסוים?
- אנו ממליצים על טיפול בנקסיום במינון 40 מיליגרמים פעמיים ביום למשך כל תקופת הטיפול כדי להעלות את יעילות הטיפול בקרב מטופלים שהם Rapid metabolizers של PPI. לאחר סיום הטיפול האנטיביוטי אין צורך בהמשך טיפול ב-PPI מעבר לתקופת ההכחדה אלא אם קיימת התוויה מפורשת לכך
- המלצה 7- מהו הטיפול המומלץ?
- טרם בחירת הטיפול יש לתשאל את המטופלים באשר לטיפול קודם במאקרולידים, תופעות לוואי או קושי בהיצמדות למתווה הטיפולי
- טיפול קו ראשון- יכלול את אחד מהמישלבים הבאים:
- טיפול מרובע ללא ביסמוט
- טיפול מרובע עם ביסמוט
- טיפול עוקב
- טיפול קו שני לחולה שנכשל בטיפול קו ראשון
- לא לחזור על הטיפול בקו ראשון ולהימנע ממשלב שמכיל אנטיביוטיקות שהיו בשימוש בקו הטיפולי הראשון. בקו טיפול שני אנו ממליצים על אחד מהטיפולים הבאים:
- טיפול מרובע עם ביסמוט (עדיף בחולה שטופל במשלב שמכיל קלריטרטמיצין)
- טיפול משולש עם לבופלוקסצין (עדיף בחולה שטופל במשלב שמכיל קלריטרטמיצין)
- טיפול מרובע ללא ביסמוט (בחולה שטופל במשלב שלא מכיל קלריטרטמיצין)
- לא מומלץ טיפול עוקב כקו טיפול שני
- טיפול קו שלישי לחולה שנכשל בשני קווי טיפול
- לאחר שני כישלונות טיפוליים מומלץ להפנות את המטופל לרופא מומחה המתמחה בטיפול בזנים עמידים
- במקרים אלו מומלץ ניסיון טיפולי אמפירי (קו שלישי) או לחלופין בדיקת רגישות לחיידק בתרבית מרירית הקיבה או בדיקה מולקולארית מרירית הקיבה או מהצואה וטיפול בהתאם. נראה לנו שבשלב זה איננו ערוכים לבדיקה מולקולארית (Molecular) במרכזים השונים או במעבדה מרכזית. על כן מומלץ לבצע גסטרוסקופיה עם תרבית באחד המרכזים שבהם המעבדה הבקטריולוגית מצליחה לגדל את החיידק בהצלחה
- האנטיביוטיקות שבאופן שגרתי מומלץ לבדוק את הרגישות אליהן צריכות לכלול: אמוקסיצילין, קלריטרומיצין, לבופלוקסצין, מטרונינדזול וטטרציקלין
- אפשרות טיפולית נוספת כקו שלישי הוא טיפול משולש הכולל ריפבוטין
- המלצה 8- וידוא הכחדת החיידק
- מומלץ לוודא הכחדה של החיידק אצל כל החולים לפחות חודש לאחר סיום טיפול על ידי מבחן נשימה
- המלצה 9- מטופלים אלרגיים לפניצילין
- בשלב ראשון מומלץ להפנות את המטופל למרפאה אלרגיה ולשלול אלרגיה לפניצילין. במקרים רבים לא תמצא רגישות והחולה יקבל טיפול על פי ההמלצות הרגילות. אם יש אלרגיה לפניצילין מומלץ טיפול מרובע על בסיס ביסמוט.
- המלצה 10
- היעדר מידע עדכני ומדויק אודות הרגישות של החיידק ושיעורי ההצלחה של המשלבי הטיפול השונים בישראל מקשה על מתן המלצות מותאמות לטיפול בהליקובקטר פילורי עם הפצת קווים מנחים אלה מומלץ להתחיל במעקב אחר המטופלים בקהילה ובמרפאות החוץ לניטור שיעור המסיימים את הטיפול ואחוזי ההצלחה של הכחדת החיידק. כמו כן מומלץ ליזום בחינת משלבים חדשים להערכת יעילותם באוכלוסייה המקומית
טבלה 1: אפשרויות טיפוליות בהליקובקטר פילורי בישראל
| סוג הטיפול | משלב |
|---|---|
| טיפול מרובע עם ביסמוט 14-10 ימים | Bismuth (Kalbeten) 262mg (q.i.d.) +
Tetracycline 500 mg (q.i.d.) + Metronidazole/Tinidazole 500mg (t.i.d.) + Esmoprazole 40 mg (b.i.d.) |
| טיפול מרובע ללא ביסמוט 14-10 ימים | Amoxycillin 1gr (b.i.d.) +
Clarithromycin 500 mg (b.i.d.) + Metronidazole/Tinidazole 500mg (b.i.d.) + Esmoprazole 40 mg (b.i.d.) |
| טיפול רציף - 10–14 ימים | |
| 7-5 ימים ראשונים |
Esmoprazole 40 mg (b.i.d.)+ Amoxycillin 1gr (b.i.d.) Followed by a 5-7 days therapy with: |
| 7-5 מיד לאחר מכן | Esmoprazole 40 mg (b.i.d.)+
Clarothromycin 500 mg (b.i.d.) + Metronidazole/Tinidazole 500mg (b.i.d.) |
| טיפול משולש עם לבופלוקסצין 14-10 ימים | Esmoprazole 40 mg (b.i.d.) +
Amoxycillin 1gr (b.i.d.) + Levofloxacin 500 mg (b.i.d.) |
| טיפול משולש עם ריפבוטין למשך 10–14 ימים | Esmoprazole 40 mg (b.i.d.)+
Amoxycillin 1gr (b.i.d.) + Rifabutin 150 mg (b.i.d.) |
*q.i.d - ארבע פעמים ביום
t.i.d - שלוש פעמים ביום
b.i.d - פעמיים ביום
טבלה 2: אחוזי הצלחה של הכחדת הליקובקטר בישראל בקרב מבוגרים וילדים
| שנה | מספר | AOC% | AOM% | OCT% | SEQ% | |
|---|---|---|---|---|---|---|
| מבוגרים | ||||||
|
Moshkowitz et al[30]
|
1996 | 144 | 1st – 96 2nd- 56 |
|||
| Gal et al[31]
|
2003 | 539 | 81.3 | 66.1 | ||
| Niv et al[32]
|
2005 | 97 | O-79.4
|
|||
| Shirin et al[33]
|
2005 | 233 | 79.9 | |||
| Shmuely et al[34]
|
2007 | 88+712 | 82.5 | |||
| Schmilowitz-Weiss et al[29]
|
2011 | 120 | 95.8 | |||
| ילדים | ||||||
| Niv et al[35]
|
2003 | 435 | 57.5 | |||
| Levine et al[36]
|
2004 | 95 | 82.4 | |||
| Faber et al[37]
|
2005 | 265 | 62.6 | 73.4 | ||
- מקרא
- APT - Alimentary Pharmacology & Therapeutics Journal
- IMAJ - The Israel Medical Association Journal
- Dig Dis Sci - Digestive Diseases and Sciences Journal
- Digestion - Digestion Journal
- Mol Nutr Food Res - Molecular Nutrition & Food Research Journal
- J Clin Gastro - Journal of Clinical Gastroenterology
- Pediatrics - Pediatrics Journal
- J Ped Gastro Nutr- Journal of Pediatric Gastroenterology and Nutrition
- A - אמוקסיצילין
- O - אומפרזול
- M - מטרונידזול
- C - קלריטרומיצין
- T - טינידזול
- SEQ - טיפול עוקב
טבלה 3: שעורי עמידות להליקובקטר פילורי במבוגרים וילדים נאיביים או לאחר כישלון טיפולי קודם בישראל
| % AMO | % TEVA | % LEVO | % CLA | % MZ | מספר | שנה | |
|---|---|---|---|---|---|---|---|
| מבוגרים | |||||||
| 10 | 67 | 40 | 1999 | Avidan et al[38]
| |||
| 0.9 | 0 | 8.2 | 38.2 | 110 | 2002 | Samra et al[39]
J Antimicrobial Chemotherapy | |
| 2.3 | 2.3 | 22.3 | 70 | 44 | 2014 | Peretz A[40]
J Antibiot (Tokyo) | |
| 0 | 0 | 46.4 | 60.7 | 28 | 2002 | Samra et al (2nd)[39]
J Antimicrobial Chemotherapy | |
| 18.6 | 65.7 | 57.1 | 70 | 2006 | Yahav et al (3rd)[41]
Diag Microbiol Infec Dis | ||
| 5.1 | 57.2 | 64.4 | 1042 | 2015 | Boltin et al (3rd)[42]
J Clin Microbial | ||
| 10.2 | 2015 | (*) Peretz A[43]
Microb Drug Resist | |||||
| 20 | 68.2 | 85 | 2017 | Pastukh N (Not naive)[44]
Helicobacter | |||
| 8.6 | 7 | 21 | 39 | 61 | 23 | 2017 | Khoury J (Not naive)[45]
J Global Antimicrob Resistance |
| ילדים | |||||||
| 15 | 31.4 | 105 | 2005 | Faber et al[37]
J Ped Gastr Nutr | |||
| 0 | 0 | 0 | 25 42 |
19 52 |
55 | 2010 | Zevit et al[46] (Naive) Scan J Gastro (2nd) |
| 12.2 | 2.4 | 24.4 | 24 | 41 | 2014 | Peretz A[40]
J Antibiot (Tokyo) | |
| 12 | 8 | 2 | 35 | 8 | 89 | 2018 | Pastukh N[47]
J Global Antimicrob Resistance |
| 9.5
|
32.6
|
95
|
2017 | Kori et al[48] (Naive)
| |||
(*) העבודה כללה מבוגרים וילדים
- מקרא
- Harefuah Journal - Harefuah
- Journal of Antimicrobial Chemotherapy - J Antimicrobial Chemotherapy
- Journal of antibiotics (Tokyo) - J Antibiot
- Diagnostic Microbiology and Infectious Disease - Journal - Diag Microbiol Infec Dis
- Journal of Clinical Microbiology - J Clin Microbial
- Microb Drug Resist - Microbial Drug Resistance Journal
- Journal of Global Antimicrobial Resistance - J Global Antimicrob Resistance
- J Ped Gastr Nutr - Journal of Pediatric Gastroenterology and Nutrition
- Scan J Gastro - Scandinavian Journal of Gastroenterology
- AMO - אמוקסיצילין
- MZ - מטרונידזול
- CLA - קלריטרומיצין
- LEVO - לבופלוקסצין
- TEVA – טטרציקלין
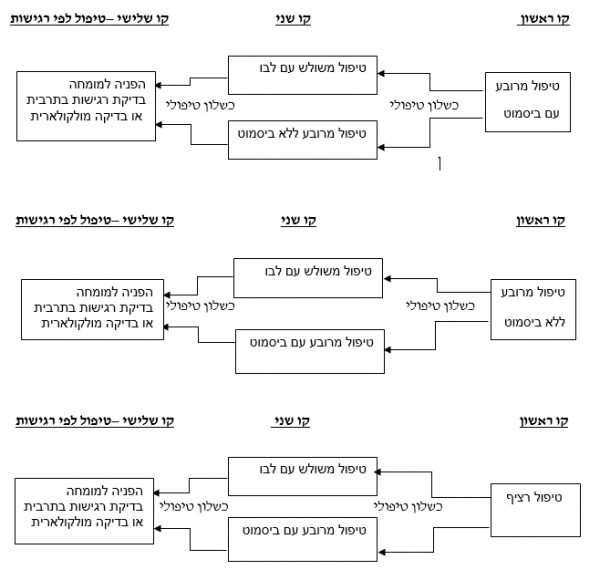
תרשים 1: אלגוריתם טיפולי בהליקובקטר פילורי
ביבליוגרפיה
- ↑ 1.0 1.1 Chey WD, Leontiadis GI, Howden CW & Moss SF, ACG Clinical Guideline: Treatment of Helicobacter pylori infection. Am J Gastroenterol, 2017;112:212-39.
- ↑ El-Serag HB, Kao JY, Kanwal F & al, Houston Consensus Conference on testing for Helicobacter pylori infection in the United States. Clin Gastroenterol Hepatol, 2018;16:992-1002.
- ↑ 3.0 3.1 Malfertheiner P, Megraud F, O'Morain CA & al, European Helicobacter and Microbiota Study Group and Consensus panel. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report, Gut, 2017;66:6-30.
- ↑ 4.0 4.1 Fallone CA, Chiba N, van Zanten SV & al, The Toronto Consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology, 2016;151:51-69.
- ↑ Sugano K, Tack J, Kuipers EJ & al, Kyoto global consensus report on Helicobacter pylori gastritis. Gut, 2015;64:1353-67.
- ↑ Zamani M, Ebrahimtabar F, Zamani V & al, Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment Pharmacol Ther, 2018;47:868-76.
- ↑ Delport W, Cunningham M, Olivier B & al, A population genetics pedigree perspective on the transmission of Helicobacter pylori. Genetics, 2006;174:2107-18.
- ↑ [No authors listed], Infection with Helicobacter pylori. IARC Monogr Eval Carcinog Risks Hum, 1994;61:177-240.
- ↑ Stasi R, Sarpatwari A, Segal JB, Osborn J, Evangelista ML, Cooper N, Provan D, Newland A, Amadori S, Bussel JB. Effects of eradication of helicobacter pylori infection in patients with immune thrombocytopenic purpura: a systematic review. Blood 2009 Feb 5;113(6):1231-40. doi: 10.1182/blood-2008-07-167155. Epub 2008 Oct 22.
- ↑ Shirin D, Matalon S, Avidan B & al, Real-world Helicobacter pylori diagnosis in patients referred for esophagoduodenoscopy: The gap between guidelines and clinical practice. United European Gastroenterol J, 2016;4:762-9.
- ↑ Correa P. Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol, 1995;19(Suppl 1);37-43.
- ↑ Chen HN, Wang Z, Li X, Zhou ZG. Helicobacter pylori eradication cannot reduce the risk of gastric cancer in patients with intestinal metaplasia and dysplasia: evidence from a meta-analysis. Gastric Cancer. 2016 Jan;19(1):166-75. doi: 10.1007/s10120-015-0462-7. Epub 2015 Jan 22.
- ↑ Mera RM, Bravo LE, Camargo MC, Bravo JC, Delgado AG, Romero-Gallo J, Yepez MC, Realpe JL, Schneider BG, Morgan DR, Peek RM Jr, Correa P1, Wilson KT, Piazuelo MB. Dynamics of Helicobacter pylori infection as a determinant of progression of gastric precancerous lesions: 16-year follow-up of an eradication trial. Gut. 2018 Jul;67(7):1239-1246. doi: 10.1136/gutjnl-2016-311685. Epub 2017 Jun 24.
- ↑ O'Connor A, McNamara D & O'Moráin CA, Surveillance of gastric intestinal metaplasia for the prevention of gastric cancer. Cochrane Database Syst Rev, 2013;(9): CD009322.
- ↑ Choi JM, Kim SG, Choi J, Park JY, Oh S, Yang HJ, Lim JH, Im JP, Kim JS, Jung HC. Effects of Helicobacter pylori eradication for metachronous gastric cancer prevention: a randomized controlled trial. Gastrointest Endosc. 2018 Sep;88(3):475-485.e2. doi: 10.1016/j.gie.2018.05.009. Epub 2018 May 22.
- ↑ El-Omar EM1, Oien K, Murray LS, El-Nujumi A, Wirz A, Gillen D, Williams C, Fullarton G, McColl KE. Increased prevalence of precancerous changes in relatives of gastric cancer patients: critical role of H. pylori. Gastroenterology. 2000 Jan;118(1):22-30.
- ↑ Rokkas T, Sechopoulos P, Pistiolas D, Margantinis G, Koukoulis G Helicobacter pylori infection and gastric histology in first-degree relatives of gastric cancer patients: a meta-analysis. Eur J Gastroenterol Hepatol. 2010 Sep;22(9):1128-33. doi: 10.1097/MEG.0b013e3283398d37.
- ↑ Moayyedi PM, Lacy BE, Andrews CN, Enns RA, Howden CW, Vakil N. ACG and CAG Clinical Guideline: Management of Dyspepsia. Am J Gastroenterol. 2017 Jul;112(7):988-1013. doi: 10.1038/ajg.2017.154. Epub 2017 Jun 20.
- ↑ Ford AC, Qume M, Moayyedi P & al, Helicobacter pylori ‘test and treat’ or endoscopy for managing dyspepsia: an individual patient data meta-analysis. Gastroenterology 2005;128:1838–4.
- ↑ Vakil NB, Howden CW, Moayyedi P & al, White Paper AGA: Functional dyspepsia. Clin Gastroenterol Hepatol, 2017;15:1191-94.
- ↑ Gyawali CP, Kahrilas PJ, Savarino E, Zerbib F, Mion F, Smout AJPM, Vaezi M, Sifrim D, Fox MR, Vela MF, Tutuian R, Tack J, Bredenoord AJ, Pandolfino J, Roman S. Modern diagnosis of GERD: the Lyon Consensus. Gut. 2018 Jul;67(7):1351-1362. doi: 10.1136/gutjnl-2017-314722. Epub 2018 Feb 3.
- ↑ Raghunath AS, Hungin AP, Wooff D & Childs S, Systematic review: the effect of Helicobacter pylori and its eradication on gastro-oesophageal reflux disease in patients with duodenal ulcers or reflux oesophagitis. Aliment Pharmacol Ther, 2004;20:733-44.
- ↑ Rokkas T, Pistiolas D, Sechopoulos P & al, Relationship between Helicobacter pylori infection and esophageal neoplasia: a meta-analysis. Clin Gastroenterol Hepatol, 2007;5:1413-7, 1417.e1-2.
- ↑ Sostres C, Carrera-Lasfuentes P, Benito R & al, Peptic ulcer bleeding risk. The role of Helicobacter pylori infection in NSAID/low-dose aspirin users. Am J Gastroenterol, 2015;110:684-9.
- ↑ Chan FK, Chung SC, Suen BY & al, Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen. N Engl J Med, 2001;344:967-73.
- ↑ Bhatt DL, Scheiman J, Abraham NS & al, American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol, 2008;52:1502-17.
- ↑ Boltin D, Schmilovitz-Weiss H, Gingold-Belfer R & al, Temporal trends in Helicobacter pylori eradication success in a test-and-treat population. Digestion, 2018;98:169-174.
- ↑ McNicholl AG, Linares PM, Nyssen OP & al, Meta-analysis: esomeprazole or rabeprazole vs. first-generation pump inhibitors in the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 2012;36:414–25.
- ↑ 29.0 29.1 Schmilovitz-Weiss H, Shalev T, Chechoulin Y & al, High eradication rates of Helicobacter pylori infection following sequential therapy: the Israeli experience treating naïve patients. Helicobacter, 2011;16:229-33.
- ↑ Moshkowitz M, Konikoff FM, Peled Y & al, One-week triple therapy with omeprazole, clarithromycin and tinidazole for Helicobacter pylori: differing efficacy in previously treated and untreated patients. Aliment Pharmacol Ther, 1996;10:1015-9.
- ↑ Gal E, Abuksis G, Fraser G & al, 13C-urea breath test to validate eradication of Helicobacter pylori in an Israeli population. Isr Med Assoc J, 2003;5:98-100.
- ↑ Niv Y. Effectiveness of omeprazole- versus lansoprazole-based triple therapy for Helicobacter pylori eradication. Dig Dis Sci, 2005;50:839-41.
- ↑ Shirin H, Levine A, Shevah O & al, Eradication of Helicobacter pylori can be accurately confirmed 14 days after termination of triple therapy using a high-dose citric acid-based 13C urea breath test. Digestion 2005;71:208-12.
- ↑ Shmuely H, Yahav J, Samra Z & al, Effect of cranberry juice on eradication of Helicobacter pylori in patients treated with antibiotics and a proton pump inhibitor. Mol Nutr Food Res, 2007;51:746-51.
- ↑ Niv Y, Abuksis G & Koren R, 13C-urea breath test, referral patterns, and results in children. J Clin Gastroenterol, 2003;37:142-6.
- ↑ Levine A, Milo T, Broide E & al, Influence of Helicobacter pylori eradication on gastroesophageal reflux symptoms and epigastric pain in children and adolescents. Pediatrics, 2004;113:54-8.
- ↑ 37.0 37.1 Faber J, Bar-Meir M, Rudensky B & al, Treatment regimens for Helicobacter pylori infection in children: is in vitro susceptibility testing helpful? J Pediatr Gastroenterol Nutr, 2005;40:571-4.
- ↑ Avidan B, Weiss B, Chowers Y & al, Sensitivity and resistance of Helicobacter pylori to antibiotic treatment. [Article in Hebrew]. Harefuah, 1999;137:272-4.
- ↑ 39.0 39.1 Samra Z, Shmuely H, Niv Y & al, Resistance of Helicobacter pylori isolated in Israel to metronidazole, clarithromycin, tetracycline, amoxicillin and cefixime. J Antimicrob Chemother, 2002;49:1023-6.
- ↑ 40.0 40.1 Peretz A, Paritsky M, Nasser O & al, Resistance of Helicobacter pylori to tetracycline, amoxicillin, clarithromycin and metronidazole in Israeli children and adults. J Antibiot (Tokyo), 2014;67(8):555-7.
- ↑ Yahav J, Shmuely H, Niv Y & al, In vitro activity of levofloxacin against Helicobacter pylori isolates from patients after treatment failure. Diagn Microbiol Infect Dis, 2006;55:81-3.
- ↑ Boltin D, Ben-Zvi H, Perets TT & al, Trends in secondary antibiotic resistance of Helicobacter pylori from 2007 to 2014: has the tide turned? J Clin Microbiol, 2015;53:522-7.
- ↑ Peretz A, Paritsky M, Dinisman-Zavulunov E & al, Susceptibility of Helicobacter pylori to Levofloxacin and Rifampicin in Israel. Microb Drug Resist, 2015;21:448-51.
- ↑ Pastukh N, Binyamin D, On A & al, GenoType® HelicoDR test in comparison with histology and culture for Helicobacter pylori detection and identification of resistance mutations to clarithromycin and fluoroquinolones. Helicobacter, 2017;22.
- ↑ Khoury J, Geffen Y, Shaul R & al, Secondary antibiotic resistance of Helicobacter pylori isolates in Israeli children and adults. J Glob Antimicrob Resist, 2017;10:182-5.
- ↑ Zevit N, Levy I, Shmuely H & al, Antibiotic resistance of Helicobacter pylori in Israeli children. Scand J Gastroenterol, 2010;45:550-5.
- ↑ Pastukh N, Peretz A, Brodsky D & al, Antimicrobial susceptibility of Helicobacter pylori strains isolated from children in Israel. J Glob Antimicrob Resist, 2018;12:175-8.
- ↑ Kori M, Yahav J, Berdinstein R & al, Primary and secondary antibiotic resistance of Helicobacter pylori in Israeli children and adolescents. Isr Med Assoc J, 2017;19:747-50.
המידע שבדף זה נכתב על ידי דר' דורון בולטין, מנהל מרפאת הליקובקטר ודיספפסיה, מערך לגסטרואנטרולוגיה, מרכז רפואי רבין, בי"ח בילינסון, פתח תקווה; דר' יאן מיסקין, מחלות זיהומיות, שרותי בריאות כללית, מחוז ירושלים; פרופ' חיים שירין – מנהל מכון לגסטרואנטרולוגיה ומחלות כבד, מרכז רפואי אסף הרופא, צריפין


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק